Болезнь Девика (БД, оптический нейромиелит, G36.0 по МКБ-10) в виде одновременного или последовательного развития неврита зрительных нервов и поперечного миелита впервые описана французским врачом E. Devic в 1894 году [9] и спустя много лет получила эпонимическое название. Долгие годы это заболевание считалось одной из атипичных клинических форм рассеянного склероза, однако открытие в 2004 г. V. Lennon и соавт. специфических для данной патологии сывороточных антител к аквапорину-4 (neuromyelitisoptica — Immunoglobulin G, NMO-IgG) позволило предположить его самостоятельность [12, 13]. Данная патология относится к числу редких болезней, но при этом чаще встречается среди лиц африканского и азиатского происхождения [14]. В европейских странах при эпидемиологических исследованиях распространенность БД составляет 0,3–4,4 случая на 100 тысяч населения [8, 11]. Возраст начала заболевания колеблется в широком диапазоне с пиком дебюта в 35–41 год. Женщины страдают БД существенно чаще (85 % случаев), чем мужчины. Несмотря на 125-летнюю историю изучения этой болезни в России и Украине, к настоящему времени опубликовано только несколько научных статей с описанием единичных наблюдений БД [1–4, 7]. При этом самая большая серия случаев диагностики БД (30 чел.) описана Т.О. Симанив в 2015 году [6].
Установлено, что в основе развития данной патологии центральной нервной системы лежит аутоиммунный процесс с участием клеточного и гуморального звеньев иммунитета. Ведущую роль в подтверждении нарушений гуморальных механизмов иммунитета при БД играет высокий титр NMO-IgG, входящий в состав мембраны макромолекулярного комплекса астроцитов как части гематоэнцефалического барьера. Его поражение вызывает открытие водных каналов, приводит к потере внутриклеточного Na+ и попаданию в нейроны глутамата, что вызывает их апоптоз. По мнению T. Misuetal [13], чувствительность определения NMO-IgG при БД составляет 91 %, а специфичность достигает 100 %. Кроме того, показано, что титр NMO-IgG в сыворотке крови коррелирует с размерами очагов в спинном мозге и частотой обострений БД [12]. Нарушение клеточных механизмов транспорта воды, повреждение гематоэнцефалического барьера и инфильтрация периваскулярного пространства клеточными элементами крови (нейтрофилами, макрофагами) способствуют процессу демиелинизации в белом и сером веществе преимущественно спинного мозга, а также зрительных нервов. Таким образом, патогенез БД отличается от рассеянного склероза аутоиммунной астроцитопатией и/или каналопатией, которая имеет преимущественно гуморально-опосредованный механизм [5, 13].
Заболевание начинается подостро либо имеет хроническое течение. В половине случаев развитию БД предшествуют перенесенные инфекции или стресс, в остальных начинается без видимой причины [1, 5]. Преобладают пациенты (до 90 %) с рецидивирующим течением [6]. Реже встречается монофазное течение (15–25 %); при этом вторично прогрессирующее течение для БД не характерно. Прогностическими факторами рецидивирующего течения заболевания являются короткие ремиссии (до 6 мес.), женский пол, поздний возраст начала, остаточный двигательный дефицит после обострения процесса, наличие сопутствующей аутоиммунной патологии и наличие в сыворотке NMO-IgG [10].
Патоморфологически при БД поражаются зрительные нервы, хиазма, серое и белое вещество спинного мозга, реже — гипоталамус и ствол мозга. При микроскопии обнаруживается воспалительная инфильтрация, очаг (очаги) полного некроза с липофагами, аксональными шарами, зоной демиелинизации вокруг очага, лимфо- и плазмоцитарными периваскулярными инфильтратами в спинном мозге, полушариях большого мозга и его стволе, гипертрофия и пролиферация астроцитов, микроглиоцитов. В зрительном нерве также обнаруживаются очаги демиелинизации, лимфоцитарная инфильтрация и гипертрофированные астроциты [1].
Неврологические нарушения при БД связаны с преимущественным поражением спинного мозга и зрительных нервов. Чаще при этой патологии страдают шейный и грудной отделы спинного мозга. Клинические признаки БД зависят от распространенности демиелинизирующего процесса по длиннику и поперечнику спинного мозга, уровня поражения и колеблются от пирамидной недостаточности до симметричной пара- либо тетраплегии (66 %). Характерны чувствительные нарушения проводникового типа и тазовые (58 %) нарушения. Часто встречаются боли в конечностях нейропатического характера (33 %), симптом Лермитта и болезненные судороги (крампи) в ногах [8, 13]. После острого эпизода миелита при БД обычно наблюдается только частичное восстановление двигательных функций, при этом полный регресс всех неврологических симптомов в отличие от рассеянного склероза не характерен [6].
В случаях распространения демиелинизирующего процесса на продолговатый мозг могут присоединяться некупированная икота, рвота, несистемное головокружение, нистагм и нейроэндокринные нарушения (аменорея, галакторея) [5]. У части пациентов с БД отмечается сухость во рту вследствие сопутствующей воспалительной инфильтрации слюнных желез.
Поражение зрительных нервов при БД чаще (до 80 %) может предшествовать поражению спинного мозга либо возникать одновременно с ним, или присоединяться позже, через несколько месяцев или лет. Причем зрительные симптомы могут варьировать от субклинических в виде побледнения дисков зрительных нервов, выявляемых только при целенаправленном осмотре окулистом, до выраженной степени с развитием слепоты вследствие первичной атрофии. Невриты зрительных нервов при БД чаще бывают двусторонними (41 %), реже — односторонними (20 %). Характерны позитивные зрительные симптомы в виде появления болей в орбите, мерцающих огней, пятен, линий, изменения цветоощущения [1–4, 7]. При проведении ретинальной папиллярометрии у больных с БД выявляется истончение волокон зрительных нервов, выраженность которого коррелирует с остротой зрения, шкалами контрастного зрения и числом рецидивов [12].
В диагностике БД помимо оценки клинической картины существенное значение имеют исследование цереброспинальной жидкости (ЦСЖ) и проведение МРТ головного и спинного мозга. ЦСЖ в острой фазе заболевания характеризуется появлением незначительного (не более 50 клеток/мм3) лимфоцитарного плейоцитоза. Характерные для рассеянного склероза олигоклональные антитела в ЦСЖ для БД не типичны [5].
Характерный МРТ-признак БД — выявление в Т2W-режиме гиперинтенсивного очага (либо сливающихся очагов демиелинизации) с вовлечением как серого, так и белого вещества спинного мозга, вытянутого в кранио-каудальном направлении, протяженностью не менее трех позвоночных сегментов. Эти очаги способны к накоплению контраста, редко имеют масс-эффект. Диагностически значимо отсутствие характерных для рассеянного склероза очагов при одновременном проведении МРТ головного мозга [11, 15]. Диагностические критерии БД представлены в табл. 1.
При постановке диагноза важно учитывать критерии исключения БД — «красные флаги», которые включают клинические, лабораторные данные и МРТ-результаты исследования спинного мозга [15].
1. Клинические особенности или лабораторные результаты, подтверждающие диагноз «рассеянный склероз»:
— атипичное время обострения (ухудшение менее 4 часов, продолжительность обострения более 4 недель);
— частичный миелит с не характерной для БД картиной при МРТ спинного мозга;
— обнаружение в ЦСЖ олигоклональных антител.
2. Наличие коморбидных заболеваний:
— саркоидоз, лимфомы, паранеопластические синдромы;
— хронические инфекции (ВИЧ, сифилис).
3. Результаты МРТ головного и спинного мозга:
— очаги демиелинизации в Т2w с ориентацией перпендикулярно мозолистому телу («пальцы Доусона»);
— очаги демиелинизации, направленные от боковых желудочков в нижние отделы височных долей;
— субкортикальные очаги демиелинизации с вовлечением U-волокон;
— очаг демиелинизации в спинном мозге менее трех позвоночных сегментов.
Кроме того, следует учитывать, что похожие клинические симптомы могут выявляться при оптикомиелит-ассоциированных расстройствах, которые чаще наблюдаются в рамках системных заболеваний [6]. Диагностические критерии заболеваний, относящихся к оптикомиелит-ассоциированным расстройствам, в зависимости от наличия либо отсутствия NMO-IgG, представлены в табл. 2 [15].
/73.jpg)
В качестве метода патогенетического лечения первой линии при обострении БД предложено парентеральное назначение глюкокортикостероидов [1–7]. Предпочтительным является назначение метилпреднизолона в дозе 1 г/сут внутривенно в период от 1 до 5 дней. Возможна схема назначения преднизолона внутрь в дозе 1 мг/кг массы тела ежедневно в качестве монотерапии или в сочетании с азатиоприном (50 мг/сут с последующим повышением дозы до 2,5–3 мг/кг ежедневно). Препаратами второй линии лечения обострений БД являются внутривенные иммуноглобулины в дозе 0,4 г/кг в течение 5 дней или лечебный плазмаферез с заменой плазмы в размере 55 мл/кг в течение одного дня, на курс 7 процедур в последующем [5]. При отсутствии эффекта подобной терапии либо при повторном обострении рекомендовано назначение ритуксимаба в дозе 1000 мг внутривенно, повторяя каждые 2 недели в течение года. По данным мультицентрового исследования, проводившегося в 7 центрах в США и Англии, у 25 больных c БД эффективность ритуксимаба составила 80 % [10]. С 2013 года завершили клинические испытания и начали использоваться в лечении БД другие моноклональные антитела: экулизумаб, бортезомиб, тоцилизумаб, секукинумаб [15]. При этом положительно зарекомендовавший себя в лечении рассеянного склероза натализумаб при БД, напротив, оказался неэффективным [6].
Препаратом выбора третьей линии при некупирующемся обострении БД является митоксантрон 12 мг/м2 внутривенно ежемесячно в течение 6 месяцев [13]. В качестве профилактического способа предотвращения обострений при прогредиентно-ремиттирующем течении БД может назначаться иммуномодулирующая терапия (бетаферон, копаксон, ребиф, авонекс) [14]. Однако редкость этой патологии пока не позволила проведение контролируемых исследований.
Для симптоматической терапии болезненных судорог при БД показано назначение антиконвульсантов (энкорат, депакин). Коррекция спастичности достигается применением антиспастических средств (мидокалм, дантролен), инъекциями ботулотоксина в заинтересованные мышцы, интратекальным введением баклофена с помощью специальной помпы [5]. Регресс нейропатической боли возможен при использовании трициклических антидепрессантов (амитриптилин) или центральных средств (прегабалин, габапентин). В восстановительном периоде БД используют все виды физиотерапевтических про-цедур (парафин, озокерит, электрофорезы медиаторов), массаж, механотерапию и др.
За последние 10 лет (с 2008 года) в 5-й клинической больнице г. Минска и Минской областной клинической больнице (базах кафедры неврологии и нейрохирургии БелМАПО) мы наблюдали 8 пациенток с БД с характерной для этой патологии клинической картиной, положительных к NMO-Ig. При этом каждый случай течения болезни имел свои персонифицированные особенности. По этой причине мы решили представить последнее из данной серии клиническое наблюдение, отличавшееся рядом особенностей, сопоставимых с анализом современной литературы.
Клинический случай
Пациентка Ц., 65 лет, не работает, пенсионерка, заболела 28 сентября 2018 года, когда впервые без видимой причины в течение нескольких дней снизилось зрение на правый глаз до слепоты. По этому поводу была госпитализирована в отделение микрохирургии глаза, где ей диагностировали заднюю ишемическую оптикопатию справа (H53.8 по МКБ-10) и начали лечение. В отделении присоединились боли в межлопаточной области жгучего характера, а через несколько дней — задержка мочи и незначительная слабость и онемение правой ноги, которые быстро прогрессировали с развитием выраженного нижнего спастического парапареза. Ранее подобные состояния отрицает. 5 октября 2018 года пациентка была переведена для дообследования в неврологическое отделение Минской областной клинической больницы.
На момент перевода общее состояние пациентки удовлетворительное. Правильного телосложения, повышенного питания (индекс массы тела — 38). На коже спины воспалительные изменения по типу фолликулита. Артериальное давление — 160/100 мм рт.ст., пульс ритмичный — 98 уд/мин. Дыхание свободное. Соматический статус компенсирован. Неврологически: в сознании, ориентирована правильно, эмоционально лабильна, снижен фон настроения, когнитивный статус соответствует возрасту. Черепные нервы: амавроз справа, движения глазных яблок в полном объеме, лицо симметрично, голос и глотание не нарушены, язык по средней линии. Объем движений и сила в верхних конечностях достаточные, мышечный тонус в них не изменен. В ногах сила снижена в проксимальных и дистальных отделах до 2 баллов, мышечный тонус умеренно повышен по пирамидному типу. Глубокие рефлексы на руках средней живости D = S, коленные, ахилловы, подошвенные рефлексы низкие, патологические стопные знаки группы Бабинского и Россолимо с обеих сторон. Проводниковый тип расстройств поверхностных видов чувствительности с уровня Th7 книзу. Глубокая чувствительность сохранена. Нарушение функции тазовых органов по типу частичной задержки мочи. Пальценосовую пробу выполняет удовлетворительно. Самостоятельно не передвигается из-за выраженного нижнего спастического парапареза.
При обследовании: рутинные общеклинические и биохимические анализы крови без патологии. Иммуноглобулины классов G и М к волчаночному антикоагулянту и кардиолипину отрицательные. Иммуноферментные исследования исключили возможные инфекции (боррелиоз, туберкулез, сифилис, энтеровирус, цитомегаловирус, вирус Эпштейна — Барр, ВИЧ). В сыворотке крови NMO-IgG положительные. ЭКГ: ритм синусовый, горизонтальное положение электрической оси сердца. Консультация окулиста: visus OD/OS — движение руки у лица/0,4 с коррекцией + 2,0 = 0,5; диски зрительных нервов бледно-розовые, контуры четкие, артерии сужены. УЗИ почек: правая почка размерами 105 × 58 × 17 мм, в синусе киста до 15 мм в диаметре; левая почка размерами 111 × 58 × 17 мм, в синусе киста до 20 мм; осмотрена нефрологом — рекомендован прием фитохола в течение месяца.
МРТ головного мозга без контрастирования: определяется единичный очаг глиоза перивентрикулярно умеренно гиперинтенсивный в Т2 с четкими контурами размером до 5 мм в диаметре без перифокального отека (рис. 1); зрительные нервы не изменены; желудочковая система мозга не расширена, в субкортикальных зонах патологии нет (рис. 2);
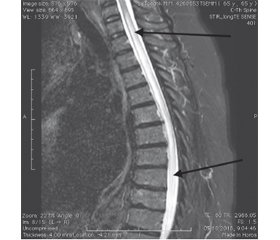
МР-ангиография — асимметрия позвоночных артерий (S < D). МРТ шейного и грудного отдела с контрастированием: определяется очаг повышения сигнала в Т2-режиме на уровне сегментов С6-Th10 с нерезким утолщением и накоплением контраста на уровне Th3–Th6 (рис. 3, 4); сколиотическая деформация грудного отдела позвоночника, множественные грыжи Шморля, краевые костные разрастания в телах позвонков; гипертрофия желтой связки, гемангиомы в телах позвонков Th5, Th11; задние протрузии межпозвонковых дисков до 2–3 мм на грудном уровне.
/75.jpg)
Назначено лечение: метилпреднизолон по схеме проведения пульс-терапии в дозе 1000 мг/сут в течение 5 дней с корректорами (омепразол), цефтриаксон и дискретный плазмаферез (3 сеанса с заменой 2,5 литра плазмы). После чего начата восстановительная терапия (ипигрикс), ЛФК, физиотерапия. Спустя 2 недели на фоне проводимой терапии состояние пациентки несколько улучшилось: острота зрения на правый глаз увеличилась до счета пальцев на расстоянии 1,5 метра, уменьшились боли, наросла сила в ногах до 3 баллов, появилась возможность самостоятельного передвижения в пределах палаты, однако развилось выраженное повышение мышечного тонуса в ногах по пирамидному типу. Была выписана домой для продолжения лечения.
23 января 2019 года без видимой причины состояние пациентки резко ухудшилось: остро появилась выраженная боль в области лопаток, усугубилась слабость в ногах, вновь присоединилось недержание мочи. Экстренно госпитализирована в неврологическое отделение по месту жительства, где был проведен курс пульс-терапии метилпреднизолоном 1 г/сут пять инфузий — без существенного улучшения. 29 января 2019 года переведена в отделение неврологии Минской областной клинической больницы. В этот период в неврологическом статусе у пациентки определялась нижняя вялая параплегия с низкими глубокими рефлексами с ног, средней живости — с рук, без четких патологических стопных знаков. Проводниковый тип гипестезии с уровня Th5–Th6 с нарушением суставно-мышечной чувствительности в пальцах стоп. Нарушение функции тазовых органов по типу задержки, чередующееся с недержанием мочи. Острота зрения на правый глаз резко снижена до счета пальцев; на глазном дне бледность правого зрительного нерва вследствие его атрофии. Назначен курс внутривенных иммуноглобулинов (октагам) в дозе 0,4 мг/кг в течение 5 дней. После чего вновь отмечена положительная динамика: появились движения в левой ноге, восстановилась функция тазовых органов, однако снова повысился мышечный тонус в ногах по пирамидному типу. Последующее динамическое наблюдение в течение 5 месяцев с проведением повторных курсов восстановительного лечения показало частичный регресс неврологических симптомов с сохранением умеренного нижнего спастического парапареза.
Представленное нами клиническое наблюдение пациентки при наличии всех основных и дополнительных диагностических критериев БД имело ряд особенностей:
1) поздний возраст начала заболевания (65 лет), при этом классическое рецидивирующее течение с двумя явными обострениями демиелинизирующего процесса;
2) в дебюте БД почти одновременное развитие тяжелого оптического неврита справа и выраженного продольно-поперечного миелита (очаг обширного поражения спинного мозга захватывал в длину 12 сегментов);
3) несмотря на то, что максимум поражения спинного мозга при МРТ нами отмечен на грудном уровне, также было выявлено вовлечение нижнешейного отдела, что в сочетании с выраженными нейропатическими болями считается не характерным для пациентов с БД, положительных к NMO-IgG [6];
4) в начале болезни, при выраженном поражении преимущественно грудного отдела спинного мозга, мышечный тонус в ногах у пациентки был низким и только через 1 неделю начал повышаться по пирамидному типу, что, вероятно, связано с развитием диашиза пораженных олигодендроцитов;
5) несмотря на одностороннее резко выраженное снижение остроты зрения на правый глаз, в остром периоде дебюта состояние диска зрительного нерва не менялось, а его бледность развилась только спустя несколько месяцев;
6) в процессе активного имуносупрессивного лечения (пульс-терапия метилпреднизолоном, плазмаферез) в дебюте мы наблюдали только частичное восстановление двигательных функций конечностей, при этом зрение на правый глаз улучшилось незначительно;
7) повторное обострение БД развилось за короткий срок (через 3 месяца) и проявилось более выраженным изолированным поражением спинного мозга на грудном уровне по типу поперечного миелита без ухудшения со стороны зрительных функций. Умеренный эффект получен только после проведения курса внутривенных иммуноглобулинов по стандартной схеме.
Таким образом, БД и другие оптикомиелит-ассоциированные расстройства относятся к числу редко встречающихся клинических форм демиелинизирующих заболеваний центральной нервной системы. Несмотря на относительную редкость, эта патология имеет четко очерченную, хотя и полиморфную, клиническую картину и строгие диагностические критерии. При условии своевременной диагностики и адекватной патогенетической терапии БД имеет высокую 5-летнюю выживаемость и потенциальную возможность восстановления утраченных моторных и зрительных функций.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.

/72.jpg)
/73.jpg)
/74.jpg)
/75.jpg)