Журнал «Почки» Том 9, №1, 2020
Вернуться к номеру
Мультимодальна візуалізація раку передміхурової залози
Авторы: Король П.О.(1, 2), Ткаченко М.М.(3), Щербіна О.В.(2)
(1) — Київська міська клінічна лікарня № 12, м. Київ, Україна
(2) — Національна медична академія післядипломної освіти імені П.Л. Шупика, м. Київ, Україна
(3) — Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Нефрология
Разделы: Справочник специалиста
Версия для печати
В огляді літератури розглянуті ключові питання клінічного застосування методів мультимодальної візуалізації раку передміхурової залози (РПЗ). Світова наукова спільнота на сучасному етапі докладає інтенсивних зусиль для розробки інструментів стратифікації ризику для допомоги в прийнятті клінічних рішень та оптимізації догляду за пацієнтами з РПЗ. Мультимодальна візуалізація відіграє ключову роль у веденні пацієнтів з РПЗ завдяки її неінвазивному підходу до оцінювання наявності та масштабів первинного пухлинного процесу, метастатичного поширення. Активно впроваджується в клінічну практику перспективний напрямок ядерної медицини — тераностика. Основний принцип тераностики полягає в тому, щоб «бачити, що ви лікуєте», поєднуючи діагностичні маркери з терапевтичними радіолігандами.
В обзоре литературы рассмотрены ключевые вопросы клинического применения методов мультимодальной визуализации рака предстательной железы (РПЖ). Мировое научное сообщество на современном этапе прикладывает интенсивные усилия для разработки инструментов стратификации риска, помогающих в принятии клинических решений и оптимизации диагностического ведения пациентов с РПЖ. Мультимодальная визуализация играет ключевую роль в управлении пациентами с РПЖ благодаря ее неинвазивному подходу к оценке наличия и масштабов первичного опухолевого процесса, метастатического распространения. Активно внедряется в клиническую практику перспективное направление ядерной медицины — тераностика. Основной принцип тераностики заключается в том, чтобы «видеть, что вы лечите», сочетая диагностические маркеры с терапевтическими радиолигандами.
The literature review presents key issues of the clinical application of multimodal imaging methods in prostate cancer. The world scientific community at the present stage exerts intensive efforts to develop risk stratification tools to help making clinical decisions and optimizing the care of patients with prostate cancer. Multimodal imaging plays a key role in the management of prostate cancer patients for its non-invasive approach to assessing the presence and extent of the primary tumor process, metastatic spread. A promising area of nuclear medicine, theranostics, is being actively introduced into clinical practice. The basic principle of theranostics is to “see that you are treating” by combining diagnostic markers with therapeutic radioligands.
магнітно-резонансна томографія; позитронно-емісійна томографія; радіофармпрепарат; рак передміхурової залози; огляд
магнитно-резонансная томография; позитронно-эмиссионная томография; радиофармпрепарат; рак предстательной железы; обзор
magnetic resonance imaging; positron emission tomography; radiopharmaceutical; prostate cancer; review
Рак передміхурової залози (РПЗ) є класичною моделлю неоднорідності пухлинного процесу з різноманітним спектром клінічних фенотипових станів, що лежать в основі гістопатологічної та молекулярної неоднорідності [1].
Світова наукова спільнота на сучасному етапі докладає інтенсивних зусиль для розробки інструментів стратифікації ризику з метою допомоги в прийнятті клінічних рішень та оптимізації догляду за пацієнтами із РПЗ, зазвичай поєднуючи дослідження рівня сироваткового простатспецифічного антигена (PSA), гістологічну шкалу Глісона й оцінку анатомічної міри первинної пухлини [2]. Променева візуалізація відіграє ключову роль у веденні пацієнтів із РПЗ завдяки її неінвазивному підходу до оцінювання наявності та масштабів первинного пухлинного процесу, метастатичного поширення [3]. Найпоширенішими ділянками метастазування РПЗ є регіонарні лімфатичні вузли (ЛВ) та кістки. Вісцеральні метастази зазвичай рідко зустрічаються й асоціюються з кастраційною резистентною формою захворювання [4]. Кілька способів візуалізації використовуються в різних клінічних сценаріях із помітними географічними варіаціями застосування, пов’язаними з доступністю того чи іншого методу та нормативними обмеженнями. Триває вдосконалення технології променевої візуалізації, що дозволяє диференціювати поширення пухлинного процесу на більш ранньому етапі захворювання [5]. У наступних розділах подано загальний опис найважливіших способів променевої візуалізації, що використовуються в пацієнтів із РПЗ.
Магнітно-резонансна томографія
Мультипараметрична магнітно-резонансна томографія (мпМРТ) органів таза дозволяє провести анатомічну оцінку передміхурової залози з чітким зображенням зональної анатомії та роздільної здатності м’яких тканин, що перевершує на сьогодні за діагностичною інформативністю будь-яку іншу модальність. МРТ передміхурової залози зазвичай виконується на томографах із силою магнітного поля 1,5 або 3 Т за допомогою багатоканальної тазової фазової решітки котушки. Використання ендоректальної котушки збільшує співвідношення «сигнал/шум» й історично вважається пріоритетним, особливо в окремих випадках (пацієнти з великою вагою, застосування магнітів із силою магнітного поля більше ніж 1,5 Т). Але, з іншого боку, застосування даної котушки призводило до дискомфорту пацієнта під час обстеження, артефактів зображень та збільшення терміну візуалізації. Зараз немає єдиної думки щодо використання ендоректальної котушки [6].
Мультипараметрична МРТ передміхурової залози базується на поєднанні анатомічної (T1-зважені та багатоплощинні Т2-зважені зображення) та функціональної послідовності (дифузійне зважене зображення з відображенням очевидних карт коефіцієнта дифузії та динамічним збільшенням контрасту). Додавання цих функціональних послідовностей підвищує чутливість і позитивне прогностичне значення МРТ [7]. Ефективність мпМРТ передміхурової залози багато в чому залежить від отримання високоякісних зображень та використання адекватного технічного обладнання в поєднанні з експертним досвідом спеціаліста. Система звітності PI-RADS та даних стосовно РПЗ була розроблена у 2012 році для подолання надмірних розбіжностей у питаннях отримання та інтерпретації діагностичних зображень та упорядкування звітності між медичними закладами [8]. Слід підкреслити, що PI-RADS не спрямована на збільшення загальної швидкості виявлення всіх типів РПЗ. Система звітності PI-RADS призначена для виявлення клінічно значущих форм РПЗ, що визначаються як ті пухлини, що можуть впливати на життєвий період пацієнта. Сьогодні не існує єдиного визначення клінічної значущості РПЗ, найпоширенішим критерієм є наявність пухлини, що за шкалою Глісона має показник не менше 7, а об’єм — не менше 0,5 см3.
МРТ усього тіла — ефективна методика діагностичної візуалізації, при застосуванні якої завдяки високому контрасту м’яких тканин можна отримувати анатомічні деталі структур, що досліджуються за відсутності іонізуючого випромінювання. Дана методика широко використовується для візуалізації кісткового мозку, м’яких тканин та вісцеральних метастазів, а також із метою стадіювання пухлинного процесу. Комбіноване застосування анатомічних послідовностей (T1- та T2-зважена візуалізація) та дифузійно зважене зображення перетворюють МРТ усього тіла в гібридну техніку, що забезпечує отримання поєднаної морфологічної та функціональної діагностичної інформації. Слід зазначити, що дані наукової літератури дозволяють припустити, що МРТ усього тіла в контексті виявлення РПЗ може мати меншу чутливість щодо ПЕТ-візуалізації [9–12]. Однак необхідний подальший науковий пошук для отримання нових обнадійливих даних щодо оцінки можливої додаткової ролі методів МРТ та ПЕТ у діагностиці РПЗ.
Комп’ютерна томографія
Комп’ютерна томографія (КТ) не вважається основним методом візуалізації в діагностиці РПЗ. Причиною тому є низький контраст м’яких тканин та відсутність молекулярної діагностичної інформації. Основне завдання КТ — оцінка регіонарного та дистанційного метастазування. У даному контексті КТ має більш низьку діагностичну інформативність порівняно з гібридними методами діагностичної візуалізації, такими як ПЕТ/КТ або ПЕТ/МРТ. Недоліком КТ та МРТ для оцінки пухлинного ураження ЛВ є залежність методу від морфологічних критеріїв, наприклад форми та розмірів [13]. Метастатично уражені ЛВ можуть мати нормальний розмір, а збільшенні неметастатичні ЛВ можуть бути наслідком реактивної гіперплазії як результату інфекційного або запального процесу.
Сцинтиграфія кісток
Сцинтиграфія кісток (СК) із застосуванням 99mTc, міченого фосфонатами, забезпечує діагностичну візуалізацію всього скелета та дозволяє візуалізувати введення радіоіндикатора в матрицю гідроксіапатиту кістки пропорційно кровотоку та активності реконструкції кісток. Слід зазначити, що за даними сцинтиграфії кісток запальні зміни можуть імітувати метастатичний процес [14].
ПЕТ/КТ
ПЕТ/КТ набуває все більшого значення в діагностичному виявленні РПЗ. Сьогодні використовується декілька радіомаркерів, які продемонстрували ефективність при виявлення РПЗ у різних клінічних умовах [15].
ПЕТ/КТ із 18F-фтордизоксиглюкозою
Незважаючи на широке застосування 18F-фтордизоксиглюкози (18F-ФДГ) у ПЕТ/КТ в онкологічній практиці, даний метод не відіграє важливої ролі у візуалізації РПЗ через його обмежену чутливість при локалізованих і ранніх метастатичних формах захворювання [16]. Збільшення поглинання 18F-ФДГ частіше спостерігається при агресивних аберантних гістологічних формах РПЗ (наприклад, нейроендокринній) [17, 18].
ПЕТ/КТ із 18F-фторидом натрію
Активне поглинання пухлиною 18F-фториду натрію (18F-NaF) не забезпечує прямої візуалізації наявності пухлинних клітин, але відображає посилення припливу крові, ремоделювання кісткової тканини, а також остеобластичну активність, що пов’язана з кістковими метастазами. Порівняно з 99mTc-фосфатними комплексами 18F-NaF має краще поглинання в кістковій тканині та більш швидкий м’якотканинний кліренс (завдяки мінімальному зв’язуванню з білками сироватки крові), що призводить до більш високого контрасту між кістками та фоном, а також скорочення часу обстеження [19]. На сучасному етапі немає прямих доказів, які б підтверджували переважання клінічної користі від рутинного застосування 18F-NaF ПЕТ/КТ щодо СК [20]. Іншим обмеженням застосування 18F-NaF ПЕТ/КТ у хворих на РПЗ є її здатність візуалізувати лише кісткову тканину, що робить цей метод менш привабливим в епоху діагностичної молекулярної візуалізації РПЗ.
ПЕТ/КТ із холіном
ПЕТ/КТ із холіном заснована на підвищеному поглинанні й обороті фосфатидилхоліну в ракових клітинах, який є важливою частиною фосфоліпідів у клітинній мембрані [21]. Перевагою 11C над 18F є нижня екскреція сечі, яка полегшує діагностичну оцінку передміхурової залози та забезпечує зменшення опромінення пацієнта, що обумовлене коротким періодом напіввиведення — 20 хв [22]. Роль ПЕТ/КТ із холіном обмежена в діагностиці і первинному стадіюванні РПЗ через відносно низьку чутливість даного методу. Основним сектором застосування ПЕТ/КТ із холіном є діагностична візуалізація РПЗ в умовах біохімічного рецидиву (БР). ПЕТ/КТ із холіном у багатьох установах з часом була замінена на ПЕТ/КТ із простатспецифічним мембранним антигеном (ПСМА), хоча у США та деяких інших країнах ще тільки очікується затвердження нормативно-правового забезпечення для використання ПСМА. Потенційна роль візуалізації ПЕТ/КТ із холіном може розглядатися в незначній когорті пацієнтів із РПЗ із ПСМА-негативним сканом, однак показання до застосування даного методу залишається дискусійним та вимагає подальшого вивчення.
ПЕТ/КТ із 18F-флуцикловіном
18F-флуцикловін (анти-1-аміно-3-18F-флуроциклобутан-1-карбонова кислота (аксумін; Blue Earth Diagnostics, Inc.)) є аналогом амінокислоти L-лейцину.
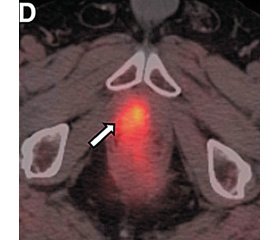
ПЕТ/КТ із 18F-флуцикловіном відображає нерегульований трансмембранний транспорт амінокислот, який відбувається при РПЗ, внаслідок посилення метаболізму та синтезу білка [23] (рис. 1). Аксумін був затверджений у 2016 році Управлінням з харчових продуктів та лікарських засобів для візуалізації ПЕТ у чоловіків із підозрою на біохімічний рецидив РПЗ [24, 25].
ПЕТ/КТ із ПСМА
ПСМА — трансмембранний глікопротеїн II типу з активністю ферментативної карбоксипептидази, що проявляє високу експресію до нормальної тканини передміхурової залози і значно виражений у мембранах клітин РПЗ [26]. ПСМА, здається, є найбільш ефективним лігандом у зв’язку з вираженою експресією більшості клітин РПЗ, позитивною кореляцією його експресії зі ступенем пухлинного процесу та стадією захворювання, низькою наявністю в кровотоку, внаслідок його трансмембранної локалізації, інтерналізації та утримання в пухлинних клітинах після зв’язування [27]. Крім того, в епоху персоніфікованої медицини існує підвищений інтерес до використання ПСМА з терапевтичною метою, що сприяє поєднуванню візуальної діагностики з прицільною радіонуклідною терапією. ПСМА має високу специфічність не тільки до тканин передміхурової залози. У нирках та тонкому кишечнику спостерігаються фізіологічно висока експресія та аномальна експресія при різних доброякісних та злоякісних непростатичних процесах, патології кісток скелета (переломи, фіброзна дисплазія) тощо [28, 29]. Завдяки високій чутливості ПСМА швидко став передовим та доступним трейсером для візуалізації РПЗ та мав високі показники діагностичної інформативності навіть при низьких рівнях ПСМА. На сучасному етапі найбільш широко використовується трейсер 68Ga-ПСМА-11. Інші трейсери, що часто застосовуються в клінічній практиці, є радіофторованими: 18F-DCFPyL-ПСМА, 18F-DFCBC-ПСМА та 18F-ПСМА-1007. Останній із них потенційно цікавий для майбутніх застосувань завдяки своєму переважно гепатобіліарному кліренсу на відміну від ниркового кліренсу 68Ga-ПСМА-11. Завдяки цьому він може подолати деякі обмеження в оцінці локального рецидиву та локорегіонарної патології тазових органів [30].
ПЕТ/КТ із 18F-ФДГТ
18F-16b-фтор-5a-дигідротестостерон (18F-ФДГТ) викликає особливий інтерес для діагностики стійких до кастрації форм РПЗ. Він орієнтований на рецептор андрогенів (АР), який зі своїми природними лігандами тестостерону та 5a-дигідротестостерону відіграє ключову роль у розвитку чоловічої статевої диференціації. Функціональні зміни АР пов’язані з розвитком та прогресуванням РПЗ. Тому практично всі пацієнти реагують на андрогендеприваційну терапію, однак майже незмінно протягом 2–3 років прогресують до стійкого до кастрації стану, незважаючи на низький рівень тестостерону [31]. Це пов’язано з неповним виснаженням андрогенів та стійкою сигналізацією АР через такі механізми, як мутація, переекспресія та активація, що сприяє росту РПЗ та метастазуванню в пацієнтів, які отримують андрогендеприваційну терапію.
Слід зауважити, що 18F-ФДГТ ПЕТ/КТ на сучасному етапі використовується виключно для дослідницьких цілей. Попередні дослідження щодо застосування 18F-ФДГТ ПЕТ/КТ у пацієнтів із резистентними до кастрації формами РПЗ продемонстрували безпеку, доцільність, високу точність виявлення вогнищевих уражень та ефективні показники виживаності [32, 33].
ПЕТ/МРТ
Основними перевагами ПЕТ/МРТ перед ПЕТ/КТ є більш висока м’якотканинна контрастність тканин та менша доза опромінення для пацієнта. Однак залишаються деякі питання, які перешкоджають широкому застосуванню гібридних ПЕТ/МРТ-систем у клінічній практиці, а саме питання, що пов’язані з корекцією затухання МР та валідацією кількісних показників поглинання (наприклад, точність вимірювання відсотка стандартизованого накопичення). Слід зазначити, що літературні дані засвідчили потенціал у контексті покращення показників діагностичної інформативності візуалізації первинного РПЗ за допомогою комбінованого ПЕТ/МРТ із ПСМА [34, 35].
Огляд показників діагностичної візуалізації за різними клінічними сценаріями
Метод МРТ завдяки високій роздільній здатності м’яких тканин зарекомендував себе як метод вибору з метою оцінки первинних пухлин передміхурової залози і застосовується в клінічній практиці вже понад три десятиліття. Протягом більшої частини цього часу метод МРТ переважно використовувався в узкоспеціалізованих академічних центрах із певним досвідом, але останнім часом його застосовують більш часто, частково за рахунок впровадження PI-RADS у 2012 році [36, 37]. PI-RADS стандартизував сканування та отримання діагностичних висновків, заснованих на інтерпретації пошкоджень за Т2-зваженими зображеннями, коефіцієнта дифузії та динамічній контрастності. Пухлини передміхурової залози зазвичай демонструють гомогенно низьку інтенсивність сигналу Т2, обмеження дифузії та раннє посилення. Розроблено категорії оцінки ураження, що становлять від 1 до 5 і відображають імовірність клінічної значущості РПЗ. Таким чином, PI-RADS-1 передбачає дуже низьку ймовірність клінічно значущого раку, тоді як PI-RADS-5 — дуже високу ймовірність, а PI-RADS-3 — відповідно, проміжну (а в клінічній практиці — невизначену) ймовірність. У багатоцентровому проспективному дослідженні [38] було порівняно діагностичну інформативність результатів дослідження мпМРТ із даними трансректальної ультразвукової керованої біопсії (TRUS) у 576 пацієнтів із підвищеним ризиком виникнення РПЗ. За результатами отриманих даних мпМРТ була більш чутливою, ніж керована біопсія TRUS (93 % для мпMРТ, 48 % для TRUS, P < 0,0001), але менш специфічною (41 % для мпМРТ, 95 % для TRUS, P < 0,0001).
Діагностичну роль МРТ із метою виявлення клінічно значущої групи РПЗ було визначено у великому метааналізі, що складався з 48 досліджень та включав 9613 пацієнтів [39]. Середнє негативне прогностичне значення мпМРТ для виявлення клінічно значущої групи РПЗ становило 88,1 %, хоча результати значно варіювали через гетерогенність у дизайні дослідження [40]. Хибнонегативні мпМРТ-знахідки зазвичай пов’язані з меншим розміром пухлини, мультифокальністю, наявністю постзапальних змін, що спотворюють нормальну зональну анатомію та розташування пухлини в перехідному періоді [41]. У цьому полягає потенційне додаткове значення ПЕТ/МРТ, що забезпечує покращення швидкості виявлення РПЗ, що зазвичай не визначається шляхом здійсненя мпМРТ (рис. 2) [24]. У ретроспективному дослідженні [35] 32 пацієнтів із підтвердженою біопсією РПЗ автори розглядали особливості регіону порівняння чутливості та специфічності ПСМА-11 ПЕТ/МРТ із мпМРТ. ПСМА-11 ПЕТ/МРТ показала більш високу чутливість, ніж ізольована мпМРТ (74 проти 50 %; P < 0,001), тоді як обидва методи дослідження були однаково специфічними.
Важливим є діагностичне значення мпМРТ в оцінці наявності екстрапростатичного пухлинного поширення, що ефективно можна оцінити на Т2-зваженому зображенні у вигляді ділянки широкого контакту пухлини з передміхуровою капсулою, облітерації ректопростатичного кута та асиметрії нервово-судинного пучка. Ознаками інвазії сім’яних міхурців є низький сигнал на Т2-зваженому зображенні в сім’янних міхурцях, втрата нормальної канальцевої архітектури везикул сім’янних міхурців [42]. Систематичний аналіз робіт інших науковців [43] показав помірну чутливість, але дуже високу специфічність та негативне прогностичне значення мпМРТ при прогнозуванні екстрапростатичного розширення та інвазії сім’янних міхурців.
Незважаючи на те, що МРТ є основною модальністю діагностичної візуалізації оцінки екстрапростатичного поширення, нещодавно виник інтерес до використання комбінованого дослідження ПСМА ПЕТ/МРТ для оцінки екстрапростатичного поширення [44].
Частота виявлення метастазів у регіональні лімфовузли при первинній діагностиці локалізованих форм РПЗ залежить зазвичай від рівня ризику. Пацієнти з дуже низьким та низьким рівнем ризику (наприклад, ступінь за шкалою Глісона дорівнює 6, ПСА — 10 нг/мл,
стадія Т1–Т2а) мають надзвичайно низьку ймовірність метастазування в регіональні ЛВ [45]. Точна оцінка стану залучення в пухлинний процес регіональних ЛВ допомагає при прийнятті терапевтичних рішень, прогнозуванні ризику рецидиву й оцінці прогнозу хворих на РПЗ.
Існує великий інтерес до застосування передопераційної ідентифікації пухлинного процесу на основі оцінки метастазів у ЛВ із метою оптимізації планування хірургічного та ад’ювантного або неоад’ювантного лікування. На сучасному етапі в клінічній урологічній практиці зазвичай орієнтуються на валідовані клінічні номограми в контексті прийняття правильного рішення щодо видалення тазових ЛВ, при цьому розрахунковий оціночний ризик більше 5 % вважається показанням для проведення розширеної дисекції тазового ЛВ. [46, 47]. Незважаючи на те, що дисекція тазових ЛВ є золотим стандартом для верифікації залучення їх у пухлинний процес, це інвазивний, трудомісткий підхід, який багато в чому залежить від хірургічної майстерності та шаблонів. Роль методів променевої візуалізації для виявлення метастазів у регіональні ЛВ є суперечливою та знаходиться в стадії розвитку [6]. У метааналізі, що включав 24 дослідження [48], виявлено такі значення показників чутливості та специфічності в контексті виявлення злоякісних ЛВ у пацієнтів із РПЗ: 42 та 82 % відповідно — для КТ та 39 та 82 % відповідно — для МРТ. За данними іншого метааналізу, що включав 24 дослідження, у 2928 пацієнтів, хворих на РПЗ, здійснювали оцінку злоякісних ЛВ шляхом виконання мпМРТ [49]. Чутливість методики дорівнювала 56 %, специфічність — 94 %. Слід зазначити, що зараз жодна модальність діагностичної візуалізації не мала оптимальних показників діагностичної інформативності при оцінці виявлення метастатичних ЛВ у пацієнтів із РПЗ. Дослідження із застосуванням ПЕТ-маркерів 18F-холіну, 11С-холіну та 18F-флуцикловіну в контексті виявлення злоякісних ЛВ мали високі показники специфічності, але низькі — чутливості (від 40 до 50 %) [49–51].
У проспективному дослідженні, що нараховувало 122 пацієнтів [52], науковцями було оцінено показники діагностичної інформативності 68Ga-ПСМА-11 ПЕТ/МРТ для передопераційних груп хворих на РПЗ. Було виявлено високі параметри чутливості, специфічності та точності залучення метастазів у регіональні ЛВ хворих на РПЗ (68,8, 100 та 93 % відповідно). Той факт, що всі отримані зображення метастатичних ЛВ були розміром менше ніж 4 мм, вказував на обмежену чутливість для метастазів дуже малого розміру. Ці висновки було узгоджено з висновками інших авторів [53, 54], які наголошують на високій ефективності застосування ПСМА ПЕТ/КТ при виявленні злоякісних ЛВ невеликих розмірів, які не відповідають звичайним морфологічним критеріям.
Діагностична візуалізація віддалених метастазів у хворих на РПЗ
Найбільш поширеною локалізацією віддалених метастазів у хворих на РПЗ є кістки скелета, але поширеність їх мінлива і залежить від категорії ризику. Наприклад, у пацієнтів із нещодавно діагностованими формами РПЗ, що виявлені за допомогою передопераційного стадіювання шляхом виконання мпМРТ, поширеність кісткових метастазів становила лише 1,5 % [18].
Хоча деякі автори рекомендують для виявлення скелетних метастазів застосування остеосцинтиграфії та КТ, дані методики, незважаючи на високі показники чутливості, мають низькі показники рівня ПСА (менше ніж 20 нг/мл) та низький показник специфічності. У зв’язку з цим вдосконалюються новітні методи діагностичної візуалізації РПЗ. Слід зазначити, що остеосцинтиграфія ефективно застосовується з метою оцінки терапевтичної відповіді на лікування і є незалежним прогностичним маркером виживання в пацієнтів із метастазами РПЗ [55].
Важливу роль для візуалізації при запущених стадіях РПЗ відіграє виявлення пацієнтів із несприятливими ознаками, а саме метастазами в кістки поза осьовим скелетом, вісцеральними метастазами. Цим пацієнтам з несприятливими прогностичними умовами зазвичай рекомендоване призначення прицільної променевої терапії та хіміотерапії [56].
У ретроспективному дослідженні, що включало 126 пацієнтів [57], порівнювались показники діагностичної інформативності 68Ga-ПСМА ПЕТ та остеосцинтиграфії з 99mTc-метилдифосфонатом із метою виявлення кісткових метастазів у змішаній когорті пацієнтів із РПЗ у ранній стадії захворювання, рецидивуючим пухлинним процесом та прогресуючим РПЗ. Чутливість та специфічність даних методів дослідження становила 98,7–100 та 88,2–100 % відповідно — для методу 68Ga-ПСМА ПЕТ, 86,7–89,3 та 60,8– 96,1 відповідно — для остеосцинтиграфії.
Ці висновки підкреслюють, що в пацієнтів із РПЗ у діагностичному пошуку метастатичного процесу надають перевагу методам КТ, МРТ та остеосцинтиграфії. Незважаючи на те, що метод 68Ga-ПСМА ПЕТ у контексті діагностики метастатичного процесу РПЗ показав більш високу діагностичну інформативність, його прогностична цінність у хворих на РПЗ ще до кінця не вивчена.
Діагностична візуалізація відіграє ключову роль в оцінці рецидиву захворювання за допомогою надання інформації стосовно наявності, обсягу та поширення пухлинного процесу, що має глибокі наслідки для управління терапевтичним процесом та прийняття клінічних рішень [58, 59]. Мультипараметрична магнітно-резонансна томографія — це найбільш широко вивчений метод візуалізації для виявлення місцевого рецидиву після проведення системної терапії. Найбільш поширеним місцевим рецидивом РПЗ після радикальної простатектомії є неовезикоуретральний анастомоз [60]. За даними мпМРТ локальний рецидив зазвичай являє собою вузловату м’якотканинну масу проміжної інтенсивності сигналу із супутнім дифузійним обмеженням і швидким раннім посиленням на динамічному Т2-зваженому контрастному зображенні. В умовах променевої терапії дифузійно-зважена МРТ та динамічні зображення з підсиленим контрастом дозволяють точно виявити локальний рецидив пухлинного процесу в передміхуровій залозі [61, 62].
У проведеному метааналізі діагностичної інформативності методу мпМРТ [63] у контексті виявлення локальних рецидивів РПЗ після радикальної простатектомії показники чутливості та специфічності дорівнювали 82 та 87 % відповідно. Ці висновки підтверджено іншим метааналізом, що включав 718 пацієнтів [64], яким було здійснено мпМРТ для виявлення локального рецидиву після радикальної простатектомії з об’єднаним розрахуванням параметрів діагностичної інформативності. Значення показників чутливості та специфічності даного дослідження дорівнювали 84 та 85 % відповідно. Слід зазначити, що існують чіткі клінічні сценарії діагностики локального рецидиву РПЗ, при якому метод ПСМА ПЕТ/МРТ може підвищувати ефективність виявлення MР-окультного ураження, наприклад після брахітерапії. Ще один сценарій застосування методу ПСМА ПЕТ/МРТ використовується з метою діагностичної оцінки локальних рецидивів після фокальної абляційної терапії (наприклад, після високоінтенсивної спрямованої ультразвукової терапії або кріоабляції) (рис. 3) [65]. Обмеженням застосування на сучасному етапі найбільш широко використованого ПЕТ-трейсера 68Ga-ПСМА-11 є його виділення із сечею та висока радіоактивність у сечовому міхурі [2]. Активне впровадження в діагностичну практику нових діагностичних трейсерів, таких як нещодавно представлений 18F-ПСМА-1007, який виводиться з організму переважно гепатобіліарним шляхом, може суттєво покращити виявлення й оцінку локорегіональних рецидивів РПЗ та регіонарних ЛВ малого таза навколо сечоводу.
Незважаючи на те, що 18F-флуорометилхолін, 11С-холін та 18F-флуцикловін ПЕТ/КТ використовуються в пацієнтів із РПЗ за умов рецидивуючого підвищення рівнів ПСА, дані трейсери мають обмежену ефективність при низьких рівнях ПСА. Однак останні літературні дані свідчать про те, що зображення з орієнтованими на ПСМА радіолігандами є чутливими для виявлення злоякісних пухлин РПЗ навіть при низьких рівнях ПСА [66].
У нещодавньому метааналізі, що базувався на 43 дослідженнях 5113 пацієнтів [67], було проаналізувано діагностичну працездатність радіотрейсерів, що орієнтовані на ПСМА з метою виявлення РПЗ, стратифікованого рівнем ПСА. Коефіцієнт об’єднаного виявлення РПЗ при аналізі стратифікованої підгрупи становив 70,2 % для всієї когорти, для рівня ПСА, меншого за 0,5 нг/мл, дорівнював 44,9 %, для рівня ПСА, меншого за 2 нг/мл, коефіцієнт становив 93,9 %. Слід зазначити, що за результатами аналізу 5–10 % пацієнтів із РПЗ виявились ПСМА-негативними [68]. Автори дійшли висновку, що ПСМА-радіотрейсери, ймовірно, ефективні для виявлення пухлинного процесу при низьких рівнях ПСА, але спостерігалась значна неоднорідність досліджень через різницю в критеріях, що застосовувались, методології, типах радіотрейсерів, еталонних стандартах.
У багатоцентровому дослідженні [69], що включало 213 хворих на РПЗ (середній рівень ПСА — 1,0 нг/мл,
діапазон — 0,2–93,5 нг/мл), оцінювали вплив 18F-флуцикловіну на клінічне управління ПЕТ/КТ-дослідженням (у 59 % пацієнтів клінічне управління було змінено). Швидкість виявлення патологічного вогнища порівнювалась із результатами інших методів діагностичної візуалізації (остеосцинтиграфія, КТ та МРТ). Загальний показник виявлення пацієнтів із РПЗ за допомогою ПЕТ/КТ із 18F-флуцикловіном становив 57 % при позитивній кореляції з рівнями ПСА (50 % при рівні ПСА 0,5–1,0 нг/мл, 31 % — при рівні ПСА 0,5 нг/мл).
У ретроспективному дослідженні [70] було порівняно коефіцієнт діагностичного виявлення метастазів у регіональні ЛВ за допомогою методу ПЕТ/КТ із 18F-холіном та ПЕТ/КТ із 68Ga-ПСМА із використанням гістопатології з виділеного ЛВ таза, що був використаний як еталонний стандарт. Науковцями було досліджено коефіцієнт швидкості виявлення регіональних метастазів за допомогою ПЕТ-візуалізації у співвідношенні з величиною регіонального ЛВ. Метод 68Ga-ПСМА ПЕТ/КТ мав кращі показники діагностичної ефективності, ніж ПЕТ/КТ із 18F-холіном при виявленні метастазів у ЛВ меншого розміру. При застосуванні методу 68Ga-ПСМА ПЕТ/КТ коефіцієнт швидкості виявлення регіональних ЛВ розміром 7,4 і 4,9 мм (довгий і короткий діаметр) дорівнював 90 %; при використанні ПЕТ/КТ із 18F-холіном коефіцієнт швидкості виявлення регіональних ЛВ розміром 11,2 та 6,3 мм також становив 90 %. Таким чином, за результатами аналізу метод 68Ga-ПСМА ПЕТ/КТ показав більш високу чутливість при діагностиці метастазів РПЗ у регіональні ЛВ меншого розміру [66] (рис. 3).
В іншому проспективному дослідженні [71], що включало 635 чоловіків, хворих на РПЗ, було використано складений еталонний стандарт та незалежний маскований багатопрочитаний аналіз. У результаті були встановлені не тільки високі показники виявлення та позитивне прогнозне значення (84–92 %, залежно від еталонного стандарту), але і високе значення локалізації рецидивуючої пухлини, навіть при низьких рівнях ПСА (коефіцієнт швидкості виявлення пухлинного процесу дорівнював 84 % при значенні ПСА
2 нг/мл).
Незважаючи на широке впровадження та клінічну привабливість радіотрейсерів, орієнтованих на ПСМА, їх показники діагностичної інформативності та потенціал комбінованого діагностичного та терапевтичного застосування знаходяться на стадії вивчення, ще немає опублікованих вірогідних результатів проспективних випробувань та порівняльної характеристики показників аналізу ПСМА-трейсерів з іншими радіологічними маркерами [72, 73].
Перспективний напрямок ядерної медицини: тераностика
Крім діагностичних можливостей, ПСМА-маркери знаходять ефективне застосування в терапевтичній клінічній практиці [74]. Обґрунтування тераностики полягає в тому, щоб «бачити, що ви лікуєте», поєднуючи діагностичні маркери з терапевтичними радіолігандами. 177Lu-ПСМА-617 і 177Lu-ПСМА I&T — це маломолекулярні інгібітори ПСМА, які можна використовувати з терапевтичною метою [8]. Застосування радіолігандної терапії 177Lu-ПСМА ще не затверджене Управлінням з харчових продуктів і лікарських засобів та Європейським агентством лікарських засобів, але за даними клінічних випробувань було показано, що дане лікування має сприятливі профілі безпеки та токсичності [75, 76]. Крім того, результати проспективних випробувань показали високий коефіцієнт терапевтичної відповіді на ПСМА-радіолігандну терапію в пацієнтів із РПЗ, що мали прогресування хвороби після звичайних методів лікування [77–81].
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
1. Yadav S.S., Stockert J.A., Hackert V. et al. Intratumor heteroge neity in prostate cancer. Urol Oncol. 2018. 36. Р. 349-360. DOI: 10.1016/j.urolonc.2018.05.008.
2. Freitag M.T., Radtke J.P., Afshar-Oromieh A. et al. Local recurrence of prostate cancer after radical prostatectomy is at risk to be missed in 68Ga-PSMA-11-PET of PET/CT and PET/MRI: comparison with mpMRI integrated in simultaneous PET/MRI. Eur. J. Nucl. Med. Mol. Imaging. 2017. 44. Р. 776-787. DOI: 10.1007/s00259-016-3594-z. Epub 2016 Dec 17.
3. Korol P., Tkachenko M. The role of radioactive methods in the diagnostic type of hydronephrosis in clean-up workers of chornodil accident. Problems of radiation medicine and radiobiology. 2018. 23. Р. 351-358 (in Ukraine).
4. Park S.Y., Zacharias C., Harrison C. et al. Gallium 68 PSMA-11 PET/MR imaging in patients with intermediate- or high-risk prostate cancer. Radiology. 2018. 288. Р. 495-505. DOI: 10.1148/radiol.2018172232. Epub 2018 May 22.
5. Kasivisvanathan V., Rannikko A.S., Borghi M. et al. MRI-targeted or standard biopsy for prostate-cancer diagnosis. N. Engl. J. Med. 2018. 378. Р. 1767-1777. DOI: 10.1056/NEJMoa1801993.
6. Torabi M., Aquino S.L., Harisinghani M.G. Current concepts in lymph node imaging. J. Nucl. Med. 2004. 45. Р. 1509-1518.
7. Armstrong A.J., Anand A., Edenbrandt L. et al. Phase 3 assessment of the automated bone scan index as a prognostic imaging biomarker of overall survival in men with metastatic castration-resistant prostate cancer: a secondary analysis of a randomized clinical trial. JAMA Oncol. 2018. 4. Р. 944-951. DOI: 10.1001/jamaoncol.2018.1093.
8. von Eyben F.E., Roviello G., Kiljunen T. et al. Third-line treatment and177Lu-PSMA radioligand therapy of metastatic castration-resistant prostate cancer: a systematic review. Eur. J. Nucl. Med. Mol. Imaging. 2018. 45. Р. 496-508. DOI: 10.1007/s00259-017-3895-x. Epub 2017 Dec 16.
9. Fanti S., Minozzi S., Antoch G. et al. Consensus on molecular imaging and theranostics in prostate cancer. Lancet Oncol. 2018. Vol. 19. P. 696-708. DOI: 10.1016/S1470-2045(18)30604-1.
10. Metser U., Chua S.S., Ho B. et al. The contribution of multiparametric pelvic &whole body MR to interpretation of 18F-fluoromethylcholine or 68Ga-HBED-CC PSMA-11 PET/CT in patients with biochemical failure following radical prostatectomy. J. Nucl. Med. March 22, 2019 [Epub ahead of print]. DOI: 10.2967/jnumed.118.225185. Epub 2019 Mar 22.
11. Padhani A.R., Lecouvet F.E., Tunariu N. et al. Metastasis Reporting and Data System for Prostate Cancer: practical guidelines for acquisition, interpretation, and reporting of whole-body magnetic resonance imaging-based evaluations of multiorgan involvement in advanced prostate cancer. Eur. Urol. 2017. 71. Р. 81-92. DOI: 10.1016/j.eururo.2016.05.033. Epub 2016 Jun 14.
12. Zacho H.D., Nielsen J.B., Afshar-Oromieh A. et al. Prospective comparison of 68Ga-PSMA PET/CT,18F-sodium fluoride PET/CT and diffusion weighted-MRI at for the detection of bone metastases in biochemically recurrent prostate cancer. Eur. J. Nucl. Med. Mol. Imaging. 2018. 45. Р. 1884-1897. DOI: 10.1007/s00259-018-4058-4. Epub 2018 Jun 6.
13. Padhani A.R., Lecouvet F.E., Tunariu N. et al. Rationale for modernising imaging in advanced prostate cancer. Eur. Urol. Focus. 2017. 3. Р. 223-239. DOI: 10.1016/j.euf.2016.06.018. Epub 2016 Jul 15.
14. Donohoe K.J., Cohen E.J., Giammarile F. et al. Appropriate use criteria for bone scintigraphy in prostate and breast cancer: summary and excerpts. J. Nucl. Med. 2017. 58(4). Р. 14-17.
15. Wibmer A.G., Burger I.A., Sala E. et al. Molecular imaging of prostate cancer. Radiographics. 2016. 36. Р. 142-159. DOI: 10.1148/rg.2016150059. Epub 2015 Nov 20.
16. Jadvar H. Is there use for FDG-PET in prostate cancer? Semin. Nucl. Med. 2016. 46. Р. 502-506. DOI: 10.1053/j.semnuclmed.2016.07.004. Epub 2016 Sep 3.
17. Shen G., Liu J., Hao Z. et al. Is18F-FDG PET/CT a useful tool in prostate cancer? [abstract]. J. Nucl. Med. 2017. 58(suppl. 1). Р. 1077.
18. Vargas H.A., Wassberg C., Fox J.J. et al. Bone metastases in castration-resistant prostate cancer: associations between morphologic CT patterns, glycolytic activity, and androgen receptor expression on PET and overall survival. Radiology. 2014. 271. Р. 220-229. DOI: 10.1148/radiol.13130625. Epub 2013 Nov 18.
19. Segall G., Delbeke D., Stabin M.G. et al. SNM practice guideline for sodium 18F-fluoride PET/CT bone scans 1.0. J. Nucl. Med. 2010. 51. Р. 1813-1820. DOI: 10.2967/jnumed.110.082263.
20. Löfgren J., Mortensen J., Rasmussen S.H. et al. A prospective study comparing 99mTc-hydroxyethylene-diphosphonate planar bone scintigraphy and whole-body SPECT/CT with 18F-fluoride PET/CT and18F-fluoride PET/MRI for diagnosing bone metastases. J. Nucl. Med. 2017. 58. Р. 1778-1785. DOI: 10.2967/jnumed.116.189183. Epub 2017 Aug 10.
21. Schwarzenböck S., Souvatzoglou M., Krause B.J. Choline PET and PET/CT in primary diagnosis and staging of prostate cancer. Theranostics. 2012. 2. Р. 318-330. DOI: 10.7150/thno.4008. Epub 2012 Mar 15.
22. Hodolic M. Role of 18F-choline PET/CT in evaluation of patients with prostate carcinoma. Radiol. Oncol. 2011. 45. Р. 17-21. DOI: 10.2478/v10019-010-0050-8.
23. Calais J., Ceci F., Nguyen K. et al. Prospective head-to-head comparison of 18F-fluciclovine and 68Ga-PSMA-11 PET/CT for localization of prostate cancer bio-chemical recurrence after primary prostatectomy [abstract]. J. Clin. Oncol. 2019. 37(suppl.). Р. 15. DOI: 10.1200/JCO.2019.37.7.
24. Burger I.A., Müller J., Donati O.F. et al. 68Ga-PSMA-11 PET/MR detects local recurrence occult on mpMRI in prostate cancer patients after HIFU. J. Nucl. Med. 2019. 60. Р. 1118-1123. DOI: 10.2967/jnumed.118.221564. Epub 2019 Jan 25.
25. Schuster D.M., Savir-Baruch B., Nieh P.T. et al. Detection of recurrent prostate carcinoma with anti-1-amino-3-18F-fluorocyclobutane-1-carboxylic acid PET/CT and111In-capromab pendetide SPECT/CT. Radiology. 2011. 259. Р. 852-861. DOI: 10.1148/radiol.11102023. Epub 2011 Apr 14.
26. Bostwick D.G., Pacelli A., Blute M. et al. Prostate specific membrane antigen expression in prostatic intraepithelial neoplasia and adenocarcinoma: a study of 184 cases. Cancer. 1998. 82. Р. 2256-2261. DOI: 10.1002/(sici)1097-0142(19980601)82:11<2256::aid-cncr22>3.0.co;2-s.
27. Oh S.W., Cheon G.J.. Prostate-specific membrane antigen PET imaging in prostate cancer: opportunities and challenges. Korean J. Radiol. 2018. 19. Р. 819-831. DOI: 10.3348/kjr.2018.19.5.819. Epub 2018 Aug 6.
28. Chang S.S., O’Keefe D.S., Bacich D.J. et al. Prostate-specific membrane antigen is produced in tumor-associated neovasculature. Clin. Cancer Res. 1999. 5. Р. 2674-2681.
29. Kesler M., Levine C., Hershkovitz D. et al. 68Ga-PSMA is a novel PET-CT tracer for imaging of hepatocellular carcinoma: a prospective pilot study. J. Nucl. Med. July 12, 2018 [Epub ahead of print]. DOI: 10.2967/jnumed.118.214833. [Epub ahead of print].
30. Giesel F.L., Knorr K., Spohn F. et al. Detection efficacy of 18F-PSMA-1007 PET/CT in 251 patients with biochemical recurrence of prostate cancer after radical prostatectomy. J. Nucl. Med. 2019. 60. Р. 362-368. DOI: 10.2967/jnumed.118.212233. Epub 2018 Jul 24.
31. Rathkopf D., Scher H.I. Androgen receptor antagonists in castration-resistant prostate cancer. Cancer J. 2013. 19. Р. 43-49. DOI: 10.1097/PPO.0b013e318282635a.
32. Larson S.M., Morris M., Gunther I. et al. Tumor localization of 16b-18F-fluoro-5a-dihydrotestosterone versus18F-FDG in patients with progressive, metastatic prostate cancer. J. Nucl. Med. 2004. 45. Р. 366-373.
33. Vargas H.A., Kramer G.M., Scott A.M. et al. Reproducibility and repeatability of semiquantitative18F-fluorodihydrotestosterone uptake metrics in castration-resistant prostate cancer metastases: a prospective multicenter study. J. Nucl. Med. 2018. 59. Р. 1516-1523. DOI: 10.2967/jnumed.117.206490. Epub 2018 Apr 6.
34. Eiber M., Weirich G., Holzapfel K. et al. Simultaneous 68Ga-PSMA HBED-CC PET/MRI improves the localization of primary prostate cancer. Eur. Urol. 2016. 70. Р. 829-836. DOI: 10.1016/j.eururo.2015.12.053. Epub 2016 Jan 18.
35. Hicks R.M., Simko J.P., Westphalen A.C. et al. Diagnostic accuracy of 68Ga-PSMA-11 PET/MRI compared with multiparametric MRI in the detection of prostate cancer. Radiology. 2018. 289. Р. 730-737. DOI: 10.1148/radiol.2018180788. Epub 2018 Sep 18.
36. Turkbey B., Mani H., Shah V. et al. Multiparametric 3T prostate magnetic resonance imaging to detect cancer: histopathological correlation using prostatectomy specimens processed in customized magnetic resonance imaging based molds. J. Urol. 2011. 186. Р. 1818-1824. DOI: 10.1016/j.juro.2011.07.013. Epub 2011 Sep 25.
37. Weinreb J.C., Barentsz J.O., Choyke P.L. et al. PI-RADS prostate imaging: reporting and data system-2015, version 2. Eur. Urol. 2016. 69. Р. 16-40. DOI: 10.1016/j.eururo.2015.08.052. Epub 2015 Oct 1.
38. Ahmed H.U., El-Shater Bosaily A., Brown L.C. et al. Diagnostic accuracy of multiparametric MRI and TRUS biopsy in prostate cancer (PROMIS): a paired validating confirmatory study. Lancet. 2017. 389. Р. 815-822. DOI: 10.1016/S0140-6736(16)32401-1. Epub 2017 Jan 20.
39. Moldovan P.C., Van den Broeck T., Sylvester R. et al. What is the negative predictive value of multiparametric magnetic resonance imaging in excluding prostate cancer at biopsy? A systematic review and meta-analysis from the European Association of Urology Prostate Cancer Guidelines Panel. Eur. Urol. 2017. 72. Р. 250-266. DOI: 10.1016/j.eururo.2017.02.026. Epub 2017 Mar 21.
40. Mohammadian Bajgiran A., Afshari Mirak S., Shakeri S. et al. Characteristics of missed prostate cancer lesions on 3T multiparametric-MRI in 518 patients: based on PI-RADSv2 and using whole-mount histopathology reference. Abdom. Radiol. (NY). 2019. 44. Р. 1052-1061. DOI: 10.1007/s00261-018-1823-6.
41. Borofsky S., George A.K., Gaur S. et al. What are we missing? False-negative cancers at multiparametric MR imaging of the prostate. Radiology. 2018. 286. Р. 186-195. DOI: 10.1148/radiol.2017152877. Epub 2017 Oct 20.
42. Sala E., Akin O., Moskowitz C.S. et al. Endorectal MR imaging in the evaluation of seminal vesicle invasion: diagnostic accuracy and multivariate feature analysis. Radiology. 2006. 238. Р. 929-937. DOI: 10.1148/radiol.2383050657.
43. de Rooij M., Hamoen E.H., Witjes J.A. et al. Accuracy of magnetic resonance imaging for local staging of prostate cancer: a diagnostic metaanalysis. Eur. Urol. 2016. 70. Р. 233-245. DOI: 10.1016/j.eururo.2015.07.029. Epub 2015 Jul 26.
44. Mühlematter U.J., Becker K.S.A., Müller J. et al. Detection of extracapsular extension in high risk prostate cancer patients: multiparametric MRI vs.68Ga-PSMA-11 PET/MRI. Paper presented at: 2019 European Congress of Radiology; February 28, 2019; Vienna, Austria.
45. Ross H.M., Kryvenko O.N., Cowan J.E. et al. Do adenocarcinomas of the prostate with Gleason score (GS) #6 have the potential to metastasize to lymph nodes? Am. J. Surg. Pathol. 2012. 36. Р. 1346-1352. DOI: 10.1097/PAS.0b013e3182556dcd.
46. Briganti A., Larcher A., Abdollah F. et al. Updated nomogram predicting lymph node invasion in patients with prostate cancer undergoing extended pelvic lymph node dissection: the essential importance of percentage of positive cores. Eur. Urol. 2012. 61. Р. 480-487. DOI: 10.1016/j.eururo.2011.10.044. Epub 2011 Nov 7.
47. Eggener S.E., Scardino P.T., Walsh P.C. et al. Predicting 15-year prostate cancer specific mortality after radical prostatectomy. J. Urol. 2011. 185. Р. 869-875. DOI: 10.1016/j.juro.2010.10.057. Epub 2011 Jan 15.
48. Hövels A.M., Heesakkers R.A.M., Adang E.M. et al. The diagnostic accuracy of CT and MRI in the staging of pelvic lymph nodes in patients with prostate cancer: a meta-analysis. Clin. Radiol. 2008. 63. Р. 387-395. DOI: 10.1016/j.crad.2007.05.022. Epub 2008 Feb 4.
49. Evangelista L., Guttilla A., Zattoni F. et al. Utility of choline positron emission tomography/computed tomography for lymph node involvement identification in intermediate- to high-risk prostate cancer: a systematic literature review and meta-analysis. Eur. Urol. 2013. 63. Р. 1040-1048. DOI: 10.1016/j.eururo.2012.09.039. Epub 2012 Sep 25.
50. Hofman M.S., Murphy D.G., Williams S.G. et al. A prospective randomized multicentre study of the impact of gallium-68 prostate-specific membrane antigen (PSMA) PET/CT imaging for staging high-risk prostate cancer prior to curative-intent surgery or radiotherapy (proPSMA study): clinical trial protocol. BJU Int. 2018. 122. Р. 783-793. DOI: 10.1111/bju.14374. Epub 2018 Jun 3.
51. Selnæs K.M., Kruger-Stokke B., Elschot M. et al. 18F-fluciclovine PET/MRI for preoperative lymph node staging in high-risk prostate cancer patients. Eur. Radiol. 2018. 28. Р. 3151-3159. DOI: 10.1007/s00330-017-5213-1. Epub 2018 Jan 2.
52. Grubmüller B., Baltzer P., Hartenbach S. et al. PSMA ligand PET/MRI for primary prostate cancer: staging performance and clinical impact. Clin. Cancer Res. 2018. 24. Р. 6300-6307. DOI: 10.1158/1078-0432.CCR-18-0768. Epub 2018 Aug 23.
53. Giesel F.L., Fiedler H., Stefanova M. et al. PSMA PET/CT with Glu-urea-Lys-(Ahx)-[68Ga(HBED-CC)] versus 3D CT volumetric lymph node assessment in recurrent prostate cancer. Eur. J. Nucl. Med. Mol. Imaging. 2015. 42. Р. 1794-1800. DOI: 10.1007/s00259-015-3106-6. Epub 2015 Jul 11.
54. Maurer T., Gschwend J.E., Rauscher I. et al. Diagnostic efficacy of 68 gallium-PSMA positron emission tomography compared to conventional imaging for lymph node staging of 130 consecutive patients with intermediate to high risk prostate cancer. J. Urol. 2016. 195. Р. 1436-1443. DOI: 10.1007/s00259-015-3106-6. Epub 2015 Jul 11.
55. Scher H.I., Morris M.J., Stadler W.M. et al. Trial design and objectives for castration-resistant prostate cancer: updated recommendations from the Prostate Cancer Clinical Trials Working Group 3. J. Clin. Oncol. 2016. 34. Р. 1402-1418. DOI: 10.1200/JCO.2015.64.2702. Epub 2016 Feb 22.
56. Sweeney C.J., Chen Y.H., Carducci M. et al. Chemohormonal therapy in metastatic hormone-sensitive prostate cancer. N. Engl. J. Med. 2015. 373. Р. 737-746. DOI: 10.1056/NEJMoa1503747.
57. Pyka T., Okamoto S., Dahlbender M. et al. Comparison of bone scintigraphy and 68Ga-PSMA PET for skeletal staging in prostate cancer. Eur. J. Nucl. Med. MolImaging. 2016. 43. Р. 2114-2121. DOI: 10.1007/s00259-016-3435-0.
58. Mottet N., Bellmunt J., Bolla M. et al. EAU-ESTRO-SIOG guidelines on prostate cancer. Part 1: screening, diagnosis, and local treatment with curative intent. Eur. Urol. 2017. 71. Р. 618-629. DOI: 10.1016/j.eururo.2016.08.003. Epub 2016 Aug 25.
59. Briganti A., Karnes R.J., Joniau S. et al. Prediction of outcome following early salvage radiotherapy among patients with biochemical recurrence after radical prostatectomy. Eur. Urol. 2014. 66. Р. 479-486. DOI: 10.1016/j.eururo.2013.11.045. Epub 2013 Dec 12.
60. Oppenheimer D.C., Weinberg E.P., Hollenberg G.M. et al. Multiparametric magnetic resonance imaging of recurrent prostate cancer. J. Clin. Imaging. Sci. 2016. 6. Р. 18. DOI: 10.4103/2156-7514.181494. eCollection 2016.
61. Akin O., Gultekin D.H., Vargas H.A. et al. Incremental value of diffusion weighted and dynamic contrast enhanced MRI in the detection of locally recurrent prostate cancer after radiation treatment: preliminary results. Eur. Radiol. 2011. 21. Р. 1970-1978. DOI: 10.1007/s00330-011-2130-6.
62. Donati O.F., Jung S.I., Vargas H.A. et al. Multiparametric prostate MR imaging with T2-weighted, diffusion-weighted, and dynamic contrast-enhanced sequences: are all pulse sequences necessary to detect locally recurrent prostate cancer after radiation therapy? Radiology. 2013. 268. Р. 440-450. DOI: 10.1148/radiol.13122149. Epub 2013 Mar 12.
63. Wu L.M., Xu J.R., Gu H.Y. et al. Role of magnetic resonance imaging in the detection of local prostate cancer recurrence after external beam radiotherapy and radical prostatectomy. Clin. Oncol. (R. Coll. Radiol.). 2013. 25. Р. 252-264.
64. Sandgren K., Westerlinck P., Jonsson J.H. et al. Imaging for the detection of locoregional recurrences in biochemical progression after radical prostatectomy: a systematic review. Eur. Urol. Focus. November 11, 2017 [Epub ahead of print]. DOI: 10.1016/j.euf.2017.11.001. Epub 2017 Nov 11.
65. Barchetti F., Stagnitti A., Megna V. et al. Unenhanced whole-body MRI versus PET-CT for the detection of prostate cancer metastases after primary treatment. Eur. Rev. Med. Pharmacol. Sci. 2016. 20. Р. 3770-3776.
66. Afshar-Oromieh A., Zechmann C.M., Malcher A. et al. Comparison of PET imaging with a68Ga-labelled PSMA ligand and18F-choline-based PET/CT for the diagnosis of recurrent prostate cancer. Eur. J. Nucl. Med. Mol. Imaging. 2014. 41. Р. 11-20.
67. Tan N., Bavadian N., Calais J. et al. Imaging of prostate specific membrane antigen targeted radiotracers for the detection of prostate cancer biochemical recurrence after definitive therapy: a systematic review and meta-analysis. J. Urol. 2019. 202. Р. 231-240. DOI: 10.1097/JU.0000000000000198. Epub 2019 Jul 8.
68. Bravaccini S., Puccetti M., Bocchini M. et al. PSMA expression: a potential ally for the pathologist in prostate cancer diagnosis. Sci. Rep. 2018. 8. Р. 4254. DOI: 10.1038/s41598-018-22594-1.
69. Andriole G.L., Kostakoglu L., Chau A. et al. The impact of positron emission tomography with18F-fluciclovine on the treatment of biochemical recurrence of prostate cancer: results from the LOCATE trial. J. Urol. 2019. 201. Р. 322-331. DOI: 10.1016/j.juro.2018.08.050.
70. Jilg C.A., Drendel V., Rischke H.C. et al. Detection rate of 18F-choline PET/CT and 68Ga-PSMA-HBED-CC PET/CT for prostate cancer lymph node metastases with direct link from PET to histopathology: dependence on the size of tumor deposits in lymph nodes. J. Nucl. Med. 2019. 60. Р. 971-977. DOI: 10.2967/jnumed.118.220541. Epub 2019 Jan 25.
71. Fendler W.P., Calais J., Eiber M. et al. Assessment of 68Ga-PSMA-11 PET accuracy in localizing recurrent prostate cancer: a prospective single-arm clinical trial. JAMA Oncol. 2019. 5. Р. 856-863. DOI: 10.1001/jamaoncol.2019.0096.
72. Fox J.J., Gavane S.C., Blanc-Autran E. et al. Positron emission tomography/computed tomography — based assessments of androgen receptor expression and glycolytic activity as a prognostic biomarker for metastatic castration-resistant prostate cancer. JAMA Oncol. 2018. 4. Р. 217-224. DOI: 10.1001/jamaoncol.2017.3588.
73. Pandit-Taskar N., Veach D.R., Fox J.J. et al. Evaluation of castration-resistant prostate cancer with androgen receptor — axis imaging. J. Nucl. Med. 2016. 57(suppl). Р. 73-78. DOI: 10.2967/jnumed.115.170134.
74. Fendler W.P., Rahbar K., Herrmann K. Et al. 177Lu-PSMA radioligand therapy for prostate cancer. J. Nucl. Med. 2017. 58. Р. 1196-1200. DOI: 10.2967/jnumed.117.191023. Epub 2017 Jun 29.
75. Ghafoor S., Burger I.A., Vargas A.H. Multimodality Imaging of Prostate Cancer. J. Nucl. Med. 2019. 60(10). Р. 1350-1358. DOI: 10.2967/jnumed.119.228320. Epub 2019 Sep 3.
76. Rahbar K., Ahmadzadehfar H., Kratochwil C. et al. German multicenter study investigating177 Lu-PSMA-617 radioligand therapy in advanced prostate cancer patients. J. Nucl. Med. 2017. 58. Р. 85-90. DOI: 10.2967/jnumed.116.183194. Epub 2016 Oct 20.
77. Hofman M.S., Violet J., Hicks R.J. et al. [177Lu]-PSMA-617 radionuclide treatment in patients with metastatic castration-resistant prostate cancer (LuPSMA trial): a single-centre, single-arm, phase 2 study. Lancet Oncol. 2018. 19. Р. 825-833. DOI: 10.1016/S1470-2045(18)30198-0. Epub 2018 May 8.
78. Ceder Y., Bjartell A., Culig Z. et al. The molecular evolution of castration-resistant prostate cancer. Eur. Urol. Focus. 2016. 2. Р. 506-513. DOI: 10.1016/j.euf.2016.11.012. Epub 2016 Dec 9.
79. Heitkötter B., Steinestel K., Trautmann M. et al. Neovascular PSMA expression is a common feature in malignant neoplasms of the thyroid. Oncotarget. 2018. 9. Р. 9867-9874.
80. Pezaro C., Omlin A., Lorente D. et al. Visceral disease in castration-resistant prostate cancer. Eur. Urol. 2014. 65. Р. 270-273. DOI: 10.1016/j.eururo.2013.10.055. Epub 2013 Nov 22.
81. Король П.О., Ткаченко М.М. Сучасні напрямки радіонуклідної діагностики і терапії хворих на рак передміхурової залози. Лучевая диагностика. Лучевая терапия. 2018. 3. С. 59-70. (in Ukraine).

/88-1.jpg)
/90-1.jpg)