Резюме
Актуальність. Паранеопластичний синдром (ПНПС) при раку легені (РЛ) характеризується ревматологічними, дерматологічними, ендокринними, неврологічними, нефрологічними та іншими проявами. ПНПС став актуальною проблемою сучасної онкології, але особливості його перебігу та безпосередній перебіг самого пухлинного процесу залишаються недостатньо вивченими. Мета: оцінити клініко-лабораторні прояви паранеопластичного (неоплазмового) ревматоїдоподібного артриту (РПА) у контексті зв’язків з окремими ознаками РЛ. Матеріали та методи. ПНПС виявлено у 258 (16 %) хворих на РЛ, а РПА — у 41 (16 %) випадку ПНПС. Ці пацієнти (27 чоловіків та 14 жінок, середній вік 57 років) становили основну групу спостереження, а решта 217 пацієнтів з ПНПС (177 чоловіків и 40 жінок, середній вік 59 років) увійшли до групи порівняння. Ще одну групу сформували 105 хворих (22 чоловіки й 83 жінки, середній вік 46 років) з первинним ревматоїдним артритом (РА) без РЛ. Результати. РЛ з РПА характеризується почастішанням средньочасткової локалізації пухлинного процесу (в 7,4 раза), його дрібноклітинного варіанта (в 5,3 раза) з низькими ступенями диференціації, наявністю ексудативного плевриту, проростанням неоплазми в стравохід та розвитком метастазів у скелет (у лобкову, клубову, крижову й стегнову кістки, в щелепи та хребет). При порівняльній оцінці з РА для РПА більш типові олігоартрит, виникнення ентезопатій, серонегативність за ревматоїдним фактором і антитілами до циклічного цитрулінового пептиду, вірогідно менші (на 1/4) активність й стадійність суглобового синдрому, більш часте ураження променево-зап’ясткових (у 1,8 раза), плечових (у 4,8 раза), п’ястково- (у 2,4 раза) і плеснофалангових суглобів (у 2,5 раза), відсутність остеоузур, інтраартикулярних хондромних тіл, тіл Штайді й Гоффа. Висновки. Формування паранеопластичного РПА спостерігається в кожного шостого хворого з ПНПС, обумовленим РЛ, що супроводжується особливостями не лише пухлинного процесу, а й суглобового синдрому порівняно з первинним РА. Отримані дані диктують необхідність подальших досліджень для створення критеріїв ранньої діагностики РПА та інформативних прогностичних чинників щодо подальшого перебігу РЛ.
Актуальность. Паранеопластический синдром (ПНПС) при раке легкого (РЛ) характеризуется ревматологическими, дерматологическими, эндокринными, неврологическими, нефрологическими и другими проявлениями. ПНПС стал актуальной проблемой современной онкологии, но особенности его течения и непосредственное течение самого опухолевого процесса остаются недостаточно изученными. Цель исследования: оценить клинико-лабораторные проявления паранеопластического (неоплазменного) ревматоидоподобного артрита (РПА) в контексте связей с отдельными признаками РЛ. Материалы и методы. ПНПС выявлен у 258 (16 %) больных РЛ, а РПА — в 41 (16 %) случае ПНПС. Эти пациенты (27 мужчин и 14 женщин, средний возраст 57 лет) составили основную группу наблюдения, а остальные 217 пациентов с ПНПС (177 мужчин и 40 женщин, средний возраст 59 лет) вошли в группу сравнения. Еще одну контрольную группу сформировали 105 больных (22 мужчины и 83 женщины, средний возраст 46 лет) с первичным ревматоидным артритом (РА) без РЛ. Результаты. РЛ с РПА характеризуется учащением среднедолевой локализации опухолевого процесса (в 7,4 раза), его мелкоклеточного варианта (в 5,3 раза) с низкой степенью дифференциации, наличием экссудативного плеврита, прорастанием неоплазмы в пищевод и развитием метастазов в скелет (в лобковую, подвздошную, крестцовую и бедренную кости, в челюсти и позвоночник). При сравнительной оценке с РА для РПА более типичны олигоартрит, возникновение энтезопатий, серонегативность по ревматоидному фактору и антителам к циклическому цитруллиновому пептиду, достоверно меньшие (на 1/4) активность и стадийность суставного синдрома, более частое поражение лучезапястных (в 1,8 раза), плечевых (в 4,8 раза), пястно- (в 2,4 раза) и плюснефаланговых суставов (в 2,5 раза), отсутствие остеоузур, интраартикулярных хондромных тел, тел Штайди и Гоффа. Выводы. Формирование паранеопластического РПА наблюдается у каждого шестого больного с ПНПС, обусловленным РЛ, что сопровождается особенностями не только опухолевого процесса, но и суставного синдрома в сравнении с первичным РА. Полученные данные диктуют необходимость дальнейших исследований для выработки критериев ранней диагностики РПА и информативных прогностических факторов в отношении дальнейшего течения РЛ.
Background. Paraneoplastic syndrome (PNPS) associated with lung cancer (LC) is characterized by rheumatological, dermatological, endocrinological, neurological, nephrologic and other manifestations. PNPS has become an urgent problem of modern oncology, but specifics of its course and immediate tumor process have not been investigated enough. The purpose was to estimate the clinical laboratory manifestations of paraneoplastic (neoplasmic) rheumatoid-like arthritis (RLA) within the context of its associations with LC individual signs. Materials and methods. PNPS was detected in 258 (16%) patients with LC and RLA in 41 (16%) cases of PNPS. These patients (29 men and 15 women with an average age of 57 years) made up the main group of this study, and other 217 patients with PNPS (177 men and 40 women with an average age of 59 years) were included into the comparison group. Another control group was formed by 105 patients (22 men and 83 women aged 46 years) with primary rheumatoid arthritis (RA) without LC. Results. LC with RLA is characterized by the accelerated midlobar localization of tumor process (7.4 times more often), its small-cell variant (5.3 times more often) with a low degree of differentiation, the presence of exudative pleurisy, neoplasms germinating into esophagus and metastases growing into the skeleton (pubic, iliac, femoral and sacral bone, jaw and spine). By contrast to the RA, RLA is characterized by oligoarthritis, enthesopathies, seronegativity by the rheumatoid factor and antibodies to cyclic citrulline peptide, less manifested activity and stages of the articular syndrome (by 1/4), higher damage rate of radiocarpal joints (1.8 times), shoulder joints (4.8 times), metacarpal (2.4 times) and metatarsophalangeal (2.5 times) joints, absence of osteousuras, intra-articular chondromic bodies, Steidi and Goff bodies. Conclusions. Formation of paraneoplastic RLA is observed in every sixth patient with PNPS caused by LC, which is accompanied by specific features not only of tumor process, but also by joint syndrome in comparison with the primary RA. The obtained data necessitate the further investigation in order to develop criteria for early diagnosis of RLA and informative prognostic factors for the further course of LC.
Вступ
Рак легені (РЛ) вважається найчастішою формою злоякісних новоутворень [1–3]. При цьому автоімунні суглобові параканкрозні зміни зустрічаються у 4 % від числа хворих на РЛ [4]. Паранеопластичний синдром (ПНПС) безпосередньо не пов’язаний з первинною неоплазмою та її метастазами, а зумовлений складними запальними системними або локальними дистантними змінами, часто у вигляді перехресту (overlap) ревматичного й пухлинного захворювань [5, 6].
Проявом ПНПС при РЛ є ревматоїдоподібний артрит (РПА) [7], який зменшує виживаність пацієнтів з такою злоякісною пухлиною [8–10], а успішне лікування РЛ (оперативне, радіохіміотерапія) може супроводжуватися зникненням ознак РПА [11, 12]. На відміну від первинного ревматоїдного артриту (РА) РПА переважно перебігає із залученням до процесу середніх і великих суглобів (зокрема, плечових), з гострим або підгострим початком, наявністю періартикулярної набряклості [13]. Загалом рецидивуючий серонегативний синовіт за відсутності ефекту від глюкокортикоїдної терапії повинен насторожувати в плані пухлинного процесу [14]. Вивчення РПА при РЛ є актуальною, але невирішеною проблемою сучасної ревматології та онкології [15, 16].
Мета дослідження: визначити частоту та клінічні ознаки паранеопластичного РА (РПА) при РЛ, вивчити характер взаємовпливу з перебігом пухлинного процесу, оцінити фактори ризику розвитку ПНПС.
Матеріали та методи
В одномоментному дослідженні під спостереженням знаходилися 1669 хворих на РЛ віком від 24 до 87 років (у середньому 59,0 ± 0,2 року), серед яких було 89 % чоловіків і 11 % жінок. Правобічна локалізація ракового процесу мала місце в 57 % від числа пацієнтів, лівобічна — у 42 %, двостороння — в 1 %. Верхньочастковий РЛ встановлено в 29 % випадків, середньоверхньочастковий — в 21 %, верхньонижньочастковий зліва — в 20 %, нижньочастковий — у 13 %, медіастинальний — в 11 %, середньочастковий — у 3 %, середньонижньочастковий — в 2 %. Дрібноклітинний гістологічний варіант захворювання діагностований у 19 % спостережень, а недрібноклітинний — у 82 %, серед яких аденокарциному констатовано в 37 % від загального числа обстежених пацієнтів і в 46 % від числа з недрібноклітинною формою, плоскоклітинну карциному — відповідно в 35 та 43 %, великоклітинну — в 9 і 11 %.
IB і ІІА стадії захворювання виявлено відповідно в 1 % випадків РЛ, IIB — у 4 %, IIIA — в 35 %, IIIB — у 26 %, IV — в 34 %. Середній показник інтегральної стадійності пухлини (SТT) становив 5,90 ± 0,03 в.о., інтегрального індексу тяжкості пухлинного процесу (IWT) — 2,90 ± 0,02 в.о., який оцінювали за формулою: IWT = ln[T + N2 + (ΣM)2], де ln — натуральний логарифм, Т — міжнародний показник характеру первинної пухлини, N — міжнародний показник метастатичного ураження регіонарних лімфатичних вузлів, ΣМ — сума віддалених органів з метастазами. Із проявів РЛ у 10 % хворих відзначено ексудативний плеврит, у 8 % — компресійний синдром, у 7 % — проростання пухлини в трахею, у 3 % — відповідно в ребра та грудну стінку, у 2 % — у стравохід і в 1 % — у перикард. У 4 % випадків мав місце обтураційний ателектаз, у 3 % — здавлення поворотного нерва і у 2 % — верхньої порожнистої вени. Метастази в лімфатичні вузли виявлено в 81 % випадків РЛ, у віддалені органи — в 31 %, у скелет — у 20 %.
Статистичну обробку отриманих результатів досліджень проведено за допомогою комп’ютерного варіаційного, непараметричного, кореляційного, одно- (ANOVA) і багатофакторного (ANOVA/MANOVA) дисперсійного аналізу (програми Microsoft Excel та Statistica StatSoft, США). Оцінювали середні значення (M), їх стандартні помилки (SE) й відхилення (SD), коефіцієнти параметричної кореляції Пірсона (r) та непараметричної Кендалла (τ), критерії однорідності дисперсії Брауна — Форсайта (BF), багатофакторного дисперсійного аналізу Уїлкоксона — Рао (WR), відмінностей Стьюдента (t) і Мак-Немара — Фішера (χ2), а також вірогідність статистичних показників (p). Критичним рівнем значущості перевірки статистичних гіпотез у даному дослідженні вважали такий, що дорівнював 0,05. Підраховували ступінь прогнозування запропонованого результату моделі (PPV).
Результати
Основна (1-ша) група хворих на РПА і група порівняння (2-га) без такого не відрізнялися між собою за віком, стороною ураження, пухлинним процесом і формою захворювання (центральна, периферична). Разом з тим в основній групі в 6,9 раза рідше спостерігали нижньочасткову локалізацію РЛ (χ2 = 5,62, p = 0,02) і в 6,0 раза — медіастинальну (χ2 = 4,45, p = 0,04), але в 7,4 раза частіше — середньочасткову (χ2 = 16,96, p < 0,001), в 5,3 раза — дрібноклітинний варіант (χ2 = 51,13, p < 0,001), а співвідношення дрібноклітинного та недрібноклітинного РЛ у 1-й групі становило 5 : 1, тоді як у 2-й — 1 : 2. Розподіл за частотою аденокарциноми, плоскоклітинної й великоклітинної карциноми в основній і контрольній групах відповідно був 18 : 1 : 0 і 4 : 3 : 1 (χ2 = 16,41, p < 0,001). Окрім великоклітинної карциноми, на тлі РПА були відсутні випадки верхівкового РЛ Панкоста — Тобіаса, який діагностовано у 4,2 % від числа інших пацієнтів. За даними багатофакторного аналізу Уїлкоксона — Рао, наявність РПА значно впливає на інтегральні клінічні прояви РЛ (WR = 7,89, p < 0,001).
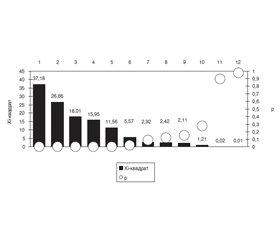
В основній групі хворих з РПА співвідношення поліартриту й олігоартриту становило 2 : 1, а в групі порівняння — 34 : 1 (χ2 = 25,15, p < 0,001). При РПА були відсутні ураження верхньощелепних суглобів (χ2 = 5,57, р = 0,018), в 2,3 раза рідше відзначали артрит міжфалангових суглобів кистей (χ2 = 26,66, p < 0,001), у 2,4 раза — п’ястково-фалангових зчленувань (χ2 = 37,18, p < 0,001), в 1,8 раза — променево-зап’ясткових (χ2 = 15,95, p < 0,001), у 4,8 раза — плечових (χ2 = 11,56, р = 0,001), що знайшло своє відображення на рис. 1. Симетричність ураження суглобів в основній групі спостерігали в 13,0 раза рідше, а в групі порівняння — в 25,0 раза частіше (χ2 = 113,65, p < 0,001).
/63.jpg)
У хворих без РПА були відсутні ентезопатії, які мали місце в 22 % спостережень основної групи (χ2 = 49,36, p < 0,001). Крім того, у пацієнтів з РПА в 7,9 раза частіше відзначали тендовагініти (χ2 = 23,18, p < 0,001), але в 3,7 раза рідше остеоартропатію Бамбергера (χ2 = 7,46, р = 0,006). При зіставленні з хворими на РА (друга група порівняння) РПА характеризувався в 15,7 раза більшою частотою серонегативності захворювання за ревматоїдним фактором (χ2 = 62,77, p < 0,001), в 1,5 раза — за антитілами до циклічного цитрулінового пептиду (χ2 = 11,22, p = 0,001) і вдвічі — за наявністю тендовагінітів (χ2 = 6,00, p = 0,014). Якщо остеоузури, інтраартикулярні хондромні тіла, тіла Штайді й Гоффа відповідно виявлено у 51, 24, 6 і 4 % від числа хворих групи порівняння, то такі рентгеносонографічні ознаки суглобового синдрому на тлі РЛ були відсутні. При РПА на 24 % меншим виявився рівень DAS (t = 5,65, p = 0,001) і на 28 % — індекс Лансбурі (t = 3,57, p = 0,001).
Підкреслимо, що при РПА істотно відрізнявся характер не тільки суглобового синдрому, а й пухлинного процесу. Так (рис. 2), в основній групі з РПА вдвічі частіше виявляли ексудативний плеврит (χ2 = 5,14, p = 0,02), в 14,6 раза — проростання РЛ у стравохід (χ2 = 10,62, p = 0,001), у 3,1 раза — метастази в скелет (χ2 = 42,86, p < 0,001), але в таких пацієнтів були відсутні випадки проростання неоплазми в трахею (χ2 = 4,32, p = 0,04).
Основна група та група порівняння хворих на РЛ не відрізнялися між собою за стадіями пухлинного процесу, але неоплазма в групі з РПА була менш диференційованою (t = 4,03, p < 0,001) і вірогідно (на 14 %) мала більшу тяжкість перебігу (t = 3,21, p = 0,002). Кількість груп метастазів у скелет на тлі РПА виявилася в 2,8 раза більшою (t = 5,17, p < 0,001).
Обговорення
Наявність у хворих на РЛ РПА суттєво впливає на інтегральний характер метастазування в скелет, що продемонстрував багатофакторний аналіз Уїлкоксона — Рао (WR = 9,04, p < 0,001). Цей факт підтверджують також виконаний однофакторний дисперсійний аналіз і непараметричний порівняльний аналіз Мак-Немара — Фішера (рис. 3). Так, наявність РПА тісно пов’язана з розвитком метастазів у щелепи (D = 23,28, p < 0,001) і лобкову кістку (D = 11,04, p = 0,001), які у хворих групи порівняння були відсутні (відповідно χ2 = 21,50, p < 0,001 і χ2 = 10,67, p = 0,001). У хворих з РПА вірогідно (p < 0,001) частіше (в 2,1 раза) відзначали метастази в хребет (χ2 = 8,18), у 3,5 раза — у стегнову кістку (χ2 = 6,93), у 5,3 раза — у крижово-здухвинні зчленування (χ2 = 148,18), у 7,7 раза — в клубову кістку (χ2 = 42,43), у 9,2 раза — в крижову кістку (χ2 = 41,02).
/65.jpg)
За даними літератури, РПА частіше спостерігається при аденокарциномі легенів [17] і у пацієнтів з метастазами в кістки [18], закономірно перебігає з підвищеними рівнями в крові С-реактивного протеїну та із серонегативністю за ревматоїдним фактором [13], що відповідає отриманим нами даним. Факт взаємовпливів РА й онкологічної патології багато в чому визначається наявністю вираженої однакової дисрегуляції системи імунітету при обох групах хвороб [19–21]. Збільшує частоту взаємозв’язків розвитку РПА та РЛ наявність генетичної схильності одночасно до обох патологічних процесів, зокрема мутацій генів GSAs і DEGs [22, 23]. Ми не спостерігали випадків РПА, що нагадував би хворобу Стілла дорослих, втім, як і ізольованого гоніту, на що є вказівки в літературі [24, 25].
Висновки
1. Доведено взаємовплив розвитку РЛ та коморбідного РА, визначено частоту виникнення ПНПС, клінічні ознаки його перебігу і зв’язок з фоновим пухлинним процесом (тяжкість неоплазми, характер проростання в сусідні органи й метастазування, верхівкова локалізація, дрібноклітинний та недрібноклітинний гістологічній варіант).
2. РПА характеризується почастішанням випадків середньочасткової локалізації пухлинного процесу, його дрібноклітинного варіанта, наявністю ексудативного плевриту, проростанням неоплазми в стравохід та розвитком метастазів у скелет.
3. Існують відмінності клініко-лабораторних ознак РПА и так званого первинного (ідіопатичного) РА.
4. Для РПА типові олігоартрит, виникнення ентезопатій, серонегативність за ревматоїдним фактором і антитілами до циклічного цитрулінового пептиду, мала частота уражень променево-зап’ясткових, плечових, п’ястково-фалангових і плеснофалангових суглобів, відсутність остеоузур, інтраартикулярних хондромних тіл, тіл Штайді й Гоффа.
5. Подальше вивчення РПА при РЛ, ймовірно, дозволить поліпшити якість ранньої діагностики обох груп захворювань, розробити прогностичні критерії та підвищити ефективність індивідуальної комбінованої медичної технології лікування хвороб.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів, при цьому автори не отримували від окремих осіб і організацій фінансової підтримки дослідження, гонорарів та інших форм винагород.
Інформація про внесок кожного автора: Синяченко О.В. — концепція дослідження та написання тексту; Єрмолаєва М.В. — аналіз даних літератури за проблемою та дизайн дослідження; Степко П.А. — обстеження хворих на рак і статистична обробка матеріалів; Верзілов С.М. — обстеження хворих на артрити та підготовка ілюстрацій; Потапов Ю.О. — обстеження хворих, аналіз отриманих даних.
Список литературы
1. Muzamil J., Bashir S., Guru F.R., Nabi F., Bhat G.M. Squamous cell carcinoma lung with skeletal muscle involvement: a 8-year study of a tertiary care hospital in Kashmir. Indian J. Med. Paediatr. Oncol. 2017. 38(4). 456-60. doi: 10.4103/ijmpo.ijmpo_169_16.
2. Wilkins C.M., Johnson V.L., Fargason R.E., Birur B. Psychosis as a sequelae of paraneoplastic syndrome in small-cell lung carcinoma: A psycho-neuroendocrine interface. Clin. Schizophr. Relat. Psychoses. 2017. 22(11). 153-8. doi: 10.3371/CSRP.CWVJ.111717.
3. Latimer K.M. Lung cancer: clinical presentation and diagnosis. FP Essent. 2018. 464(1). 23-6.
4. Miret M., Horváth-Puhó E., Déruaz-Luyet A., Sørensen H.T, Ehrenstein V. Potential paraneoplastic syndromes and selected autoimmune conditions in patients with non-small cell lung cancer and small cell lung cancer: A population-based cohort study. PLoS One. 2017. 12(8). 0181564. doi: 10.1371/journal.pone.0181564.
5. Hébant B., Miret N., Berthelot L., Jaafar M., Maltête D., Lefaucheur R. Generalized pruritus preceding paraneoplastic neuropathy. J. Clin. Neurosci. 2016. 26. 156-7. doi: 10.1016/j.jocn.2015.09.015.
6. Ramírez-Bellver J.L., Macías E., Bernárdez C., López-Robles J., Vegas-Sánchez M.D., Díaz-Recuero J.L. et al. Anti-NXP2-positive paraneoplastic dermatomyositis with histopathologic changes confined to the acrosyringia. Am. J. Dermatopathol. 2017. 39(1). 3-7. doi: 10.1097/DAD.0000000000000694.
7. Han Y.M., Fang L.Z., Zhang X.H., Yuan S.H., Chen J.H., Li Y.M. Polyarthritis as a prewarning sign of occult lung cancer. Kaohsiung J. Med. Sci. 2012. 28(1). 54-6. doi: 10.1016/j.kjms.2011.06.035.
8. Azar L., Khasnis A. Paraneoplastic rheumatologic syndromes. Curr. Opin. Rheumatol. 2013. 25(1). 44-9.
9. Katzen J.B., Raparia K., Agrawal R., Patel J.D., Rademaker A., Varga J. et al. Early stage lung cancer detection in systemic sclerosis does not portend survival benefit: a cross sectional study. PLoS One. 2015. 10(2). 0117829. doi: 10.1371/journal.pone.0117829.
10. Park J.K., Yang J.A., Ahn E.Y., Chang S.H., Song Y.W., Curtis J.R. et al. Survival rates of cancer patients with and without rheumatic disease: a retrospective cohort analysis. BMC Cancer. 2016. 16(4). 381-91. doi: 10.1186/s12885-016-2444-5.
11. Stummvoll G.H., Aringer M., Machold K.P., Smolen J.S., Raderer M. Cancer polyarthritis resembling rheumatoid arthritis as a first sign of hidden neoplasms. Report of two cases and review of the literature. Scand. J. Rheumatol. 2001. 30(1). 40-4.
12. Beel A.J., Demos D.S., Chung A., Liao C., Lui N.S. Ground-glass opacity heralding invasive lung adenocarcinoma with prodromal dermatomyositis: a case report. J Cardiothorac. Surg. 2018. 13(1). 20-8. doi: 10.1186/s13019-018-0705-x.
13. Sakamoto T., Ota S., Haruyama T., Ishihara M., Natsume M., Fukasawa Y. A case of paraneoplastic remitting seronegative symmetrical synovitis with pitting edema syndrome improved by chemotherapy. Case Rep. Oncol. 2017. 10(3). 1131-7. doi: 10.1159/000484977.
14. Jeong H., Baek S.Y., Kim S.W., Eun Y.H., Kim I.Y., Kim H. et al. PLoS One. 2017. 12(4). 0176260. doi: 10.1371/journal.pone.0176260.
15. Lange U., Bachmann G., Müller-Ladner U. Tibial pain and unilateral knee arthritis: Precursors of paraneoplastic arthropathy. Z. Rheumatol. 2014. 70(4). 332-5. doi: 10.1007/s00393-010-0734-x.
16. Durieux V., Coureau M., Meert A.P., Berghmans T., Sculier J.P. Autoimmune paraneoplastic syndromes associated to lung cancer: A systematic review of the literature. Lung Cancer. 2017. 106(4). 102-9. doi: 10.1016/j.lungcan.2017.01.015.
17. Han Y.M., Fang L.Z., Zhang X.H., Yuan S.H., Chen J.H., Li Y.M. Polyarthritis as a prewarning sign of occult lung cancer. Kaohsiung J. Med. Sci. 2012. 28(1). 54-6. doi: 10.1016/j.kjms.2011.06.035.
18. Hakkou J., Rostom S., Bahiri R., Hajjaj-Hassouni N. Paraneoplastic rheumatic syndromes: report of eight cases and review of literature. Rheumatol. Int. 2012. 32(6). 1485-9. doi: 10.1007/s00296-011-2252-9.
19. Kanaji N., Watanabe N., Kita N., Bandoh S., Tadokoro A., Ishii T. et al. Paraneoplastic syndromes associated with lung cancer. World J. Clin. Oncol. 2014. 5(3). 197-223. doi: 10.5306/wjco.v5.i3.197.
20. Goobie G.C., Bernatsky S., Ramsey-Goldman R., Clarke A.E. Malignancies in systemic lupus erythematosus: a 2015 update. Curr. Opin. Rheumatol. 2015. 27(5). 454-60. doi: 10.1097/BOR.0000000000000202.
21. Azrielant S., Tiosano S., Watad A., Mahroum N., Whitby A., Comaneshter D. et al. Correlation between systemic lupus erythematosus and malignancies: a cross-sectional population-based study. Immunol. Res. 2017. 65(2). 464-9. doi: 10.1007/s12026-016-8885-8.
22. Hong G., Li H., Li M., Zheng W., Li J., Chi M. et al. A simple way to detect disease-associated cellular molecular alterations from mixed-cell blood samples. Brief Bioinform. 2017. 14(2). 177-86. doi: 10.1093/bib/bbx009.
23. Rosenberger A., Sohns M., Friedrichs S., Hung R.J., Fehringer G., McLaughlin J. et al. Gene-set meta-analysis of lung cancer identifies pathway related to systemic lupuserythematosus. PLoS One. 2017. 12(3). 0173339. doi: 10.1371/journal.pone.0173339.
24. Wu N., Li Q., Gu C.X., Ahmed T., Yao X.P. Paraneoplastic syndrome mimicking adult-onset Still’s disease caused by advanced lung cancer: a case report. BMC Cancer. 2011. 16(11). 487-9. doi: 10.1186/1471-2407-11-487.
25. Cantini F., Niccoli L., Nannini C., Chindamo D., Bertoni M., Cassarà E. et al. Isolated knee monoarthritis heralding resectable non-small-cell lung cancer. A paraneoplastic syndrome not previously described. Ann. Rheum. Dis. 2012. 71(12). 1672-4.

/63.jpg)
/64.jpg)
/65.jpg)