Журнал «Здоровье ребенка» Том 15, №2, 2020
Вернуться к номеру
Рівень цинку й особливості перебігу атопічного дерматиту в дітей
Авторы: Сорокман Т.В., Попелюк Н.О.
ВДНЗ України «Буковинський державний медичний університет», м. Чернівці, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
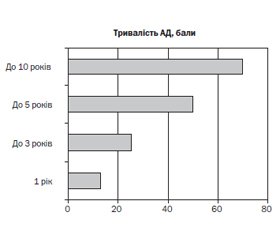
Актуальність. У пошуках основних патогенетичних механізмів атопічного дерматиту (АД) і покращення варіантів профілактики й лікування все більше уваги приділяється забезпеченню мікроелементами організму дитини. Особлива роль надається цинку, який є одним із найбільш багатофункціональних мікроелементів. Мета: вивчити особливості клінічного перебігу АД в дітей залежно від вмісту цинку в сироватці крові. Матеріали та методи. У роботі наведені матеріали клінічного спостереження, клініко-лабораторного та інструментального обстеження 168 дітей віком від 7 до 18 років із АД. Контрольну групу становили 60 практично здорових дітей. Уміст цинку в сироватці крові визначали методом атомно-абсорбційної спектроскопії на спектрофотометрі С-115-М1, згідно з інструкціями, що додаються до приладу. Результати. Більше половини дітей (55,6 %) мали дуже низький рівень цинку — 0,35 ± 0,11 мг/л, ще 22,2 % — украй низький (0,12 ± 0,02 мг/л). Відзначена низка особливостей клінічного перебігу АД: частіші епізоди гострих респіраторних вірусних інфекцій, переважання середньотяжкого та тяжкого перебігу з періорбітальним, періоральним, періанальним дерматитом, дистрофічними змінами і гіперкератозом нігтів, підвищеною ламкістю волосся, вираженою сухістю шкіри (2,31 ± 0,73 бала проти 1,92 ± 0,69 бала; p < 0,01). Виявлено зворотні кореляційні зв’язки між концентрацією цинку в сироватці крові і сухістю шкірних покривів (р = 0,001; r = –0,67; t = –2,99), значенням індексу SСORAD (р = 0,01; r = –0,49; t = –2,34) і тривалістю перебігу АД (р = 0,001; r = –0,46; t = –2,13). Встановлено вірогідно нижчі показники зросту (p < 0,05), особливо в дітей із дуже низьким вмістом цинку (0,12 ± 0,02 мг/л). Висновки. У дітей, хворих на атопічний дерматит, вміст цинку в плазмі крові вірогідно нижчий, ніж у здорових дітей. У дітей зі зниженим вмістом цинку в організмі відзначена низка особливостей клінічного перебігу атопічного дерматиту (більш тяжкий та затяжний перебіг із періорбітальною та періанальною локалізацією, часті респіраторні інфекції, виражені дистрофічні зміни придатків шкіри, затримка зросту).
Актуальность. В поисках основных патогенетических механизмов атопического дерматита (АД) и улучшения вариантов профилактики и лечения все больше внимания уделяется обеспечению организма ребенка микроэлементами. Особая роль принадлежит цинку, который является одним из самых многофункциональных микроэлементов. Цель: изучить особенности клинического течения АД у детей в зависимости от содержания цинка в сыворотке крови. Материалы и методы. В работе представлены материалы клинического наблюдения, клинико-лабораторного и инструментального обследования 168 детей в возрасте от 7 до 18 лет с АД. Контрольную группу составили 60 практически здоровых детей. Содержание цинка в сыворотке крови определяли методом атомно-абсорбционной спектроскопии на спектрофотометре С-115-М1, согласно инструкциям, прилагаемым к прибору. Результаты. Более половины детей (55,6 %) имели очень низкий уровень цинка — 0,35 ± 0,11 мг/л, еще 22,2 % — крайне низкий (0,12 ± 0,02 мг/л). Отмечен ряд особенностей клинического течения АД: более частые эпизоды острых респираторных вирусных инфекций, преобладание среднетяжелого и тяжелого течения с периорбитальным, периоральным, перианальным дерматитом, дистрофическими изменениями и гиперкератозом ногтей, повышенной ломкостью волос, выраженной сухостью кожи (2,31 ± 0,73 балла против 1,92 ± 0,69 балла; p < 0,01). Выявлены обратные корреляционные связи между концентрацией цинка в сыворотке крови и сухостью кожных покровов (р = 0,001; r = –0,67; t = –2,99), значением индекса SСORAD (р = 0,01; r = –0,49; t = –2,34) и длительностью течения АД (р = 0,001; r = –0,46; t = –2,13). Установлены достоверно более низкие показатели роста (p < 0,05), особенно у детей с очень низким содержанием цинка (0,12 ± 0,02 мг/л). Выводы. У детей с атопическим дерматитом содержание цинка в плазме крови достоверно ниже, чем у здоровых детей. У детей с пониженным содержанием цинка в организме отмечен ряд особенностей клинического течения атопического дерматита (более тяжелое и затяжное течение с периорбитальной и перианальной локализацией, частые респираторные инфекции, выраженные дистрофические изменения придатков кожи, задержка роста).
Background. Searching for the fundamental pathogenic mechanisms of atopic dermatitis (AD) and improvement of options for prevention and treatment, increasing attention is paid to the state of trace elements supply of the child’s body. Particular role is given to zinc, which is one of the most versatile trace elements. The purpose was to study the features of atopic dermatitis in children depending on the serum content of zinc. Materials and methods. The paper presents the materials of clinical observation, clinical laboratory and instrumental examination of 168 children aged 7 to 18 years with AD. The control group consisted of 60 healthy children. The serum zinc content was determined by atomic absorption spectroscopy on a C-115-M1 spectrophotometer according to the instructions that are attached to the device. Results. More than half of children (55.6 %) had very low levels of zinc (0.35 ± 0.11 mg/l), while another 22.2 % had extremely low levels (0.12 ± 0.02 mg/l). Several features of AD clinical course were noted: more frequent episodes of acute respiratory infection, predominance of moderate and severe course with periorbital, perioral, perianal dermatitis, dystrophic changes and hyperkeratosis of the nails, increased hair brittleness, expressed skin dryness (2.31 ± 0.73 vs. 1.92 ± 0.69 points, p < 0.01). High inverse correlation between serum zinc concentration and dry skin (p = 0.001; r = –0.67; t = –2.99), the value of the SCORAD index (p = 0.01; r = –0.49; t = –2.34) and the duration of the course of AD (p = 0.001; r = –0.46; t = –2.13). Significantly lower growth rates (p < 0.05) were found, especially significant growth retardation was found in children with very low zinc content (0.12 ± 0.02 mg/l). Conclusions. In children with atopic dermatitis, the plasma zinc content is probably lower than in healthy children. The children with low zinc content presented with some features of the clinical course of atopic dermatitis (more severe and prolonged course with periorbital and perianal localization, frequent respiratory infections, pronounced dystrophic changes of skin supplements, growth retardation).
діти; атопічний дерматит; рівень цинку
дети; атопический дерматит; уровень цинка
children; atopic dermatitis; zinc level
Вступ
Матеріали та методи
Результати
/27.jpg)
/28.jpg)
Обговорення
Висновки
- Намазова-Баранова Л.С., Баранов А.А., Кубанова А.А. и др. Атопический дерматит у детей: современные клинические рекомендации по диагностике и терапии. Вопросы современной педиатрии. 2016. 15(3). 279-294. doi: 10.15690/vsp.v15i3.1566.
- Shaw T.E., Currie G.P., Koudelka C.W., Simpson E.L. Eczema prevalence in the United States: Data from the 2003 National Survey of Children’s Health. Journal of Investigative Dermatology. 2011. 131. 67-73. doi: 10.1038/jid.2010.251.
- Siegfried E.C., Hebert A.A. Diagnosis of atopic dermatitis: Mimics, overlaps, and complications. Journal of Clinical Medicine. 2015. 4. 884-917. doi: 10.3390/jcm4050884.
- Mortz C.G., Andersen K.E., Dellgren C. et al. Atopic dermatitis from adolescence to adulthood in the TOACS cohort: prevalence, persistence and comorbidities. Allergy. 2015. 70. 836-845. doi: 10.1111/all.12619.
- Arima M., Shimizu Y., Sowa J. et al. Psychosomatic analysis of atopic dermatitis using a psychological test. J. Dermatol. 2005. 32(3). 160-168. PMID: 15863860.
- Su J.C., Kemp A.S., Varigos G.A., Nolan T.M. Apotic eczema: its impact on the family and financial cost. Arch. Dis. Child. 1997. 76. 159-162. PMCID: PMC1717083.
- Lee J., Noh G., Lee S. et al. Atopic dermatitis and cytokines: recent patents in immunoregulatory and therapeutic implications of cytokines in atopic dermatitis — part I: cytokines in atopic dermatitis. Recent Pat Inflamm Allergy Drug Discov. 2012 Sep. 6(3). 222-47. PMID: 22827753.
- Wen H.J., Chen P.C., Chiang T.L. et al. Predicting risk for early infantile atopic dermatitis by hereditary and environmental factors. Br. J. Dermatol. 2009. 161. 1166-1172. doi: 10.1111/j.1365-2133.2009.09412.x.
- Harris V.R., Cooper A.J. Atopic dermatitis: the new frontier. Med. J. Aust. 2017. 207(8). 351-356. PMID: 29020907.
- Wen H.J., Wang Y.J., Lin Y.C. et al. Prediction of atopic dermatitis in 2-yr-old children by cord blood IgE, genetic polymorphisms in cytokine genes, and maternal mentality during pregnancy. Pediatr Allergy Immunol. 2011. 22(7). 695-703. doi: 10.1111/j.1399-3038.2011.01177.x.
- Ahn K. The role of air pollutants in atopic dermatitis. J. Allergy Clin. Immunol. 2014. 134(5). 993-9. doi: 10.1016/j.jaci.2014.09.023.
- Sayaseng K.Y., Vernon P. Pathophysiology and Management of Mild to Moderate Pediatric Atopic Dermatitis. J. Pediatr Health Care. 2018. 32(2). 2-12. doi: 10.1016/j.pedhc.2017.10.002.
- Vaughn A.R., Foolad N., Maarouf M., Tran K.A., Shi V.Y. Micronutrients in Atopic Dermatitis: A Systematic Review. The Journal of Alternative and Complementary Medicine. 2019. doi: 10.1089/acm.2018.0363.
- Tasaki M., Hanada K., Hashimoto I. Analyses of Serum Copper and Zinc Levels and Copper/Zinc Ratios in Skin Diseases. The Journal of Dermatology. 2015. 20(1). 21-24.
- El Hachem M., Di Mauro G., Rotunno R. et al. Pruritus in pediatric patients with atopic dermatitis: a multidisciplinary approach — summary document from an Italian expert group. Ital. J. Pediatr. 2020. 46(1). 11. doi: 10.1186/s13052-020-0777-9.
- Gray N.A., Dhana A., Stein D.J., Khumalo N.P. Zinc and atopic dermatitis: a systematic review and meta‐analysis. Journal of the European Academy of Dermatology and Venereology. 2019. 33(6). 1042-1050.
- Kambe T., Fukue K., Ishida R., Miyazaki S. Overview of Inherited Zinc Deficiency in Infants and Children. J. Nutr. Sci. Vitaminol. (Tokyo). 2015. 61. 44-6. doi: 10.3177/jnsv.61.S44.
- Aida M. Yousef and Ekramy Elmorsy. Serum zinc level in bronchial asthma. Egyptian Journal of Chest Diseases and Tuberculosis. 2017. 66 (1). 1-4. doi: 10.1016/j.ejcdt.2016.10.009.
- Wahab A.A., Zeidan A., Avades T. et al. Serum Zinc Level in Asthmatic and Non-Asthmatic School Children. Children. 2018. 5(3). 42. doi: 10.3390/children5030042.
- Umair M., Alfadhel M. Genetic Disorders Associated with Metal Metabolism. Cells. 2019. 9(8). 12. doi: 10.3390/cells8121598.
- Ackland M.L., Michalczyk A.A. Zinc and infant nutrition. Arch. Biochem. Biophys. 2016. 1(611). 51-57. doi: 10.1016/j.abb.2016.06.011.
- Samuel T.M., Thomas T., Thankachan P., Bhat S., Virtanen S.M., Kurpad A.V. Breast milk zinc transfer and early post-natal growth among urban South Indian term infants using measures of breast milk volume and breast milk zinc concentrations. Matern. Child Nutr. 2014. 10(3). 398-409.
- Sabatier M., Garcia-Rodenas C.L., Castro C.A. Longitudinal Changes of Mineral Concentrations in Preterm and Term Human Milk from Lactating Swiss Women. Nutrients. 2019. 11(8). E1855. doi: 10.3390/nu11081855.
- Rosenkranz E., Hilgers R.D., Uciechowski P. et al. Zinc enhances the number of regulatory T cells in allergen-stimulated cells from atopic subjects. Eur. J. Nutr. 2017. 56(2). 557-567. Epub 2015 Nov 20.
- Gombart A.F., Pierre A., Maggini S. A Review of Micronutrients and the Immune System-Working in Harmony to Reduce the Risk of Infection. Nutrients. 2020. 16(12(1)). E236. doi: 10.3390/nu12010236.
- Chen M., Sun Y., Wu Yili. Lower circulating zinc and selenium levels are associated with an increased risk of asthma: evidence from a meta-analysis. Public Health Nutrition. 2019. 5. 1-8. doi: 10.1017/S1368980019003021.
- Kumar S., Thakur V., Choudhary R., Vinay K. Acrodermatitis Enteropathica. J. Pediatr. 2020. 21. S0022-3476(20)30030-5. doi: 10.1016/j.jpeds.2020.01.017.
- Kim J.E., Yoo S.R., Jeong M.G., Ko J.Y., Ro Y.S. Hair zinc levels and the efficacy of oral zinc supplementation in patients with atopic dermatitis. Acta Derm. Venereol. 2014. 94(5). 558-62. doi: 10.2340/00015555-1772.
- Yamada T., Saunders T., Kuroda S. et al. Cohort study for prevention of atopic dermatitis using hair mineral contents. J. Trace Elem. Med. Biol. 2013. 27. 126-131.
- Ogawa Y., Kinoshita M., Shimada S., Kawamura T. Zinc in Keratinocytes and Langerhans Cells: Relevance to the Epidermal Homeostasis. J. Immunol. Res. 2018. 9. 5404093. doi: 10.1155/2018/5404093.
- Gil-Soon Choi, Min-Soo Jang, Hee-Kyoo Kim. Acquired acrodermatitis enteropathica caused by zinc deficiency in a heavy drinker: A case report. Allergy Asthma Respir. Dis. 2017. 5(6). 361-365.
- Maggini S., Wenzlaff S., Hornig D. Essential role of vitamin C and zinc in child immunity and health. J. Int. Med. Res. 2010. 38. 386-414.
- Rizk P., Rodenas M., De Benedetto A. Allergen Immunotherapy and Atopic Dermatitis: the Good, the Bad, and the Unknown. Curr. Allergy Asthma Rep. 2019. 19(12). 57. doi: 10.1007/s11882-019-0893-z.
- Weidinger S., Novak N. Atopic dermatitis. Lancet. 2016. 387. 1109-1122.
- Sánchez Caraballo J.M., Cardona Villa R. Clinical and immunological changes of immunotherapy in patients with atopic dermatitis: randomized controlled trial. ISRN Allergy. 2012. 2012. 183983. doi: 10.5402/2012/183983.
- Nakamura T., Yamada T., Kataoka K. et al. Statistical resolutions for large variabilities in hair mineral analysis. PLoS ONE. 2018. 13(12). Е0208816. https://doi.org/10.1371/journal.pone.0208816.

/27_2.jpg)
/28_2.jpg)