Основними вимогами до лікарських засобів (ЛЗ) є їх ефективність і безпека. Розвиток фармацевтичної індустрії і результати досліджень у фармакології дозволили суттєво розширити можливості фармакотерапії багатьох захворювань. Однак при цьому зросла і кількість патологічних станів, пов’язаних із ЛЗ. Проблеми, пов’язані із ЛЗ (DRPs — Drug Related Problems), не лише досить поширені й спричиняють значну захворюваність пацієнтів, у деяких випадках вони призводять до летального кінця, а також збільшують витрати на охорону здоров’я [1–3]. Так, у США несприятливі побічні реакції на лікарські засоби (НПР) щорічно є причиною понад 100 тис. фатальних випадків і спричиняють економічні витрати в середньому близько 136 мільярдів доларів [4].
Згідно з кваліфікаційною системою DRP PCNE V5.01 (Pharmaceutical Care Network Europe) 2006 року, DRPs кодують за 4 основними категоріями: Р (Problems) — проблеми, С (Causes) — причини, I (Interventions) — втручання і О (Outcomes) — наслідки. За кодом «P» DRPs виділяються: а) прояви НПР (алергічні/неалергічні); б) раціональність вибору підозрюваного і супутніх ЛЗ, режиму їх дозування і лікарської форми; в) помилки, що виникають у процесі прийому ЛЗ пацієнтами; г) вірогідність взаємодії ЛЗ тощо. Причини DRPs за кодом «С» класифікуються таким чином: а) DRPs, обумовлені вибором підозрюваного ЛЗ і його дози; б) DRPs унаслідок застосування супутніх ЛЗ і можливості взаємодії ЛЗ між собою; в) пацієнт-орієнтовані психологічні чинники появи DRPs (неможливість пацієнтом прийняти підозрюваний і/або супутній ЛЗ); г) DRPs, що виникають у результаті низької інформованості лікарів і пацієнтів про раціональне застосування ЛЗ; д) DRPs, пов’язані з доступністю отримання ЛЗ. Втручання лікаря або клінічного провізора, позначені кодом «I», розглядаються на 3 рівнях: I рівень — рівень фахівця, який призначив ЛЗ; II рівень — рівень пацієнта; III рівень — рівень ЛЗ. Серед таких втручань можна виділити відміну підозрюваного ЛЗ, відміну супутніх ЛЗ, а також призначення ЛЗ для корекції наслідків, викликаних НПР. Серед наслідків DRPs (код «O») виділяють 2 основні варіанти: повністю вирішені DRPs і невирішені DRPs [5].
НПР є однією з ключових DRPs. Згідно із сучасними уявленнями НПР — небажані стани, що виникають в організмі людини при прийомі лікарських засобів у звичайних дозах. У наш час переважно користуються ABCDE-системою класифікації НПР [6].
Тип А (augmented — доповнені) — дозозалежні й передбачувані (прогнозовані) НПР, виникають унаслідок перебільшення нормальної фармакологічної дії ЛЗ.
Тип В (bizarre — дивні) — непередбачувані (непрогнозовані), незалежні від дози. До даного типу НПР належать імунні (алергічні) і неімунні (псевдоалергічні реакції, ідіосинкразія).
Тип С (continuing — тривати) — реакції, що виникають при тривалому застосуванні ЛЗ.
Тип D (delayed — затриманий) — реакції, що з’являються через певний час (мутагенні, канцерогенні, тератогенні).
Тип Е (end-of-use — відміна) — реакції відміни.
Залежно від тяжкості виділяють НПР легкі, помірні й тяжкі, а з урахуванням наслідків для пацієнта — серйозні й несерйозні.
Серед госпіталізованих дітей НПР зустрічаються в 5 % [7]. Частіше (у 4,9–21,1 % дітей) відмічаються шкірні реакції (почервоніння шкіри, кропив’янка) [8, 9]; лихоманка (2,9–10,3 %) [8, 9]; гіперчутливість — у 4,1 % [8], блювання — у 2,8 % [8]. Серед зареєстрованих у дітей НПР у 0,28 % випадків вони були зі смертельними наслідками [10].
Для прикладу розглянемо ризики розвитку НПР у дітей, які потребують лікування когнітивної дисфункції.
Як відомо, поширення цифрових технологій призвело до суттєвого зростання об’ємів інформації, які сучасна людина повинна щоденно обробляти. Це збільшує вимоги до когнітивних процесів і ставить завдання підтримки центральної нервової системи в стані високої готовності до розумової діяльності, у тому числі до навчання. Цим, зокрема, обумовлена, з одного боку, поширеність когнітивних розладів у дітей, а з іншого — потреба в застосуванні засобів, що покращують когнітивні функції (ноотропів), у тому числі пам’ять і увагу [11]. Вважається, що когнітивне підсилення є важливою складовою прискорення процесів навчання та зменшення ризиків розвитку відхилення поведінки в дітей і підлітків. Але воно залишається однією із найбільш інтригуючих і суперечливих тем нейронауки [12].
/62.jpg)
Умовно ЛЗ ноотропної дії поділяють на ноотропи прямої дії («справжні» ноотропи або когнітивні підсилювачі — cognitive enhancers) і нейропротектори з ноотропною дією [13]. Вважається, що когнітивні підсилювачі мають імітувати дію певних нейромедіаторів, створюючи або підсилюючи нейронну молекулярну сигналізацію. Крім психостимуляторів (амфетаміну, метилфенідату), інгібіторів ацетилхолінестерази (мемантин тощо), до засобів, що історично використовуються для когнітивного підсилення, належать глюкоза [14], кофеїн [15], омега-3 жирні кислоти, фолієва кислота, біофлавоноїди [11], фітозасоби гінкго білоба [16] тощо. Значні сподівання покладались на неамфетамінний препарат модафініл, його називали першим розумним препаратом (smart drug) [17]. Його дія пояснюється здатністю інгібувати зворотний захват дофаміну та модуляцією норадренергічного, серотонінергічного, орексинергічного, гістамінергічного, глутаматергічного і ГАМКергічного шляхів [18].
Побічні ефекти когнітивних підсилювачів досить часті. Так, доведено, що модафініл може спричинити головний біль, запаморочення, сухість у роті, нудоту, діарею, інсомнію, тривожність, підвищення артеріального тиску й частоти серцевих скорочень (ЧСС), дещо рідше викликає серйозні реакції гіперчутливості, у тому числі мультиформну еритему й синдром Стівенса — Джонса [18]. Серед побічних ефектів кофеїну — серцебиття, головний біль, інсомнія, більш тяжкі побічні ефекти — біль у ділянці серця, суправентрикулярна тахікардія, шлуночкові аритмії.
Частота побічних ефектів гінкго становить близько 1,7 % (зрідка диспепсія, ще рідше — головний біль і шкірний алергічний висип). Інколи відмічаються випадки внутрішньочерепних крововиливів і післяопераційних кровотеч. Мемантин може викликати низку побічних ефектів із боку центральної нервової системи: запаморочення, неспокій, у тому числі руховий, відчуття втоми, важкості в голові, нудоту [19].
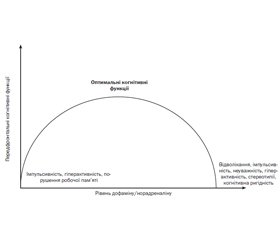
На рис. 1 показано залежність між дозою і впливом когнітивних підсилювачів на когнітивні функції — збільшення концентрації лікарського засобу в крові вище від необхідного спричиняє погіршення когнітивних функцій.
Крім того, що когнітивні підсилювачі асоціюються з ризиком побічних ефектів, доказова база щодо їх використання недостатньо переконлива [20], оскільки результати досить варіабельні. Так, холін розглядають як важливий компонент для зменшення когнітивного дефіциту внаслідок алкогольного впливу в матерів [21], тоді як результати іншого дослідження [22] не показали ефективності даного впливу. Метилфенідат підвищує акуратність у виконанні завдань, але при цьому збільшує тривалість часу реакції [23].
Тому широко обговорюються етичні аспекти застосування лікарських засобів «для розуму» [24]. Не може не турбувати те, що останнім часом з’явились тенденції застосовувати когнітивні підсилювачі й у здорових людей з метою профілактики навчальних проблем. Так, наприклад, метилфенідат та інші психостимулятори були розроблені для лікування синдрому дефіциту уваги з гіперактивністю. Однак з метою підвищення продуктивності в навчанні все частіше їх стали застосовувати здорові підлітки й дорослі. Тому наголошується на ризиках зловживання психостимуляторами, особливо в здорових підлітків [25]. Тим більше що досі до кінця не зрозуміло, як ці ЛЗ можуть впливати на когнітивні показники, особливо в молодому мозку.
З огляду на зазначене, зокрема часті побічні реакції на когнітивні підсилювачі, почали розроблятись напрями нутритивної підтримки (з використанням амінокислот, вітамінів, мінеральних речовин) і фітозасоби для посилення нейроадаптації дітей до інтенсивних інтелектуальних навантажень. Так, триптофан є незамінною амінокислотою, пул якої поновлюється завдяки триптофану їжі й катаболізму білків. З точки зору когнітивного підсилення триптофан — це джерело для синтезу нікотинамідних коферментів — нікотинамідаденіндинуклеотиду й нікотинамідаденіндинуклеотидфосфату, нікотинової кислоти, біогенного моноаміну серотоніну, гормону мелатоніну, що здатні значною мірою впливати на метаболічні процеси в різних органах і тканинах організму. Серотонін є одним з основних медіаторів центральної нервової системи, а також виконує важливі гормональні функції на периферії організму.
Глутамін — найпоширеніша замінна вільна амінокислота (її вміст становить близько 20 % від загального вмісту амінокислот) в організмі людини, вона є важливою складовою гомеостазу. Глутамін містить два атоми азоту, тому є також джерелом для побудови амінокислот в організмі. Глутамін є попередником головних збуджуючих та інгібуючих нейротрансмітерів мозку, таких як ГАМК і глутамат.
Аспарагін — амід аспарагінової кислоти, він бере участь у синтезі сечовини та піримідинових основ, а також у переамінуванні амінокислот.
DL-фосфосерин міститься в мембранах усіх клітин організму, і найбільше — у головному мозку. Фосфатаза фосфосерину перетворює його на L-серин (потужний нейротрофічний фактор, попередник низки важливих сполук, включно з фосфатидилсерином, сфінгомієліном, гліцином і D-серином).
Вітамін В6 відіграє ключову роль у розвитку мозку. Його активний метаболіт є коферментом у реакціях декарбоксилювання амінокислот, що беруть участь у синтезі всіх нейромедіаторів. Вітамін В6 також виявляє антиоксидантні властивості, відіграє важливу роль у регуляції клітинного транспорту кальцію, захищає від нейротоксичності, викликаної ішемією і глутаматом. Піридоксин також сприяє функціонуванню гіпокампу шляхом підвищення гідроксилазної імунореактивності серотоніну й тирозину [26]. Хронічне додаткове вживання піридоксину покращує диференціювання нейробластів у зубчастій звивині й індукує нові зрілі нейрони в гіпокампі [27]. Піридоксин також виявляв нейропротекторну дію [28].
Як відомо, магній є регулятором ДНК-транскрипції, зв’язування гормонів із рецепторами, мітохондріального окисного фосфорилювання, трансмембранного перенесення іонів, активності аденілатциклази, м’язового скорочення, судинного тонусу тощо. Дефіцит магнію спричиняє хронічне низькоінтенсивне запалення [29]. Магній здійснює нейропротекторну дію через антагоністичний вплив на глутаматні рецептори, оскільки блокує надходження іонів кальцію в клітину, та антиоксидантні ефекти [30].
Властивості покращувати когнітивні функції є і в лікарських рослин [31] (наприклад, у водного розчину листя Albizia adianthifolia [32]). Нейротропні ефекти флавоноїдів липи широколистої проявляються в седативній і антитривожній дії, зменшенні локомоторної [33] і судомної [34] активності. Флавоноїд ромашки аптекарської апігенін знижує тривожність [35], а інший флавоноїд лютеолін дає антиоксидантні, протизапальні, нейропротекторні ефекти [35].
Враховуючі особливості вказаних біологічно активних нутрієнтів і фітозасобів, створюють комбінації, у яких кожний компонент поданий у незначній дозі, що мінімізує ризик дозозалежної побічної реакції, однак за рахунок потенціювання дії досягається виражений нейропротекторний ефект.
Так, препарат Сілента (містить у 5 мл 278,2 мг цитрату магнію (у тому числі 30 мг магнію); 50 мг L-триптофану; 80 мг сухого екстракту квіток ромашки аптечної; 50 мг сухого екстракту листя меліси лікарської і 20 мг сухого екстракту суцвіть липи широколистої) і препарат Когівіс (у 5 мл сиропу містить 35 мг аспарагіну моногідрату, 32,5 мг N-ацетил-L-глутаміну, 35 мг DL-фосфосерину та 0,75 мг вітаміну В6) чинять відповідно седативну й тонізуючу дію на нервову систему, підвищують розумову й фізичну працездатність [36]. Як показали дослідження, належність Когівісу і Сіленти до природних препаратів дозволяє їх поєднувати з будь-якими нейротропними лікарськими засобами для використання в дітей із різними проявами порушення вегетативної нервової системи [36].
Отже, ризик розвитку несприятливих побічних реакцій на лікарські засоби може обумовити зміну парадигм лікування багатьох захворювань у дітей. Певною мірою неоднозначність реакцій на когнітивні підсилювачі можна пояснити фармакогенетичними особливостями [24]. Це вказує на необхідність подальшого вивчення ролі поліморфізмів генів, що кодують рецептори нейрональних сигнальних систем.
Для запобігання НПР велике значення має орієнтація лікаря в частоті НПР даного конкретного засобу, ретельний збір медикаментозного, у тому числі алергологічного, анамнезу. Оскільки частіше відмічаються дозозалежні НПР, необхідно мінімізувати застосування лікарських засобів із вузьким терапевтичним індексом і/або значну увагу приділяти запобіганню фармакокінетичній або фармакодинамічній взаємодії ЛЗ, використовувати найбільш синергічні комбінації малих доз ЛЗ із широким терапевтичним індексом.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Ruths S., Viktil K.K., Blix H.S. Classification of drug-related problems. Tidsskr Nor. Laegeforen. 2007. 127(23). 3073-3076. URL: https://www.ncbi.nlm.nih.gov/pubmed/18049498.
2. Adusumilli P., Adepu R. Drug related problems: an over view of various classification systems. Asian J. Pharm. Clin. Res. 2014. 7(4). 7-10. URL: https://innovareacademics.in/journals/index.php/ajpcr/article/view/2728/1122.
3. Roshanzamiri S., Eslami K., Najmeddin F. et al. Validating a Drug-Related Problems Classification System in Outpatient Setting in Iran. J. Res Pharm. Pract. 2018. 7(3). 117-122. doi: 10.4103/jrpp.JRPP_18_17.
4. Tan Y., Hu Y., Liu X. et al. Improving drug safety: From adverse drug reaction knowledge discovery to clinical implementation. Methods. 2016. 110. 14-25. doi: 10.1016/j.ymeth.2016.07.023.
5. PCNE Classification for Drug related problems (revised 01-05-06 vm) V5.01. URL: https://www.pcne.org/upload/files/16_PCNE_classification_V5.01.pdf
6. Guidance on adverse drug reactions. URL: https://www.gov.uk/government/uploads/system/uploads/attachment_data/file/403098/Guidance_on_adverse_drug_reactions.pdf.
7. Kurian J., Mathew J., Sowjanya K. et al. Adverse Drug Reactions in Hospitalized Pediatric Patients: A Prospective Observational Study. Indian J. Pediatr. 2016. 83(5). 414-419. doi: 10.1007/s12098-015-2002-1.
8. Saint-Martin C., Kanagaratnam L., de Boissieu P. et al. Adverse drug reactions in pediatrics: Experience of a regional pharmacovigilance center. Therapie. 2016. 71(5). 467-473. doi: 10.1016/j.therap.2016.04.001.
9. Obebi Cliff-Eribo K., Sammons H., Star K. et al. Adverse drug reactions in Nigerian children: a retrospective review of reports submitted to the Nigerian Pharmacovigilance Centre from 2005 to 2012. Paediatr. Int. Child Health. 2016. 36(4). 300-304. DOI: 10.1179/2046905515Y.0000000059
10. Rosli R., Ming L.C., Aziz N.A., Manan M.M. A Retrospective Analysis of Spontaneous Adverse Drug Reactions Reports Relating to Paediatric Patients. PLOS ONE. 2016. 11(6). e0155385. doi: 10.1371/journal.pone.0155385. eCollection 2016.
11. Dresler M., Sandberg A., Bublitz C. et al. Hacking the Brain: Dimensions of Cognitive Enhancement. ACS Chem. Neurosci. 2019. 10(3). 1137-1148. doi: 10.1021/acschemneuro.8b00571.
12. Urban K.R., Gao W.-J. Performance enhancement at the cost of potential brain plasticity: neural ramifications of nootropic drugs in the healthy developing brain. Frontiers in Systems Neuroscience. 2014. 8. 38. 1-10. doi: 10.3389/fnsys.2014.00038.
13. Чекман И.С., Беленичев И.Ф., Демченко А.В. и др. Ноотропы в комплексной терапии хронической ишемии мозга. Наука та інновації. 2014. 10(4). 61-75. URL: ftp://nas.gov.ua/
14. Sun F.H., Cooper S.B., Gui Z. Effects of carbohydrate and protein co-ingestion during short-term moderate-intensity exercise on cognitive function. J. Sports Med. Phys. Fitness. 2020. doi: 10.23736/S0022-4707.20.10322-0.
15. Cappelletti S., Piacentino D., Sani G., Aromatario M. Caffeine: cognitive and physical performance enhancer or psychoactive drug? Curr. Neuropharmacol. 2015. 13(1). 71-88. doi: 10.2174/1570159X13666141210215655.
16. Suliman N.A., Taib C.N.M., Moklas M.A.M. et al. Establishing Natural Nootropics: Recent Molecular Enhancement Influenced by Natural Nootropic Evidence-Based Complementary and Alternative Medicine. 2016. 4391375. 1-12. URL: https://doi.org/10.1155/2016/4391375.
17. Sharp C. Cognitive enhancers — performance or problem? Occupational Medicine. 2016. 66. 88-91. doi:10.1093/occmed/kqv190.
18. Sousa A., Dinis-Oliveira R.J. Pharmacokinetic and pharmacodynamic of the cognitive enhancer modafinil: Relevant clinical and forensic aspects. Subst. Abus. 2020. 17. 1-19. doi: 10.1080/08897077.2019.1700584.
19. Штрыголь С.Ю., Кортунова Т.В., Штрыголь Д.В. Побочные эффекты ноотропных средств. Провізор. 2003. 11. URL: http://www.provisor.com.ua/archive/2003/N11/art_31.php.
20. Schleim S., Quednow B.B. How Realistic Are the Scientific Assumptions of the Neuroenhancement Debate? Assessing the Pharmacological Optimism and Neuroenhancement Prevalence Hypotheses. Front Pharmacol. 2018. 9. 3. doi: 10.3389/fphar.2018.00003. eCollection 2018.
21. Akison L.K., Kuo J., Reid N. et al. Effect of Choline Supplementation on Neurological, Cognitive, and Behavioral Outcomes in Offspring Arising from Alcohol Exposure During Development: A Quantitative Systematic Review of Clinical and Preclinical Studies. Alcohol. Clin. Exp. Res. 2018. 42(9). 1591-1611. doi: 10.1111/acer.13817.
22. Nguyen T.T., Risbud R.D., Mattson S.N. et al. Randomized, double-blind, placebo-controlled clinical trial of choline supplementation in school-aged children with fetal alcohol spectrum disorders. Am. J. Clin. Nutr. 2016. 104(6). 1683-1692.
23. ter Huurne N., Fallon S.J., van Schouwenburg M. et al. Methylphenidate alters selective attention by amplifying salience. Psychopharmacology (Berl). 2015. 232(23). 4317-23. doi: 10.1007/s00213-015-4059-y.
24. Fond G., Micoulaud-Franchi J.A., Brunel L. et al. Innovative mechanisms of action for pharmaceutical cognitive enhancement: A systematic review. Psychiatry Res. 2015. 229(1–2). 12-20. doi: 10.1016/j.psychres.2015.07.006.
25. Urban K.R., Gao W.-J. Psychostimulants As Cognitive enhancers in Adolescents: More Risk than Reward? Frontiers in Public Health. 2017. 5. 260. 1-7. doi: 10.3389/fpubh.2017.00260
26. Jung H.Y., Kim D.W., Nam S.M. et al. Pyridoxine improves hippocampal cognitive function via increases of serotonin turnover and tyrosine hydroxylase, and its association with CB1 cannabinoid receptor-interacting protein and the CB1 cannabinoid receptor pathway. Biochim. Biophys. Acta Gen. Subj. 2017. 861(12). 3142-3153. doi: 10.1016/j.bbagen.2017.09.006.
27. Yoo D.Y., Kim W., Nam S.M. et al. Chronic effects of pyridoxine in the gerbil hippocampal CA1 region after transient forebrain ischemia. Neurochem. Res. 2012. 37(5). 1011-1008. doi: 10.1007/s11064-011-0696-7.
28. Abraham P.M., Kuruvilla K.P., Mathew J. et al. Alterations in hippocampal serotonergic and INSR function in streptozotocin induced diabetic rats exposed to stress: neuroprotective role of pyridoxine and Aegle marmelose. J. Biomed. Sci. 2010. 17. 78. doi: 10.1186/1423-0127-17-78.
29. Nielsen F.H. Magnesium deficiency and increased inflammation: current perspectives. J. Inflamm. Res. 2018. 11. 25-34. doi: 10.2147/JIR.S136742.
30. Magnesium in the Central Nervous System / Edited by R. Vink, M. Nechifor. 2011. URL: https://www.adelaide.edu.au/press/titles/magnesium/magnesium-ebook.pdf.
31. Kulkarni R., Girish K.J., Kumar A. Nootropic herbs (Medhya Rasayana) in Ayurveda: An update. Pharmacogn. Rev. 2012. 6(12). 147-53. doi: 10.4103/0973-7847.99949.
32. Beppe G.J., Dongmo A.B., Foyet H.S. et al. Memory-enhancing activities of the aqueous extract of Albizia adianthifolia leaves in the 6-hydroxydopamine-lesion rodent model of Parkinson’s disease. BMC Complement Altern. Med. 2014. 14. 142. doi: 10.1186/1472-6882-14-142.
33. Loscalzo L.M., Wasowski C., Marder M. Neuroactive flavonoid glycosides from Tilia petiolaris DC. Extracts. Phytother. Res. 2009. 23(10). 1453-1457. doi: 10.1002/ptr.2800.
34. Cárdenas-Rodríguez N., González-Trujano M.E., Aguirre-Hernández E. et al. Anticonvulsant and antioxidant effects of Tilia americana var. mexicana and flavonoids constituents in the pentylenetetrazole-induced seizures. Oxid. Med. Cell Longev. 2014. 2014. 329172. doi: 10.1155/2014/329172.
35. Taliou A., Zintzaras E., Lykouras L. Francis K. An open-label pilot study of a formulation containing the anti-inflammatory flavonoid luteolin and its effects on behavior in children with autism spectrum disorders. Clin. Ther. 2013. 35(5). 592-602. doi: 10.1016/j.clinthera.2013.04.006.
36. Квашніна Л.В., Майдан І.С., Ігнатова Т.Б. Можливості комплексної корекції проявів шкільної дезадаптації в дітей молодшого шкільного віку. Здоровье ребенка. 2019. 14(2). 2-7. URL: http://www.mif-ua.com/archive/article/47704.

/62.jpg)
/63.jpg)