Журнал "Гастроэнтерология" Том 54, №1, 2020
Вернуться к номеру
Зв’язок біомаркерів запалення в товстій кишці з індексами активності неспецифічного виразкового коліту
Авторы: Псарьова І.В.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
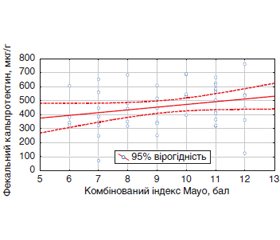
Мета: проаналізувати вміст маркерів кишкового запалення в крові та калі хворих на неспецифічний виразковий коліт (НВК) порівняно з відомими індексами активності хвороби. Матеріали та методи. Досліджені 60 пацієнтів із підтвердженим діагнозом НВК. Клінічну активність НВК оцінювали за допомогою клінічного індексу активності за D. Rachmilewitz. Ендоскопічна активність НВК визначалася за індексом Mayo. Ступінь активності НВК оцінювали за комбінованим індексом Mayo. У сироватці крові визначали вміст α-1-антитрипсину та С-реактивного білка. В калі досліджували вміст мієлопероксидази, кальпротектину та α-1-антитрипсину. Кореляційний аналіз здійснювали з розрахунком коефіцієнта кореляції Спірмена та його значущості. Результати. У хворих на НВК виявлено суттєве підвищення рівня фекальної мієлопероксидази в 4,5 раза (р = 0,027) та α-1-антитрипсину в калі в 3,6 раза (р = 0,039) відповідно до збільшення ступеня клінічної активності НВК. При вираженому ступені ендоскопічної активності НВК відзначено вірогідне збільшення рівня маркерів запалення в калі: α-1-антитрипсину — в 17,8 раза (р = 0,037), кальпротектину — в 1,7 раза (р = 0,023), мієлопероксидази — 4,3 раза (р = 0,019). Водночас рівні С-реактивного білка та α-1-антитрипсину в крові не мали значущої різниці залежно від ступеня активності НВК. Висновки. У пацієнтів із НВК встановлено взаємозв’язки вмісту мієлопероксидази і кальпротектину в калі з індексом ендоскопічної активності НВК (r = 0,63, p = 0,0008 і r = 0,53, p = 0,001 відповідно), а також рівня фекальної мієлопероксидази зі ступенем активності НВК за комбінованим індексом Mayo (r = 0,68, p = 0,0001).
Цель: проанализировать содержание маркеров кишечного воспаления в крови и кале больных с неспецифическим язвенным колитом (НЯК) в сопоставлении с известными индексами активности болезни. Материалы и методы. Исследованы 60 пациентов с подтвержденным диагнозом НЯК. Клиническую активность НЯК оценивали с помощью клинического индекса активности по D. Rachmilewitz. Эндоскопическая активность НЯК определялась по индексу Mayo. Степень активности НЯК оценивали по комбинированному индексу Mayo. В сыворотке крови определяли содержание α-1-антитрипсина и С-реактивного белка. В кале исследовали содержание миелопероксидазы, кальпротектина и α-1-антитрипсина. Корреляционный анализ осуществляли с расчетом коэффициента корреляции Спирмена и его значимости. Результаты. У больных НЯК выявлено существенное повышение уровня фекальной миелопероксидазы в 4,5 раза (р = 0,027) и α-1-антитрипсина в кале в 3,6 раза (р = 0,039) по мере увеличения клинической активности НЯК. При выраженной степени эндоскопической активности НЯК отмечено достоверное увеличение уровня маркеров воспаления в кале: α-1-антитрипсина — в 17,8 раза (р = 0,037), кальпротектина — в 1,7 раза (р = 0,023), миелопероксидазы — 4,3 раза (р = 0,019). В то же время уровни С-реактивного белка и α-1-антитрипсина в крови не имели значимых различий в зависимости от степени активности НЯК. Выводы. У пациентов с НЯК установлены взаимосвязи уровня миелопероксидазы и кальпротектина в кале с индексом эндоскопической активности (r = 0,63, p = 0,0008 и r = 0,53, p = 0,001 соответственно), а также уровня фекальной миелопероксидазы со степенью активности заболевания согласно комбинированному индексу Mayo (r = 0,68, p = 0,0001).
Background. The goal is to analyze the content of markers of intestinal inflammation in the blood and feces of patients with ulcerative colitis (UC) in comparison with the known disease activity indices. Materials and methods. We examined 60 patients with a confirmed diagnosis of UC. The clinical activity of UC was evaluated using a clinical activity index of D. Rachmilewitz. Endoscopic activity of UC was determined by the Mayo index. The degree of UC activity was assessed by the combined Mayo index. Serum levels of α1-antitrypsin and C-reactive protein were determined. The content of myeloperoxidase, calprotectin and α1-antitrypsin in the feces was studied. Correlation analysis was carried out with the calculation of the Spearman’s rank correlation coefficient and its significance. Results. In patients with UC, a significant increase in the level of fecal myeloperoxidase was detected — by 4.5 times (p = 0.027) and α1-antitrypsin in the feces — by 3.6 times (p = 0.039) as the clinical activity of UC was increased. With a pronounced degree of endoscopic activity of UC, a significant increase in the level of markers of inflammation in the feces was noted: α1-antitrypsin — by 17.8 times (p = 0.037), calprotectin — by 1.7 times (p = 0.023), myeloperoxidase — by 4.3 times (p = 0.019). At the same time, the level of C-reactive protein and α1-antitrypsin in the blood did not have significant differences depending on the degree of activity of ulcerative colitis. Conclusions. In patients with UC, correlations were established between the level of myeloperoxidase and calprotectin in the feces and the index of endoscopic activity of UC (r = 0.63; p = 0.0008, and r = 0.53; p = 0.001, respectively), as well as between the level of fecal myeloperoxidase and the degree of disease activity according to the combined Mayo index (r = 0.68; p = 0.0001).
неспецифічний виразковий коліт; діагностика; індекс активності виразкового коліту; маркери запалення в крові; фекальні маркери запалення
неспецифический язвенный колит; диагностика; индекс активности язвенного колита; маркеры воспаления в крови; фекальные маркеры воспаления
ulcerative colitis; diagnosis; index of ulcerative colitis activity; markers of inflammation in the blood; fecal markers of inflammation
Вступ
Матеріали та методи
Результати
Висновки
1. Kawalec P., Stawowczyk E., Mossakowska M., Pilc A. Disease activity, quality of life, and indirect costs of ulcerative colitis in Poland. Gastroenterology Review/Przegląd. Gastroenterologiczny. 2017. N 12(1). P. 60-65.
2. Ananthakrishnan A.N., Kaplan G.G., Ng S.C. Changing global epidemiology of inflammatory bowel diseases-sustaining healthcare delivery into the 21st century. Clin. Gastroenterol. Hepatol. 2020. pii: S1542-3565(20)30107-5.
3. Yu Y.R., Rodriguez J.R. Clinical presentation of Crohn's, ulcerative colitis, and indeterminate colitis: Symptoms, extraintestinal manifestations, and disease phenotypes. Semin. Pediatr. Surg. 2017. Vol. 26(6). P. 349-355.
4. Maaser C., Sturm A., Vavricka S.R. et al. ECCO-ESGAR Guideline for diagnostic assessment in IBD. Part 1: Initial diagnosis, monitoring of known IBD, detection of complications. Journal of Crohn’s and Colitis. 2019. Vol. 13. Issue 2. P. 144-164.
5. Cao Q., Huang Y.H., Jiang M., Dai C. The prevalence and risk factors of psychological disorders, malnutrition and quality of life in IBD patients. Scand. J. Gastroenterol. 2019. Vol. 54(12). P. 1458-1466.
6. Armuzzi A., Tarallo M., Lucas J. et al. The association between disease activity and patient-reported outcomes in patients with moderate-to-severe ulcerative colitis in the United States and Europe. BMC Gastroenterol. 2020. Vol. 20(1). P. 18.
7. Pizarro G., Quera R., Figueroa C. Prognostic factors of ulcerative colitis at the moment of diagnosis. Rev. Med. Chil. 2017. Vol. 145(10). P. 1319-1329.
8. Simian D., Fluxá D., Flores L. et al. Inflammatory bowel disease: A descriptive study of 716 local Chilean patients. World J. Gastroenterol. 2016. Vol. 22(22). P. 5267-5275.
9. Allez M., Lemann M. Role of endoscopy in predicting the disease course in inflammatory bowel disease. World J. Gastroenterol. 2010. Vol. 16(21). P. 2626-2632.
10. Бойко Т.Й. Клинико-эндоскопические и морфологические параллели при неспецифическом язвенном колите. Вісник проблем біології і медицини. 2013. № 1. С. 68-73.
11. Sturm A., Maaser C., Calabrese E. et al. ECCO-ESGAR Guideline for diagnostic assessment in IBD. Part 2: IBD scores and general principles and technical aspects. Journal of Crohn's and Colitis. 2019. Vol. 13. Issue 3. P. 273-284.
12. Travis S.P., Schnell D., Krzeski P. et al. Developing an instrument to assess the endoscopic severity of ulcerative colitis: the Ulcerative Colitis Endoscopic Index of Severity (UCEIS). Gut. 2012. N 61(4). P. 535-542.
13. Mosli M.H., Zou G., Garg S.K. et al. C-reactive protein, fecal calprotectin, and stool lactoferrin for detection of endoscopic activity in symptomatic infl ammatory bowel disease patients: a systematic review and meta-analysis. Am. J. Gastroenterol. 2015. N 110(6). P. 802-19.
14. Никитин А.В., Матюхин А.А., Мордасова В.И., Латышева М.Н. Значение кальпротектина для оценки активности воспаления при язвенном колите. Клиническая медицина. 2016. № 94(7). С. 540-543.
15. Walsh A.J., Ghosh A., Brain A.O. et al. Travis; Comparing disease activity indices in ulcerative colitis, Journal of Crohn’s and Colitis. 2014. Vol. 8. Issue 4. P. 318-325.
16. Rachmilewitz D. Coated mesalazine (5-aminosalicylic acid) versus sulphasalazine in the treatment of active ulcerative colitis: a randomised trial. BMJ. 1989. N 298. P. 82-86.
17. Schroeder K.W., Tremaine W.J., Ilstrup D.M. Coated oral 5-aminosalicylic acid therapy for mildly to moderately active ulcerative colitis. A randomized study. N. Engl. J. Med. 1987. Vol. 317. P. 1625-1629.

/50.jpg)
/51_2.jpg)
/51.jpg)
/52.jpg)
/52_2.jpg)