Периферична полінейропатія належить до захворювань периферичної нервової системи, що можуть чинити досить суттєвий вплив на якість життя пацієнтів. Вона виникає як складова поширених або рідкісних захворювань, може бути ідіопатичною і мати різні клінічні прояви [1]. Поширеність периферичних нейропатій у загальній популяції варіює і становить 8,1 % у віці 40–49 років, дещо збільшуючись у пацієнтів, старших від 55 років [2, 3].
Полінейропатія характеризується множинним ураженням периферичних нервів, як правило, одночасним, іноді послідовним (з більш або менш швидким поширенням від одного нерва до іншого). До клінічних особливостей полінеропатії належить симетричність ураження й переважно повільно прогресуючий перебіг [4]. Перші ознаки ураження периферичних нервів спостерігаються майже завжди на нижніх кінцівках і поширюються на верхні кінцівки. При полінейропатії в патологічний процес може залучатися також автономна нервова система. Існує безліч причин для виникнення гострої або хронічної полінейропатії, саме тому пошук первинної причини є основним для успішного лікування полінейропатії. Існують різні підходи до класифікації полінейропатії: за причиною виникнення, клінічними проявами (сенсорна, мотор-на тощо) або патоморфологічними характеристиками (аксонопатії, мієлінопатії, нейронопатії). Полінейропатія з переважним ураженням аксона називається дистальною аксонопатією, вона виникає при метаболічних або токсичних розладах, таких як цукровий діабет, захворювання сполучної тканини, дефіцитні стани, алкоголізм, хіміотерапія тощо. Полінейропатія з переважним ураженням мієлінової оболонки називається мієлінопатією і характеризується порушенням проведення потенціалу дії по аксонах. Серед захворювань, що призводять до виникнення мієлінопатії, найпоширенішим є гостра запальна демієлінізуюча полінейропатія. Ураження нейронів периферичної нервової системи призводить до розвитку нейронопатій, що виникають при хворобі мотонейрона, сенсорних нейропатіях, дії токсинів, хіміотерапевтичних препаратів [5, 6].
Перед лікарями первинної ланки (сімейними лікарями) при лікуванні пацієнтів із периферичною полінейропатією, як правило, постають 3 основні проблеми: 1) ефективно провести скринінг на наявність ознак периферичної полінейропатії в безсимптомних пацієнтів, які мають розлади, що часто супроводжуються виникненням периферичної полінейропатії; 2) правильно визначити необхідність консультації вузьких спеціалістів у пацієнтів із симптомами полінейропатії і призначити таким пацієнтам необхідні додаткові методи обстеження; 3) усунути прояви нейропатичного болю для полегшення стану пацієнтів. Відомо, що виявлення симптомів периферичної полінейропатії в пацієнтів із розладами, частим проявом яких є остання, позитивно позначається на лікуванні цих станів. Зокрема, пацієнтам із цукровим діабетом показаний щорічний скринінг на наявність ознак периферичної полінейропатії [3, 7]. Для проведення ефективного скринінгу на наявність ознак периферичної полінейропатії лікарі повинні перевіряти тактильну, больову чутливість, вібраційну чутливість із використанням камертона із частотою 128 Гц, ахіллові рефлекси [8–10].
Периферична полінейропатія характеризується наявністю таких клінічних проявів: появою перших ознак у дистальних відділах нижніх кінцівок; парестезією в пальцях і підошвах ступень, переважно вночі; поколюванням; приглушеним відчуттям на підошві («ніби шкарпетки на ступні»); втратою ахіллових рефлексів; зниженням або втратою вібраційної чутливості, що виникає спочатку в дистальних відділах кінцівок. При прогресуванні захворювання спостерігається парез коротких розгиначів пальців стопи (пацієнт уже не може розігнути пальці ніг — не може стояти на пальцях ), а згодом і парез довгих розгиначів пальців ступень і розгиначів ступень. Це призводить до двостороннього звисання стопи й зміни ходи на «півнячу». Згодом чутливі й рухові порушення поширюються на верхні кінцівки [4, 9–11]. У пацієнтів також можуть спостерігатися вегетативні розлади (імпотенція, ортостатична гіпотензія, порушення потовиділення тощо), невропатичний біль, що має пекучий, колючий характер, супроводжується відчуттям проходження електричного струму по кінцівках [4]. При підозрі на наявність полінейропатії (з анамнезу пацієнта або на основі скринінгу — обстеження пацієнтів із ризиком) при проведенні детального клінічного обстеження (включно з визначенням м’язової сили, рефлексів, ходи) необхідно класифікувати полінейропатію за клінічними характеристиками (тривалістю, переважанням рухових, чутливих, вегетативних проявів або їх поєднання). За наявності в пацієнтів рухових і чутливих дифузних порушень, втягненні в патологічний процес одночасно верхніх і нижніх кінцівок можлива полірадикулонейропатія. Полірадикулонейропатії і мультифокальні полінейропатії досить часто спостерігаються при саркоїдозі, амілоїдозі, неопластичних, паранеопластичних процесах, васкулітах, інфекціях, запальних імуноопосередкованих станах (хронічна запальна демієлінізуюча полірадикулонейропатія) [3, 4]. Пацієнти обов’язково терміново потребують консультації вузького спеціаліста (невролога) за наявності в них: гострого або підгострого початку полінейропатії, швидко прогресуючого перебігу, тяжких випадків з випадінням функції; полірадикулонейропатій, вираженість симптомів яких не залежить від тривалості процесу; мультифокальних полінейропатій із переважанням рухових розладів; полінейропатії з тяжкими вегетативними розладами [3].
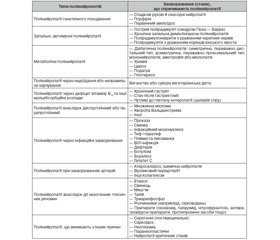
У табл. 1 наведений перелік типів полінейропатій і захворювань, при яких вони зустрічаються (запозичено з [4]).
Перелік лабораторних досліджень, що мають проводитися при обстеженні пацієнтів з полінейропатією, наведений у табл. 2 (запозичено з [4]).
/74.jpg)
Пацієнти з хронічними периферичними полінейропатіями потребують обов’язкового призначення таких додаткових обстежень: розгорнутого загального аналізу крові, біохімічного аналізу крові з акцентом на визначення вмісту кретиніну, сечовини, печінкових проб, глюкози крові, глікованого гемоглобіну, тиреотропного гормону, моноклональних протеїнів (електрофорез з імунофіксацією сироваткового білка), вмісту вітаміну В12 (і метилмалонової кислоти), тесту на ВІЛ, хворобу Лайма; генетичного обстеження (за наявності в пацієнта деформації ступень: pes cavus, молоткоподібного пальця) [3, 4, 10]. У пацієнтів, які мають неврологічні ознаки або симптоми, що свідчать про периферичну нейропатію, електроміографія і дослідження провідності по нерву (електронейроміографія) є корисними для підтвердження діагнозу, особливо для виключення станів з подібною клінічною симптоматикою (S1-радикулопатії в пацієнта із симптомами ураження ступень або синдрому зап’ястного каналу в пацієнта з парестезіями на кистях), допомагають локалізувати, верифікувати порушені модальності (сенсорні, рухові), визначити, чи є невропатія вторинною — у результаті аксонального ураження або демієлінізації, і встановити тяжкість невропатії [3, 10].
Низка діагностичних тестів може бути корисною для діагностики периферичної полінейропатії дрібних волокон: оцінка вегетативних рефлексів, функції потовиділення, проведення епідермальної біопсії для визначення щільності нервових волокон. Полінейропатії дрібних волокон виникають при ураженні немієлінізованих і тонких мієлінізованих волокон, клінічно проявляються пекучими відчуттями в ногах, переважно в дистальних відділах, больовою і пекучою дизестезією, зниженням больової і температурної чутливості, у той час як тактильна, вібраційна й пропріоцептивна чутливість не порушені. У подальшому виникають ознаки вегетативної дисфункції. Саме тому проведення дослідження потовидільної функції, оцінки мінливості серцевого ритму при диханні, проб Вальсальви, ортостатичної проби може бути корисним для об’єктивізації полінейропатії дрібних нервових волокон. Ці вегетативні тести найбільш корисні за наявності нейропатії з вираженими вегетативними порушеннями. При оцінці нейропатії дрібних волокон без ознак клінічної дизавтономії може бути корисним тест оцінки потовидільної функції. Однак слід пам’ятати, що на результати досліджень функції вегетативної нервової системи можуть впливати ліки, що негативно позначається на їх специфічності. У пацієнтів із нейропатіями дрібних волокон дослідження температурної чутливості також є доречним [3, 4]. Рутинні електрофізіологічні дослідження зазвичай не виявляють відхилень від норми. Основною діагностичною процедурою (золотим стандартом) є біопсія шкіри, що виявляє знижену щільність нервових волокон [4]. Біопсія шкіри — це затверджена методика визначення щільності внутрішньоепідермальних нервових волокон (соматичні немієлінізовані нервові терміналі С-волокон), що має високу доступність. Тест має чутливість 90 % при діагностиці нейропатії дрібних волокон зі специфічністю від 95 до 97 % [12]. Нейропатія дрібних волокон часто є проявом спадкової або набутої полінейропатії, зокрема діабетичної або алкогольної [3, 4].
Біопсія нерва також є корисним методом діагностики, особливо для пацієнтів із запальними полінейропатіями (при васкулітах, саркоїдозі, хронічній запальній демієлінізуючій полінейропатії), деякими інфекційними полінейропатіями (проказа), інфільтративними полінейропатіями (карцинома, лімфома, амілоїдоз) [3, 4, 10].
Диференціальна діагностика полінейропатій повин-на проводитись на основі знання клінічних особливостей різних видів нейропатій. Зокрема, наявність у пацієнта чітко виражених пропріоцептивних розладів, що виникли від початку захворювання (атактична хода, статична атаксія, що посилюється при усуненні зорового контролю), вимагає виключення низки захворювань, які супроводжуються ураженням задніх канатиків спинного мозку (дефіцит вітаміну В12, або сенсорна гангліопатія при синдромі Шегрена, або паранеопластичні розлади) [3]. Незважаючи на значну поширеність діабетичної полінейропатії (до 50 % пацієнтів з діабетом можуть мати підтверджений клінічно або нейрофізіологічно діагноз полінейропатії [13]), багато пацієнтів є асимптомними [14], в 11–26 % прояви полінейропатії обмежуються вираженим невропатичним болем [15]. У патогенезі діабетичної полінейропатії відіграють роль такі основні патологічні процеси, як запалення, оксидативний стрес і мітохондріальна дисфункція [16]. Полінейропатія виникає внаслідок діабетичної ангіопатії і прямої токсичної дії гіперглікемії. Патоморфологічно спостерігається аксональна дегенерація із сегментарною демієлінізацією. У клінічній картині на початку переважають сенсорні розлади, включно з парестезією, пекучою дизестезією на ступнях, що посилюються в теплі, особливо вночі під ковдрою. Зазвичай у пацієнтів відсутні ахіллові рефлекси, порушена тактильна й вібраційна чутливість у дистальних відділах кінцівок. Із часом у половини пацієнтів виникають рухові розлади. Неврологічний дефіцит може бути асиметричним, можуть спостерігатися мононейропатії з переважним ураженням черепних нервів (III, IV, VI пар) або стегнового нерва. Типовими для діабетичної полінейропатії є вегетативні порушення: сухість, почервоніння шкіри, дисфункція сечового міхура, ортостатична гіпотензія, тахікардія, діарея, еректильна дисфункція в молодих чоловіків із цукровим діабетом [3].
Американська асоціація діабету рекомендує 5 простих обстежень для визначення клінічних ознак полінейропатії: визначення ахіллових рефлексів, больової, температурної, вібраційної чутливості й відчуття тиску [14]. Нейрофізіологічні дослідження є найбільш точним методом діагностики, що поряд із клінічними ознаками підвищує точність діагностики [13]. Хоча діабет є вірогідною причиною полінейропатії в пацієнтів із периферичною нейропатією, які страждають від цукрового діабету, іноді необхідно провести додаткове лабораторне обстеження (зокрема, електрофорез з імунофіксацією білка в сироватці крові, визначення вмісту вітаміну В12 з метилмалоновою кислотою, аналіз крові на гормони щитоподібної залози) для виключення інших метаболічних порушень, що потребують лікування [3]. Зокрема, у літературі містяться докази того, що тривале використання метформіну пов’язане з низьким рівнем вітаміну В12 у крові пацієнтів із цукровим діабетом [17–19]. Відповідно до сучасних настанов Американської асоціації діабету (ADA) рекомендуються періодичні вимірювання вмісту вітаміну В12 пацієнтам, які лікуються метформіном, особливо за наявності в них периферичної полінейропатії [20].
Целіакія може бути причиною периферичної полінейропатії у 2,5 % пацієнтів. Зазвичай у таких пацієнтів спостерігаються переважно сенсорна полінейропатія і шлунково-кишкові розлади, при цьому неврологічні прояви можуть передувати шлунково-кишковим симптомам [21]. Антитканинні трансглутаміназні антитіла є найбільш чутливим серологічним скринінговим тестом, однак потрібна також біопсія тонкої кишки, щоб пов’язати нейропатію з целіакією [21, 22]. Дефіцит міді може клінічно імітувати дефіцит вітаміну B12 (з мієлопатією і переважно сенсорною нейропатією), і його особливо необхідно виключати за наявності в пацієнта в анамнезі баріатричного хірургічного втручання, при підозрі на значні обмеження харчування або високий вміст цинку (харчові добавки або деякі зубні пасти) [23, 24].
До 10 % периферичних невропатій пов’язані з диспротеїнемією, причому більшість є моноклональними гаммапатіями невизначеного значення (monoclonal gammopathy of undetermined significance — MGUS). IgM — найбільш поширений моноклональний протеїн, пов’язаний із полінейропатією, для виявлення якого рекомендовано застосовувати електрофорез з імунофіксацією сироваткового білка [12]. Виявлення моноклонального білка потребує подальшого дослідження й гематологічного обстеження для виключення таких захворювань, як амілоїдоз, множинна мієлома, остеосклеротична мієлома (POEMS-синдром: полінейропатія, органомегалія, ендокринопатія, моноклональний білок, шкірні аномалії), лімфома, макроглобулінемія Вальденстрема, кріоглобулінемія. Більшість парапротеїнемій IgM пов’язані з MGUS; проте деякі асоціюються з чітко вираженою демієлінізацією (відрізняючись від MGUS-асоційованої аксональної нейропатії) з вираженим симетричним дистальним дефіцитом, переважно сенсорним (дистальна набута демієлінізуюча симетрична нейропатія) [25]. Дві третини пацієнтів з дистальною набутою демієлінізуючою симетричною нейропатією мають антимієлінові глікопротеїнові антитіла в сироватці крові), а тому можуть відповідати на імуномодулюючу терапію [26].
Важко переоцінити роль вітаміну В12 для нервової системи, зокрема, останній є невід’ємним елементом для утворення й підтримання сталого вмісту мієліну [27]. Дефіцит вітаміну В12 може призводити як до розвитку підгострої поєднаної дегенерації спинного мозку, так і до ізольованої периферичної полінейропатії без залучення центральної нервової системи [28]. У пацієнтів із тривало існуючою полінейропатією слід обов’язково контролювати рівень вітаміну В12 у сироватці крові. Серед пацієнтів із полінейропатією, у яких вміст вітаміну В12 знаходиться на нижній межі норми, у 5–10 % спостерігається підвищення рівня метилмалонової кислоти, що вказує на внутрішньоклітинний дефіцит вітаміну В12 [12]. Саме тому додаткове визначення вмісту метилмалонової кислоти з гомоцистеїном допомагає встановити наявність внутрішньоклітинного дефіциту В12 як причину полінейропатії у хворих [29].
Не слід забувати, що значна частина полінейропатій може виникати в результаті токсичної дії призначених медикаментозних препаратів. У такому разі підказкою для лікаря може стати тісний зв’язок початку симптомів і наростання їх вираженості з часом призначення й корегуванням дози. При цьому спостерігається наростання вираженості клінічних проявів при високих дозах препаратів, поява симптомів на руках і ногах одночасно, стабілізація процесу або зникнення симптомів при припиненні застосування ліків [30]. Незважаючи на те, що більшість токсичних полінейропатій стабілізуються незабаром після припинення дії токсичного агента, деякі ліки (зокрема, хіміотерапевтичні засоби на основі платини) можуть залишаються активними протягом декількох тижнів або місяців після припинення, саме тому стабілізації або покращання симптомів полінейропатії може бути відразу не помітно [31].
Надмірне тривале вживання алкоголю може спричинити периферичну полінейропатію як у контексті інших системних ускладнень, включно з харчовими дефіцитними станами, зокрема дефіцитом тіаміну, так і безпосередньо через прямий нейротоксичний ефект [30]. Основним клінічним проявом є виражений біль у ногах, судоми в м’язах нижніх кінцівок, відсутність ахіллових рефлексів. Спостерігаються також порушення пропріоцептивної чутливості, зниження тактильної і вібраційної чутливості, парези розгиначів ступень. При біопсії шкіри виявляються ознаки аксональної дегенерації [4].
Спадкові невропатії належать до найбільш поширених успадкованих нервово-м’язових захворювань у всьому світі і, ймовірно, являють собою найчастіше ігнорований етіологічний чинник периферичної нейропатії [32]. Спадкова рухова й сенсорна нейропатія Шарко — Марі — Тута є найбільш поширеною формою спадкової нейропатії, виділяють аксональні й демієлінізуючі її форми. Ці нейропатії найчастіше є автосомно-домінантними і зчепленими з Х-хромосомою [33]. Клінічно спадкова нейропатія характеризується підступним початком симптомів із повільно прогресуючим перебігом протягом багатьох років, переважанням моторного дефіциту в дистальних відділах кінцівок, відсутністю сенсорних симптомів (дизестезії, печіння), супутніми структурними деформаціями ступень і щиколоток (pes cavus, hammer toes), нижні кінцівки нагадують перевернуті пляшки шампанського (з дуже тонкими щиколотками), також є сімейний анамнез нейропатії. Досить часто члени родини пацієнтів не обізнані про наявність сімейного анамнезу [3, 4].
Одним з найбільш обмежуючих і неприємних симптомів при периферичній полінейропатії є невропатичний біль, що характеризується печінням, відчуттям поколювання голками, проходження електричного струму і має стріляючий характер [34]. Високоспецифічними проявами нейропатичного болю є також алодинія (біль, що виникає при небольовому стимулі, легкому дотику одягу тощо) і гіпералгезія (надмірна болісна відповідь на звичайний больовий подразник, такий як поколювання). Отже, на сьогодні виникає необхідність коротко розглянути визначення різних типів болю [34].
Є різні класифікації болю, що базуються на визначенні інтенсивності, тривалості й механізмів, що лежать у його основі [35]. Враховуючи патологічні механізми, що лежать в основі болю, можна виділити дві основні його категорії: ноцицептивний і нейропатичний. Нейропатичний біль визначається як біль, що виникає як прямий наслідок ураження або захворювання, яке вражає соматосенсорну систему, і може класифікуватися за походженням (центральний або периферичний) або етіологією, клінічними симптомами й механізмами [36]. Нейропатичний біль виникає при пошкодженні або органічному ураженні периферичних або центральних ланок соматосенсорної нервової системи: при травмі нерва, діабетичній полінейропатії, запальній демієлінізуючій полінейропатії, постгерпетичній невралгії, травмі спинного мозку, наслідках інсульту, розсіяному склерозі тощо. Отже, нейропатичний біль, на відміну від ноцицептивного й запального, не є сигналом про пошкодження тканин і не має захисної функції, його причина — виникнення патологічних змін у самій нервовій системі на різних рівнях [37, 38]. Безліч нейромедіаторів та інших біологічно активних речовин беруть участь у розвитку й підтриманні нейропатичного болю, а також відіграють роль у формуванні інших нейробіологічних розладів, що частково може пояснити високий рівень коморбідності хронічного болю, розладів сну, депресії. Саме тому препарати, ефективні для одного з цих станів, можуть бути ефективними в терапії інших вищеперерахованих патологічних станів. Нейропатичний біль можна відрізнити від іншого болю за двома ознаками. По-перше, при нейропатичному болі не відбувається трансдукції (перетворення ноцицептивного подразника в електричний імпульс). По-друге, прогноз при невропатичному болі гірший: відбувається хронізація болю [39]. При цьому нейропатичний біль негативно впливає на якість життя пацієнтів, дає інвалідизуючий ефект і є досить затратним [37]. Крім того, нейропатичний біль більш рефрактерний, ніж ненейропатичний, до звичайних анальгетиків, таких як нестероїдні протизапальні препарати й опіоїди [39].
На відміну від нейропатичного болю ноцицептивний біль має захисну функцію, виникає внаслідок активації ноцицепторів у відповідь на фактичне або потенційне пошкодження, що локалізується не в нервовій тканині. Подразники, що викликають ноцицептивний біль, можуть бути зовнішніми або внутрішніми й зазвичай класифікуються як термічні, механічні та хімічні. Ноцицептивний біль може бути додатково розподілений на соматичний (проявляється в опорно-руховому апараті або шкірі) і вісцеральний (при ураженні порожнистих органів і гладких м’язів) [40]. Важливо також розрізняти ноцицепцію і біль. Сприйняття болю відбувається в корі головного мозку, куди потрапляє інформація внаслідок дії різних подразників, що активують ноцицептори в периферичних структурах, звідки інформація потрапляє в задні роги, по висхідних провідних шляхах передається до стовбура мозку та в кінцевому результаті — до кори головного мозку. У більшості випадків ноцицептивний біль є адаптивною захисною реакцією, що сприяє виживанню. При пошкодженні тканини виникає запальна реакція, одним із наслідків якої є запальний біль. Макрофаги, тучні клітини й нейтрофіли виділяють численні медіатори запалення. Останні впливають на ноцицептори й підвищують їх чутливість. На цьому фоні навіть незначне механічне, температурне або хімічне подразнення сприймається як больовий сигнал. Мета запального болю — не допустити додаткової травматизації тканин і таким чином забезпечити оптимальні умови для їх загоєння. Однак у випадках патологічного запалення (наприклад, при ревматоїдному артриті) адаптивне значення болю втрачається [38]. Останнім часом виникло поняття змішаного болю, що включає хронічні больові стани, у тому числі біль у нижній частині спини, біль при раку, остеоартриті, має характеристики як ноцицептивного, так і нейропатичного болю. Змішаний біль є своєрідним викликом для лікарів і вимагає ретельної оцінки пацієнта й мультимодальних, індивідуалізованих підходів до лікування [35].
Етіологія має вирішальне значення в призначенні лікування й визначенні прогнозу в пацієнтів з болем. Лікування болю має бути спрямоване на основну причину. Симптоматична терапія застосовується для лікування нейропатичного болю. Накопичений великий практичний досвід застосування простих анальгетиків, нестероїдних протизапальних засобів, м’язових релаксантів, пластин із лідокаїном, антидепресантів, антиконвульсантів, опіоїдів. Однак ефективність цих методів у терапії нейропатичного болю в більшості випадків не є очевидною з точки зору доказової медицини. Нестероїдні протизапальні препарати високоефективні в лікуванні ноцицептивного болю. Однак при терапії нейропатичного болю ці препарати виявилися неефективними, тому не рекомендуються для лікування й не включені в міжнародні рекомендації з лікування ней-ропатичного болю. Тільки при змішаному типі болю (тунельні синдроми, радикулопатії, онкологічний біль), коли присутні як нейропатичний, так і ноцицептивний компоненти, вони можуть бути використані для цілеспрямованого впливу на ноцицептивний компонент, найчастіше запального характеру. Отже, нестероїдні протизапальні засоби можуть використовуватися головним чином для лікування неспецифічного больового синдрому, коли немає пошкодження нервового корінця, а також у складі комплексної терапії корінцевого больового синдрому в поєднанні з антиконвульсантами, місцевими анестетиками й антидепресантами. Препаратами першої лінії при лікуванні невропатичного болю є протисудомні засоби (габапентин або прегабалін), трициклічні антидепресанти (вторинні аміни, такі як нортриптилін і дезипрамін, мають нижчий профіль побічних ефектів, ніж третинні аміни, такі як амітриптилін) або селективні інгібітори зворотного захвату серотоніну й норадреналіну (дулоксетин) [3, 4, 41, 42]. Вибір лікарських препаратів першого ряду має відбуватись з урахуванням супутніх захворювань пацієнтів. Зокрема, при коморбідній депресії пацієнти можуть відчути покращання при використанні дулоксетину, який можна використовувати в аналогічних дозах для лікування як депресії, так і невропатичного болю. Тоді як ефективна доза трициклічних антидепресантів для нейропатичного болю зазвичай недостатня для терапевтичного втручання при депресії або тривозі. Трициклічні антидепресанти, дулоксетин або прегабалін можуть бути ефективними засобами першої лінії в пацієнтів із супутньою фіброміалгією, тоді як пацієнти із супутньою хронічною мігренню можуть отримати покращення від призначення габапентину або трициклічного антидепресанта. Супутні захворювання можуть виявитися протипоказанням для призначення певних препаратів. Наприклад, слід уникати трициклічних антидепресантів або застосовувати їх з обережністю пацієнтам за наявності ортостатичної гіпотензії, серцевої аритмії, затримки сечовипускання. Якщо пацієнт має лише часткову відповідь на препарат першої лінії, слід додати інший препарат першого ряду з іншим чітким механізмом дії [3]. Комбінована терапія нейропатичного болю з використанням ліків із різними механізмами дії неодноразово виявлялися ефективнішою, ніж монотерапія [43].
У літературі наведені дані щодо аналгетичного ефекту вітамінів групи В у лікуванні периферичної полінейропатії [1, 35, 44]. Зокрема, в оглядовому дослідженні F.M. Gazoni та співавт. [44] на основі проведеного аналізу даних Pubmed, Medline, LILACS, Cochrane Library and Scielo виявлено виражений аналгетичний ефект вітамінів групи В при полінейропатіях, болі в нижній частині спини, остеоартриті, постгерпетичній невралгії як у комплексній терапії, так і в монотерапії. У разі застосування вітамінів групи В у лікуванні пацієнтів із гострим або хронічним болем останні сприяли вірогідному скороченню часу застосування знеболюючих і протизапальних ліків, опіоїдів, тим самим сприяючи зменшенню частоти їх побічних ефектів [45]. Останнім часом зростає кількість доказів важливої ролі вітамінів групи В для периферичної нервової системи, зокрема, останні сприяють прискоренню регенерації нервів і відновленню їх функцій при полінейропатії [46, 47]. Вітаміни групи В відіграють роль у ноцицепції, завдяки чому можуть зменшувати прояви болю й гіпералгезії. Зокрема, знеболюючий ефект вітаміну В1 пов’язаний із блокуванням метаболічного ушкодження нервів, також останній відіграє роль модуляції нейронального збудження [48]. Тіамін може зменшувати прояви болю через такі механізми, як трансактивація кетолази (забезпечуючи перехід глюкози на пентозофосфатний шунт), протеїнкіназа B опосередковано потенціює ангіогенез й гальмує апоптоз [49], а також протидіє церебральному окислювальному стресу [50]. Роль вітаміну В6 у полегшенні проявів гіпералгезії полягає в пресинаптичному інгібуванні вивільнення нейротрансмітерів з аферентних ноцицептивних волокон, що несуть імпульси збудження до ІІ і ІІІ нейронів больової чутливості, і пригніченні гіперзбудливості нейронів. Крім того, призначення вітаміну В6 приводить до збільшення в мозку рівня гальмівного нейротрансмітера 5-гідрокситриптаміну, за рахунок чого посилюються гальмівні процеси в центральній передачі болю. Запропоновані механізми дії вітаміну В12 щодо полегшення болю включають сприяння регенерації нервів і/або ремієлінізації [51]. Оскільки вітамін В12 може ставати донором метилу в метаболізмі ДНК, його високі концентрації покращують транскрипцію генів, збільшуючи синтез білка для регенерації нервів. Також вітамін В12 бере участь у вибірковій блокаді сенсорної нервової провідності по нерву, за рахунок чого чинить знеболюючу дію [52].
Отже, з огляду на важливість кожного з вітамінів групи В для відновлення функцій периферичних нер-вів, на сьогодні основним завданням фармацевтичних технологій є створення стабільних полівітамінних препаратів, оскільки останні мають величезні переваги перед монокомпонентними вітамінними препаратами. Саме до таких препаратів належить Невралон в ампулах, що містить тіаміну гідрохлориду 50 мг, піридоксину гідрохлориду 50 мг, ціанокобаламіну 500 мкг, а також місцевий анестетик лідокаїну гідрохлорид. Відомо, що подібний комплексний препарат не може стабільно існувати в одній лікарській формі без стабілізаторів і регуляторів кислотності [53]. Лідокаїну гідрохлорид як анестетик у даному препараті вибраний не випадково, він не є окислювачем і не вступає у взаємодію з вітамінами в препараті, а також як стабілізатор використано калію гексаціаноферат (III), який є також стабілізатором ціанокобаламіну, що дозволяє зменшити кількість допоміжних речовин у розчині, що, у свою чергу, сприятливо відбивається на стабільності й іонному балансі лікарської форми. Як консервант у препараті використаний бензиловий спирт, що має низьку токсичність, протимікробну активність і здатний брати участь у створенні депо препарату при внутрішньом’язових ін’єкціях, має слабко виражені місцевоанестезуючі властивості, а в комбінації з лідокаїном здатний підсилювати його дію [53].
Отже, з огляду на все вищезазначене комплекс вітамінів групи В (В1, В6 і В12) відіграє фундаментальну роль в адекватному функціонуванні периферичної нервової системи. З урахуванням наростаючої кількості доказів у літературі останніх років щодо значного внеску вітамінів групи В у відновлення (регенерацію) структури та функції периферичних нервів вони можуть бути рекомендовані для призначення в комплексній терапії полінейропатій. З огляду на оптимальну комбінацію основних і допоміжних складових на особливу увагу заслуговує європейський препарат Невралон виробництва компанії World Medicine, що може бути рекомендований для активного застосування у складі комплексного лікування захворювань периферичної нервової системи.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Hakim M., Kurniani N., Pinzon R., Tugasworo D., Basuki M., Haddani H., Pambudi P., Fithrie A., Wuysang A. Management of peripheral neuropathy symptoms with a fixed dose combination of high-dose vitamin B1, B6 and B12: A 12-week prospective non-interventional study in Indonesia. Asian Journal of Medical Sciences. 2018. 9(1). 32-40. URL: https://doi.org/10.3126/ajms.v9i1.18510.
2. Head K.A. Peripheral neuropathy: pathogenic mechanisms and alternative therapies. Altern. Med. Rev. 2006. 11(4). P. 294-329.
3. Watson J.C., Dyck P.J.B. Peripheral Neuropathy: A Practical Approach to Diagnosis and Symptom Management. Mayo Clin. Proc. 2015. 90(7). P. 940-951 URL: http://dx.doi.org/10.1016/j.mayocp.2015.05.004.
4. Mattle H., Mumenthaler M. Fundamentals of Neurology: An Illustrated Guide. 2nd ed. Berlin: Thieme, 2017. 456 pp. 567 ill.
5. Barohn R.J., Amato A.A. Pattern-recognition approach to neuropathy and neuronopathy. Neurol. Clin. 2013. 31. P. 343-61.
6. Yu H.-J., Koh S.-H. Overview of symptoms, pathogenesis, diagnosis, treatment, and prognosis of various acquired polyneuropathies. Hanyang. Med. Rev. 2017. 37. P. 34-39. URL: https://doi.org/10.7599/hmr.2017.37.1.34. pISSN 1738-429X eISSN 2234-4446.
7. American Diabetes Association. Standards of medical care in diabetes 2014. Diabetes Care. 2014. 37 (suppl. 1). S14-S80.
8. Perkins B.A., Olaleye D., Zinman B., Bril V. Simple screening tests for peripheral neuropathy in the diabetes clinic. Diabetes Care. 2001. 24(2). P. 250-256.
9. Azpiroz F., Malagelada C. Diabetic neuropathy in the gut: pathogenesis and diagnosis. Diabetologia. 2016. 59(3). P. 404-408.
10. Azhary H., Farooq M.U., Bhanushali M., Majid A., Kas-sab M.Y. Peripheral neuropathy: differential diagnosis and management. Am. Fam. Physician. 2010. 81(7). P. 887-92.
11. Miranda-Massari J.R., Gonzalez M.J., Jimenez F.J. et al. Metabolic correction in the management of diabetic peripheral neuropathy: improving clinical results beyond symptom control. Curr. Clin. Pharmacol. 2011. 6(4). P. 260-273.
12. England J.D., Gronseth G.S., Franklin G. et al. Practice Parameter: evaluation of distal symmetric polyneuropathy: role of laboratory and genetic testing (an evidence-based review); report of the American Academy of Neurology, American Association of Neuromuscular and Electrodiagnostic Medicine, and American Academy of Physical Medicine and Rehabilitation. Neurology. 2009. 72(2). P. 185-192
13. Tesfaye S., Boulton A.J., Dyck P.J. et al. Diabetic neuropathies:update on definitions, diagnostic criteria, estimation of severity, and treatments. Diabetes Care. 2010. 33(10). P. 2285-2293.
14. Boulton A.J., Vinik A.I., Arezzo J.C. et al. Diabetic neuropathies: a statement by the American Diabetes Association. Diabetes Care. 2005. 28(4). P. 956-962. doi:10.2337/diacare.28.4.956
15. Van Acker K., Bouhassira D., De Bacquer D. et al. Prevalence and impact on quality of life of peripheral neuropathy with or without neuropathic pain in type 1 and type 2 diabetic patients attending hospital outpatients clinics. Diabetes Metab. 2009. 35(3). P.206-213.
16. Román-Pintos L.M., Villegas-Rivera G., Rodríguez-Carrizalez A.D., Miranda-Díaz A.G., Cardona-Muñoz E.G. Diabetic Polyneuropathy in Type 2 Diabetes Mellitus: Inflammation, Oxidative Stress, and Mitochondrial Function. J. Diabetes Res. 2016. 2016. 3425617. Published online 2016 Dec 12. doi: 10.1155/2016/3425617.
17. de Jager J., Kooy A., Lehert P. et al. Long term treatment with metformin in patients with type 2 diabetes and risk of vitamin B-12 deficiency: randomised placebo controlled trial. British Medical Journal. 2010. 340. c2181.
18. Nervo M., Lubini A., Raimundo F.V. et al. Vitamin B12 in metformin-treated diabetic patients: a cross-sectional studyin Brazil. Revista da Associação Médica Brasileira. 2011. 57(1). P. 46-49.
19. Ahmed M.A., Muntingh G.L., Rheeder P. Perspectives on Peripheral Neuropathy as a Consequence of Metformin-Induced Vitamin B12 Deficiency in T2DM. Int. J. Endocrinol. 2017. 2017. 2452853. doi: 10.1155/2017/2452853.
20. American Diabetes Association. Pharmacologic approaches to glycemic treatment. Diabetes Care. 2017. 40(1). S64-S74.
21. Chin R.L., Sander H.W., Brannagan T.H. et al. Celiac neuropathy. Neurology. 2003. 60(10). P. 1581-1585.
22. McKeon A., Lennon V.A., Pittock S.J., Kryzer T.J., Murray J. The neurologic significance of celiac disease biomarkers. Neurology. 2014. 83(20). P. 1789-1796.
23. Kumar N., Gross J.B. Jr, Ahlskog J.E. Copper deficiency myelopathy produces a clinical picture like subacute combined dege–neration. Neurology. 2004. 63(1). P. 33-39.
24. Thaisetthawatkul P., Collazo-Clavell M.L., Sarr M.G., Norell J.E., Dyck P.J. A controlled study of peripheral neuropathy after bariatric surgery. Neurology. 2004. 63(8). Р. 1462-1470.
25. Saperstein D.S., Katz J.S., Amato A.A., Barohn R.J. Clinical spectrum of chronic acquired demyelinating polyneuropathies. Muscle Nerve. 2001. 24(3). P. 311-324.
26. Mygland A., Monstad P. Chronic acquired demyelinating symmetric polyneuropathy classified by pattern of weakness. Arch. Neurol. 2003. 60(2). P. 260-264.
27. Stabler S.P. Vitamin B12 deficiency. N. Engl. J. Med. 2013. 368(2). P. 149-160.
28. Saperstein D.S., Wolfe G.I., Gronseth G.S. et al. Challenges in the identification of cobalamin-deficiency polyneuropathy. Arch. Neurol. 2003. 60(9). P. 1296-1301.
29. Smith A.G., Singleton J.R. The diagnostic yield of a standar-dized approach to idiopathic sensory-predominant neuropathy. Arch. Intern. Med. 2004. 164(9). P. 1021-1025.
30. Morrison B., Chaudhry V. Medication, toxic, and vitamin related neuropathies. Continuum (Minneap. Minn.). 2012. 18(1). P. 139-160.
31. Windebank A.J., Grisold W. Chemotherapy-induced neuropathy. J. Peripher. Nerv. Syst. 2008. 13(1). P. 27-46.
32. Braathen G.J., Sand J.C., Lobato A., Høyer H., Russell M.B. Geneticepidemiology of Charcot-Marie-Tooth in the general population. Eur. J. Neurol. 2011. 18(1). P. 39-48.
33. Saporta M.A. Charcot-Marie-Tooth disease and other inhe-rited neuropathies. Continuum (Minneap. Minn.). 2014. 20 (5, Peripheral Nervous System Disorders). P. 1208-1225.
34. Haanpää M., Attal N., Backonja M. et al. NeuPSIG guidelines on neuropathic pain assessment. Pain. 2011. 152(1). P. 14-27.
35. Geller M., Oliveira L., Nigri R. et al. B Vitamins for Neuropathy and Neuropathic Pain. Vitam. Miner. 2017. 6. 2. DOI: 10.4172/2376-1318.1000161.
36. van Hecke O., Austin S.K., Khan R.A. et al. Neuropathic pain in the general population: a systematic review of epidemiological studies. Pain. 2014. 155. P. 654-662. doi: 10.1016/j.pain.2013.11.013.
37. Baron R., Binder A., Wasner G. Neuropathic pain: diagnosis, pathophysiological mechanisms, and treatment. The Lancet Neuro-logy. 2010. 9. P. 807-819.
38. Данилов А.Б. Боль смешанного типа. Патофизиологические механизмы — значение для клинической практики. Подходы к диагностике и лечению смешанных типов болевых синдромов. РМЖ. 2014. С. 10-15.
39. Cohen S.P., Mao J. Neuropathic pain: mechanisms and their clinical implications. BMJ. 2014. 348. f7656. doi: 10.1136/bmj.f7656.
40. Basbaum A.I., Bautista D.M., Scherrer G., Julius D. Cellular and molecular mechanisms of pain. Cell. 2009. 139. P. 267-284.
41. Attal N., Cruccu G., Baron R. et al. EFNS guidelines on the pharmacological treatment of neuropathic pain: 2010 revision. Eur. J. Neurol. 2010. 17(9). P. 1113-e88.
42. Mervaala E., Auranen M., Partanen J.V. Настанова 00781. Полінейропатії. Настанови на засадах доказової медицини. Створені DUODECIM Medical Publications, Ltd. Адаптовані для України групою експертів МОЗ України. 2014.
43. Chaparro L.E., Wiffen P.J., Moore R.A., Gilron I. Combination pharmacotherapy for the treatment of neuropathic pain in adults. Cochrane Database Syst. Rev. 2012. 7. CD008943. doi: 10.1002/14651858.CD008943.pub2.
44. Gazoni M.F., Malezan W.R., Santos F.C. B complex vitamins for analgesic therapy. Rev. Dor. Sao Paulo. 2016. 17(1). P. 52-6 DOI 10.5935/1806-0013.20160013.
45. Maladkar M., Tekchandani C., Dave U. Post-marketing surveillance of fixed dose combination of methylcobalamin, alpha lipoic acid, folic acid, biotin, benfotiamine & vitamin В6-nutripathy for the management of peripheral neuropathy. J. Diabetes Mellitus. 2014. 4. P. 124-32.
46. Al-Saaeed S.M., Al-Khalisy M.H. The Regenerative Role of Vitamins B1, B6, B12 in Treatment of Peripheral Neuropathy Dr. International Journal of Science and Research. 2017. 6(3). Р. 2411-2415. DOI: 10.21275/ART20171627.
47. Altun I., Kurutas E.B. Vitamin B complex and vitamin B12 levels after peripheral nerve injury. Neural. Regen. Res. 2016. 11. P. 842-845.
48. Song X.S., Huang Z.J., Song X.J. Thiamine suppresses thermalhyperalgesia, inhibits hyperexcitability, and lessens alterations of sodium currents in injured, dorsal root ganglion neurons in rats. Anesthesiology. 2009. 110. P. 387-400.
49. Gadau S., Emanueli C., Van Linthout S. et al. Benfotiamine accelerates the healing of ischaemic diabetic limbs in mice through protein kinase B/Akt-mediated potentiation of angiogenesis and inhibition of apoptosis. Diabetologia. 2006. 49. P. 405-420.
50. Wu S., Ren J. Benfotiamine alleviates diabetes-induced cerebral oxidative damage independent of advanced glycation end-product, tissue factor and TNF-alpha. Neurosci Lett. 2006. 394. P. 158-162.
51. Mauro G.L., Martorana U., Cataldo P., Brancato G., Leti-zia G. Vitamin B12 in low back pain: a randomised, double-blind, placebo-controlled study. Eur. Rev. Med. Pharmacol. Sci. 2000. 4. P. 53-58.
52. Takeshige C., Ando Y., Ando M. Effects of vitamin B12 and aldosterone on the conduction of sensory and motor nerve impulse. Vitamins. 1971. 44. 272- 282.
53. Зайченко, А.В., Лыткин Д.В., Коваленко Е.Н. Фармацевтическое обоснование комбинации действующих и вспомогательных веществ в составе препарата Мильгамма® ампулы. Международный неврологический журнал. 2015. № 1(71). С. 138-141.

/73.jpg)
/74.jpg)