Международный неврологический журнал Том 16, №3, 2020
Вернуться к номеру
Роль ліпідно-фосфоліпідного стану в розвитку нейродеструкції внаслідок компресії корінців спинного мозку
Авторы: Багмут І.Ю.(1), Погорєлов В.В.(2), Жуков В.І.(3)
(1) — Харківська медична академія післядипломної освіти, м. Харків, Україна
(2) — Харківська клінічна лікарня на залізничному транспорті № 1, м. Харків, Україна
(3) — Харківський національний медичний університет, м. Харків, Україна
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
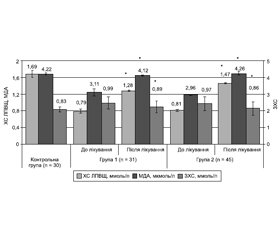
Актуальність. Дослідження присвячене вивченню патофізіологічних змін у нервовій тканині при ішемії корінців спинного мозку (КСМ) та пошуку маркерів нейродеструкції на ранніх етапах розвитку патологічного процесу з метою більш ефективного лікування. Мета дослідження — визначення структурних змін у ліпідному обміні при компресії корінців спинного мозку та їх взаємозв’язок із васкулярним фактором росту (VEGF-А) під впливом патогенетично скерованої терапії. Матеріали та методи. 76 хворих із хронічною компресією КСМ розподілені на 2 групи. Хворі 1-ї групи (31 пацієнт) одержували комплексну терапію з пентоксифіліном, тоді як 45 хворим 2-ї групи до цієї терапії включали мелатонін-С3. Вивчались показники серотоніну, активність VEGF-А, стан окислення ліпідів оцінювали за вмістом малонового діальдегіду (МДА). Також вивчались показники загального холестерину (ЗХС), холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ), сфінгомієліну та глутатіонпероксидази (ГП). Результати. У хворих до лікування відмічалось підвищення МДА, ІЛ-1β, ІЛ-6 та ФНП-α, що свідчить про перебіг імунного запалення в результаті вивільнення вільних радикалів, накопичення нейротоксичних речовин та підсилення оксидативного стресу. Також відмічались збільшення вмісту VEGF-А, зниження ЗХС, ХС ЛПВЩ, сфінгомієліну, ГП та серотоніну. Включення до комплексної терапії пентоксифіліну в комбінації з мелатоніном привело до зниження вмісту МДА, VEGF-А, прозапальних інтерлейкінів та підвищення ЗХС, ХС ЛПВЩ, сфінгомієліну, ГП і серотоніну. Таким чином, підвищення рівня ХС ЛПВЩ і сфінгомієліну після лікування сприяло упорядкуванню структури ліпідного бішару нейросудинних мембран, приводило до більш швидкого відновлення і репарації електропровідної функції КСМ та запобігало формуванню радікуломієлопатії. Висновки. При компресії КСМ відмічались зміни активності VEGF-А, нейрогормонів та загострення імунного запалення, що спричиняло пошкодження судинно-нейрональних клітин оболонок КСМ та спонукало накопиченню нейротоксичних продуктів, які зумовлюють інтраневральні пошкодження з формуванням радикуломієлопатії. Застосування пентоксифіліну з мелатоніном спонукало до нормалізації вищезазначених показників, приводило до більш швидкого відновлення структури та функції нервової тканини та запобігало формуванню радикуломієлопатії.
Актуальность. Исследование посвящено изучению патофизиологических изменений в нервной ткани при ишемии корешков спинного мозга (КСМ) и поиску маркеров нейродеструкции на ранних этапах развития патологического процесса с целью более эффективного лечения. Цель исследования — изучение структурных изменений в липидном обмене при компрессии КСМ и их взаимосвязь с васкулярным фактором роста (VEGF-А) под влиянием патогенетически направленной терапии. Материалы и методы. 76 больных с хронической компрессией корешков спинного мозга были разделены на 2 группы. Больные 1-й группы (31 пациент) получали комплексную терапию с пентоксифиллином, в то время как 45 пациентам 2-й группы в эту же терапию включали мелатонин-С3. Изучались показатели серотонина, активность VEGF-А, состояние окисления липидов оценивали по содержанию малонового диальдегида (МДА). Также изучались показатели общего холестерина (ОХС), холестерина липопротеинов высокой плотности (ХС ЛПВП), сфингомиелина и глутатионпероксидазы (ГП). Результаты. У больных до лечения отмечалось повышение МДА, ИЛ-1β, ИЛ-6 и ФНО-α, что свидетельствует о развитии иммунного воспаления в результате высвобождения свободных радикалов, накопления нейротоксических веществ и усиления оксидативного стресса. Также отмечались повышение содержания VEGF-А, снижение ОХС, ХС ЛПВП, сфингомиелина, ГП и серотонина. Включение в комплексную терапию пентоксифиллина в комбинации с мелатонином привело к снижению содержания МДА, VEGF-А, провоспалительных интерлейкинов и повышению ОХС, ХС ЛПВП, сфингомиелина, ГП, серотонина. Таким образом, повышение уровня ХС ЛПВП и сфингомиелина после лечения способствовало упорядочиванию структуры липидного бислоя нейрососудистых мембран, приводило к более быстрому восстановлению электропроводящей функции КСМ и предотвращало формирование радикуломиелопатии. Выводы. При компрессии КСМ отмечались изменения активности VEGF-А, нейрогормонов и обострение иммунного воспаления, что приводило к повреждению сосудисто-нейрональных мембран оболочек КСМ и способствовало накоплению нейротоксичных продуктов, которые обусловливают интраневральные повреждения с формированием радикуломиелопатии. Применение пентоксифиллина в комбинации с мелатонином способствовало нормализации вышеуказанных показателей, приводило к более быстрому восстановлению структуры и функции и предотвращало формирование радикуломиелопатии.
Background. The study deals with the pathophysiological changes in nervous tissue at spinal roots ischemia and the search for neurodegradation markers at the early stages of the pathological process for more effective treatment. The purpose of the study: to determine structural changes in lipid metabolism in spinal roots compression and their relationship to the vascular growth factor (VEGF-A) under the influence of pathogenetically oriented therapy. Materials and methods. Seventy-six patients with chronic spinal roots compression are divided into 2 groups. Patients in the first group (31 patients) received a complex therapy with pentoxifylline, whereas 45 patients in group 2 received melatonin C3 in addition to this therapy. Serotonin, VEGF-A indexes were studied, lipid oxidation status was evaluated by malonic dialdehyde content. Also, the rates of total cholesterol, high-density lipoprotein cholesterol, sphingomyelin, and glutathione peroxidase were assessed. Results. Before treatment, the patients were detected with an increase in malonic dialdehyde, IL-1β, IL-6 and TNF-α, which indicates the development of immune inflammation as a result of the release of free radicals and accumulation of neurotoxic substances and increased oxidative stress. There were also an increase of total cholesterol and VEGF-A, reduced high-density lipoprotein cholesterol, sphingomyelin, glutathione peroxidase and serotonin. The complex therapy added with pentoxifylline in combination with melatonin leads to the decrease in malonic dialdehyde, VEGF-A, proinflammatory interleukins and increase in total cholesterol, high-density lipoprotein cholesterol, sphingomyelin, glutathione peroxidase and serotonin. Thus, ele-vated levels of high-density lipoprotein cholesterol and sphingomyelin after treatment contributed to the ordering of the lipid bilayer of the neuron-vascular membranes and led to a more rapid recovery and reparation of the conductive function of spinal roots and prevented the development of radiculomyelopathy. Conclusions. Compression of spinal roots showed changes in the activity of VEGF-A, neurohormones, and exacerbation of immune inflammation, which caused damage to the vascular neuronal cells of the membranes of spinal roots and led to the accumulation of neurotoxic products that cause intraneural damage with development of radiculomyelopathy. The use of pentoxifylline in combination with melatonin led to normalization of the above indicators and resulted in faster restoration of the structure and function of the nervous tissue and prevented the formation of radiculomyelopathy.
компресійно-ішемічна радикуломієлопатія; VEGF-А; ліпідно-фосфоліпідний обмін; ней-рогормони; інтерлейкіни; пентоксифілін + мелатонін
компрессионно-ишемическая радикуломиелопатия; VEGF-А; липидно-фосфолипидный обмен; нейрогормоны; интерлейкины; пентоксифиллин + мелатонин
compression ischemic radiculomyelopathy; VEGF-A; lipid-phospholipid metabolism; neurohormones; interleukins; pentoxifylline + melatonin
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
1. Кольман Я., Рем К.-Г. Наглядная биохимия: монография. Под ред.: Решетова П.Д., Соркиной Т.И. Пер. с нем. Л.В. Козлова и др. 3-е изд. Москва: Мир; БИНОМ. Лаборатория знаний, 2009. 469 с.
2. Kikuchi R. et al. An antiangiogenic isoform of VEGF-A contributes to impaired vascularization in peripheral artery disease. Nat. Med. 2014. V. 20. № 12. P. 1464-1471. DOI: 10.1038/nm.3703.
3. Simons M., Gordon E., Claesson-Welsh L. Mechanisms and regulation of endothelial VEGF receptor signalling. Nat. Rev. Mol. Cell. Biol. 2016. V. 17. № 10. P. 611-625. DOI: 10.1038/nrm.2016.87.
4. Das A. et al. Cysteine Oxidation of Cu Importer CTR1 Promotes VEGF Signaling and Angiogenesis. Circulation. 2016. V. 134. № 1. A15199. URL: https://www.ahajournals.org/doi/abs/10.1161/circ.134.suppl_1.15199.
5. Andersen J.K. Oxidative stress in neurodegeneration: cause or consequence? Nat. Med. 2004. V. 10. P. 18-25. DOI: 10.1038/nrn1434.
6. Караулова Ю.В. Изучение гуморального звена серотонинергической системы при хронических болевых синдромах. Российский журнал боли. 2011. № 2. С. 10-11. URL: https://painrussia.ru/russian-Journal-of-Pain/31%2011.pdf.
7. Коршняк В.О. Роль мелатоніну в нейроендокринній регуляції нервової системи у хворих із наслідками закритих черепно-мозкових травм (огляд літератури). Міжнародний неврологічний журнал. 2016. № 4. С. 108-113. URL: http://nbuv.gov.ua/UJRN/Mnzh_2016_4_15.
8. Мальцев Г.Ю., Тышко Н.В. Методы определения содержания глутатиона и активности глутатионпероксидазы в эритроцитах. Гигиена и санитария. 2002. № 2. С. 69-72. URL: http://www.fesmu.ru/elib/Article.aspx?id=72460.
9. Погорєлов В.В., Жуков В.І. Динаміка продуктів перекисного окиснення ліпідів та антиоксидантного захисту в крові щурів в умовах експериментальної радикулоішемії та її патогенетична корекція. Вісник наукових досліджень. 2014. № 1. С. 106-108. URL: http://nbuv.gov.ua/UJRN/vndt_2014_1_36.
10. Wirtz K.W.A. Phospholipid transfer proteins. Ann. Rev. Biochem. 1991. V. 60. P. 73-99. URL: https://www.annualreviews.org/doi/pdf/10.1146/annurev.bi.60.070191.000445.

/39.jpg)
/40.jpg)