Останніми десятиріччями спостерігається невпинне старіння населення, особливо в країнах із високим рівнем доходів. Так, у США особи похилого віку (тобто люди віком понад 65 років) є найбільш швидко зростаючою категорією населення. Епідеміологічні дослідження показали, що захворюваність на епілепсію значно вища в осіб похилого віку, ніж у будь-якій іншій віковій групі.
Наприклад, у 1995 році в США приблизно 181 000 осіб захворіли на епілепсію, 68 000 із них були віком понад 65,4 року. Захворюваність на епілепсію висока в педіатричній когорті, знижується в молодих людей, але починає зростати після 55 років. Показники поширеності захворювання серед населення похилого віку в США становлять приблизно 1,5 %, що значно вище, ніж у молодих людей — приблизно 0,5 %. Високі показники епілепсії в літніх людей також були зареєстровані в інших розвинених країнах. У Фінляндії число літніх людей з епілепсією в даний час більше, ніж в педіатричній когорті, ця зміна сталася лише кілька десятиліть тому.
Визначено, що епілепсія — одне з найпоширеніших захворювань нервової системи в людей похилого віку, займає 3-тє місце після цереброваскулярних захворювань та деменцій.
Річна захворюваність на епілепсію становить 85 випадків на 100 000 для людей віком 65–69 років, 159 на 100 000 — віком понад 80 років, 80,8 на 100 000 осіб — у всіх вікових групах.
Недавнє епідеміологічне дослідження показує, що середньорічна захворюваність на епілепсію в літніх людей, віком 65 років і старше, становить до 240 на 100 000. Майже 25 % усіх нових випадків епілепсії відбувається в літніх людей. Було прогнозовано, що до 2020 року число випадків епілепсії в осіб похилого віку становитиме половину від усіх нових випадків цього захворювання.
Структура геріатричної епілепсії неоднорідна і включає:
— епілепсію з початком у більш ранньому віці (< 60–65 років), що триває до старості;
— епілепсію new onset у літніх людей (із маніфестом після 60–65 років).
Епілепсія, особливо епілепсія пізнього віку, суттєво впливає на якість життя людей похилого віку та збільшує навантаження на ресурси охорони здоров’я, суспільство.
Існує дуже багато проблем епілепсії похилого віку, починаючи вже з установлення діагнозу, призначення лікування й соціально-економічних аспектів.
Епілепсія була концептуально визначена у 2005 році як розлад головного мозку, що характеризується стійкою схильністю до виникнення епілептичних нападів. Із практичної точки зору це означає наявність двох неспровокованих нападів із проміжком часу > 24 год один від одного. Міжнародна протиепілептична ліга (ILAE) ухвалила рекомендації цільової групи щодо зміни практичного визначення при низці особливих обставин, які не відповідають критерію двох неспровокованих нападів. Цільова група запропонувала, щоб епілепсія вважалася хворобою головного мозку, яку визначатимуть за будь-якою з таких умов: 1) принаймні два неспровоковані (або рефлекторні) напади, що розвиваються з проміжком > 24 год один від одного; 2) один неспровокований (або рефлекторний) напад та ризик його подальшого повторення, подібний до загального ризику рецидиву (щонайменше 60 %) після двох неспровокованих нападів, протягом наступних 10 років; 3) діагностований синдром епілепсії.
Епідеміологічні дослідження показали, що люди з певними станами, такими як інсульт або пухлина мозку, мають високу ймовірність виникнення наступних нападів після початкової іктальної події, а лікування таких хворих після одного нападу, швидше за все, зменшить кількість осіб, які будуть мати наступний напад. Саме до такої категорії хворих і відносяться хворі похилого віку.
ILAE виділила 4 категорії епілепсії (генетична, структурна, метаболічна, невідома причина) відповідно до етіології захворювання. Ці конкретні причини співвідносяться з віковими групами; різні вікові групи, як правило, мають різні причини епілепсії.
Епілепсія, що вперше виникає в людей похилого віку (new onset), в основному є наслідком накопичених пошкоджень мозку та інших вторинних факторів. До найпоширеніших етіологічних факторів new onset епілепсії в літніх людей відносять цереброваскулярні захворювання, нейродегенеративні захворювання з когнітивним порушенням, внутрішньомозкові пухлини та черепно-мозкові травми. Зазвичай етіологічні чинники можна виявити в майже 50 % пацієнтів літнього віку.
Етіологія new onset епілепсії в осіб похилого віку (Shasha Liu, Weihua Yu, Yang Lü, 2016):
— цереброваскулярні захворювання — 30–50 %;
— первинні нейродегенеративні захворювання — ~10–20 %;
— черепно-мозкова травма — 10–20 %;
— пухлини мозку — 10–30 %;
— від 1/3 до 1/2 випадків епілепсії мають невідому причину.
Але треба зазначити, що гострий симптоматичний напад, що є вторинним наслідком метаболічних або токсичних порушень у літніх людей, не можна назвати епілепсією.
Цереброваскулярні захворювання
Інсульт та інші цереброваскулярні захворювання є найважливішими факторами ризику виникнення епілепсії в літньому віці — 30–50 % від усіх виявлених причин. Епілепсія може виникнути в момент після інсульту, а також може бути раннім клінічним проявом цереброваскулярного захворювання. Ризик розвитку епілепсії в перший рік після інсульту зростає в 20 разів (табл. 1). Ризик розвитку епілептичних нападів протягом 5 років після першого інсульту становить 11,5 % (за різними даними, від 4 до 43 %).
/70.jpg)
Складним діагностичним фактором є те, що транзиторні ішемічні атаки (ТІА) іноді призводять до фокальних нападів, картина яких подібна до симптоматики неврологічного дефіциту при TIA. Головною клінічною диференціальною ознакою між ТІА та фокальним нападом може бути тривалість події. Фокальні напади рідко тривають більше декількох хвилин, тоді як ТІА — набагато довше, як правило, години. Крім того, при ТІА неврологічна симптоматика дефіцитарна (парези, афазія тощо), а при епілептичних нападах переважно надлишкова.
Постінсультні напади
Постінсультні напади визначаються як поодинокі чи множинні напади через оборотне або необоротне ураження головного мозку (судин), незалежно від часу прояву після інсульту.
Класифікація нападів за часом виникнення після інсульту
1. Негайні напади (оnset seizures) — напади, що розвиваються протягом перших 24 годин захворювання (інсульту):
— розвиваються у 2–4,8 % пацієнтів;
— ризик смертності в 30-денний період збільшується у 2 рази (Szaflarski J. et al., 2008);
— становлять до 40 % усіх нападів після інсульту.
2. Ранні судоми — розвиваються протягом першого тижня після початку інсульту в 5–6,2 % пацієнтів.
3. Пізні судоми — проявляються через 1–2 тижні після розвитку інсульту в 5–7,4 % пацієнтів.
4. Постінсультна епілепсія розвивається у 2,5 % (3–4 %) пацієнтів, які перенесли інсульт.
Незалежно від часу виникнення нападів після інсульту більшість із них є вогнищевими (36 %) або вогнищевими з наступною генералізацією (28 %); половина з них — моторні. Генералізовані судоми класифікуються як такі за відсутності чіткої інформації про вогнища та при характерних порушеннях на ЕЕГ (в 1/3 пацієнтів). Епілептичний статус спостерігається в 1 % (до 9 %) пацієнтів з інсультом і пов’язаний із високою смертністю (до 50 %) (Velioglu et al., 2001). Епілептичний статус у ранньому періоді у 2–3 рази збільшує ризик розвитку епілепсії.
Незалежно від часу виникнення нападів після інсульту основними факторами підвищеного ризику є: субарахноїдальний крововилив, великий крововилив у півкулі, кірковий кардіоемболічний інфаркт, порушення свідомості в гострій стадії, повторний інсульт, лівобічний кортикальний інфаркт, вік понад 84 роки й молодий вік, ураження в зоні васкуляризації середньої мозкової та передньої мозкової артерії із залученням кори, застосування тромболітиків (ризик 10,8–11,3 % проти 8 % контролю). Предикторами постінсультної епілепсії також є visual neglect, дисфазія, підтип інсульту, ступінь неврологічного дефіциту.
Низький ризик розвитку епілептичних нападів спостерігається при лакунарних та вертебробазилярних інсультах.
На розвиток епілептичних нападів також впливає наявність супутніх захворювань (наприклад, діабет 1-го або 2-го типу, дисліпідемія, ниркова недостатність, гіпертонія, ішемічна хвороба серця або інфаркт міокарда, периферичні інфекції, порушення обміну речовин, депресія, деменція), спосіб життя (куріння, вживання алкоголю, наркотиків та ін.), супутня фармакотерапія (норадренергічні блокатори, норадренергічні агоністи, бензодіазепіни, блокатори кальцієвих каналів, статини, антидепресанти та ін.)
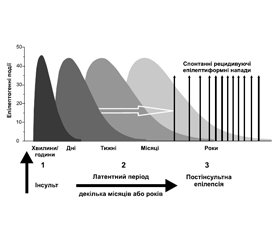
Розвиток постінсультної епілепсії проходить три стадії (рис. 1):
1) початкове ураження — інсульт (епілептогенна подія);
2) латентний період (безнападний період після інсульту різної тривалості);
3) хронічний період із спонтанними рецидивуючими епілептичними нападами.
Хоча точні механізми, що лежать в основі постінсультної епілепсії, залишаються остаточно не встановленими, вважають, що вогнищеве пошкодження активує різні сигнальні події, такі як запалення, окиснення, апоптоз, нейродегенерацію, епігенетичний нейрогенез та синаптична пластичність, які в підсумку призводять до структурних та функціональних змін у нейронних мережах із стійкою схильністю до синхронізованої гіперзбудливості і судом (рис. 2). Свою роль відіграють також генетичні фактори: алель A поліморфізму rs671 у гені, що кодує мітохондріальну альдегіддегідрогеназу 2, CD40-1С/T поліморфізм, 12SNP та функціональна сполучуваність багатьох генів на рівні транскриптоміки були виявлені в умовах ішемічного інсульту.
/72.jpg)
Не тільки гострі судинні події, а й захворювання малих судин можуть бути найчастішою причиною епілепсії в літніх людей (від 40 до 68 %). Фактори ризику цереброваскулярних захворювань, такі як високий кров’яний тиск, високий рівень холестерину, кардіоваскулярна патологія, можуть бути пов’язані з епілепсією, навіть за відсутності інсульту. Такі стани, як лейкоареоз та лакунарний інфаркт, особливо якщо вони супроводжуються порушенням когнітивних функцій, мають значний ризик виникнення епілепсії.
Тромбоз церебральних вен та синусів або вади судин також є факторами ризику епілепсії. Тромбоз церебральних вен призводить до депонування крові в капілярній та венозній системах, локального набряку тканин мозку, дегенерації нервових клітин, некрозу й навіть венозного інфаркту або крововиливу, що з часом призводить до виникнення епілепсії. Розвиток епілептичних нападів реєструється досить часто, і в 10–63 % випадків у гострій стадії захворювання разом із головним болем є першим симптомом захворювання. У 5,2 % таких хворих розвивається епілепсія.
При артеріовенозних мальформаціях епілептичні напади є другим за поширеністю клінічним симптомом і спостерігаються у 20–30 % випадків. Найбільший ризик становлять супратенторіальні вади великих розмірів, розташовані близько до кори головного мозку. Вади розвитку судин та каверноми, у свою чергу, можуть викликати епілепсію, але вони нечасто діагностуються в людей похилого віку або в молодших пацієнтів без супутньої геморагії.
Треба зауважити, що епілепсія, у свою чергу, підвищує ризик розвитку цереброваскулярних захворювань. Пізній початок нападів (після 60–65 років), навіть якщо його причиною не була цереброваскулярна патологія, пов’язаний із підвищенням ризику подальшого інсульту втричі. У пацієнтів похилого віку з епілепсією значно більша ймовірність розвитку інфаркту міокарда, захворювання периферичних артерій, гіпертонії/гіпертрофії лівого шлуночка, підвищення рівня холестерину, асимптомної ішемії та лейкоареозу. Більше того, протиепілептичні препарати (ПЕП) — індуктори печінкових ферментів підвищують рівень ліпідів у сироватці крові та інших атерогенних маркерів через індукцію цитохрому Р450 і, отже, можуть збільшувати ризик виникнення судинної патології.
Пухлини головного мозку, черепно-мозкові травми та хвороба Альцгеймера (ХА) — інші найпоширеніші причини епілепсії в літніх людей. Як основна причина деменції (Reitz et al., 2011) хвороба Альцгеймера вивчена більш детально, і дослідники усвідомлюють її складний взаємозв’язок із судомами та епілепсією. Відповідно до діагностичних критеріїв Dubois et al. (2007), імовірна ХA визначається як наявність поступового прогресуючого об’єктивного погіршення епізодичної пам’яті, ізольованого або в поєднанні з іншими когнітивними змінами (наприклад, візуально-просторовою, мовленнєвою чи виконавчою дисфункцією), з підтримуючими ознаками, такими як атрофія медіальної скроневої частки, наявність патологічних біомаркерів у лікворі, специфічні зміни на ПЕТ-візуалізації або доведена автосомно-домінантна мутація в найближчих родичів. Для діагностики доведеної ХА необхідні або клінічні і гістопатологічні дані, або клінічні дані і наявність специфічних генетичних мутацій, притаманних ХА.
Установлено, що пацієнти з ХА мають більший ризик виникнення судом, ніж недементні пацієнти аналогічного віку. Поширеність нападів у хворих на ХА коливається в межах 1–22 %, за даними низки досліджень (Sjogren, 1952; Hesdorffer et al., 1996; Scarmeas et al., 2009), а рівень захворюваності — 4,8–11,9 на 1000 осіб на рік, що у 2–6 разів вище, ніж в осіб аналогічного віку без деменції (Imfeld et al., 2013; Cheng et al., 2015). Однак залишається незрозумілим, чи є епілептичні напади наслідком втрати нейронів або вони обумовлені прямим неконтрольованим підвищенням збудливості. Враховуючи, що пацієнти з генетичними формами ХА (APP, PS1 та PS2) особливо схильні до судом, очевидно, наявний зв’язок між амілоїдом β (Aβ) та епілептогенністю. Особливий взаємозв’язок між Aβ та судомами підкреслюється тим, що інші деменції, тобто тауропатії та синуклеопатії, як правило, не пов’язані з більш високим ризиком судом порівняно із загальною популяцією. Інші дані свідчать, що поєднане збільшення тау-білка та Aβ, як це має місце при ХА, може мати синергетичний вплив на генерацію нападів (Roberson et al., 2011). Іншим механізмом нападів при АД може бути наявність мікрокровиливів унаслідок церебральної амілоїдної ангіопатії (Greenberg et al., 2010; Picco et al., 2011; Rossi et al., 2013), а також ней-розапалення (Bartfai et al., 2007; Perkins, 2007; Ravizza and Vezzani, 2006) і нейрохімічні порушення в головному мозку. Очевидно, свій внесок робить і прийом специфічних протидементних препаратів, що змінюють нейрональну збудливість.
Таким чином, хвороба Альцгеймера та інші нейродегенеративні захворювання є факторами ризику епілепсії в осіб похилого віку:
— у пацієнтів з усіма типами деменцій підвищений ризик епілепсії порівняно з віковою популяцією без деменції;
— первинні нейродегенеративні розлади становлять ~10–20 % усіх виявлених причин епілепсії у літніх людей;
— кілька факторів сприяють епілепсії:
- тип нейродегенеративного розладу;
- тяжкість і перебіг процесу деменції;
- епілептиформні порушення на ЕЕГ у пацієнтів із деменцією;
- раса (є свідчення про переважання епілепсії в пацієнтів з ХА — представників афроамериканської раси).
Існує низка факторів, що ускладнюють діагностику епілепсії в осіб похилого віку з деменцією: складнощі в зборі анамнезу, наявність періодів сплутаної свідомості й неадекватної поведінки, які можуть імітувати або приховувати епілептичні напади, особливо фокальні безсудомні, значна кількість супутньої патології і, як наслідок, прийом великої кількості ліків.
Загалом ризик розвитку судом та епілепсії в пацієнтів із хворобою Альцгеймера в 3, а іноді у 87 разів вищий, ніж в аналогічній віковій популяції в цілому (табл. 2). Деменція неальцгеймерівського типу підвищує ризик фокальних нападів в 11 разів і ризик генералізованих нападів у 7 разів. З усіх неальцгеймерівських деменцій пацієнти із хворобою Крейцфельдта — Якоба мають найбільший ризик виникнення епілепсії (захворюваність становить до 20 %).
Змішана деменція, судинна деменція та деменція з тільцями Леві ускладнюються епілептичними нападами в дуже невеликому відсотку випадків (Pandis D., Scarmeas N., 2012; Hesdorffer D.C., Hauser W.A., Annegers J.F., Kokmen E., Rocca W.A., 1996; Appel S., Chapman J., Cohen O.S., Rosenmann H., Nitsan Z., Blatt I., 2015).
Тяжкість деменції і тривалість процесу також впливають на розвиток епілепсії. Так, при легкій деменції напади розвиваються в 1,5–16 % пацієнтів, а при вираженій деменції — у 9–64 %. Загалом епілепсія може виникати на будь-якій стадії нейродегенеративних захворювань, але вона зазвичай розвивається через роки. Середній час появи епілепсії після настання деменції — 6,8 року. Причому ризик появи епілепсії збільшується на 11 % через 10 років, на 26 % — через 15 років від дебюту захворювання. Це може бути пов’язане зі збільшенням віку та зростанням тяжкості нейродегенеративного процесу. Електроенцефалографічні епілептиформні порушення можуть з’являтися вже за декілька років від клінічного маніфесту нападів.
Найпоширеніший тип епілептичних нападів при деменціях, зокрема при ХА, — фокальні з порушенням усвідомлення (в основному з порушенням мислення), у 55 % пацієнтів без моторних проявів, але можуть бути й тоніко-клонічні генералізовані судоми, як ізольовані, так і в поєднанні з іншими типами нападів (до 52 %, за даними Mayo Alzheimer’s disease registry, 1997). Рідко зустрічається міоклонічна епілепсія, в основному вона була описана при ранніх фамільних формах ХA. Міоклонічні напади часто передують тоніко-клонічним нападам і пов’язані з гіршим прогнозом.
Прийом препаратів для лікування деменції також є важливим фактором ризику розвитку епілепсії. Так, антипсихотичні препарати, мемантин, донепезил мають значні проконвульсивні властивості. З іншого боку, раннє застосування ПЕП при деменціях покращує не тільки прогноз щодо розвитку нападів, а й перебіг ХА (Nicastro N. et al., 2016).
Гострий симптоматичний напад
Такий напад визначається як перший напад в осіб без епілепсії, що виникає в тісному часовому зв’язку з гострим ураженням ЦНС, включаючи метаболічні, токсичні, структурні пошкодження, інфекційні та запальні процеси. Важливо відрізняти від провокації епілептичних нападів у хворих з епілепсією. Такі напади не діагностуються як епілепсія. Є досить поширеним симптомом у дорослих, що збільшує ризик розвитку епілепсії в майбутньому. Частота гострих симптоматичних нападів у пацієнтів віком понад 60 років становить ~100 на 100 000 осіб і збільшується з кожним наступним десятиліттям. У третини пацієнтів із гострими симптоматичними нападами розвивається епілепсія.
Основними етіологічними факторами розвитку гострих симптоматичних нападів є цереброваскулярні захворювання, травматичні пошкодження головного мозку, пухлини головного мозку, інфекція центральної нервової системи, вживання низки медичних препаратів (антибіотики, гормональні препарати, місцеві анестетики, протиаритмічні засоби, психотропні препарати, стимулюючі препарати, анестетики, наркотичні препарати, барбітурати, бензодіазепіни), соматичні захворювання: лихоманка, гіпоглікемія, електролітний дисбаланс, водна інтоксикація, пневмонія з респіраторною недостатністю або без неї, мікседема, печінкова недостатність, ниркова недостатність; алкоголь тощо.
Розглядаючи діагноз епілепсії, слід чітко розмежовувати епілептичні напади (виникають внаслідок патології мозку) та неепілептичні напади (спровоковані судоми), що виникають у нормальному мозку через зміни фізіології, наприклад унаслідок гіпоксії. Обов’язково слід виключити спровоковані судоми, перш ніж зробити висновок про те, що судоми були епілептичними, і призначити лікування.
Складним питанням у вивченні впливу старіння на епілепсію є неоднорідність цього розладу. Механізм розвитку епілепсії після інсульту суттєво відрізняється від механізмів при хворобі Альцгеймера. Навіть у межах категорії інсульту геморагічний інсульт може мати інший механізм, ніж ішемічний інсульт. Крім того, є велика кількість осіб, що мають епілепсію невизначеної етіології. У той же час у старіючому мозку спостерігається низка змін, що можуть знизити судомний поріг і впливають на діагностику, лікування і прогноз.
Проблеми, з якими стикаються люди похилого віку, які страждають від епілепсії, різноманітні та складніші, ніж ті, з якими стикаються молодші пацієнти. Ці проблеми пов’язані з медичними труднощами: наприклад, правильним діагнозом, підбором відповідних ліків та наявністю коморбідних захворювань, а також із соціальними факторами, такими як емоційна нестабільність та економічні проблеми.
Отже, необхідна всебічна оцінка першого нападу. Необхідно отримати ґрунтовну історію, зосере-дившись на подіях попереднього дня або днів, щоб виявити будь-які провідні або причинні фактори, які могли призвести до нападу. Обов’язкове проведення ЕКГ, щоб виключити можливу серцеву патологію. Необхідно в максимальному обсязі провести лабораторні дослідження для виявлення порушення обміну речовин, а також проаналізувати лікарські засоби, що приймає пацієнт. Крім того, увагу треба звернути на нелікарські засоби й біологічні добавки, які використовуються пацієнтом. На жаль, багато натуральних продуктів, призначених для схуднення або покращення пам’яті, можуть мати проконвульсантні властивості.
Обов’язкові нейровізуалізаційні дослідження — КТ/МРТ.
За допомогою КТ проводиться скринінг на наявність внутрішньомозкових крововиливів, пухлин мозку та енцефаломаляції, тобто для візуалізації гострих змін у гострих ситуаціях. Для виявлення більш тонких специфічних змін (зміни гіпокампа, пороки розвитку, гліальні пухлини) потрібна МРТ, що має проводитися, якщо структурна патологія не виявлена при первинному КТ.
Електроенцефалограма (ЕЕГ) обов’язково проводиться до початку лікування. Виявлення інтеріктальної епілептиформної активності підтверджує епілептичний характер нападу, дає інформацію про ступінь тяжкості епілепсії, може визначити епілептогенну ділянку і надати додаткові підказки до визначення етіології хвороби пацієнта, а також зорієнтувати лікаря в прогнозі захворювання й виборі ПЕП. Особи, у яких після інсульту виникають періодичні латералізовані епілептиформні розряди (PLEDs), мають високий ризик розвитку епілептичних нападів. При наявності вогнищевих спайків ризик розвитку епілептичних нападів становить 78 %. ЕЕГ має записуватися з використанням ЕКГ-каналу з метою виявлення артефактів та виключення серцевої причини для нападу.
До складнощів додаються також і відмінності між людьми, які живуть у сім’ї, особами, які живуть окремо, та літніми людьми, які проживають у медичних установах. Побічні ефекти ліків, ефективність, абсорбція та інші фактори можуть помітно різнитися між здоровою людиною 93-річного віку, яка живе незалежно, та немічною людиною 68 років.
Також суттєво проблематичним є вибір відповідного ПЕП, що вимагає врахування багатьох факторів. До таких факторів належать: зміни в роботі органів, підвищена сприйнятливість до побічних ефектів, використання інших лікарських засобів, що можуть взаємодіяти з ПЕП, та економічні обмеження, пов’язані з відповідним пацієнтом. Крім того, фармацевтичне лікування в літніх людей несе більші ризики, ніж у молодих людей. Окрім застосування при епілепсії, ПЕП призначають при низці інших розладів, включаючи біль та психіатричні розлади в людей похилого віку. Треба пам’ятати, що ПЕП посідають п’яте місце серед усіх категорій медичних препаратів за здатністю до небажаних побічних реакцій. Таким чином, хворі похилого віку потребують дуже уважного підходу в діагностиці епілепсії і призначенні ПЕП.
Вибір ПЕП у хворих похилого віку
Основи очікуваних вікозалежних змін фармакокінетики були описані багато років тому, але досі не завжди враховуються при виборі ПЕП. Концентрація препарату в місці дії визначає вираженість як бажаних, так і токсичних реакцій. Концентрація незв’язаного препарату в сироватці крові знаходиться в прямій рівновазі з концентрацією в місці дії та забезпечує найкраще співвідношення з реакцією на препарат. Загальна концентрація препарату в сироватці крові корисна для моніторингу терапії, коли лікарський засіб не має високого ступеня зв’язку з білком (менше 75 %) або коли відношення незв’язаного ПЕП до загальної концентрації ліків залишається відносно стабільним. Вікові фізіологічні зміни, які найбільше впливають на фармакокінетику ПЕП, пов’язані з зв’язуванням білка та зниженням функції печінки, нирок та кровотоку. Треба зазначити, що три основні ПЕП (вальпроєва кислота, фенітоїн та карбамазепін) мають високий рівень зв’язування з білками і цей рівень змінюється в літніх людей (можливе як збільшення зв’язування, так і зниження, що змінює рівень вільної фракції в крові). Зниження сироваткового альбуміну та підвищення концентрації α1-кислого глікопротеїну (AAG) у літніх людей змінює зв’язування білка з ПЕП. Значна кількість пацієнтів віком понад 65 років має низькі нормальні концентрації альбуміну або вважається гіпоальбумінемічною.
Вплив віку на метаболізм печінки залишається остаточно не визначеним, але є дані про зниження метаболізму, що має призвести до уповільнення елімінації медичних препаратів, зокрема ПЕП. Нирковий кліренс є основним способом елімінації для низки нових ПЕП. Ниркова ємність літньої людини зменшується приблизно на 10 % на десятиліття, що також призводить до зниження швидкості виведення ПЕП і їх метаболітів.
Імовірно, з такими змінами метаболізму пов’язане те, що в пацієнтів літнього віку напади часто контролюються нижчими рівнями ПЕП, ніж у молодих людей. І в той же час побічні ефекти розвиваються частіше і при нижчих дозуваннях препаратів. Фармакокінетика основних ПЕП в осіб літнього віку подана в табл. 3.
Обов’язково слід зазначити, що супутні ліки, які приймають пацієнти літнього віку, можуть змінити абсорбцію, розподіл та метаболізм ПЕП, тим самим збільшуючи ризик токсичності або неефективності терапії (табл. 4).
Таким чином, на сьогодні недостатньо даних щодо клінічного використання ПЕП у літніх людей. Зважаючи на брак інформації, складно впевнено рекомендувати конкретні препарати для досягнення оптимального результату. За результатами аналізу низки досліджень, оптимальними препаратами для лікування епілепсії в пацієнтів похилого віку можуть бути ламотриджин (LTG) і леветирацетам (LEV).
Ламотриджин (Ламотрин) ефективний при фокальних епілепсіях і має профіль ефективності та безпечності, сприятливий для осіб похилого віку. LTG в основному метаболізується печінкою за допомогою шляху глюкуронідації, який, на відміну від системи Р450, менше залежить від вікових змін. Дані популяційного фармакокінетичного дослідження показали, що вік мінімально впливає на кліренс LTG. Відміна препарату внаслідок побічних дій була тільки у 18 % пацієнтів, у той час як KBZ відміняли в 42 % (в основному через шкірну висипку, сонливість, запаморочення, когнітивні порушення).
Леветирацетам (Левіцитам) надзвичайно водорозчинний, що дозволяє швидко та повноцінно всмоктуватися після перорального прийому, дія препарату настає дуже швидко, не потребне тривале титрування дози. LEV не метаболізується печінкою і, таким чином, не має нелінійної елімінації, індукції та взаємодії з іншими лікарськими препаратами. Майже не зв’язується з білками (< 10 %), має сприятливий профіль безпеки, позитивно впливає на когнітивні функції. При розробці LEV спочатку його вивчали як потенційний засіб для лікування когнітивних розладів у літніх людей. Препарат на цей час є майже ідеальним ПЕП для лікування літніх пацієнтів з епілепсією, особливо тих пацієнтів, які мають інші захворювання та приймають інші ліки. Однак, враховуючи всі застереження й рекомендації щодо лікування епілепсії в осіб похилого віку, дози потрібно коригувати залежно від функції нирок пацієнта, виміряної концентраціями креатиніну та леветирацетаму в сироватці кров. За даними аналізу 3252 літніх людей, які брали участь у дослідженнях леветирацетаму при епілепсії та інших захворюваннях, LEV добре переноситься людьми похилого віку.
Також препаратами вибору для лікування епілепсії в літніх людей можуть бути габапентин і прегабалін, що також ефективні при хронічних больових синдромах. Дослідження показали ефективність габапентину для лікування фокальної епілепсії в похилому віці, але до цього часу обмаль даних для впевнених рекомендацій.
Нами проаналізовані дані власних спостережень лікування епілепсії у осіб літнього віку за 7 років. Кращу ефективність і добрий профіль безпеки показав LEV (Левіцитам). 24 особи приймали LEV в середньотерапевтичних дозах 1000–1500 мг/на добу, 11 пацієнтів у нижчих дозах — 750 мг/добу. Препарат призначали як монотерапію. За час спостереження 3 (8,6%) пацієнти відмовилися від прийому препарату через побічні дії (запаморочення, підвищена дратівливість, безсоння), 3 (8,6 %) пацієнти — через низьку ефективність, 2 (5,7 %) — з економічних причин. У 27 (77,1 %) пацієнтів препарат показав добру переносимість і ефективність:
— повний контроль нападів > 1 року — 31,4 %;
— зменшення частоти нападів > 50 % — 34,3 %;
— зменшення частоти нападів < 50 % — 11,4 %;
— неефективність лікування — 11,4 %;
— відміна через побічні дії — 8,6 %;
— відміна з інших причин — 5,7 %.
LTG (Ламотрин) продемонстрував добру ефективність і переносимість при лікуванні фокальних нападів в осіб похилого віку. За даними 6-річного спостереження, препарат приймали 65 пацієнтів літнього віку, із них 28 пацієнтів отримували монотерапію, 37 приймали Ламотрин у комбінації: з препаратами вальпроєвої кислоти — 14 хворих, карбамазепіном — 23 хворі. Дози LTG у даної категорії хворих були дещо нижчими за середньотерапевтичні: 100–250 мг/добу — монотерапія; 75–150 мг/добу — комбінована терапія. Монотерапія LTG була ефективна в 46,4 % випадків (відсутність нападів протягом року/зниження частоти нападів > 50 %), недостатньо ефективна — у 28,6 % (зниження частоти нападів ≥ 50 %). При недостатній ефективності терапії підвищення дози препарату до 300–400 мг/добу в низці випадків призводило або до появи побічних дій, або не давало значного клінічного ефекту. Відміна препарату з різних об’єктивних і суб’єктивних причин була у 25 % пацієнтів (недостатня ефективність, побічні дії, економічні причини). При застосуванні LTG у комбінації з іншими ПЕП у більшості хворих небажані ефекти були обумовлені другим препаратом (вальпроатом або карбамазепіном). Загалом LTG відміняли через небажані побічні дії в 19 % випадків, але треба відмітити, що при більш повільному збільшенні дози препарату (на 12,5 мг кожні 10 днів як монотерапія, на 12,5 мг кожні 12–14 днів — на фоні прийому вальпроатів) побічних дій в більшості випадків вдавалося уникнути.
Незначна кількість спостережень лікування епілепсії в осіб похилого віку, гетерогенна група спостереження (різний вік — від 65 до 81 року, різна етіологія захворювання й тип нападів, тривалість захворювання від 1 до 16 років, наявність значної кількості супутніх захворювань, соціально-економічні аспекти тощо) не дозволяють зробити впевнений висновок про переваги лікування епілепсії в такій когорті тим чи іншим ПЕП. Але можна вважати LEV і LTG найбільш ефективними і безпечними ПЕП в осіб похилого віку, особливо за наявності когнітивних порушень і супутньої патології.
Основні принципи лікування епілепсії в осіб похилого віку
1. Перший вогнищевий ранній епілептичний напад не є обов’язковим для лікування, за винятком геморагічних інсультів з ураженням кори, при яких можливе короткочасне лікування (не менше 6 міс.). Профілактики епілептичних нападів і епілепсії не існує, але деякі ПЕП знижують ризик ранніх нападів, не впливаючи на можливість розвитку епілепсії в подальшому.
2. Пізні судоми після цереброваскулярної події, особливо повторні, є показанням до лікування ПЕП — ризик повторення становить 71,5 %. При виникненні навіть однократних неспровокованих судом на тлі хронічної цереброваскулярної хвороби (судинна епілепсія) ПЕП необхідні.
3. Перший епілептичний напад на тлі хвороби Альц-геймера та інших первинних нейродегенерацій є показанням до початку лікування, що значно покращує не тільки прогноз епілепсії, а й уповільнює прогресування когнітивної дисфункції.
4. Необхідно докласти зусиль для найскорішого встановлення етіології епілепсії de novo в осіб похилого віку для лікування (хірургічного і/або медикаментозного) основного захворювання.
5. Слід враховувати підвищену чутливість пацієнтів віком понад 65 років до побічних ефектів ПЕП та вплив супутніх захворювань. Необхідно враховувати взаємодію з іншими препаратами ПЕП та не-ПЕП, що прий-має хворий.
6. Можливе лікування низькими дозами ПЕП (1/2, 1/3 від стандартних) із повільним збільшенням дозування та ретельним титруванням. У більшості випадків необхідне визначення концентрації ПЕП у плазмі крові.
7. Рекомендоване застосування ПЕП, що не пригнічують когнітивні функції, не впливають на метаболізм ліпідів, вагу, не викликають аритмій, мінімально взаємодіють з іншими препаратами. Препаратами вибору для пацієнтів похилого віку, особливо з когнітивними порушеннями (унаслідок дегенеративних захворювань, цереброваскулярних захворювань тощо) мають бути леветирацетам (Левицитам) і ламотриджин (Ламотрин), по можливості як монотерапія.
8. Необхідно враховувати фармакоекономічні й соціальні аспекти.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Baftiu A., Feet S.A., Larsson P.G. et al. Utilisation and polypharmacy aspects of antiepileptic drugs in elderly versus younger patients with epilepsy: A pharmacoepidemiological study of CNS-active drugs in Norway, 2004–2015. Epilepsy Res. 2018 Jan. 139. 35-42.
2. Bergey G.K. Initial treatment of epilepsy: special issues in treating the elderly. Neurology. 2004. 63(Suppl. 4). S40-8.
3. Bourdet S.V., Gidal B.E., Alldredge B.K. Pharmacologic management of epilepsy in the elderly. J. Am. Pharm. Assoc. (Wash.). 2001. 41(3). 421-36.
4. Brodie M.J., Overstall P.W., Giorgi L. Epilepsy Res. 1999. 37. 81–87. PubMed: 10515178.
5. Chen B., Choi H., Hirsch L.J., Katz A., Legge A., Buchsbaum R., Detyniecki K. Psychiatric and behavioral side effects of antiepileptic drugs in adults with epilepsy. Epilepsy Behav. 2017. 76. 24-31.
6. Cramer J.A., Leppik I.E., Rue K.D., Edrich P., Kramer G. Epilepsy Res. 2003. 56. 135-145. PubMed: 14642998.
7. De la Court A., Breteler M.M., Meinardi H., Hauser W.A., Hofman A. Epilepsia. 1996. 37. 141-147. PubMed: 8635424.
8. Fisher R.S., Acevedo C., Arzimanoglou A., Bogacz A. et al. A practical clinical definition of epilepsy. Epilepsia. 2014. 55(4). 475-482.
9. Graham N.S., Crichton S., Koutroumanidis M., Wolfe C.D., Rudd A.G. Incidence and associations of poststroke epilepsy: the prospective South London Stroke Register. Stroke. 2013.
10. Greenblatt D.J. J. Am. Geriatr. Soc. 1979. 27. 20-22. PubMed: 759470.
11. Gupta S.R., Naheedy M.H., Elias D., Rubino F.A. Stroke. 1988. 19. 1477-1481. PubMed: 3201504.
12. Hаuser W., Hesdorffer D. Epilepsy, Frequency, Causes and Consequences. New York, NY: Demos Publications, 1990.
13. Hauser W.A., Annegers J.F., Rocca W.A. Mayo Clin. Proc. 1996. 71. 576-586. PubMed: 8642887.
14. Hermann B.P., Sager M.A., Koscik R.L., Young K., Nakamura K. Vascular, inflammatory, and metabolic factors associated with cognition in aging persons with chronic epilepsy. Epilepsia. 2017 Nov. 58(11). e152-e156.
15. Hernández-Ronquillo L., Adams S., Ballendine S., Téllez-Zenteno J.F. Epilepsy in an elderly population: Classification, etiology and drug resistance. Epilepsy Res. 2018. 140. 90-94.
16. Hesdorffer D.C. et al., 2011; Olafsson E. et al., 2005; Leppik I.E. et al., 2010; Wallace H., Shorvon S., Tallis R., 1998; Faught E., Richman J., Martin R. et al., 2012; Ghosh S., Jehi L.E., 2014; Pugh M.J., Knoefel J.E., Mortensen E.M. et al., 2009.
17. Holmes G. Clin. Electroencephalogr. 1980. 11. 83-86.
18. Hussein Z., Posner J. Br. J. Clin. Pharmacol. 1997. 43. 457-465. PubMed: 9159559.
19. Ip Q., Malone D.C., Chong J., Harris R.B., Labiner D.M. An update on the prevalence and incidence of epilepsy among older adults. Epilepsy Res. 2018. 139. 107-112.
20. Leppik I.E., Birnbaum A.K. Epilepsy in the Elderly. Ann. NY Acad. Sci. 2010. 1184. 208-224.
21. Leppik I.E., Brodie M.J., Saetre E.R., Rowan A.J., Ramsay R.E., Macias F., Jacobs M.P. Epilepsy Res. 2006. (Suppl. 1). S71-S76. PubMed: 16413171.
22. Liu J., Wang L., Wu L., Wang Y. Treatment of epilepsy for people with Alzheimer’s disease. Cochrane Database of Systematic Reviews. 2016. Issue 11. Art. No.: CD011922.
23. Martin R., Vogtle L., Gilliam F., Faught E. Health-related quality of life in senior adults with epilepsy: what we know from randomized clinical trials and suggestions for future research. Epilepsy and Behavior. 2003. 4(6). 626-634.
24. May T.W., Pfäfflin M., Brandt C., Füratsch N. et al. Epilepsy in the elderly: restrictions, fears, and quality of life. Acta Neurol. Scand. 2015. 131(3). 176-86.
25. Moore S.A. Teal T.W. Proceedings of the Drug Information Association Workshop Geriatric Drug Use: Clinical and Social Perspectives. Washington, DC: Pergamon Press, 1985. Adverse drug reaction surveillance in the geriatric population: a preliminary review.
26. Morrell M.J., Leppik I., French J., Ferrendelli J., Han J., Magnus L. Epilepsy Res. 2003. 54. 153-161. PubMed: 12837566.
27. Nicastro N., Assal F., Seek M. From here to epilepsy: the risk of seizure in patients with Alzheimer’s disease. Epileptic Disord. 2016. 18 (1). 1-12.
28. Patsalos P.N., Sander J.W. Drug Saf. 1994. 11. 37-67. PubMed: 7917080; French J. Epilepsia. 2001. 42(Suppl. 4). 40-43. PubMed: 11564125.
29. Peck A.W. Epilepsia. 1991. 32(Suppl. 2). S9-S12. PubMed: 1773780.
30. Perucca E., Berlowitz D., Birnbaum A. et al. Pharmacological and clinical aspects of antiepileptic drug use in the elderly. Epilepsy Res. 2006 Jan. 68 (Suppl. 1). S49-63.
31. Reddy D.S., Bhimani A., Kuruba R., Park M.J., Sohrabji F. Prospects of Modeling Post-Stroke Epileptogenesis. J. Neurosci. Res. 2017. 95(4). 1000-1016.
32. Richens A. Clinical pharmacokinetics of gabapentin. London, England: Royal Society of Medicine Services, 1993.
33. Rowan A., Ramsay R., Collins J. et al. Neurology. 2005. 64. 1868-1873. PubMed: 15955935.
34. Scheffer I.E., Berkovic S., Capovilla G., Connolly M.B. et al. ILAE classification of the epilepsies: Position paper of the ILAE Commission for Classification and Terminology. Epilepsia. 2017. 58(4). 512-521.
35. Sillanpaa M., Kalviainen R., Klaukka T., Helenius H., Shinnar S. Epilepsy Res. 2006. 71. 206-215. PubMed: 16876984.
36. Stefan H., May T.W., Pfäfflin M., Brandt C. et al. Epilepsy in the elderly: comparing clinical characteristics with younger patients. Acta Neurol. Scand. 2014. 129(5). 283-93.
37. Verbeeck R.K., Cardinal J.A., Wallace S.M. Eur. J. Clin. Pharmacol. 1984. 27. 91-97. PubMed: 6489431.
38. Wallace S., Verbeeck R. Clin. Pharmacokinet. 1987. 12. 91-97.
39. Wynne H.A., Cope L.H., Mutch E., Rawlins M.D., Woodhouse K.W., James O.F. Hepatology. 1989. 9. 297-301. PubMed: 2643548.
40. Yang H., Rajah G., Guo A., Wang Y., Wang Q. Pathogenesis of epileptic seizures and epilepsy after stroke. Neurol. Res. 2018 Apr. 21. 1-7.
/70.jpg)
/72.jpg)
/76.jpg)

/71.jpg)
/73.jpg)
/75.jpg)