Введение
Цереброваскулярная патология у лиц молодого возраста (18–45 лет) является важной проблемой современной ангионеврологии. Во многих индустриальных странах наблюдается отчетливая тенденция к росту распространенности инфаркта мозга в этой возрастной группе, что приводит к значительному ограничению жизнедеятельности и инвалидизации самой трудоспособной части населения, большим экономическим потерям для общества в целом [1–4]. Частота развития инфаркта головного мозга у пациентов молодого возраста, по различным данным, составляет 5–14 % от всех случаев заболевания [5]. Актуальность и сложность этой проблемы в первую очередь обусловлены существенным различием причин в этой возрастной группе, недостаточной изученностью и настороженностью в их поиске среди неврологов, в том числе в Украине и Беларуси [6–10]. Несмотря на то что в настоящее время большое внимание уделяется изучению этиологии инфаркта мозга в молодом возрасте, зачастую она так и остается невыясненной. Одной из признанных закономерностей в ангионеврологии является прогрессирующее снижение полиморфизма этиологических факторов на протяжении жизни человека. Так, если в старших возрастных группах преобладают атеросклероз, артериальная гипертензия, кардиальная патология и их сочетание, то у детей и лиц молодого возраста только неатеросклеротических причин инфаркта мозга насчитывается более 50 [8–12]. Недостаточно разработан алгоритм диагностики, что влияет на проведение лечения и дальнейшей вторичной профилактики у данной категории пациентов.
В соответствии с общепризнанной концепцией гетерогенности инфаркта мозга в международных исследованиях применяется классификация TOAST (Trial of Org 10172 in Acute Stroke Treatment) [13], согласно которой выделяют следующие основные подтипы инфаркта мозга: атеротромботический — вследствие атеросклеротического поражения крупных артерий; кардиоэмболический — вследствие наличия факторов кардиогенной эмболии; лакунарный — в результате окклюзии сосудов мелкого калибра; инфаркт мозга другой установленной этиологии — в результате редких причин и неустановленной этиологии (криптогенный инфаркт мозга).
В крупнейшем исследовании, проведенном в Финляндии среди 1008 пациентов молодого возраста с инфарктами мозга, было показано, что у них, в отличие от пациентов старшей возрастной группы, реже встречаются такие факторы риска, как атеросклероз — 10 %, сахарный диабет 2-го типа — 13,8 %, артериальная гипертензия — 20,8 %; достоверно возрастает число инфарктов, обусловленных другими уточненными причинами, — 26 %, а также невыясненной этиологии, несмотря на всестороннее обследование, — 22,4 % [4].
По данным других исследований, проведенных, в частности, в Корее и Японии, атеротромбоз выявлен в 20,8 % случаев, кардиоэмболия — в 18,1 %, инфаркт мозга в результате других известных причин — в 26,8 %, в 36 % случаев причина не была установлена [14, 15]. Большинство работ указывают, что инсульт вследствие неуточненных причин встречается в достаточно высоком проценте случаев — от 22,4 до 36 %. В группе криптогенных инсультов принято выделять инсульты от невыясненных причин с полным и неполным обследованием, а также с множественными вероятными причинами [12].
В литературе отмечается широкий диапазон причин, которые характерны только для пациентов молодого возраста. К ним относятся артериальные диссекции, васкулиты (инфекционные и неинфекционные), тромбофилии, гемоглобинопатии, сосудистые аномалии, мигрень, метаболические и наследственные расстройства (гомоцистинурия, митохондриальная энцефалопатия с рецидивирующим лактат-ацидозным инсультом — MELAS-синдром, болезнь Фабри, болезнь Леше — Нихена и др.), употребление медикаментов и химических препаратов, вазоконстрикторные синдромы, обезвоживание, лейкемия, миелопролиферативные, злокачественные неопластические заболевания, диссеминированное внутрисосудистое свертывание крови, беременность [9, 16, 17].
Редкие причины инфаркта мозга в молодом возрасте представляют 5 % всех случаев ишемического инсульта [17]. Неатеросклеротическая васкулопатия (НАВ) входит в их число и является причиной 14–25 % инсультов у пациентов до 50 лет [3, 8]. НАВ включает много разновидностей заболеваний с различными основными механизмами, включая иммунологические, инфекционные, патологию соединительной ткани и гематологические состояния. Механизмы инсульта при НАВ варьируют от травматических, сосудистых до воспалительных и инфекционных, зачастую при установлении основополагающей генетической предрасположенности [17].
Широкое внедрение в практику методов нейровизуализации головного мозга и улучшение качества неинвазивных ангиографических изображений способствовали более точной и своевременной диагностике и дифференциации васкулопатий, что имеет большое значение для дальнейшей тактики лечения.
Артериальная диссекция
Артериальная диссекция (расслоение, от латинского dissecans — расслаивающий), как травматическая, так и спонтанная, является самой распространенной НАВ и причиной инфаркта головного мозга в молодом возрасте — около 20 % [18]. Диссекция зачастую взаимосвязана с другими артериопатиями, включая фибромускулярную дисплазию (ФМД), и другими коллагеновыми заболеваниями. Установлена роль синдрома обратимого церебрального спазма сосудов, односторонней интракраниальной артериопатии у детей, болезни моя-моя (БММ), пострадиационной васкулопатии и церебральных васкулитов [17].
Диссекция внутренней сонной артерии почти всегда вовлекает мобильный участок артерии, не прикрепленный к костным структурам, часто включает в себя экстракраниальный фарингеальный и дистальный сегменты внутренней сонной артерии, нередко про-длеваясь до своего каменистого супраклиноидного сегмента. Экстракраниальный отдел позвоночной артерии фиксирован в месте ее отхождения от подключичной артерии, в канале поперечных отростков позвонков и в месте проникновения в череп через твердую мозговую оболочку. Короткие мобильные сегменты артерий, расположенные между ее фиксированными участками, наиболее подвержены растяжению при поворотах головы и предрасположены к разрыву интимы. Самым частым местом локализации диссекции позвоночной артерии является дистальный отдел ее экстракраниального участка (сегмент V3), который относительно мобилен и уязвим для разрыва при внезапном повороте головы, приводящем к натяжению и надрыву подслизистого слоя [18]. За этим следует образование интрамуральной гематомы (ИМГ) внутри медиального слоя. Продольное растяжение гематомой впоследствии приводит к сужению и уменьшению просвета сосуда, локальному стенозу или окклюзии пораженной артерии [19, 20]. По длине артерии ИМГ может распространяться на различное расстояние и вовлекать как экстра-, так и интракраниальные отделы мозговых артерий. При интракраниальной локализации расслаивающая аневризма может явиться причиной субарахноидального кровоизлияния [18].
Этиопатогенез диссекции брахиоцефальных артерий (дсБЦА) остается пока малоизученным. Имеются данные, что основной причиной спонтанной диссекции является слабость соединительной ткани артериальной стенки, что снижает ее эластические свойства [20]. Пациенты с наследственным нарушением соединительной ткани, лежащим в основе артериопатии, таким как фибромускулярная дисплазия, синдром Элерса — Данло IV типа (сосудистый вариант), синдром Марфана и MASS-подобный фенотип (Mitral valve, Aorta, Skeleton, Skin), особенно подвержены артериальным диссекциям [9, 20–24].
Травма головы и шеи в качестве провоцирующего фактора при диссекции, по данным Л.А. Калашниковой [18], отмечается чаще при поражении сонных (26 %), чем позвоночных артерий (3 %). Повреждение может возникнуть при различных обстоятельствах: удар, падение, удушение, чрезмерный форсированный поворот головы с натяжением экстракраниальных артерий приводят к надрыву интимы и проникновению крови в артериальную стенку. Диссоциация между относительной легкостью травмы и серьезными последствиями свидетельствует о слабости артериальной стенки, а травма выступает в роли триггера [25]. Провоцирующим фактором диссекции наряду с травмой может быть запрокидывание и неудобное положение головы (синдром «салона красоты»), занятие некоторыми видами спорта (плавание), долгий разговор по мобильному телефону, когда аппарат удерживается плечом. Диссекция может также произойти при интубационном наркозе, мануальной терапии, интенсивных усилиях во время родов, неудобном положении головы во время сна, что было показано в многочисленных публикациях [18, 26–28]. Это также приводит к натяжению стенки артерий и ее травматизации о расположенные рядом костные структуры, вследствие чего образуется надрыв интимы. Описаны случаи диссекции при физическом напряжении во время кашля, рвоты, поднятия тяжести [29].
О роли инфекционных факторов в развитии диссекции свидетельствует тот факт, что частота спонтанных диссекций увеличивается в осенне-зимний период [30, 31]. По литературным данным, ишемические инсульты при дсБЦА, обусловленных инфекционными факторами, возникают почти в 30 % случаев, что значительно чаще, чем при инсультах другого генеза (13,5 %), и вовлекают в патологический процесс несколько артерий, что предполагает наличие у пациента более тяжелой артериопатии [30]. Подтверждением роли инфекции является повышение уровня цитокинов, свободных радикалов и протеиназ, которые ослабляют сосудистую стенку и в сочетании с характерными для вирусных инфекций кашлем и чиханием приводят к повреждению артерий. Другим подтверждением влияния воспалительных изменений в сосудистой стенке при диссекции является выявление при МРТ-исследовании периартериального отека, который коррелирует с лабораторными изменениями [32, 33]. Развитие диссекции может быть обусловлено специфическим артериитом при сифилисе, ВИЧ-инфекции [34]. К другим состояниям, связанным с повышенным риском дсБЦА, относятся мигрень, эластическая псевдоксантома, несовершенный остеогенез, поликистоз почек, MTHFR 677ТТ-мутации, дефицит альфа-1-антитрипсина, гомоцистинурия, болезнь Такаясу, болезнь моя-моя, коарктация аорты, атеросклероз, артериальная гипертензия, фарингеальные инфекции, курение, прием оральных контрацептивов, менинговаскулярный сифилис [35–37].
Диагностика дсБЦА может представлять значительные трудности. Даже при осведомленности неврологов дсБЦА диагностируется в небольшом проценте случаев — 6–10 % по нашим данным, зачастую является асимптомной и случайной находкой при магнитно-резонансной (МРТ) или компьютерной томографии (КТ) [7]. Характерным клиническим проявлением дсБЦА являются ипсилатеральные головные или шейные боли с ретроорбитальными и ретроаурикулярными болями, нарушение мозгового кровообращения (инфаркт головного мозга, транзиторные ишемические атаки), описанные у пациентов с диссекцией внутренней сонной и позвоночной артерии [38]. Головную боль или боль в шее отмечали большинство наших пациентов — 80 %, она являлась первым клиническим симптомом и предшествовала очаговым симптомам. Интенсивность боли варьировала, она не была похожа на ту боль, которую пациенты испытывали ранее. Нередко головная боль была настолько легкой и кратковременной, что пациенты не придавали ей значения и вспоминали только после уточняющих вопросов. Другие неврологические симптомы, возникающие из-за прямой компрессии или стеноза/окклюзии артерии: синдром Горнера, параличи черепных нервов, пульсирующий шум в ушах (тиннитус), извращение вкуса и зрительные нарушения (amaurosis fugas, окклюзия центральной артерии сетчатки, задняя ишемическая оптикопатия). Причиной пульсирующего шума является анатомическая близость барабанной перепонки к пораженной внутренней сонной артерии, увеличенной в диаметре за счет расслоения и ИМГ [17, 39].
В отличие от атеросклероза, при котором поражение сосудов развивается постепенно, стенозирование (окклюзия) при артериальной диссекции происходит достаточно остро или подостро, чем объясняется ее роль в развитии острых ишемических цереброваскулярных синдромов в молодом возрасте. Среди пациентов с диссекцией они наблюдались в 90 % случаев и были представлены инфарктами головного мозга. По литературным данным, частота ишемических нарушений мозгового кровообращения варьирует от 50 до 95 % и развиваются они в бассейне средней мозговой артерии [40]. Диагностика инфаркта головного мозга, обусловленного дсБЦА, должна базироваться на следующих критериях: молодой возраст пациента, отсутствие типичных факторов риска инсульта, атеросклеротического поражения сосудов головного мозга, клинических и лабораторных признаков гиперкоагуляции, наличие характерных провоцирующих моментов (травма головы и шеи, форсированные движения и мануальные воздействия на шейном отделе позвоночника), наличие головной, лицевой или шейной боли на стороне поражения.
При подозрении на дсБЦА рекомендуются неинвазивные исследования головы и шеи, такие как дуплексное сканирование с допплеровским картированием, МРТ и магнитно-резонансная ангиография (МРА), мультиспиральная компьютерная томографическая ангиография (МС-КТА), которые облегчают раннюю диагностику дсБЦА и способствуют назначению адекватной терапии. МС-КТА и МРА являются минимально инвазивной техникой, которая может обеспечить высококачественное и высококонтрастное изображение артериального просвета и сосудистой стенки [41]. В последние годы методы неинвазивной нейровизуализации заменили стандартную дигитальную субтракционную ангиографию (ДСА), исторически считавшуюся золотым стандартом. Ангиографическими признаками дсБЦА являются: симптом струны — равномерное продолженное сужение просвета сосуда, обусловленное наличием в стенке ИМГ, или неравномерное сужение просвета артерии по типу нитки бус или четок; конусообразное предокклюзионное сужение артерии на 2–3 см выше ее устья — симптом «пламени свечи»; наличие ложного просвета, образованного проникшей через разрыв интимы кровью; формирование расслаивающей аневризмы [17]. Однако ДСА не выявляет такой важный диагностический симптом, как увеличение наружного диаметра внутренней сонной артерии, обу-словленное ИМГ в ее стенке, а также является инвазивным и дорогостоящим методом, что ограничивает возможность повторного обследования в динамике. Тем не менее данное исследование сохраняет свою актуальность тогда, когда данные КТ или МРТ были не совсем убедительными.
МС-КТА позволяет обеспечить высококачественное и высококонтрастное изображение артериального просвета и сосудистой стенки, с высокой чувствительностью (90–100 %) и специфичностью [42]. Ограничения по проведению КТА связаны с предварительной оценкой выделительной функции почек в связи с риском развития нефропатии на введение контраста. При проведении КТА используются методы двухмерного и трехмерного построения изображения, сравнимые по информативности с ДСА. Признаки диссекции, выявляемые при КТА, аналогичны ангиографическим признакам: равномерное или неравномерное сужение артериальной стенки, симптом «пламени свечи», наличие расслаивающей аневризмы. Кроме того, КТА выявляет увеличение наружного диаметра ВСА, обусловленное ИМГ в ее стенке. Бесконтрастная КТ головного мозга в остром периоде диссекции ВСА может обнаружить ИМГ в прекраниальном отделе в виде участка повышенной плотности полулунной формы. Иногда КТА удается визуализировать отслоенную интиму, выступающую в просвет артерии (intimal flap), и двойной просвет, образованный кровью в стенке сосуда. Находки могут включать в себя псевдоаневризматическое образование, движение внутренней стенки сосуда с двойным светом, стеноз сосуда или полную закупорку артерии [17].
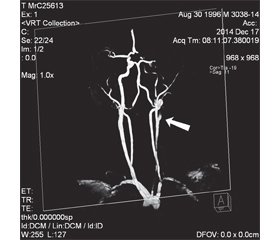
МРТ по сосудистой программе выявляет большинство патогномоничных для диссекции признаков: симптом «пламени свечи», неравномерное сужение артерии, аневризмы, однако чувствительность этой техники в диагностике диссекции ниже, чем КТА [42, 43]. При исследовании в аксиальной проекции ИМГ имеет кольцевидную или полулунную форму, которую окружает суженный, эксцентрично расположенный просвет артерии. На рис. 1, 2 представлены МРТ-исследования пациента К., 18 лет, с инфарктом головного мозга в бассейне левой внутренней сонной артерии, обусловленным ее окклюзией в результате диссекции. Механизм развития был связан с резким форсированным поворотом головы и шеи во время танца на дискотеке. Все последующие неоднократно проведенные клинико-инструментальные и лабораторные исследования не выявили какой-либо патологии.
/87.jpg)
Ультразвуковая диагностика играет важную роль в диагностике диссекций и последующем мониторировании проходимости артерий, т.к. диссекция представляет собой динамический процесс. Преимуществом ее является неинвазивность, быстрота выполнения, доступность и меньшая стоимость по сравнению с КТА и МРА. Характерными УЗ-признаками диссекции являются гипоэхогенная гематома внутри стенки артерии, наличие ложного просвета, псевдоаневризмы, гипер-эхогенной отслоенной интимы, пролонгированное сужение просвета артерии [44, 45].
Лечение артериальной диссекции должно быть индивидуальным, в зависимости от остроты симптомов, клинических проявлений, повторных эпизодов, а также данных нейровизуализации.
До последнего времени отсутствовала доказательная база по лечению, имелись противоречивые клинические данные по сравнительной оценке различных вариантов лечения и профилактики инфаркта головного мозга, обусловленного дсБЦА. Результаты проведенного систематического обзора указывают на необходимость предотвращения пролонгирования интрамуральной гематомы, образования тромбов и развития артериоартериальной эмболии. Лечение включает в себя внутривенный или внутриартериальный тромболизис у пациентов, подходящих для назначения альтеплазы. Для предотвращения повторной дсБЦА используются антитромбоцитарные либо антикоагулянтные препараты. Эндоваскулярные и хирургические вмешательства предпринимаются в случае повторной диссекции, несмотря на антитромболитическую терапию [46–49].
Внутривенный тромболизис с тканевым активатором плазминогена показан в течение первых 4,5 часа от наступления первых симптомов острого инфаркта головного мозга [50, 51]. В регистре CADISP (Cervical Artery Dissection and Ischemic Stroke Patients) у 68 из 616 пациентов был проведен системный тромболизис, в основном внутривенный (55 пациентов), при этом не отмечалось клинического ухудшения, повышенного риска кровотечений, субарахноидальных кровоизлияний, образования псевдоаневризм или артериальных разрывов [52].
Профилактические мероприятия должны быть начаты как можно раньше, так как имеется высокий риск повторного инфаркта мозга в первые несколько недель после диссекции. Антикоагулянты с использованием гепарина, с последующим переходом на варфарин на период от 3 до 6 месяцев эмпирически рекомендованы, за исключением случаев, когда подозревается интракраниальное расширение (удлинение) внутренней сонной артерии [46, 53]. Данные 36 исследований из обзора Cochrane по сравнительной эффективности антитромбоцитарных и антикоагулянтных средств при участии 1285 пациентов показали, что нет достоверной разницы в вероятности смерти или ишемического инсульта между группами, использовавшими различные способы лечения [54]. Результаты единственного мультицентрового рандомизированного клинического исследования по лечению инсультов в результате артериальной диссекции CADISS (Cervical Artery Dissectionin Stroke Study), в котором проводилась сравнительная оценка двух групп препаратов (антикоагулянты и антитромбоцитарные вещества) для предотвращения повторного инсульта, подтвердили существующие данные об отсутствии достоверной разницы между этими двумя способами лечения [52]. Рекомендаций по целесообразному выбору антитромбоцитарных препаратов в этом исследовании не давалось. Один из весомых аргументов, который необходимо учитывать при выборе лечения пациентов с дсБЦА, это высокая доказательность (класс I, уровень А) рекомендаций Американской ассоциации сердца и Американской ассоциации инсульта (AHA/ASA, 2014) по предпочтению антитромбоцитарных препаратов как в остром периоде, так и для вторичной профилактики некардиоэмболического инфаркта мозга [49]. К сожалению, эффективность современных антикоагулянтов (ривароксабан, дабигатран, апиксабан и др.) у пациентов с дсБЦА не изучалась. Хирургические и эндоваскулярные вмешательства с сосудистой пластикой и стентированием показаны пациентам с повторными инфарктами, медикаментозная терапия которых была неэффективной [55, 56]. Большинство дсБЦА излечивается спонтанно, прогноз и исход обычно благоприятный. Повторная диссекция в компрометированном сосуде бывает очень редко и проявляется в течение первых 2 месяцев после первоначального случая [17, 57]. Мы располагаем собственными наблюдениями с верифицированным диагнозом дсБЦА, опубликованными ранее [51], с анализом динамики неврологического статуса и степени реканализации пораженных артерий, которая, по нашим данным, достигает почти 90 % у пациентов со стенотическим вариантом диссекции. В настоящее время наши исследования по проблеме артериальной диссекции и инфаркта головного мозга у лиц молодого возраста продолжены.
Фибромускулярная дисплазия
Неатеросклеротическая невоспалительная болезнь сосудов неизвестной этиологии, проявляющаяся сегментарным поражением средних и малых артерий почек и экстракраниального отдела внутренней сонной артерии [58]. ФМД приводит к формированию артериального стеноза, закупорки, аневризматического образования или диссекции сосудов. Распространенность и заболеваемость ФМД остается недостаточно изученной. Известно, что она чаще проявляется у женщин 30–50 лет, особенно с мигренями в анамнезе. Имеется генетическая предрасположенность с аутосомальным видом наследственности [59]. Гистологически фибропластические изменения обнаруживаются только в области медии (95–99 %), вовлечение интимы или адвентиции встречается редко (менее 1 %). Ангиографической характеристикой ФМД в 80–90 % случаев являются мультифокальные короткие участки сегментарного стеноза, чередующиеся с участками дилатации, что дает характерную картину, получившую название нитки бус или четок [60].
Клинические проявления ФМД весьма вариабельны и неспецифичны. В подавляющем большинстве случаев они имеют асимптомное течение и являются случайной находкой при проведении нейровизуализационного исследования по другим причинам. Симптомные проявления могут включать головные боли, пульсирующий шум в ушах, колебания артериального давления. Артериальные диссекции и аневризмы мозговых артерий, обусловленные ФМД, выявляются в 7–20 % случаев. Клиническими проявлениями являются церебральная ишемия или субарахноидальное кровоизлияние [60]. ФМД может быть заподозрена у молодых пациентов с билатеральной диссекцией БЦА, особенно интракраниальной локализации.
Нередко ФМД сочетается с другими заболеваниями соединительной ткани — синдромом Элерса — Данло IV типа, синдромом Марфана, синдромом Альпорта (болезнь тонких базальных мембран), а также с системными васкулитами, такими как болезнь Такаясу [23, 61, 62].
Лечение ФМД проводится по тем же принципам, что и спонтанной диссекции. До сих пор не проводилось рандомизированных контролируемых исследований, показывающих преимущества реваскуляризационных методик в сравнении с медикаментозным лечением. Лекарственная терапия является терапией первого выбора. Хирургические и интервенционные вмешательства на сосудах проводятся у пациентов с повторными стенозами и церебральными аневризмами [63].
Системные васкулиты
Это гетерогенная группа заболеваний, основным морфологическим признаком которых является воспаление сосудистой стенки с фибриноидным некрозом и лейкоцитарной инфильтрацией, сужением просвета сосуда, повреждением сосудистой стенки, возникновением аневризм и кровоизлияний, высоким риском тромбоза. В большинстве случаев сосуды головного мозга поражаются при системных заболеваниях, но описаны и изолированные церебральные ангииты [64, 65]. Спектр клинических проявлений зависит от типа, размера и локализации пораженных сосудов и тяжести сопутствующих воспалительных нарушений. В эту группу включены инфекционно-индуцированные васкулиты, неинфекционные воспалительные системные васкулиты, лекарственно-индуцированные васкулиты [65, 66].
Классификация васкулитов [16]:
1. Первичные ангииты ЦНС (ПАЦНС).
2. Амилоид-b-ассоциированный ангиит.
3. Системные васкулиты:
— больших сосудов: болезнь Такаясу, GCA;
— средних сосудов: васкулит Kawasaki, узелковый полиартериит;
— малых сосудов: ANCA-ассоциированный васкулит, Churg-Strauss;
— гиперчувствительные васкулиты: Henoch-Schönlein пурпура;
— лекарственно-индуцированные васкулиты;
— васкулиты, ассоциированные с заболеваниями соединительной ткани: системная красная волчанка, Sjogren´s-синдром;
— другие: болезнь Бехчета, нейросаркоидоз.
4. Инфекционные васкулиты:
— грибковые: аспергиллезный, мукомикозный, кандидозный, кокцидиомикозный;
— бактериальные: менингококковый;
— вирусные: ВИЧ, varicella zoster;
— спирохетозы: сифилитический;
— риккетсиозы: болезнь кошачьей царапины, пятнистая лихорадка Скалистых гор;
— вызванные микобактерией туберкулеза;
— паразитарные: амебиаз.
Первичный ангиит центральной нервной системы — это редкая патология сосудов, затрагивающая мелкие и средние лептоменингеальные артерии, со средней заболеваемостью 1 случай на 2,4 миллиона человек в год. С момента первого описания Кравиото в 1959 г. состояние было признано одной из катастрофических причин повторного инсульта с неблагоприятным течением у молодых людей [67]. Это заболевание чаще встречается у мужчин в возрасте до 40 лет и поражает исключительно головной и спинной мозг. Неврологические проявления включают в себя хронические неспецифические головные боли, поведенческие аномалии, когнитивные дисфункции, припадки, менингеальные симптомы, мультифокальные неврологические дефициты и повторные инсульты [68, 69]. Серологическое клиническое обследование и анализ спинномозговой жидкости, как правило, без особенностей. Люмбальная пункция необходима, чтобы исключить заболевания другой инфекционной этиологии и другие системные проявления, которые могут имитировать ПАЦНС. Обнаруженные изменения неспецифичны, с легким плеоцитозом у 80–90 % пациентов, глюкоза и белок в норме.
Диагностические критерии включают в себя наличие необъяснимого неврологического дефицита, отсутствие системного васкулита и ангиографического или гистопатологического подтверждения артериального процесса [68, 69]. Результаты МРТ головного мозга неспецифичны: выявляются мультифокальные инфаркты различных сроков давности корковой и подкорковой локализации в обоих полушариях мозга (рис. 3). Ангиографические данные также неспецифичны, с низкой чувствительностью и спецификой не более 27 %. При соответствующих клинических проявлениях, обнаружении множественных подкорковых и корковых инфарктов на КТ и МРТ мозга вместе с наличием утолщения артериальной стенки предполагается диагноз ПАЦНС. Биопсия мозга с образцами лептоменингеальных артерий — золотой стандарт диагностики, но отрицательные результаты биопсии не исключают диагноз [70].
/90.jpg)
Дифференциальную диагностику проводят с многочисленными состояниями, являющимися причиной церебрального васкулита (отражены в классификации). Ранняя диагностика этиологии васкулита является ключевым моментом для выбора правильной тактики лечения с помощью кортикостероидов и/или цитостатических препаратов. Этим в большинстве случаев удается предотвратить серьезные последствия. При неадекватной терапии заболевание часто прогрессирует и имеет плохой прогноз.
К основным проявлениям амилоид-β-ассоци-ированного ангиита (A-β-АA) относятся рецидивирующие геморрагические и ишемические инсульты, эпилепсия и выраженные когнитивные нарушения. Гистологическая картина чаще всего включает гранулематозный ангиит с поражением сосудов среднего и малого калибра, разрывы стенок сосудов с кровоизлияниями, накопление β-амилоида в стенке сосудов в твердой и мягкой мозговых оболочках и веществе головного мозга. Отложение β-амилоида в сосудах может приводить к повышенной ломкости сосудов, что ведет к разрыву сосудов и внутримозговым гематомам [71]. Лобарные внутримозговые гематомы являются наиболее частыми проявлениями церебральной амилоидной ангиопатии, которая может сопровождаться воспалением сосудистой стенки. Это проявляется медленным снижением когнитивных функций, судорогами, головными болями и наличием гиперинтенсивных очагов в режиме T2 магнитно-резонансной томографии, которые отвечают на лечение иммуносупрессивными препаратами [72].
Болезнь моя-моя
БММ относится к хронической прогрессирующей сосудистой патологии головного мозга и характеризуется двусторонним стенозированием супраклиноидной части внутренних сонных артерий и начальных сегментов передней и средней мозговых артерий, с последующим вовлечением вертебробазилярного бассейна, сопровождающимся развитием базальной сети анастомозов. Ранее на страницах «Международного неврологического журнала» мы уже сообщали о собственных наблюдениях и современных представлениях о данном заболевании [73].
Заболевание чаще всего проявляется в возрасте от 10 до 30–40 лет, что делает данную патологию актуальной и значимой причиной функциональных нарушений у лиц молодого возраста. Клинически проявления БММ разнообразны и зависят от степени поражения магистральных сосудов, локализации, объема и характера очага поражения головного мозга. У детей возникают нарушения кровообращения головного мозга в виде инсультов и транзиторных ишемических атак. У взрослых пациентов наблюдаются ишемические инсульты и деменция.
Выводы
Причины инфаркта мозга у пациентов молодого возраста значительно отличаются от таковых у лиц старших возрастных групп и требуют комплексного клинико-лабораторного и инструментального обследования пациентов.
Высокий процент выявления по TOAST-критериям редких и неустановленных причин инфаркта мозга у лиц молодого возраста требует детального и более длительного обследования этой группы пациентов, включая тщательный сбор анамнеза (в т.ч. семейно-наследственного), проведение современного спектра диагностических мероприятий (преимущественно неинвазивных), направленных на выявление васкулопатий различной этиологии, патологии свертывающей системы крови, инфекционных агентов, генетической патологии с целью выявления редко встречаемых в рутинной практике нозологических форм.
Четкое понимание патогенетических механизмов, лежащих в основе инфарктов головного мозга у лиц молодого возраста, позволит более эффективно и дифференцированно подходить к лечению и профилактике заболевания у данной категории пациентов.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
Список литературы
1. Инсульт. Руководство для врачей. Под ред. Л.В. Стаховской, С.В. Котова. М.: ООО «Медицинское информационное агентство», 2018. 488 с.
2. Виберс Д., Фейгин В., Браун Р. Инсульт: клиническое руководство. М.: БИНОМ, 2005. 608 с.
3. Griffiths D., Sturm J. Epidemiology and Etiology of young stroke. Stroke research and treatment. 2011. Article ID 209370. 9 p.
4. Putaala J., Metso A.J., Metso T.M. et al. Analysis of 1008 consecutive patients aged 15 to 49 with first-ever ischemic stroke. The Helsinki young stroke registry. Stroke. 2009. Vol. 40 (4). P. 1195-1203.
5. Добрынина Л.А., Калашникова Л.А., Павлова Л.Н. Ишемический инсульт в молодом возрасте. Журн. неврологии и психиатрии. 2011. Vol. 111 (3). P. 4-8.
6. Калашникова Л.А., Чайковская Р.П., Добрынина Л.А. и др. Диссекция внутренней сонной артерии как причина тяжелого ишемического инсульта с летальным исходом. Журн. неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2015. № 115 (12). P. 19-25.
7. Барабанова Э.В., Барановский А.Е., Мисникова В.А. и др. Диагностика типов и причин инсультов в молодом возрасте (предварительные результаты популяционного исследования, клинические примеры, данные литературы). Ars. Medica. 2013. № 4. С. 6-12.
8. Пизова Н.В. Редкие причины инсульта в молодом возрасте. Медицинский алфавит. 2016. № 14. С. 41-46.
9. Евтушенко С.К., Лисовский Е.В., Евтушенко О.С. Дисплазия соединительной ткани в неврологии и педиатрии (клиника, диагностика, лечение): руководство для врачей. Донецк, 2009. 372 с.
10. Евтушенко С.К. От этиологии и подвидов инсультов у лиц молодого возраста — к их эффективному лечению и профилактике. News of medicine and pharmacy. 2010. Неврология (328), тематический номер. published online. http://www.mif-ua.com/archive/article/12857
11. Прилепская О.А., Дубровина О.А. Инсульт у лиц молодого возраста: все ли мы знаем? Университетская медицина Урала. 2016. № 1. С. 75-78.
12. Дубенко О.Е. Криптогенный инсульт. Международный неврологический журнал. 2016. № 2 (80). С. 90-94.
13. Adams H.P., Bendixen B.H., Kapelle J. et al. Classification of subtype of acute ischemic stroke. Definition for use in a multicentre clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment. Stroke. 2000. Vol. 247 (4). P. 35-41.
14. Kwon S.U., Kim J.S., Lee V.C. Ischemic Stroke in Korean young adult. Acta Neurol. Scand. 2000. Vol. 101. P. 19-24.
15. Yonemura K., Kimura K., Hasegawa Y. et al. Analysis ische-mic stroke in patients aged up to 50 years. Rinsho Shinkegaku. 2000. Vol. 40 (9). P. 881-889.
16. Varona J.F., Guerra J.M., Bermejo F. et al. Causes of ische-mic stroke in young adults, and evolution of the etiological diagnosis over the long term. Eur. Neurol. 2007. Vol. 57 (4). P. 212-218.
17. Rima M. Dafer. Secondary Prevention After Non-atherosclerotic Cerebral Vasculopathies. Springer International Publishing Switzerland. 2016. P. 169-187.
18. Калашникова Л.А., Добрынина Л.А. Диссекция артерий головного мозга: ишемический инсульт и другие клинические проявления. M.: ВАКО, 2013. 208 с.
19. Schievink W.I. Spontaneous dissection of the carotid and vertebral arteries. N. Engl. J. Med. 2001. Vol. 344 (12). P. 898-906.
20. Baumgartner R.W., Lienhardt B., Mosso M. et al. Spontaneous and endotelial-independent vasodilation are impaired in patients with spontaneous carotid dissection: a case-control study. Stroke. 2007. Vol. 38 (2). P. 405-406.
21. Schievink W.I., Bjornsson J., Piepgras D.G. Coexistence of fibromuscular dysplasia and cystic medial necrosis in a patients with Marfan's syndrome and bilateral carotid artery dissection. Stroke. 1994. Vol. 25 (12). P. 2492-2496.
22. Vila N., Millan M., Ferrer X., Riutort N., Escudero D. Levels of alpha 1-antitripsin in plasma and risk of spontaneous cervical artery dissection: a case-control study. Stroke. 2003. Vol. 34 (9). P. 168-169.
23. Volker W., Ringelstein E.B., Dittrich R. et al. Morphometric analysis of collagen fibrills in skin of patients with spontaneous cervical artery dissections. J. Neurol. Neurosurg. Psychiatry. 2008. Vol. 79 (9). P. 1007-1012.
24. Brandt T., Morsher M., Hausser I. Association of cervical artery dissection with connective tissue abnormalities in skin and arteries. Front. Neurol. Neurosci. 2005. Vol. 20. P. 16-29.
25. Schievink W.I., Atkinson J.L., Bartleson J.D., Whisnant J.P. Traumatic internal carotid artery dissections caused by blunt softball injuries. Am. J. Emerg. Med. 1998. Vol. 16 (2). P. 179-182.
26. Caso V., Paciaroni M., Bogousslavsky J. Enviromental factors and cervical artery dissection. Front. Neurol. Neurosci. 2005. Vol. 20. P. 44-53.
27. Smith W.S., Johnston S.C., Skalabrin E.J. et al. Spinal manipulative therapy is a independent risk factor for vertebral artery dissection. Neurology. 2003. Vol. 60 (9). P. 1424-1428.
28. Rubinstein S.M., Peerdeman S.M., van Tulder M.W. et al. A systematic review of the risk factors for cervical artery dissection. Stroke. 2005. Vol. 36 (7). P. 1575-1580.
29. Norris J.W., Beletsky V., Nadareishvili Z.G. Sudden neck movement and cervical artery dissection. CMAJ. 2000. Vol. 163. P. 38-40.
30. Schievink W.I., Wijdicks E.F.M., Kuiper J.D. Seasonal pattern of spontaneous cervical artery dissection. J. Neurosurg. 1998. Vol. 89. P. 101-103.
31. Guillon B., Berthet K., Benslamis L. et al. Infection and risk of spontaneous cervical artery dissection: a case-control study. Stroke. 2003. Vol. 34. P. 79-81.
32. Wang S., Le Y.Q., Chida J. et al. Mechanisms of matrix metalloproteinase-9 unregulation and tissue destruction in various organs in influenza A virus infection. J. Med. Invest. 2010. Vol. 57. P. 26-34.
33. Naggara O., Touzé E., Marsico R. High-resolution MR imaging of periarterial edema associated with biological inflammation in spontaneous carotid dissection. Eur. Radiol. 2009. Vol. 19 (9). P. 2255-2260.
34. Bhayani N., Ranade P., Clark N.M., McGuinn M. Vari-cella-Zoster virus and cerebral aneurysm: case report and review of the literature clinical infectious diseases. 2008. Vol. 47. P. 1-3.
35. Pezzini A., Del Z.E., Archetti S. et al. Plasma homocysteine concentration, C677T MTHFR genotype, and 844ins68bp genotype in young adults with spontaneous cervical artery dissection and atherotrombotic stroke. Stroke. 2002. Vol. 33 (3). P. 664-669.
36. Pezzini A., Caso V., Zanferreri C. et al. Arterial hypertension as risk factor for spontaneous cervical artery dissection. A case-control study. J. Neurol. Neurosurg. Psychiatry. 2006. Vol. 77 (1). P. 95-97.
37. Pezzini A., Granella F., Grassi M. et al. History of migraine and the risk of spontaneous cervical artery dissection. Cephalalgia. 2005. Vol. 25 (8). P. 575-580.
38. Барабанова Э.В., Капацевич С.В. Неврологические проявления спонтанной экстракраниальной диссекции внутренней сонной артерии: инфаркт мозга: учеб.-метод. пособие. Минск: БелМАПО, 2012. 20 с.
39. Добрынина Л.А. Ишемический инсульт в молодом возрасте: причины, клиника, диагностика, прогноз восстановления двигательных функций: Автореф. дис… д.м.н. М., 2013. 48 с.
40. Lichy C., Metso A., Pezzini A. et al. Predictors of delayed stroke in patients with cervical artery dissection. Int. J. Stroke. 2012. Vol. 11. P. 4949.
41. Pelkonen O., Tikkakoski T., Pyntinen J., Sotaniemi K. Cerebral CT and MRI findings in cervico-cephalic artery dissection. Acta. Radiol. 2004. Vol. 45 (3). P. 259-265.
42. Древаль М.В., Кротенкова М.В., Калашникова Л.А. Современные возможности визуализации спонтанной диссекции экстракраниальных отделов внутренних сонных и позвоночных артерий. Медицинская визуализация. 2012. № 3. С. 59-69.
43. Bachmann R., Nassenstein I., Kooijman H. et al. Spontaneous acute dissection of the internal carotid artery: high-resolution magnetic resonance imaging at 3.0 tesla with a dedicated surface coil. Invest. Radiol. 2006. Vol. 41. P. 105-111.
44. Sturzenegger M. Spontaneous internal carotid artery dissection: early diagnosis and management in 44 patients. J. Neurol. 1995. Vol. 242. P. 231-238.
45. De Bray J.M., Lhoste P., Dubas F. et al. Ultrasonic features of extracranial carotid dissections: 47 cases studied by angiography. J. Ultrasound Med. 1994. Vol. 13. P. 659-664.
46. Menon R., Kerry S., Norris J.W., Markus H.S. Treatment of cervical artery dissection: a systematic review and meta-analysis. J. Neurol. Neurosurg. Psychiatr. 2008. Vol. 79 (10). P. 1122-1127.
47. Kennedy F., Lanfranconi S., Hichs C. et al. Antiplatelets vs. anticoagulation for dissection: CADISS nonrandomized arm and meta-analysis. Neurology. 2012. Vol. 79 (7). P. 686-689.
48. Antiplatelet treatment compared with anticoagulation treatment for Cervical Artery Dissection in Stroke Study (CADISS): a randomized trial. Lancet Neurol. 2015, published online Feb.12. http://dx.doi.org/10.1016/S1474-4422 (15)70018-9.
49. Kernan W.N., Ovbiagele B., BlackH. R. et al. American Heart Association Stroke Council, Council on Cardiovascular and Stroke Nursing, Council on Clinical Cardiology and Council on Peripheral Vascular Disease. Guidelines for the prevention of stroke in patients with stroke or transient ischemic attack: a guidelines for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2014. Vol. 45 (7). P. 2160-2236.
50. Derex L., Nighoghossian N., Turjman F. et al. Intravenous t-PA in acute ischemic stroke related to internal carotid artery dissection. Neurology. 2000. Vol. 54 (11). P. 2159-2161.
51. Georgiadis D., Lanczik O., Schwab S. et al. IV thrombolysis in patients with acute ischemic stroke due to spontaneous carotid dissection. Neurology. 2005. Vol. 64 (9). P. 1612-1614.
52. Engelter S.T., Dallongeville J., Kloss M. et al. Thrombolysis in cervical artery dissection — data from the Cervical Artery Dissection and Ischemic Stroke Patients (CADISP) database. Eur. J. Neurol. 2012. Vol. 19 (9). P. 1199-1206.
53. Барабанова Э.В., Пономарев В.В., Кузьменко С.Г. и др. Лечение и прогноз при диссекции брахиоцефальных артерий. Лечебное дело. 2015. № 4 (44). С. 31-35.
54. Lyrer P., Engelter S. Antitrombotic drugs for carotid artery dissection. Cochrane Database Syst. Rev. 2003. Vol. 3: CD000255.
55. Edwards N.M., Fabian T.C., Claridge J.A. et al. Antithrombotic therapy and endovascular stents are effective treatment for blunt carotid injuries: results from long-term follow-up. J. Am. Coll. Surg. 2007. Vol. 204 (5). P. 1007-1013.
56. Chiche L., Praquin B., Koskas F., Kieffer E. Spontaneous dissection of the extracranial vertebral artery: indications and long-term outcome of surgical treatment. Ann. Vasc. Surg. 2005. Vol. 19 (1). P. 5-10.
57. Touze E., Gauvrit J.Y., Moulin T. et al. Risk of stroke and recurrent dissection after a cervical artery dissection: a multicenter study. Neurology. 2003. Vol. 61 (10). P. 1347-1351.
58. Slovut D.P., Olin J.W. Fibromuscular dysplasia. N. Engl. J. Med. 2004. Vol. 350 (18). P. 1862-1871.
59. Rushton A.R. The genetic of fibromuscular dysplasia. Arch. Intern. Med. 1980. Vol. 140 (2). P. 233-234.
60. Olin J.W., Gornik H.L., Bacharach J.M. et al. Fibromuscular dysplasia: state of the science and critical unanswered questions: a scientific statement from the American heart association. Circulation. 2014. Vol. 129 (9). P. 1048-1078.
61. Hudgins L.B., Limbacher J.P. Fibromuscular dysplasia in Alport's syndrome. J. Tenn. Med. Assoc. 1982. Vol. 75 (11). P. 733-735.
62. Schievink W.I., LimburgM. Angiographic abnormalities mimicking fibromuskular dysplasia in a patient with Ehlers-Danlos syndrome, type IV. Neurosurgery. 1989. Vol. 25 (3). P. 482-483.
63. Persu A., Touze E., Mousseaux E. et al. Diagnosis and ma-nagement of fibromuscular dysplasia: an expert consensus. Eur. J. Clin. Invest. 2012. Vol. 42 (3). P. 338-347.
64. Насонов Е.Л., Баранов А.А., Шилкина Н.П. Васкулиты и васкулопатии. Верхняя Волга, 1999. 616 с.
65. Селезнева C.В. Церебральные васкулопатии (васкулиты): особенности клиники, диагностика, принципы лечения. Неврология, психиатрия, психотерапия. 2017. № 3 (42). С. 42-43.
66. Евтушенко С.К., Ефименко О.М. Прояви ураження нервовоï системи у ВIЛ-iнфiкованих та стратегiя подальшого спостережения. Мiжнародний неврологiчний журнал. 2015. № 4. С. 20-28.
67. Cravioto H., Feigin I. Noninfectious granulomatous angiitis with a predilection for the nervous system. Neurology. 1959. Vol. 9. P. 599-609.
68. Salvarani C., Broen Jr. R.D., Hunter G.G. Adult primary central nervous system vasculitis. Lancet. 2012. Vol. 380 (9843). P. 767-777.
69. Hajj-Ali R.A., Calabrese L.H. Primary angiitis of the central nervous system. Autoimmun. Rey. 2013. Vol. 12 (4). P. 463-466.
70. Salvarani C., Hunder G.G., Morris J.M., et al. Ab-related angiitis: Comparison with CAA without inflammation and primary CNS vasculitis. Neurology. 2013. Vol. 81. P. 1596-603.
71. Greenberg S. Cerebral amyloid angiopathy: prospects for clinical diagnosis and treatment. Neurology. 1998. Vol. 51. P. 690-94.
72. Salvarani C., Brown R.D. Jr, Calamia K.T. et al. Primary central nervous system vasculitis: comparison of patients with and without cerebral amyloid angiopathy. Rheumatology. 2008. Vol. 47. P. 1671-1677.
73. Кузьменко С.Г., Пономарев В.В., Римашевский В.Б., Деркачева Н.В. Клинико-нейровизуализационные сопоставления при болезни моя-моя. Международный неврологический журнал. 2017. № 5 (91). C. 130-135.
/87.jpg)

/88.jpg)
/90.jpg)