Синдром задней обратимой энцефалопатии (posterior reversible encephalopathy syndrome — PRES) — это клинико-радиологический синдром, характеризующийся острым потенциально обратимым вазогенным отеком субкортикального белого вещества головного мозга, преимущественно захватывающим затылочные и теменные доли [18, 25, 32]. Патологический процесс также может распространяться на височные и лобные доли, базальные ганглии, ствол мозга и мозжечок [18]. Иногда наряду с белым поражается и прилежащее серое вещество [25]. Преимущественное вовлечение задних отделов головного мозга объясняется тем, что симпатическая иннервация сосудов вертебробазилярного бассейна представлена менее выраженно, чем в каротидном бассейне. Физиологический адренергический дефицит в данной области делает ее более чувствительной к резким подъемам артериального давления (АД) и приводит к потере вазоконстрикторных свойств в ответ на действие повреждающего фактора [14, 45].
Впервые PRES был описан Hinchey et al. в 1996 году [20]. Данное состояние было известно ранее под различными названиями (синдром обратимой задней лейкоэнцефалопатии; синдром обратимого заднего отека мозга; обратимая затылочно-теменная энцефалопатия), в настоящее время PRES является общепринятым термином [7].
Общая распространенность PRES неизвестна. Сообщалось о развитии PRES у пациентов в возрасте от 4 до 90 лет, большинство случаев наблюдается у людей среднего возраста; среди пациентов заметно преобладают женщины [25, 27].
При адекватной терапии в 85–90 % случаев можно добиться обратного развития [14]. Задержка в диагностике и лечении может привести к необратимому повреждению пострадавших тканей мозга с летальным исходом в 10–15 % случаев [11, 25].
Состояния, ассоциированные с риском возникновения PRES [7, 17, 32]:
— хроническая артериальная гипертензия;
— преэклампсия/эклампсия;
— аутоиммунные болезни (системная красная волчанка, системная склеродермия, гранулематоз Вегенера и др.);
— высокие дозы цитостатических препаратов (химиотерапия);
— сепсис;
— трансплантация органов;
— хронические заболевания почек (хроническая болезнь почек).
Патогенетические механизмы, лежащие в основе развития синдрома задней обратимой энцефалопатии, в настоящее время изучены недостаточно. На данный момент существует две основные теории возникновения данного синдрома: 1) теория, связанная с ауторегуляцией мозгового кровообращения; 2) развитие синдрома эндотелиальной дисфункции с повышением проницаемости церебральных сосудов.
Теория, связанная с ауторегуляцией мозгового кровообращения. Ауторегуляция мозгового кровотока — это способность церебральной сосудистой сети поддерживать адекватный мозговой кровоток и удовлетворять потребности головного мозга в кислороде, несмотря на изменения среднего артериального давления, путем констрикции или дилатации мозговых сосудов. Если среднее АД резко возрастает, то резистентные сосуды (мелкие артерии и артериолы) сужаются и защищают головной мозг от перегрузки. При снижении среднего АД резистентные сосуды расширяются и кровоснабжение улучшается (миогенный механизм ауторегуляции церебрального кровообращения).
В основе данных механизмов лежит выделение эндотелием церебральных сосудов факторов вазоконстрикции (тромбоксан A2, эндотелин) и факторов релаксации (эндотелий-релаксирующий фактор — NO). В норме нижний предел ауторегуляции для среднего артериального давления составляет 60 мм рт.ст., верхний — 160 мм рт.ст. Нижний предел ауторегуляции — уровень среднего артериального давления, ниже которого скорость мозгового кровотока становится меньше оптимального значения. Верхний предел ауторегуляции — уровень среднего артериального давления, при превышении которого скорость мозгового кровотока начинает возрастать [19, 46, 47].
Теория, связанная с ауторегуляцией мозгового кровообращения, включает в себя два патогенетических пути образования синдрома задней обратимой энцефалопатии: 1) концепция вазоконстрикции/гипоперфузии (более ранняя); 2) концепция гипертензии/гиперперфузии.
1. Концепция вазоконстрикции/гипоперфузии. При повышении артериального давления (среднее АД в пределах нормы, срыва ауторегуляции не возникает) срабатывает механизм миогенной регуляции церебрального кровотока, возникает компенсаторное сужение мелких церебральных артерий и артериол, которое приводит к снижению мозговой перфузии, ишемии и вазогенному отеку.
Основания для существования данной концепции были продемонстрированы при проведении компьютерной томографии (КТ) головного мозга у пациентов с хронической артериальной гипертензией. На снимках КТ у данных пациентов были отмечены признаки вазоспазма церебральных сосудов и участки гипоперфузии, особенно теменных и затылочных областей [9, 15].
2. Концепция гипертензии/гиперперфузии. Умеренная и тяжелая артериальная гипертензия встречается в 50–70 % случаев возникновения PRES синдрома [22, 34].
При повышении среднего АД выше верхнего предела миогенной ауторегуляции (> 160 мм рт.ст.) происходит «поломка» механизма регуляции мозгового кровообращения. Церебральные сосуды не сужаются — возникает гиперперфузия головного мозга, что ведет к увеличению давления сдвига, оказываемого текущей кровью на эндотелиальные клетки (эффект Шретценмайера), активизации эндотелиальной NO-синтазы и синтезу эндотелиоцитами монооксида азота (NO) [5, 42]. Образовавшийся NO диффундирует через мембраны клеток эндотелия и поступает в прилежащие гладкомышечные клетки сосудов, где происходит активация гуанилатциклазы, которая катализирует превращение гуанозинтрифосфата (ГТФ) в циклический гуанозинмонофосфат (цГМФ), и повышение ее внутриклеточной концентрации. Циклический ГМФ активирует протеинкиназу G, которая снижает уровень ионов кальция в цитозоле (обеспечивает его перекачивание в саркоплазматический ретикулум), вызывает дефосфорилирование легких цепей миозина и стимулирует вазорелаксацию. Вследствие вазодилатации возникает гиперперфузия, гипоксия, ишемия и вазогенный отек [42, 43]. Клетки как белого, так и серого вещества поражаются, но отек более выражен в астроцитах, чем в нейронах [44]. Ишемия ведет к дефициту АТФ, поломке АТФ-зависимых Na+/K+-каналов; диффузии внеклеточной жидкости по осмотическому градиенту во внутриклеточный сектор; возниковению перегрузки кальцием и активации кальцийзависимых протеаз (катепсин B, кальпаин, сериновые протеазы, нуклеазы, фосфолипазы), что приводит к некрозу и апоптозу [36].
Высокий уровень экстракции кислорода достигается при низком объемном кровотоке, а при повышенной объемной скорости кровотока экстракция кислорода из крови становится все более неэффективной [30]. Считается, что именно снижение экстракции кислорода при высоких значениях потока крови является главной причиной развития ишемии [9]. При сохранении механизмов церебральной ауторегуляции увеличение церебрального кровотока на 250 % приводит к увеличению напряжения кислорода в мозговой ткани лишь на 50 % — так реализуется феномен физиологической церебральной гиперемии [30]. При дальнейшем нарастании объемного кровотока происходит постепенное уменьшение величины фракции экстракции кислорода и, соответственно, снижение церебрального метаболического уровня кислорода [21].
В условиях гипоксии ткани выделяют факторы, индуцируемые гипоксией (Hypoxia-inducible factors (HIFs)). Фактор HIF1α активирует несколько генов, которые способствуют выживанию в условиях низкой концентрации кислорода. К ним относятся гликолизные ферменты, которые позволяют синтезировать АТФ независимым от кислорода образом и эндотелиальный фактор роста [13, 33].
Фактор роста эндотелия (vascular endothelial growth factor (VEGF)) — сигнальный белок, вырабатываемый клетками для стимуляции ангиогенеза. Также под действием эндотелиального фактора роста происходит повышение сосудистой проницаемости. Его эффекты связаны с активацией тирозинкиназы на поверхности эндотелиоцита. Белки VEGF служат частью системы, отвечающей за восстановление подачи кислорода к тканям в ситуации, когда циркуляция крови недостаточна [13, 33].
Синдром эндотелиальной дисфункции с повышением проницаемости церебральных сосудов
Согласно альтернативной теории развития, PRES является результатом системного воспалительного состояния, вызывающего эндотелиальную дисфункцию. Данная теория подтверждается тем, что PRES часто ассоциируется с системным воспалительным процессом, таким как сепсис, эклампсия, трансплантация органов и аутоиммунные заболевания. Ангиографическое исследование при PRES демонстрирует обратимые очаговые и диффузные нарушения, которые отражают эндотелиальную дисфункцию [5].
Гистопатологические изменения головного мозга при синдроме задней обратимой энцефалопатии
При аутопсии умерших пациентов обнаруживаются признаки вазогенного отека мозга; наличие активированных/реактированных астроцитов, рассеянных макрофагов и лимфоцитов, часто без признаков воспаления, ишемии или нейронального повреждения. Более поздние исследования продемонстрировали доказательства демиелинизации вместе с признаками ишемии, нейронального аноксического повреждения и некроза в белом веществе и коре [7]. Также описывается наличие острого или хронического повреждения церебральных сосудов: истончение и микронадрывы интимы; сегментарное сужение и наличие организованных тромбов [24].
Клинические проявления
Клинические симптомы PRES включают:
— Нарушение сознания (частота встречаемости составляет 13–90 %), тяжесть которого варьирует от оглушения до комы [11, 34].
— Судорожные приступы (в 92 % случаев). По характеристике судорожные приступы — редко изолированные (23–28 %), в основном генерализированные [25]. Возникновение судорожного статуса описывается в 3–13 % случаев [25, 34].
— Нарушение зрения (в 26–67 % случаев) [6, 20]. Расстройства зрения разнообразны: затуманенное зрение (сетка, пелена перед глазами) — 7–18 %; нечеткое зрение (расплывчатость образов) — 4–27 %; гемианопсия — 4–20 %, зрительные галлюцинации — 3–5 % и кортикальная слепота — 8–33 % [11, 20, 25].
— Головная боль, тошнота/рвота (26–53 %) [6, 20].
— Фокальный неврологический дефицит (может отсутствовать или присутствовать в 3–17 % случаев) [11, 25].
Клинические симптомы могут развиваться и прогрессировать на протяжении нескольких дней или быть молниеносными [7].
Диагностические критерии PRES [1]:
— наличие неврологических симптомов (судорожные приступы, нарушение сознания, фокальный неврологический дефицит, общемозговые симптомы (головная боль, нарушение зрения, тошнота/рвота));
— наличие факторов риска развития данного синдрома;
— отсутствие других возможных причин развития энцефалопатии;
— обратимость повреждения, полное разрешение изменений ЦНС при своевременном и адекватном лечении.
Радиологические изменения, характерные для PRES
До недавнего времени считалось, что патогномоничным является билатеральный симметричный отек белого вещества головного мозга с избирательной локализацией в затылочной и теменной областях. Согласно последним литературным данным выделяют 4 радиологических варианта PRES (рис. 1), режим с подавлением сигнала свободной воды (Fluid-attenuated inversion recovery — FLAIR) [6]:
1. Гологемисферическая модель (23 %, рис. 1a). Вовлечение в зону отека лобной, теменной и затылочной доли, реже височной доли головного мозга. Данная топография соответствует зоне бассейна между передней и задней церебральной артерией и средней церебральной артерии.
2. Модель верхней лобной борозды (27 %, рис. 1б). Пятнистый отек преобладает в лобных долях вдоль верхних лобных борозд. Теменные и затылочные доли поражаются вариабельно.
3. Доминантная теменно-затылочная модель (22 %, рис. 1в). В этой модели, которая ранее считалась типичной для PRES, преимущественно поражена задняя часть теменных и затылочные доли.
4. Частичное или асимметричное выражение основных моделей (28 %, рис. 1г). Частичная форма определяется как отсутствие двустороннего отека в теменных или затылочных долях. Часто вовлечены лобные доли.
Компьютерная томография (КТ) позволяет диагностировать данный синдром в 65 % случаев. Результаты КТ часто нормальные или неспецифические. Наличие областей снижения плотности мозгового вещества дает возможность заподозрить PRES (рис. 2) [6].
Магнитно-резонансная томография (МРТ) головного мозга является ключевым исследованием для диагностики PRES. Изображения с протонной плотностью и T2-взвешенные изображения показывают области высокого сигнала, указывающие на отек. Режим с подавлением сигнала свободной воды также визуализирует поражения. Использование FLAIR было разработано для улучшения диагностики и выявления подкорковых и корковых поражений. T1-взвешенные изображения показывают очаги низкой интенсивности [6, 12].
Возможные осложнения PRES
Хотя процесс обычно обратим, в ряде случаев, особенно при несвоевременном и/или неадекватном лечении, состояние больного может ухудшаться вплоть до возникновения необратимых изменений в головном мозге и даже лейкомаляции [4].
Ишемический инсульт головного мозга (10–23 %). В основе данного осложнения лежит вазоконстрикция сосудов головного мозга и запуск ишемического каскада повреждения, что определяется наличием как минимум 2 сужений на один сосуд в двух разных мозговых артериях при магнитно-резонансной ангиографии мозга или при обычной ангиографии [16].
Внутримозговые кровоизлияния (15 %). Другим потенциальным осложнением при синдроме задней обратимой энцефалопатии, особенно у пациентов с коагулопатиями, являются внутримозговые кровоизлияния (по типу гематомы или геморрагического пропитывания очагов отека, реже — субарахноидального кровоизлияния) [3].
Сообщалось о статистически значимой связи между тяжестью отека мозга (режим МРТ — FLAIR) и риском кровотечения [28].
Механизм: окислительный стресс (как результат гипоксемии) с избытком продукции активных форм кислорода, которые вызывают окислительное повреждение липидных мембран гематоэнцефалического барьера, что приводит к формированию синдрома капиллярной утечки в ишемических очагах или разрыву [44]. Адгезия активированных лейкоцитов к эндотелию сосудов ведет к протеолизу катенина, компонента соединения клеток эндотелия. Протеолиз компонентов эндотелия сосудов матриксными металлопротеиназами и протеазами, которые секретируются активированными лейкоцитами, может вызвать кровотечение после реперфузионного повреждения. В результате повреждения эндотелия сосудов возникает отек и кровотечение [2].
Вклинение головного мозга. Отек мозга с преимущественной локализацией в задних отделах, с вовлечением мозжечка и ствола мозга может вызывать центральное транстенториальное вклинение головного мозга [8].
Дифференциальная диагностика
Неспецифические клинические проявления и множественность рентгенологических моделей могут создавать диагностические проблемы. Многие состояния могут напоминать PRES, в том числе: инфекционный энцефалит/менингит, острый диссеминированный энцефаломиелит, васкулиты, тромбоз венозного синуса головного мозга, ишемический инсульт и другие.
При проведении дифференциальной диагностики нужно взвесить все данные анамнеза, клинического, лабораторного и инструментального обследования пациента: наличие/отсутствие предрасполагающих факторов; характер развития; признаки инфекционного процесса (температура тела, лейкоцитоз, анализ ликвора и др.); менингеальные знаки; симптомы органического повреждения головного мозга; результаты МРТ, электроэнцефалографии.
Рекомендации по лечению
— Ранняя диагностика и идентификация причины PRES.
— Лечение в условиях отделения интенсивной терапии.
— Консультация невролога.
— Ограничение введения жидкости (согласно потерям).
— Раннее энтеральное питание.
— При судорожном приступе:
- Магния сульфат 4 г в/в болюсно, инфузия 1–3 г/час (под контролем сухожильных рефлексов, диуреза, частоты дыхательных движений (ЧДД) и концентрации магния в плазме крови); диазепам, тиопентал натрия [26, 37].
- Витамин В6 (пиридоксин) 200–400 мг/сут в/в. Активная форма витамина пиридоксаль-5-фосфат в качестве кофактора входит в состав более 100 ферментов, участвующих в азотистом, энергетическом, углеводном обмене и синтезе биогенных аминов (дофамин, серотонин, гамма-аминомасляная кислота (ГАМК), норадреналин, таурин и другие). ГАМК — основной тормозной медиатор в ЦНС; таурин — нейромодулятор, ингибирующий гиперактивность NMDA глутаматергических рецепторов [40].
- Контроль глюкозы крови.
— Дегидратационная терапия: маннитол 0,5–1 г/кг в/в (30 мин), повторно 0,25–0,5 г/кг (каждые 6 ч). Максимальная суточная доза 140–180 г. Контроль диуреза, ЦВД и осмолярности плазмы крови перед каждым введением. С целью профилактики феномена «рикошета» (утечка маннитола через поврежденный гематоэнцефалический барьер) после каждого введения — фуросемид 10–20 мг в/в [23, 29, 38].
— Глюкокортикоидная терапия: дексаметазон 8 мг в/в, повторно 4 мг каждые 6 ч в/в. Кортикостероиды уменьшают проницаемость гематоэнцефалического барьера. Дексаметазон — препарат выбора из-за минимального минералокортикоидного и высокого противовоспалительного эффекта [32, 35].
— Антигипертензивная терапия: целью терапии является уменьшение среднего АД на 20–25 % в течение первых 2 часов, далее достижение артериального давления 160/100 мм рт.ст. и ниже в течение первых 6 часов. Более быстрое снижение артериального давления не рекомендуется, так как это может усугубить изменения мозгового перфузионного давления и способствовать ишемии. Препараты выбора: блокаторы бета-адренорецепторов (лабеталол, бисопролол, метапролол), нифедипин, урапидил, клофелин [10, 31, 41].
Клинические случаи
В феврале — марте 2018 года в нашем центре находились на лечении 2 пациентки с синдромом задней обратимой энцефалопатии.
Родильница (1978 г. р.) была переведена в Киевский областной центр охраны здоровья матери и ребенка (КОЦОЗМиР) из родильного дома Киевской области.
Диагноз: послеродовый, послеоперационный период. Эклампсия; тяжелая преэклампсия; анемия легкой степени; миопия легкой степени обоих глаз.
Status objectivus: сознание — 14 баллов (по шкале комы Глазго). Жалобы: на общую слабость, дискомфортные ощущения в области послеоперационной раны, головную боль, тошноту, пелену перед глазами.
Кожа и видимые слизистые оболочки — бледно-розовые, чистые. Анасарка. Т тела — 36,7 °С. ЧДД — 18/мин.; SpO2 — 98 %; FiO2 — 0,21. В легких — везикулярное дыхание, хрипы отсутствуют. Тоны сердца приглушенные, ритмичные. АД 150/100 мм рт.ст. (d = s); PS — 88 уд/мин. Живот обычной формы, мягкий, чувствительный в области послеоперационной раны. Перистальтика вялая, газы не отходят. Матка плотная, на 2 поперечных пальца ниже пупка. Лохии кровянистые, умеренные. Мочеотделение — по катетеру; моча светлая.
Параклинически: ОАК (эритроциты — 3,3 • 1012/л; Hb — 98 г/л; триглицериды — 200 • 109/л; лейкоциты — 12 • 109/л; палочкоядерные нейтрофилы — 6 %). Биохимический анализ крови — без особенностей. ОАМ (протеинурия — 3,3 г/л).
Осмотр невролога: менингеальные знаки отрицательные. Глазные щели D = S. Зрачки D = S. Фотореакции средней живости D = S. Корнеальные рефлексы D = S. Нистагма, диплопии нет. Лицо симметричное. Язык по средней линии. Глоточные рефлексы сохранены. Фонация достаточная. Сухожильные рефлексы с рук, ног несколько оживлены. Мышечный тонус удовлетворительный. Брюшные рефлексы не вызываются. Патологические стопные рефлексы не вызываются. Координаторные пробы выполняет удовлетворительно. Речь не нарушена.
Осмотр офтальмолога: ангиопатия сосудов сетчатки, застойные явления на глазном дне.
Осмотр терапевта: эклампсия; тяжелая преэклампсия.
Данные ЭЭГ: повышение пароксизмальной активности на фоне дисфункции срединно-стволовых структур головного мозга.
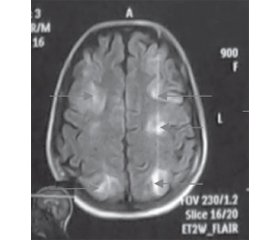
Данные МРТ-исследования при поступлении в отделение интенсивной терапии КОЦОЗМиР и переводе из отделения анестезиологии и интенсивной терапии (ОАИТ) приведены на рис. 3, 4 соответственно.
УЗИ органов брюшной полости, почек: признаки мочесолевого диатеза.
Лечение проводилось согласно приведенным выше рекомендациям. К лечению были добавлены: 1) антибактериальная терапия (цефтриаксон 2 г/сутки); 2) утеротоническая терапия (окситоцин 10 ЕД/сутки); 3) профилактика стрессовых язв ЖКТ (пантопразол); 4) п/о анальгезия (парацетамол, декскетопрофен, налбуфин).
После лечения обе пациентки в удовлетворительном состоянии были переведены в послеродовое отделение и через некоторое время выписаны из центра.
Выводы
В данной статье освещаются последние достижения в диагностике, патофизиологическом понимании и лечении PRES, приводится случай удачного лечения данного осложнения.
Клинические проявления синдрома задней обратимой энцефалопатии остаются неспецифичными, для большинства пациентов характерна комбинация симптомов. МРТ имеет решающее значение для диагностики PRES, оценки эффективности лечения, дифференциальной диагностики и идентификации осложнений. Патогенез задней обратимой энцефалопатии остается спорным и до конца не изученным. Список состояний, связанных с риском развития PRES, постоянно увеличивается.
Ранняя диагностика, устранение основной этиологической причины и адекватное лечение являются ключевыми элементами обратимости PRES.
Необходимы дальнейшие исследования для: генерации стратегии ранней диагностики; выявления факторов, имеющих неблагоприятное прогностическое значение; разработки нейропротективных стратегий профилактики развития и лечения PRES.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
/95.jpg)

/94.jpg)
/96.jpg)