Журнал «Медицина неотложных состояний» Том 16, №3, 2020
Вернуться к номеру
Делірій у хворих на гострий інсульт: особливості діагностики й лікування
Авторы: Галушко О.А., Тріщинська М.А., Заграничний Т.С.
Національна медична академія післядипломної освіти імені П.Л. Шупика, м. Київ, Україна
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
Делірій — це тяжкий, багатофакторний психоневрологічний розлад, який спричинюють деякі речовини, а також фактори та медіатори, що руйнують нейрони кори головного мозку. Частота делірію, за різними даними, коливається від 10 до 87 %. Делірій частіше розвивається після внутрішньомозкового крововиливу, великого за об’ємом гострого ішемічного інсульту та інсульту лівобічної локалізації. Причини розвитку делірію після інсульту недостатньо досліджені. Не існує єдиної думки щодо найкращого інструмента скринінгу, який слід використовувати для виявлення марення в умовах після інсульту. Немає даних про кращі втручання для профілактики та лікування гострого делірію після інсульту. У статті проведено аналіз літературних даних щодо діагностики та лікування гострого ішемічного інсульту, ускладненого делірієм. Висвітлені основні діагностичні методи для верифікації даної нозології у пацієнтів з гострим ішемічним інсультом та сучасні підходи до проведення інтенсивної терапії.
Делирий — это тяжелое, многофакторное психоневрологическое расстройство, которое вызывают некоторые вещества, а также факторы и медиаторы, которые разрушают нейроны коры головного мозга. Частота делирия, по разным данным, колеблется от 10 до 87 %. Делирий чаще развивается после внутримозгового кровоизлияния, большого по объему острого ишемического инсульта и инсульта левосторонней локализации. Причины развития делирия после инсульта недостаточно исследованы. Не существует единого мнения относительно лучшего инструмента скрининга, который следует использовать для выявления делирия в условиях после инсульта. Нет данных о лучших вмешательствах как для профилактики, так и для лечения делирия после инсульта. В статье проведен анализ литературных данных по диагностике и лечению острого ишемического инсульта, осложненного делирием. Освещены основные диагностические методы для верификации данной нозологии у пациентов с острым ишемическим инсультом и подходы к проведению интенсивной терапии.
Delirium is a severe, multifactorial neuropsychiatric disorder caused by certain substances as well as by the factors and mediators that destroy neurons of the cerebral cortex. The data on the frequency of delirium range from 10 to 87 %. Delirium develops more often after cerebral haemorrhage, large volume of acute ischemic stroke and left-sided stroke. The causes of delirium after stroke are poorly understood. There is no consensus on the best screening tool to use to detect post-stroke delusions. There are no data on the best interventions for the prevention and treatment of acute delirium after stroke. The article analyses the literature on the diagnosis and treatment of acute ischemic stroke complicated by delirium. The main diagnostic methods for the verification of this nosology in acute ischemic stroke patients and modern approaches to intensive care are highlighted.
гострий ішемічний інсульт; ускладнення; делірій; діагностика; лікування
острый ишемический инсульт; осложнения; делирий; диагностика; лечение
acute ischemic stroke; complications; delirium; diagnosis; treatment
Вступ
Матеріали та методи
Результати та обговорення
/20.jpg)
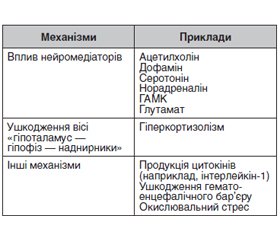
Фактори ризику розвитку делірію після інсульту
Діагностика делірію після інсульту
Лікування делірію у пацієнтів після гострого інсульту
Висновки
- Українсько-латинсько-англійський медичний енциклопедичний словник. Укл.: Л.І. Петрук, І.М. Головко. К.: ВСВ «Медицина», 2015. 968 с.
- Ely E.W., Shintani A., Truman B., Speroff T., Gordon S.M., Harrell F.E. Jr, Inouye S.K., Bernard G.R., Dittus R.S. Delirium as a predictor of mortality in mechanically ventilated patients in the intensive care unit. JAMA. 2004 Apr 14. 291(14). 1753-62.
- Barr J., Fraser G.L., Puntillo K., Ely E.W., Gélinas C., Dasta J.F., Davidson J.E., Devlin J.W., Kress J.P., Joffe A.M., Coursin D.B., Herr D.L., Tung A., Robinson B.R., Fontaine D.K., Ramsay M.A., Riker R.R., Sessler C.N., Pun B., Skrobik Y., Jaeschke R. American College of Critical Care Medicine. Clinical practice guidelines for the management of pain, agitation, and delirium in adult patients in the intensive care unit. Crit. Care Med. 2013 Jan. 41(1). 263-306.
- Ely Ew., Margolin R., Francis J. et al. Evaluation of delirium in critically ill patients: Evaluation of delirium in critically ill patients: validation of the Confusion Assessment Method for the Intensive Care Unit (CAM-ICU). Crit. Care Med. 2001 Jul. 29(7). 1370-9.
- Mansutti I., Saiani L., Palese A. Detecting delirium in patients with acute stroke: a systematic review of test accuracy. BMC Neurology. 2019. 19. 310.
- Mansutti I., Saiani L., Palese A. Delirium in patients with ischaemic and haemorrhagic stroke: findings from a scoping review. Eur. J. Cardiovasc. Nurs. 2019 Aug. 18(6). 435-448. doi: 10.1177/1474515119846226.
- McManus J., Pathansali R., Stewart R., Macdonald A., Jackson S. Delirium post-stroke. Age Ageing. 2007 Nov. 36(6). 613-8.
- Potter J., George J. Guideline Development Group. The prevention, diagnosis and management of delirium in older people: concise guidelines. Clin. Med. (Lond.). 2006 May-Jun. 6(3). 303-8.
- Ferro J.M., Caeiro L., Verdelho A. Delirium in acute stroke. Curr. Opin. Neurol. 2002. 15. 51-55.
- White S. The neuropathogenesis of delirium. Rev. Clin. Gerontol. 2002. 12. 62-7.
- Trzepacz P.T. Is there a common neural pathway in delirium? Focus on acetylcholine and dopamine. Semin. Clin. Neuropsychiatry. 2000. 5. 132-48.
- Lindsesay J., Rockwood K., Macdonald A. Delirium in Old Age, Chapter 4. Oxford: Oxford University Press, 2002.
- Han L., McCusker J., Cole M. et al. Use of medications with anticholinergic effect predicts clinical severity of delirium symptoms in older medical inpatients. Arch. Intern. Med. 2001. 161. 1099-55.
- Sanford A.M. Lewy Body Dementia. Clin. Geriatr. Med. 2018 Nov. 34(4). 603-615. doi: 10.1016/j.cger.2018.06.007.
- Kaufer D.I., Catt K.E., Lopez O.L. et al. Dementia with Lewy bodies: response of delirium-like features to donepezil. Neurology. 1998. 51. 1512-13.
- Flacker M.L., Cummings V., Mach J.R. Jr et al. The association of low serum anticholinergic activity with delirium in elderly medical inpatients. Am. J. Psychiatry. 1998. 6. 31-41.
- Itil T., Fink M. Anticholinergic drug-induced delirium: experimental modification, quantitative EEG and behavioural correlations. J. Nerv. Ment. Dis. 1966. 143. 492-507.
- Ramírez-Bermúdez J., Perez-Neri I., Montes S., Nente F., Ramirez-Abascal M., Carrillo-Mezo R. et al. Dopaminergic Hyperactivity in Neurological Patients with Delirium. Arch. Med. Res. 2020 Feb 1. 50(8). 477-483. doi: 10.1016/j.arcmed.2019.11.002.
- Neufeld K.J., Yue J., Robinson T.N., Inouye S.K., Needham D.M. Antipsychotic Medication for Prevention and Treatment of Delirium in Hospitalized Adults: A Systematic Review and Meta-Analysis. J. Am. Geriatr. Soc. 2016 Apr. 64(4). 705-14. doi: 10.1111/jgs.14076.
- Caeiro L., Ferro J.M., Claro M.I. et al. Delirium in acute stroke: a preliminary study of the role of anticholinergic medications. Eur. J. Neurol. 2004. 11. 699-704.
- Fong T.G., Bogardus S.T., Daftary A. et al. Cerebral changes in older patients using 99m Tc HMPAO SPECT. J. Gerontol. A: Biol. Sci. Med. Sci. 2006. 61. 1294-9.
- Gustafson Y., Olsson T., Asplund K. et al. Acute confusional state (delirium) soon after stroke is associated with Hypercortisolism. Cerebrovasc. Dis. 1993. 3. 33-8.
- Mitasova A., Kostalova M., Bednarik J. et al. Poststroke delirium incidence and outcomes: validation of the Confusion Assessment Method for the Intensive Care Unit (CAM-ICU). Crit. Care Med. 2012 Feb. 40(2). 484-90.
- Ryan D.J., O’Regan N.A., Caoimh R.Ó., Clare J., O’Connor M., Leonard M. et al. Delirium in an adult acute hospital population: predictors, prevalence and detection. BMJ Open. 2013 Jan 7. 3(1). Е001772. doi: 10.1136/bmjopen-2012-001772.
- Young J., Inouye S. Delirium in older people. BMJ. 2007. 334. 842-6.
- Gustafson Y., Olsson T., Erikkson S. et al. Acute confusional states (delirium) in stroke patients. Cerebrovasc. Dis. 1991. 1. 257-64.
- Caeiro L., Ferro J., Albuquerque R. et al. Delirium in the first days of acute stroke. J. Neurol. 2004. 251. 171-8.
- Sheng A.Z., Shen Q., Cordato D. et al. Delirium within three days of stroke in a cohort of elderly patients. JAGS. 2006. 54. 1192-8.
- Miu D.K., Yeung J.C. Incidence of post-stroke delirium and 1-year outcome. Geriatr. Gerontol. Int. Geriatr. Gerontol. Int. 2013 Jan. 13(1). 123-9.
- Trivedi D. Cochrane Review Summary: Mini-Mental State Examination (MMSE) for the detection of dementia in clinically unevaluated people aged 65 and over in community and primary care populations. Prim. Health Care Res. Dev. 2017 Nov. 18(6). 527-528. doi: 10.1017/S1463423617000202.
- Inouye S.K., Dyck C.H., Alessi C.A. et al. Clarifying confusion: the confusion assessment method. A new method for detection of delirium. Ann. Intern. Med. 1990. 113. 941-8.
- Ramoo V., Abu H., Rai V., Surat Singh S.K., Baharudin A.A., Danaee M., Thinagaran R.R.R. Educational intervention on delirium assessment using confusion assessment method-ICU (CAM-ICU) in a general intensive care unit. J. Clin. Nurs. 2018 Nov. 27(21–22). 4028-4039. doi: 10.1111/jocn.14525.
- Trzepacz P.T., Baker R.W., Greenhouse J. A symptom rating scale for delirium. Psychiatry Res. 1988. 23. 89-97.
- Gavinski K., Carnahan R., Weckmann M. Validation of the delirium observation screening scale in a hospitalized older population. J. Hosp. Med. 2016 Jul. 11(7). 494-7. doi: 10.1002/jhm.2580.
- Ahn S.H., Choi J.H., Im C.S., Kim T.S., Kim J.L. A Comparison of the Severe Cognitive Impairment Rating Scale With the Mini-Mental State Examination and Delirium Rating Scale-Revised-98 for Delirium: A Cross-sectional Study. Psychosomatics. 2017 Nov-Dec. 58(6). 643-651. doi: 10.1016/j.psym.2017.08.002.
- Adamis D., Treloar A., MacDonald A. et al. Concurrent validity of two instruments (the confusion assessment method and the delirium rating scale) in the detection of delirium among older medical patients. Age Aging. 2005. 34. 72-83.
- Christie J. Informant Questionnaire on Cognitive Decline in the Elderly (IQCODE) for the Early Diagnosis of Dementia Across a Variety of Healthcare Settings. Issues Ment Health Nurs. 2018 May. 39(5). 445-446. doi: 10.1080/01612840.2018.1472958.
- Park M.H. Informant questionnaire on cognitive decline in the elderly (IQCODE) for classifying cognitive dysfunction as cognitively normal, mild cognitive impairment, and dementia. Int. Psychogeriatr. 2017 Sep. 29(9). 1461-1467. doi: 10.1017/S1041610217000965.
- Blandfort S., Gregersen M., Rahbek K., Juul S., Damsgaard E.M. The short IQCODE as a predictor for delirium in hospitalized geriatric patients. Aging Clin. Exp. Res. 2019 Nov 13. doi: 10.1007/s40520-019-01412-2.
- Phung T.K., Chaaya M., Asmar K., Atweh S., Ghusn H., Khoury R.M. et al. Performance of the 16-Item Informant Questionnaire on Cognitive Decline for the Elderly (IQCODE) in an Arabic-Speaking Older Population. Dement. Geriatr. Cogn. Disord. 2015. 40(5–6). 276-89. doi: 10.1159/000437092.
- Quinn T.J., Elliott E., Langhorne P. Cognitive and mood assessment tools for use in stroke. Stroke. 2018 Feb. 49(2). 483-490.
- Pereira J.V., Sanjanwala R.M., Mohammed M.K., Le M.L., Arora R.C. Dexmedetomidine versus propofol sedation in reducing delirium among older adults in the ICU: A systematic review and meta-analysis. Eur. J. Anaesthesiol. 2020 Feb. 37(2). 121-131. doi: 10.1097/EJA.0000000000001131.
- Zaubler T.S., Murphy K., Rizzuto L., Santos R., Skotzko C., Giordano J. et al. Quality improvement and cost savings with multicomponent delirium interventions: replication of the Hospital Elder Life Program in a community hospital. Psychosomatics. 2013 May-Jun. 54(3). 219-26. doi: 10.1016/j.psym.2013.01.010.
- Савин И.А., Фокин М.С., Лубнин А.Ю. Рекомендации по интенсивной терапии у пациентов с нейрохирургической патологией. Пособие для врачей. М.: ООО «ИПК «Индиго», 2006. 224 с.
- Lonergan E., Britton A., Lixemberg J. et al. Antipsychotics for delirium. Cochrane Database Syst. Rev. 2007. 4.
- Reade M.C., Eastwood G.M., Bellomo R., Bailey M., Bersten A., Cheung B. et al. Effect of Dexmedetomidine Added to Standard Care on Ventilator-Free Time in Patients With Agitated Delirium: A Randomized Clinical Trial. JAMA. 2016 Apr 12. 315(14). 1460-8. doi: 10.1001/jama.2016.2707.

/21.jpg)