Резюме
Актуальність. Клінічна оцінка інфаркту головного мозку зазвичай базується на застосуванні найбільш адаптованих класифікацій TOAST і ASCOD. При цьому їх загальний недолік пов’язаний з їх етіопатогенетичною орієнтацією, що різко обмежує клінічну цінність даних класифікацій для подальшої медичної реабілітації. Водночас міжнародна класифікація функціонування, обмеження життєдіяльності та здоров’я, з одного боку, більш застосована в відновній медицині, а з іншого — досить складна в опису комплексної проблеми моторних порушень при інфаркті головного мозку. Метою дослідження була розробка класифікації моторних порушень при інфаркті головного мозку. Матеріали та методи. У дослідженні взяли участь 42 пацієнти (25 чоловіків і 17 жінок віком 56,1 ± 4,7 року) у ранньому відновному періоді після інфаркту головного мозку. Як група порівняння були обстежені 27 здорових добровольців (16 чоловіків і 11 жінок віком 38,3 ± 5,5 року). Діагностика адаптивної кінематики проводилася з застосуванням апаратно-програмного комплексу Teslasuit, що включає керуючу програму і «розумний» костюм із вбудованими інерційними датчиками. Як стандартизована програма діагностики використовувалося постуральне тестування, що складалося з чотирьох постуральних тестів. Дослідження включало 3 етапи. На першому етапі виконувався скринінг для відбору до дослідної групи з застосуванням клінічних шкал: шкали Ашворта, шкали тяжкості інсульту Національних інститутів здоров’я США, модифікованої шкали Ренкіна, індексу Бартел, індексу мобільності Рівермід, 10-метрового тесту ходьби, стійкості вертикальної пози і тяжкості втоми. На другому етапі проводилася діагностика адаптивної кінематики з застосуванням батареї специфічних тестових завдань і подальшим аналізом показників середньої кутової девіації основних кінематичних елементів. Під час третього етапу виконувався розрахунок загального відсотка обмеження рухливості (ЗВОР) з виділенням медіани, верхнього і нижнього квартилів, що були маркерами коридору ЗВОР. Результати. Значення показника покладено в основу якісної діагностики адаптивної кінематики та нової класифікації моторних порушень після інфаркту головного мозку за ступенем тяжкості: Iа ступінь — мінімальні порушення (ЗВОР < 26 %); Ib ступінь — легкі (ЗВОР — 26–38 %); IIа ступінь — помірні (ЗВОР — 39–51 %); IIb ступінь — значні (ЗВОР — 52–64 %); IIIa ступінь — виражені (ЗВОР — 65–77 %); IIIb ступінь — вкрай виражені (ЗВОР > 77 і більше).
Актуальность. Клиническая оценка инфаркта головного мозга, как правило, базируется на применении наиболее адаптированных классификаций TOAST и ASCOD. При этом их общий недостаток связан с их этиопатогенетической ориентацией, что резко ограничивает клиническую ценность данных классификаций для последующей медицинской реабилитации. В то же время международная классификация функционирования, ограничения жизнедеятельности и здоровья, с одной стороны, более применима в восстановительной медицине, а с другой — достаточно сложна в описании комплексной проблемы моторных нарушений при инфаркте головного мозга. Целью исследования являлась разработка классификации моторных нарушений при инфаркте головного мозга. Материалы и методы. В исследовании приняли участие 42 пациента (25 мужчин и 17 женщин в возрасте 56,1 ± 4,7 года) в раннем восстановительном периоде после инфаркта головного мозга. В качестве группы сравнения были обследованы 27 здоровых добровольцев (16 мужчин и 11 женщин в возрасте 38,3 ± 5,5 года). Диагностика адаптивной кинематики проводилась с применением аппаратно-программного комплекса Teslasuit, включающего управляющую программу и «умный» костюм со встроенными инерциальными датчиками. В качестве стандартизированной программы диагностики использовалось постуральное тестирование, состоявшее из четырех постуральных тестов. Исследование включало 3 этапа. На первом этапе выполнялся скрининг для отбора в исследовательскую группу с применением клинических шкал: шкалы Ашворта, шкалы тяжести инсульта Национальных институтов здоровья США, модифицированной шкалы Рэнкина, индекса Бартел, индекса мобильности Ривермид, 10-метрового теста ходьбы, устойчивости вертикальной позы и тяжести усталости. На втором этапе проводилась диагностика адаптивной кинематики с применением батареи специфических тестовых заданий и последующим анализом показателей средней угловой девиации основных кинематических элементов. В ходе третьего этапа выполнялся расчет общего процента ограничения подвижности (ОПОП) с выделением медианы, верхнего и нижнего квартилей, которые являлись маркерами коридора ОПОП. Результаты. Значение показателя положено в основу качественной диагностики адаптивной кинематики и новой классификации моторных нарушений при инфаркте головного мозга по степени тяжести: Iа степень — минимальные нарушения (ОПОП < 26 %); Ib степень — легкие (ОПОП — 26–38 %); IIа степень — умеренные (ОПОП — 39–51 %); IIb степень — значительные (ОПОП — 52–64 %); IIIa степень — выраженные (ОПОП — 65–77 %); IIIb степень — крайне выраженные (ОПОП > 77 и более).
Background. Clinical assessment of stroke, as a rule, is based on the use of the most adapted classifications of TOAST and ASCOD. Moreover, their general disadvantage is associated with their etiopathogenetic orientation, which sharply limits the clinical value of these classifications for subsequent medical rehabilitation. At the same time, the international classification of functioning, limitation of vital functions and health, on the one hand, is more applicable in rehabilitation medicine, and on the other hand, it is quite difficult in describing the complex problem of motor impairments in stroke. The aim of the study was to develop a classification of motor impairments in stroke. Materials and methods. The study involved 42 patients (25 men and 17 women aged 56.1 ± 4.7 years) in the early recovery period after stroke. As a comparison group, 27 healthy volunteers (16 men and 11 women aged 38.3 ± 5.5 years) were examined. Diagnosis of adaptive kinematics was carried out using the Teslasuit software and hardware, which included a control program and a smart suit with built-in inertial sensors. Postural testing consisting of four postural tests was used as a standardized diagnostic program. The study included 3 stages. At the first stage, screening was carried out for selection into the research group using clinical scales: the Ashworth scale, the National Institutes of Health Stroke Scale, the modified Rankin scale, the Barthel index, the Rivermead mobility index, a 10-meter walk test, the stability of the vertical posture and the severity of fatigue. At the second stage, the diagnosis of adaptive kinematics was performed using a battery of specific test tasks and subsequent analysis of the average angular deviation of the main kinematic elements. During the third stage, the calculation of the total percentage of restricted mobility (TPRM) was performed with the identification of the median, upper and lower quartiles, which were markers of the TPRM corridor. Results. The value of the indicator forms the basis for a qualitative diagnosis of adaptive kinematics and a new classification of motor impairments in stroke according to severity: degree Ia — minimal disturbances (TPRM < 26 %); degree Ib — mild (TPRM — 26–38 %); degree IIa — moderate (TPRM — 39–51 %); degree IIb — significant (TPRM — 52–64 %); degree IIIa — severe (TPRM — 65–77 %); degree IIIb — extremely severe (TPRM > 77 % and higher).
Введение
Инфаркт головного мозга (ИГМ) занимает лидирующее положение среди заболеваний, приводящих к стойкой утрате трудоспособности [1–4], что формирует обоснованный интерес со стороны профессионалов в отношении поиска эффективных методик медицинской реабилитации (МР) [4–8]. Современные исследования базируются на двух наиболее адаптированных к клинической практике классификациях ИГМ: TOAST (Trail of Organisanion in Acute Stroke Treatment) и ASCOD (А — atherosclerosis/атеросклероз, S — small vessel disease/микроангиопатия, С — cardiac pathology/сердечная патология, O — other cause/другая причина, D — dissection/диссекция артерий) [9–11]. Классификация TOAST направлена на выявление основных причин ИГМ, в то время как целью классификации ASCOD является выделение патогенетического фенотипа с градацией каждого фактора по степени потенциального участия в развитии ИГМ [10, 11]. При этом их общим недостатком является этиопатогенетическая ориентация, что резко ограничивает клиническую ценность классификаций для последующей МР [2–4, 7]. Международная классификация функционирования (МКФ), ограничения жизнедеятельности и здоровья, с одной стороны, более применима в восстановительной медицине, а с другой — достаточно сложна в описании комплексной проблемы моторных нарушений (МН) [4, 8, 12].
Гипотеза исследования: при ИГМ формируются специфические паттерны адаптивной кинематики (АК) с элементами компенсации двигательных ограничений и стабилизации избыточной подвижности, которые могут определять тяжесть МН.
Цель исследования: разработка количественной и качественной классификации МН ИГМ с гемипарезом в качестве ведущего клинического симптома.
Материалы и методы
Работа выполнена в рамках диссертационного исследования на соискание ученой степени доктора медицинских наук по специальности 14.03.11 — «восстановительная медицина, лечебная физкультура и спортивная медицина, курортология и физиотерапия» и проводилась на клинической базе УЗ «2-я городская клиническая больница г. Минска». Проведение исследования было одобрено этическим комитетом ГУО «Белорусская медицинская академия последипломного образования». Дизайн исследования — проспективное экспериментальное.
В исследовании приняли участие 42 пациента (25 мужчин и 17 женщин в возрасте 56,1 ± 4,7 года) в раннем восстановительном периоде после ИГМ (группа А). В качестве группы сравнения были обследованы 27 здоровых добровольцев (16 мужчин и 11 женщин в возрасте 38,3 ± 5,5 года) (группа Б). Каждым участником исследования было подписано письменное информированное согласие. Диагноз ИГМ устанавливали на основании критериев классификации TOAST, данных клинического и нейровизуализационного исследований. Критериями включения в исследование являлись: клинически подтвержденный атеротромботический или кардиоэмболический подтип ИГМ; возраст пациентов от 45 до 65 лет включительно; время от начала мозговой катастрофы не ранее 1 и не позже 3 месяцев; наличие гемипареза в качестве ведущего клинического синдрома; состояние средней степени тяжести, соответствующее 11–12 баллам по шкале тяжести инсульта Национальных институтов здоровья США (NIHSS); состояние уровня жизнедеятельности, равное 3 баллам по модифицированной шкале Рэнкина (МШР); состояние уровня повседневной активности, равное 50–55 баллам индекса Бартел (ИБ); уровень мобильности, равный 29–32 баллам индекса мобильности Ривермид (ИМР); двигательная функция нижних конечностей, равная 4–5 баллам 10-метрового теста ходьбы (10ТХ); устойчивость вертикальной позы (УВП), равная 2–3 баллам по шкале R. Babannon (1989); уровень усталости более 36 баллов по шкале тяжести усталости FSS; желание участвовать в исследовании. Критерии исключения из проводимого исследования: гемодинамический или лакунарный подтип ИГМ; когнитивные нарушения выраженной степени; состояние мышечного тонуса более 1 балла по модифицированной шкале спастичности Ашворт; деформирующий остеоартроз II–III степени одного или двух коленного и/или тазобедренного суставов.
Исследование состояло из 3 этапов. I этап — скрининг для отбора в исследовательскую группу с применением шкал Ашворта, NIHSS, МШР, ИБ, ИМР, 10ТХ, УВП и FSS. II этап — диагностика АК с применением батареи специфических тестовых заданий и последующим анализом показателей средней угловой девиации (СУД) основных кинематических элементов (ОКЭ): 1) лучезапястные суставы (ЛЗС);
2) локтевые суставы (ЛС); 3) плечевые суставы (ПС); 4) тазобедренные суставы (ТБС); 5) коленные суставы (КС); 6) голеностопные суставы (ГС); 7) поясничный регион (ПР). Для обозначения ОКЭ применяли числовые определители: 1 — интактная сторона, а 2 — сторона гемипареза. Показатели АК рассчитывали для каждой кинематической плоскости (КП): горизонтальной (ГП), сагиттальной (СП) и фронтальной (ФП). Полученные СУД использовались для описания биомеханической структуры (БМС) тестового задания и расчета процентного отношения показателей (ПОП). ПОП равно среднему арифметическому всех процентных отношений (ПО), рассчитанных для каждого значения СУД одного тестового задания (ПОП = = (ПО (ЛЗС1ФП) + ПО (ЛЗС1СП) + ПО (ЛЗС1ГП) + +ПО (ЛЗС2ФП) + ПО (ЛЗС2СП) + ПО (ЛЗС2ГП) + ПО (ЛС1) + ПО (ЛС2) + ПО (ПС1ФП) + ПО (ПС1СП) + ПО (ПС1ГП) + ПО (ПС2ФП) + ПО (ПС2СП) + ПО (ПС2ГП) + ПО (ТБС1ФП) + ПО (ТБС1СП) + ПО (ТБС1ГП) + ПО (ТБС2ФП) + ПО (ТБС2СП) + ПО (ТБС2ГП) + ПО (КС1) + ПО (КС2) + ПО (ГС1) + ПО (ГС2) + ПО (ПРФП) + ПО (ПРСП) / 26)). В свою очередь, ПО является разностью между 100 % и произведением отношения минимального значения показателя СУД, выбранного из двух групп (группы А и группы Б), к максимальному и 100 % (ПО = 100 – (СУДmin/СУДmax × 100)). АК включала компенсаторную двигательную кинематику (КДК) и биокинематическую стабилизацию (БКС). III этап — расчет ОПОП с выделением медианы (Ме), верхнего (UQ) и нижнего квартилей (LQ) (ОПОП = Me [ПОПтест 1: ПОПтест 2: ПОПтест 3: ПОПтест 4]). Значения UQ и LQ являлись маркерами коридора ОПОП.
Диагностику АК проводили с применением аппаратно-программного комплекса Teslasuit (производство компании «ВРТЭК», Республика Беларусь), включающего управляющую программу и «умный» костюм со встроенными инерциальными датчиками. В качестве стандартизации диагностики использовалось постуральное тестирование, при котором на испытуемого перед началом исследования надевался костюм Teslasuit, связанный по каналу Wi-Fi с виртуальной средой тестирования. Интегральная работа сенсоров костюма реконструировала полную скелетную модель тела, согласно которой рассчитывались показатели СУД ОКЭ. В качестве диагностических тестов были предложены тест 1 «Фронтальное перемещение» — наклоны туловища вправо и влево; тест 2 «Сагиттальное перемещение» — наклоны туловища вперед и назад; тест 3 «Аксиальное перемещение 1» — приседания и тест 4 «Аксиальное перемещение 2» — повороты туловища. При выполнении испытуемый визуализировал свои действия на экране монитора (принцип биологической обратной связи). Все тестовые задания проводились с внешней поддержкой. Время для каждого задания — 30 с.
Статистическую обработку данных выполняли с применением пакета Statistics 12.6 (разработчик — Dell, США). После оценки распределения полученных данных методом Шапиро — Уилка для данных, соответствующих нормальному распределению, применяли параметрические методы анализа, для данных, не соответствующих нормальности, — непараметрические статистические методы. За критерий достоверности принималось значение р ≤ 0,05. Параметрические данные представляли в виде среднего арифметического со стандартным отклонением, непараметрические — в виде Me, UQ и LQ. Обработка массивов данных, получаемых от инерциальных датчиков, с последующей реконструкцией скелетной модели тела и расчетом значений СУД для каждого ОКЭ выполнялась с использованием компьютерной программы Python (разработчик — Python Software Foundation, США).
Результаты
Этап I. Результаты тестирования лиц группы А с применением клинических шкал представлены в табл. 3. Для проверки репрезентативности лица группы А методом случайных чисел были рандомизированы в две подгруппы: 1) подгруппа А1 — 24 пациента; 2) подгруппа А2 — 18 пациентов. Полученные результаты (табл. 3) статистически не различались, что подтверждает однородность выборки.
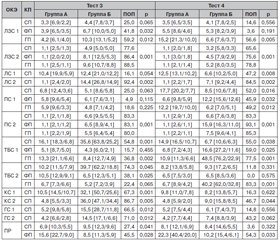
Этап II. Результаты тестирования лиц групп А и Б с применением тестов 1 и 2 представлены в табл. 1.
ПОП для теста 1 = 64,5 [75,5/46,3] %, для теста 2 — 62,6 [73,7/26,0] %. БМС теста «Фронтальная стабильность» обусловлена максимальным включением в кинематику двусторонней девиации ТБС и ПР во ФП, теста «Сагиттальная стабильность» — девиаций ТБС, ГС и ПР в СП.
Результаты тестирования исследуемых групп с применением тестов 3 и 4 представлены в табл. 2.
ПОП для теста 3 = 59,2 [79,4/25,6] %, для теста 4 — 52,0 [77,0/23,1] %. БМС теста «Аксиальная стабильность 1» связана с максимальным включением в кинематику КС, ТБС в СП и сгибаний ЛС, теста 4 — девиаций ТБС в ГП и ПС во ФП.
Полученные данные указывают на статистически значимые различия между группами за исключением:
1) осевых вращений интактных ЛЗС и ПС, сгибательно-разгибательных движений в заинтересованных КС при выполнении теста 1; 2) сгибательно-разгибательной кинематики ЛЗС, ПС и ТБС, а также ротаций ПС с интактной стороны при выполнении теста 2; 3) сгибательно-разгибательной кинематики ЛЗС, ЛС, ПС с интактной стороны и КС с заинтересованной стороны, а также приведений и отведений ПЛ и ТБС и ротаций ПС при выполнении теста 3; 4) сгибательно-разгибательных девиаций, приведений и отведений ЛЗС, девиаций КС, ГС и сгибательно-разгибательных девиаций ПР с интактной стороны, а также приведений и отведений ТБС и девиаций ГС со стороны пареза при выполнении теста 4.
/43.jpg)
Этап III. ОПОП = 59,1 [76,4/26,9] %. С целью рас-пределения группы А по подгруппам (со схожими признаками нарушения АК) были взяты UQ и LQ — 77 и 26 % соответственно (коридор равен 2 квартилям). Далее группа А с равными интервалами ОПОП была разделена на четыре подгруппы: 1) подгруппа 1 (ОПОП — 26–38 %, n = 8); 2) подгруппа 2 (ОПОП — 39–51 %, n = 10); 3) подгруппа 3 (ОПОП — 52–64 %, n = 16); 4) подгруппа 4 (ОПОП — 65–77 %, n = 6). 2 человека были исключены из исследования ввиду несоответствия ОПОП ни одной из подгрупп. Данные клинических шкал для группы А и ее подгрупп представлены в табл. 3.
При анализе данных статистических различий между подгруппами не выявлено. Также не было установлено наличия каких-либо корреляционных связей с ОПОП.
Обсуждение
При анализе литературных источников [1, 3, 7, 8, 13–19] мы не обнаружили исследований с интегральным анализом патологической биомеханики, ввиду чего нами была разработана собственная диагностическая методика постурального тестирования. В рамках предложенной концепции выполнялась стандартизированная оценка МН по отдельным фазам типичных отклонений тела: латеральных наклонов вокруг сагиттальной оси (тест 1), вентральных и дорсальных наклонов вокруг фронтальной оси (тест 2), перемещений вдоль (тест 3) и вокруг (тест 4) вертикальной оси с последующим кинематическим анализом виртуальной скелетной модели, реконструированной из инерциальных датчиков. Использование инерциальных сенсоров не является новацией [3, 4, 20–22], и в нашей работе сделан акцент не столько на математической обработке данных кватернионов, сколько на вычислении интегрального параметра оценки АК — ОПОП СУД ОКЭ ЛС. В ходе исследования и анализа специфичности АК были выделены следующие патобиомеханические фенотипы (ПБФ) ИГМ: ПБФ I (ОПОП — 26–38 %), ПБФ II (ОПОП — 39–51 %), ПБФ III (ОПОП — 52–64 %) и ПБФ IV (ОПОП — 65–77 %). Также логичным выводом является выделение ПБФ, находящихся вне зоны обозначенных коридоров ОПОП: ПБФ 0 (ОПОП < 26 %) и ПБФ V (ОПОП > 77 %).
Сформулированная градация ПБФ по количественному значению ОПОП может быть трансформирована в качественную классификацию МН при ИГМ: Iа степень — минимальные нарушения (критерий оценки — ОПОП < 26 %); Ib степень — легкие нарушения (ОПОП — 26–38 %); IIа степень — умеренные нарушения (ОПОП — 39–51 %); IIb степень — значительные нарушения (ОПОП — 52–64 %); IIIa степень — выраженные нарушения (ОПОП — 65–77 %); IIIb степень — тяжелые нарушения (ОПОП > 77 %). Полученные данные по своей структуре напоминают шкалу МКФ, в которой нарушения имеют относительные показатели: 0–4 % — ничтожные или отсутствуют; 5–24 % — незначительные, слабые; 25–49 % — средние; 50–95 % — высокие, интенсивные; 96–100 % — полные [4, 12, 23]. Согласно рекомендациям ВОЗ [23], эффективное использование МКФ требует дополнительных методов определения количественных значений относительных показателей и является основополагающим в постановке реабилитационного диагноза [8]. Предложенная методика позволяет ликвидировать данный пробел. Вместе с тем новая модель постурального тестирования может косвенно указывать на нарушение различных функций организма, принимающих участие в АК: 1) функцию ориентированности (b114) корреспондируют тесты 1 и 2; 2) функции зрения (b210), функцию непроизвольной двигательной реакции (b755) и контроль произвольных двигательных функций (b760) определяют тесты 1–4; 3) состояние вестибулярных функций (b235) косвенно демонстрируют тесты 1, 2 и 4; 4) состояние проприоцептивной функции (b260) отражают тесты 1 и 3; 5) функцию подвижности суставов нижних конечностей (b710) — тесты 1 и 3.
По мнению авторов, особенностями постурального тестирования считаются: 1) комплексный подход, согласно которому каждое тестовое задание оценивает специфическую кинематику ЛС в определенной КП; 2) индуктивный подход, связанный с определением нарушений АК по параметрам СУД; и 3) дедуктивный подход, обусловленный возможностью оценки нарушений структур организма (структуры туловища (s740), структуры таза (s760) и структуры нижних конечностей (s750)) по ОПОП (принимая во внимание коэффициент участия каждой структуры в выполнении конкретного теста).
Таким образом, полученные данные полностью подтверждают начальную гипотезу исследования, связанную с тем, что при ИГМ запускается персонализированная программа АК в виде феномена КДК (связан с увеличением СУД в первую очередь ТБС с интактной стороны: в СП — при наклонах в ФП и вращениях вокруг вертикальной оси; в ГП — при наклонах в СП и перемещениях вдоль вертикальной оси) и феномена БКС (связан с ограничением СУД первоначально ТБС с интактной стороны: в ФП и ГП — при наклонах в ФП и поворотах вокруг вертикальной оси; в ФП и СП — при наклонах в СП). Количественный анализ АК позволяет выделить 6 типов ПБФ МН. Качественный анализ определяет степень тяжести МН. Целесообразность клинического применения предложенной классификации обусловлена тем, что при схожей клинической картине ИГМ в однородной клинической группе выделяются различимые между собой ПБФ.
Выводы
В результате проведенного исследования были разработаны принципы количественной оценки адаптивной кинематики по интегральному параметру общего процентного отношения показателей средней угловой девиации основных кинематических элементов локомоторной системы при постуральном тестировании. Полученные результаты легли в основу новой классификации моторных нарушений при ИГМ (с гемипарезом в качестве ведущего клинического синдрома) по степени тяжести: Iа степень — минимальные нарушения (ОПОП < 26 %); Ib степень — легкие нарушения (ОПОП — 26–38 %); IIа степень — умеренные нарушения (ОПОП — 39–51 %); IIb степень — значительные нарушения (ОПОП — 52–64 %); IIIa степень — выраженные нарушения (ОПОП — 65–77 %); IIIb степень — тяжелые нарушения (ОПОП > 77 %).
Разработанная классификация может использоваться в медицинской реабилитации постинсультных пациентов для: 1) определения количественных значений нарушений нейромышечных скелетных и связанных с движением функций (согласно требованиям международной классификации функционирования); 2) персонализированного подбора программы двигательной тренировки, а именно — для градации тренировочных программ по уровню сложности в зависимости от выделенного патобиомеханического фенотипа.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
Финансирование. Работа выполнена в рамках диссертационного исследования на соискание ученой степени доктора медицинских наук по специальности 14.03.11 — «восстановительная медицина, лечебная физкультура и спортивная медицина, курортология и физиотерапия», без привлечения финансирования.
Благодарности. Авторы выражают благодарность Сергею Хурсу и Владиславу Мицкевичу за оказание технической поддержки и обработку массивов данных в программе Python.
Вклад авторов в подготовку статьи: Лукашевич В.А. — гипотеза, концепция, сбор и анализ материалов, написание чернового варианта статьи; Пономарев В.А. — дизайн исследования, обработка материалов, формулирование выводов, правка текста.
Список литературы
1. Katan M., Luft A. Global Burden of Stroke. Semin. Neurol. 2018. Vol. 38. № 2. P. 208-211. DOI: 10.1055/s-0038-1649503.
2. Stinear C.M. Prediction of motor recovery after stroke: advan-ces in biomarkers. Lancet Neurol. 2017. Vol. 16. № 10. P. 826-836. DOI: 10.1016/S1474-4422(17)30283-1.
3. Go A.S., Mozaffarian D., Roger V.L. [et al.]. Heart disease and stroke statistics — 2013 update: a report from the American Heart Association. Circulation. 2013. Vol. 127. P. 6-245. DOI: 10.1161/CIR.0b013e31828124ad.
4. García-Rudolph A., Laxe S., Saurí J., Opisso E., Tormos J.M., Bernabeu M. Evidence of chronic stroke rehabilitation interventions in activities and participation outcomes: systematic review of meta-analyses of randomized controlled trials. Eur. J. of Physical and Rehabilitation Medicine. 2019. Vol. 55. № 6. P. 695-709. DOI: 10.23736/S1973-9087.19.05814-3.
5. Ravi D.K., Gwerder M., König Ignasiak N. [et al.]. Revealing the optimal thresholds for movement performance: A systematic review and meta-analysis to benchmark pathological walking behaviour. Neurosci. Biobehav. Rev. 2020. Vol. 108. P. 24-33. DOI: 10.1016/j.neubiorev.2019.10.008.
6. Tashiro S., Mizuno K., Kawakami M. [et al.]. Neuromuscular electrical stimulation-enhanced rehabilitation is associated with not only motor but also somatosensory cortical plasticity in chronic stroke patients: an interventional study. Therapeutic Advances in Chronic Disease. 2019. Vol. 10. P. 1-13. DOI: 10.1177/2040622319889259.
7. Saad M.B., Vishal S.V. Stroke rehabilitation: A call to action in Saudi Arabia. Neurosciences. 2016. Vol. 21. № 4. P. 297-305. DOI: 10.17712/nsj.2017.3.20170010.
8. Сокрут В.Н., Сокрут О.П., Синяченко О.В. «Вегетативный паспорт» и реабилитационный диагноз в артрологической практике. 2016. № 1(21). С. 45-50.
9. Wolf M.E., Sauer T., Alonso A., Hennerici M.G. Comparison of the new ASCO classification with the TOAST classification in a population with acute ischemic stroke. J. Neurol. 2012. Vol. 259. P. 1284-1289. DOI: 10.1007/s00415-011-6325-1.
10. Amarenco P., Bogousslavsky J., Caplan L.R., Donnan G.A., Hennerici M.G. A new approach to stroke subtyping: the A-S-C-O (phenotypic) classification of stroke. Cerebrovasc Dis. 2009. Vol. 27. P. 502-508. DOI: 10.1159/000352050.
11. Wolf M.E., Sauer T., Hennerici M.G., Chatzikonstantinou A. Characterization of patients with recurrent ischemic stroke using the ASCO classification. Eur. J. Neurol. 2013. Vol. 20. P. 812-817. DOI: 10.1111/ene.12068.
12. Голик В.А., Мороз Е.Н., Погорелова С.А. Использование международной классификации функционирования, ограничений жизнедеятельности и здоровья в экспертной практике. Международный неврологический журнал. 2011. № 5(43). С. 136-142.
13. Kyeong S., Kim S.M., Jung S., Kim D.H. Gait pattern analysis and clinical subgroup identification: a retrospective observational study. Medicine (Baltimore). 2020. Vol. 99. № 15. e19555. DOI: 10.1097/MD.0000000000019555.
14. Mina P., Myoung-Hwan Ko., Sang-Wook O. [et al.]. Effects of virtual reality-based planar motion exercises on upper extremity function, range of motion, and health-related quality of life: a multicenter, single-blinded, randomized, controlled pilot study. J. Neuroeng. Rehabil. 2019. Vol. 16. Article 122. DOI: 10.1186/s12984-019-0595-8.
15. König N., Singh N.B., Baumann C.R., Taylor W.R. Can Gait Signatures Provide Quantitative Measures for Aiding Clinical Decision-Making? A Systematic Meta-Analysis of Gait Variability Behavior in Patients with Parkinson’s Disease. Front. Hum. Neurosci. 2016. Vol. 10. P. 308-319. DOI: 10.3389/fnhum.2016.00319.
16. Muro-de-la-Herran A., Garcia-Zapirain B., Mendez-Zorrilla A. Gait analysis methods: an overview of wearable and non-wea-rable systems, highlighting clinical applications. Sensors (Basel). 2014. Vol. 14. № 2. P. 3362-3394. DOI: 10.3390/s140203362.
17. De Vroey H., Staes F., Weygers I. [et al.]. The implementation of inertial sensors for the assessment of temporal parameters of gait in the knee arthroplasty population. Clin. Biomech. 2018. Vol. 54. P. 22-27. DOI: 10.1016/j.clinbiomech.2018.03.002.
18. Robles-García V., Corral-Bergantiños Y., Espinosa N. [et al.]. Spatiotemporal Gait Patterns During Overt and Covert Evaluation in Patients With Parkinson´s Disease and Healthy Subjects: Is There a Hawthorne Effect? J. Appl. Biomech. 2015. Vol. 3. P. 189-94. DOI: 10.1123/jab.2013-0319.
19. Li K.Y., Lin K.C., Chen C.K., Liing R.J., Wu C.Y., Chang W.Y. Concurrent and Predictive Validity of Arm Kinematics with and without a Trunk Restraint During a Reaching Task in Individuals with Stroke. Arch. Phys. Med. Rehabil. 2015. Vol. 96. P. 1666-1675. DOI: 10.1016/j.apmr.2015.04.013.
20. De Vroey H., Claeys K., Vereecke E. [et al.]. Correlation between an inertial and camera-based system for the assessment of temporal parameters of gait in the knee arthroplasty population. Gait Posture. 2017. Vol. 57. P. 280-281. DOI: 10.1016/j.gaitpost.2017.06.417.
21. Yu G., Jang Y.J., Kim J., Kim J.H., Kim H.Y., Kim K., Panday S.B. Potential of IMU Sensors in Performance Analysis of Professional Alpine Skiers. Sensors (Basel). 2016. Vol. 16. № 4. P. 432-463. DOI: 10.3390/s16040463.
22. Boutaayamou M., Schwartz C., Stamatakis J. [et al.]. Development and validation of an accelerometer-based method for quantifying gait events. Med. Eng. Phys. 2015. Vol. 37. P. 226-232. DOI: 10.1016/j.medengphy.2015.01.001
23. Международная классификация функционирования, ограничений жизнедеятельности и здоровья. Женева: ВОЗ, 2001. 342 с.

/42.jpg)
/43.jpg)
/44.jpg)