Архив офтальмологии Украины Том 8, №2, 2020
Вернуться к номеру
Підходи до лікування орбітопатії Грейвса: вчора, сьогодні, завтра
Авторы: Прусак О.І.(1), Іванюта Е.П.(2)
(1) — Національна медична академія післядипломної освіти імені П.Л. Шупика, м. Київ, Україна
(2) — Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Офтальмология
Разделы: Справочник специалиста
Версия для печати
Актуальність. У статті висвітлено основні підходи до лікування пацієнтів з орбітопатією Грейвса, яка залишається актуальним питанням офтальмології та ендокринології, оскільки ця патологія впливає на якість життя, може призвести до втрати зору, що є медико-соціальною проблемою. Мета. Проаналізувати дані літератури відносно основних підходів до лікування пацієнтів з орбітопатією Грейвса, що були застосовані в минулому, та сучасні рекомендації European Group on Graves’ Orbitopathy Guidelines for the Management of Graves’ Orbitopathy (EUGOGO) (2016) і перспективи нових досліджень; оцінити переваги й недоліки кожного методу лікування. Результати. Підходи до лікування орбітопатії Грейвса змінювались з часом завдяки розвитку науки і глибшому розумінню етіології і патогенезу цього захворювання. Застосування кортикостероїдів, променева терапія, хірургічне лікування — основні методи, які використовують для менеджменту хворих з орбітопатією Грейвса, проте кожен з них має свої переваги і недоліки. Висновки. EUGOGO (2016) рекомендує поетапний підхід до ведення пацієнтів з орбітопатією Грейвса, залежно від її активності й тяжкості та впливу на якість життя пацієнта. Нині оптимального конкретного методу лікування не визначено, проте вивчення ефекту нових лікарських засобів і застосування комп’ютерного 3D-моделювання на передопераційному етапі видаються досить перспективними.
Актуальность. В статье представлены основные подходы к лечению пациентов с орбитопатией Грейвса, которая остается актуальным вопросом офтальмологии и эндокринологии, поскольку данная патология влияет на качество жизни, может привести к потере зрения, что является медико-социальной проблемой. Цель. Проанализировать данные литературы по основным подходам к лечению пациентов с орбитопатией Грейвса, которые применяли в прошлом, современные рекомендации European Group on Graves’ Orbitopathy Guidelines for the Management of Graves’ Orbitopathy (EUGOGO) (2016) и перспективы новых исследований; оценить преимущества и недостатки каждого метода лечения. Результаты. Подходы к лечению орбитопатии Грейвса менялись со временем благодаря развитию науки и более глубокому пониманию этиологии и патогенеза этого заболевания. Применение кортикостероидов, лучевая терапия, хирургическое лечение — основные методы, которые применяют для менеджмента больных с орбитопатией Грейвса, однако каждый из них имеет свои преимущества и недостатки. Выводы. EUGOGO (2016) рекомендует поэтапный подход к ведению пациентов с орбитопатией Грейвса в зависимости от ее активности и тяжести, а также влияния на качество жизни пациента. В настоящее время оптимальный конкретный метод лечения не определен, однако изучение эффекта новых лекарственных средств и применение компьютерного 3D-моделирования на предоперационном этапе представляются весьма перспективными.
Background. The article highlights the main approaches to the treatment of patients with Graves’ orbitopathy (GO), which remains a topical issue in ophthalmology and endocrinology, as this pathology affects the quality of life, can lead to vision loss, which is a medical and social problem. The purpose of our work was to analyze the literature data on the main approaches to the treatment of patients with Graves’ orbitopathy, which were used in the past, the current guidelines of European Group on Graves’ Orbitopathy (EUGOGO) 2016 and prospects for new researches, to evaluate advantages and disadvantages of each method of treatment. Results. Approaches to the treatment of GO have changed over time due to the development of science and a deeper understanding of the etiology and pathogenesis of this disease. The use of corticosteroids, radiation therapy, surgical treatment are main methods used for the management of patients with GO, but each of them has advantages and disadvantages. Conclusions. EUGOGO 2016 recommends a step-by-step approach to the management of patients with GO, depending on its activity and severity and impact on the quality of life of the patient. At present, the optimal specific method of treatment has not been determined, but the study of the effect of new drugs and the use of computer 3D modeling in the preoperative phase seems quite promising.
орбітопатія Грейвса; глюкокортикостероїди; променева терапія; декомпресія орбіти; тепротумумаб; комп’ютерне 3D-моделювання
орбитопатия Грейвса; глюкокортикостероиды; лучевая терапия; декомпрессия орбиты; тепротумумаб; компьютерное 3D-моделирование
Graves’ orbitopathy; glucocorticosteroids; radiation therapy; orbital decompression; teprotumumab; computer 3D modeling
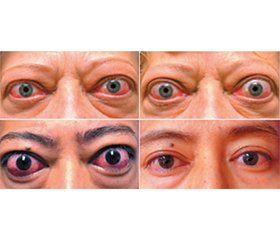
Вступ
/69.jpg)
Підходи до лікування
Перспективи в лікуванні
Висновки
- Kahaly et al. 2018 European Thyroid Association Guideline for the Management of Graves’ Hyperthyroidism. Eur. Thyroid. J. 2018. 7. 167-186. https://doi.org/10.1159/000490384.
- Ross D.S., Burch H.B., Cooper D.S. [et al.]. American Thyroid Association guidelines for diagnosis and management of hyperthyroidism and other causes of thyrotoxicosis. Thyroid. 2016. Vol. 26. № 10. P. 1343-1421. doi: 10.1089/thy.2016.0229.
- Ткаченко В.І. Аналіз поширеності тиреоїдної патології та захворюваності на неї серед населення Київської області та України за 2007–2017 рр. Міжнародний ендокринологічний журнал. 2018. Т. 14. № 3. С. 279-284. Режим доступу: http://nbuv.gov.ua/UJRN/Mezh_2018_14_3_14
- Черенько М.С. Безпечність пульс-терапії глюкокортикоїдними гормонами у лікуванні ендокринної орбітопатії. Клінічна ендокринологія та ендокринна хірургія. 2018. № 3(63). https://doi.org/10.24026/1818-1384.3(63).2018.142675
- Smith T.J., Hegedüs L. Graves’ disease. N. Engl. J. Med. 2016 Oct 20. 375(16). 1552-65.
- Smith T.J., Janssen J.A.M.J.L. Insulin-like growth factor-I receptor and thyroid-associated ophthalmopathy. Endocr. Rev. 2019 Feb 1. 40(1). 236-67.
- Tsui S., Naik V., Hoa N. et al. Evidence for an association between thyroid-stimulating hormone and insulin-like growth factor 1 receptors: a tale of two antigens implicated in Graves’ disease. J. Immunol. 2008. 181. 4397-4405.
- Bahn R.S. Graves’ ophthalmopathy. N. Engl. J. Med. 2010. 362. 726-738.
- Bartalena L., Baldeschi L., Boboridis K., Eckstein A., Kahaly G.J., Marcocci C. et al. The 2016 European Thyroid Association/European Group on Graves’ Orbitopathy guidelines for the management of Graves’ orbitopathy. Eur. Thyroid. J. 2016 Mar. 5(1). 9-26. doi: 10.1159/000443828.
- Tanda M.L., Piantanida E., Liparulo L., Veronesi G., Lai A., Sassi L., Pariani N., Gallo D., Azzolini C., Ferrario M., Bartalena L. Prevalence and natural history of Graves’ orbitopathy in a large series of patients with newly diagnosed Graves’ hyperthyroidism seen et a single center. J. Clin. Endocrinol. Metab. 2013. 98. 1443-1449.
- Mourits M.P., Koornneef L., Wiersinga W.M., Prummel M.F., Berghout A., van der Gaag R. Clinical criteria for the assessment of disease activity in Graves’ ophthalmopathy: a novel approach. Br. J. Ophthalmol. 1989. 73. 639-644.
- Graves R.J. Newly observed affection of the thyroid gland in females. London Med. and Surg. J. 1835. 7. 516-7.
- Von Basedow K.A. Exophthalmus durch Hypertrophie des Zellgewebes in der Augenhöhle. [Casper’s] Wochenschrift für die gesammte Heilkunde, Berlin, 1840. 6. 197-204; 220-228. Englische Übersetzung in: Ralph Hermon Major (1884–1970): Classic Descriptions of Disease. Springfield, C.C. Thomas, 1932. 2nd edition, 1939; 3rd edition, 1945.
- Gerabek W. Enzyklopädie Medizingeschichte, S. 152. 2005; zuletzt eingesehen am 24. März 2008.
- Hertz S., Roberts A. Application of radioactive iodine in therapy of Grave’s disease. J. div. 1942. 21(624); zuletzt eingesehen am 10. März 2008.
- Bellows J.G. et al. Early clinical results of ACTH and cortisone in treatment of ocular diseases. Arch. Ophth. 1951. 45. 320.
- Scheie H.G., Tyner G.S., Buessler J.A., Alfano J.E. Adrenocorticotropic hormone (ACTH) and cortisone in ophthalmology. Arch. Ophth. 1951. 45. 301.
- Chandler G.N., Hartfall S.J. Cortisone and ACTH in exophthalmic ophthalmoplegia. Lancet. 1952. 1. 847.
- Aterman K., Cope C.L. et al. Cortisone in exophthalmos: report on a therapeutic trial of cortisone and corticotrophin (ACTH) in exophthalmos and exophthalmic ophthalmoplegia, by a Panel Appointed by the Medical Research Council. 1955. 1. 6.
- Bruwn J., Coburn J.W., Wigod R.A., Hiss J.M.Jr., Dowling J.T. Adrenal steroid therapy of severe infiltrative ophthalmopathy of Graves’ disease. Am. J. Med. 1963 Jun. 34. 786-95. doi: 10.1016/0002-9343(63)90087-1.
- Bartalena L., Marcocci C., Bogazzi F., Bruno-Bossio G., Pinchera A. Glucocorticoid therapy of Graves’ ophthalmopathy. Exp. Clin. Endocrinol. 1991. 97. 320-328.
- Smith T.J. Dexamethasone regulation of glycosaminoglycan synthesis in cultured human fibroblasts: similar effects of glucocorticoid and thyroid hormone therapy. J. Clin. Invest. 1984. 64. 2157-2163.
- Smith T.J., Bahn R.S., Gorman C.A. Hormonal regulation of hyaluronate synthesis in cultured fibroblasts; evidence for differences between retroocular and dermal fibroblasts. J. Clin. Endocrinol. Metab. 1989. 69. 1019-1023.
- Bartalena L., Marcocci C., Pinchera A. Treating severe Graves’ ophthalmopathy. Bailliere’s Clin. Endocrinol. Metab. 1997. 11. 521-536.
- Prummel M.F., Mourits M.P., Blank L., Berghout A., Koornneef L., Wiersinga W.M. Randomised double-blind trial of prednisone vs. radiotherapy in Graves’ ophthalmopathy. Lancet. 1993. 342. 949-954.
- Marino M., Morabito E., Brunetto M.R., Bartalena L., Pinchera A., Marcocci C. Acute and severe liver damage associated with intravenous glucocorticoid pulse therapy in patients with Graves’ ophthalmopathy. Thyroid. 2004. 14. 403-406.
- Marcocci C., Bartalena L., Panicucci M. et al. Orbital cobalt irradiation combined with retrobulbar or systemic corticosteroids for Graves’ ophthalmopathy: a comparative study. Clin. Endocrinol. (Oxf). 1987. 27. 33-42.
- Pinchera A., Bartalena L., Chiovato L., Marcocci C. Radiotherapy of Graves’ ophthalmopathy. In: Gorman C.A., Waller R.R., Dyer J.A. (eds) The Eye and Orbit in Thyroid Disease. Raven Press, New York, 1984. P. 301-316 117.
- Bartalena L., Marcocci C., Manetti L., Tanda M.L., Dell’Unto E., Rocchi R., Cartei F., Pinchera A. Orbital radiotherapy for Graves’ ophthalmopathy. Thyroid. 1998. 8. 439-441.
- Bartalena L., Pinchera A., Marcocci C. Management of Graves’ Ophthalmopathy. Reality and Perspectives Endocrine Reviews. 1 April 2000. Vol. 21. Is. 2. P. 168-199.
- Donaldson S.S., Bagshaw M.A., Kriss J.P. Supervoltage orbital radiotherapy for Graves’ ophthalmopathy. J. Clin. Endocrinol. Metab. 1973. 37. 276-285.
- Olivari N. Transpalpebral decompression of endocrine ophthalmopathy (Graves’ disease) by removal of intraorbital fat: experience with 147 operations over 5 years. Plast Reconstr. Surg. 1991. 87. 627-41.
- Rootman D.B. Orbital Decompression for Thyroid Eye Disease, Survey of Ophthalmology. 2017. doi: 10.1016/j.survophthal.2017.03.007.
- Tooley A.A., Godfrey K.J., Kazim M. Evolution of thyroid eye disease decompression-dysthyroid optic neuropathy. Eye. 2019. 33. 206-211.
- Tyler M.A., Zhang C.C., Saini A.T., Yao W.C. Cutting-edge endonasal surgical approaches to thyroid ophthalmopathy. Laryngoscope Investig. Otolaryngol. 2018. 3(2). 100-104. Published 2018 Feb 26. doi: 10.1002/lio2.143.
- Sellari-Franceschini S., Dallan I., Bajraktari A. et al. Surgical complications in orbital decompression for Graves’ orbitopathy. Complicanze chirurgiche in pazienti sottoposti a decompressione orbitaria per oftalmopatia di Graves. Acta Otorhinolaryngol. Ital. 2016. 36(4). 265-274. doi: 10.14639/0392-100X-1082.
- Leong S.C., Karkos P.D., Macewen C.J. et al. A systematic review of outcomes following surgical decompression for dysthyroid orbitopathy. Laryngoscope. 2009. 119. 1106-15.
- Douglas R.S. Teprotumumab, an insulin-like growth factor-1 receptor antagonist antibody, in the treatment of active thyroid eye disease: a focus on proptosis. Eye (Lond). 2019. 33(2). 183-190. doi: 10.1038/s41433-018-0321-y.
- Douglas R.S., Kahaly G.J., Patel A. et al. Teprotumumab for the Treatment of Active Thyroid Eye Disease. N. Engl. J. Med. 2020. 382(4). 341-352. doi: 10.1056/NEJMoa1910434.
- Kamer L. et al. Anatomy-Based Surgical Concepts for Individualized Orbital Decompression Surgery in Graves Orbitopathy. I. Orbital Size and Geometry. Ophthal. Plast. Reconstr. Surg. 2010. Vol. 26. № 5. doi: 10.1097/IOP.0b013e3181c9bb52.
- Kamer L. et al. Anatomy-Based Surgical Concepts for Individualized Orbital Decompression Surgery in Graves Orbitopathy. II. Orbital Rim Position and Angulation. Ophthal. Plast. Reconstr. Surg. 2012. Vol. 28. № 4. doi: 10.1097/IOP.0b013e31824ddbfd.

/69_2.jpg)
/71.jpg)
/71_2.jpg)
/72.jpg)