Вступ
Неалкогольна жирова хвороба печінки (НАЖХП) є найвагомішим етіологічним чинником хронічних захворювань печінки в усьому світі. Загальна глобальна поширеність НАЖХП становить майже 25 %, у близько 25 % пацієнтів з НАЖХП розвивається неалкогольний стеатогепатит (НАСГ), серед яких у 25 % розвинеться цироз печінки [1].
Традиційно вважають, що НАЖХП являє собою компонент метаболічного синдрому (МС) і поєднується з ожирінням, інсулінорезистентністю, дисліпідемією та іншими його компонентами [2]. При цьому не виникає сумнівів, що не в усіх людей із підвищеною масою тіла розвивається НАЖХП, і навпаки, наявність НАЖХП можлива в осіб з нормальною масою тіла. Незважаючи на ідентичність гістологічної картини, патогенетично та клінічно ці стани розрізняються [3].
Неалкогольна жирова хвороба печінки в осіб з нормальною вагою являє собою стеатоз печінки, індукований неоднорідним спектром етіологічних факторів, починаючи від харчових звичок (таких як високий уміст фруктози та жирів у дієті), розподілу жиру в організмі (вісцеральне ожиріння на противагу загальному ожирінню), складу тіла (набута або вроджена ліподистрофія, саркопенія) та генетичних факторів ризику, включаючи рідкісні вроджені дефекти обміну речовин [4].
Деякі автори припускають, що НАЖХП може бути важливим етіологічним чинником криптогенного цирозу печінки. Інші дослідження свідчать, що наявність НАЖХП серед осіб з нормальною вагою асоціювалася з підвищеною смертністю від серцево-судинних захворювань [5].
Термінологія
Загальновживаний термін «худа НАЖХП» (lean NAFLD) або «НАЖХП без ожиріння» (nonobese NAFLD) є граматично і науково неточним, оскільки НАЖХП cама по собі не може бути «худою» або «без ожиріння» [6]. Тому, беручи до уваги різні дефініції для терміна «худий», пропонується вживати термін «НАЖХП у осіб з нормальною вагою» (NAFLD in normal weight subjects) або «НАЖХП у осіб без ожиріння» (NAFLD in nonobese subjects) [7].
Відповідь на питання, чи є пацієнт худим або таким, що не має ожиріння (має нормальну вагу), визначається індексом маси тіла (ІМТ), тоді як нормативи ІМТ різняться в дослідженнях. Всесвітня організація охорони здоров’я рекомендує 25 та 30 кг/м2 як поріг для виявлення суб’єктів із надмірною вагою та ожирінням відповідно. Найпоширенішим визначенням для нормальної ваги або «неожиріння» у пацієнтів з НАЖХП є ІМТ < 30 кг/м2 у дослідженнях із США та < 25 кг/м2 для європейських досліджень та ІМТ < 23 кг/м2 для робіт з країн Азії. У зв’язку з відмінностями в діагностичних критеріях поширеність НАЖХП у пацієнтів без ожиріння значно коливається у різних дослідженнях [6].
Епідеміологія
Навіть у межах нормального ІМТ у всьому світі спостерігається постійне зростання ваги, яке пов’язане зі збільшенням дисфункціональної запальної жирової тканини [8]. За даними досліджень, проведеними в країнах Азії, поширеність НАЖХП становить до 27 % у худорлявих осіб або осіб, які не мають ожиріння [9].
Порівняно з азіатськими дослідженнями, описаними раніше, дослідження за участю населення Європейського регіону є менш численними і зазвичай проводились за участю меншої кількості пацієнтів. У роботі італійських учених продемонстровано, що поширеність НАЖХП у осіб з нормальною вагою (ІМТ < 25 кг/м2) становила 16 % порівняно з 75,8 % у пацієнтів з ожирінням, при цьому оцінка стеатозу печінки проводилась за допомогою ультрасонографії [10].
Найбільше епідеміологічне дослідження, що аналізує поширеність та особливості перебігу НАЖХП серед пацієнтів з нормальною вагою, було проведено у США з використанням даних Третього національного обстеження з питань охорони здоров’я та харчування (NHANES III). Серед 11 613 осіб методом ультрасонографії виявлено стеатоз печінки у 27,7 % суб’єктів з надмірною вагою/ожирінням, що значно перевищує частоту виявлення стеатозу в пацієнтів з нормальним ІМТ (< 25 кг/м2) — 7,4 % [11]. Наявність фенотипу з нормальною вагою та НАЖХП спостерігалась у всіх вікових групах, включаючи підлітків. У дослідженнях 1482 підлітків з нормальною вагою (ІМТ < 85-го перцентиля) віком від 12 до 18 років, які були включені до NHANES у 2005–2014 роках, було повідомлено про поширеність попереднього діагнозу НАЖХП у 8 % підлітків з нормальною вагою (АЛТ вище за відповідне центильне значення для відповідної статі та віку й ознаки стеатозу за даними методів візуалізації) [12].
За даними метааналізу 21 дослідження (n = 55 936), розрахунковий показник поширеності НАЖХП у пацієнтів з нормальною вагою становив 10,2 % (95% довірчий інтервал (ДІ): 7,6–13,6 %) [1].
Патогенез
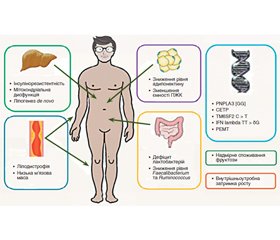
НАЖХП зазвичай розвивається у пацієнтів з ожирінням або надмірною вагою, які мають нераціональну дієту, підвищену проникність кишечника та дисбіотичні зміни, інсулінорезистентність, системне запалення та гострофазову реакцію; печінка, таким чином, піддається впливу надлишку метаболічних субстратів (ліпідів та вуглеводів) і запальних бактеріальних продуктів та цитокінів. Ці фактори викликають активацію гепатоцелюлярного стресового шляху, що призводить до загибелі клітин та активації запальної сигналізації. Стійке запалення веде до фіброгенного ремоделювання печінки аж до цирозу. Одночасно активуються регенеративні сигнали. Прогресування хвороби відображає баланс між чинниками, що сприяють розвитку фіброзу або відновленню нормальної функції та структури печінки [13]. Патогенез НАЖХП у пацієнтів без ожиріння має низку особливостей, які будуть розглянуті далі (рис. 1).
Генетика
НАЖХП у пацієнтів без ожиріння зустрічається у двох аспектах. По-перше, існують специфічні генетичні порушення, які впливають на конкретні метаболічні шляхи, що призводять до накопичення жиру в печінці, незважаючи на фізіологічний рівень надходження ліпідів через печінку. Ці генетичні порушення включають абеталіпопротеїнемію, гіпобеталіпопротеїнемію, сімейну комбіновану гіперліпідемію, хвороби накопичення, синдром Вебера — Крисчена та ліподистрофію [6].
Існують також генетичні варіанти, що зазвичай не призводять до розвитку НАЖХП, але в умовах нераціонального харчування та збільшення маси жирової тканини збільшують сприйнятливість і пов’язані з підвищеним ризиком або захистом від розвитку НАЖХП.
Ген пататинподібного домену, що містить фосфоліпазу білка-3 (PNPLA3), та його несинонічний варіант rs738409 C/G, що кодує заміну ізолейцину метіоніном у положенні 148 амінокислоти (I148M), був першим з досліджених генів, що асоційовані з НАСГ. Цей варіант пов’язаний з розвитком НАСГ, а не простого стеатозу, та його прогресуванням до цирозу й гепатоцелюлярної карциноми [14]. Детальні механізми, за допомогою яких він сприяє розвитку стеатогепатиту та гепатоцелюлярному раку, залишаються невідомими.
PNPLA3 пов’язаний з ендоплазматичним ретикулумом та утворенням ліпідних краплин у гепатоцитах (рис. 2). Фермент виявляє як властивості тригліцеридгідролази, так і трансациляційну активність in vitro, тому може сприяти або катаболізму тригліцеридів, або їх анаболізму. Заміна метіоніну на ізолейцин у залишку 148 порушує гідроліз тригліцеридів ферментом, припускаючи, що PNPLA3-I148M може бути мутацією втрати функції (рис. 2А). Однак абляція PNPLA3 у різних штамів мишей (C57BL/6J та Lepob/ob) не призвела до значного підвищення вмісту ліпідів печінки або рівня амінотрансферази в сироватці крові. І навпаки, надмірна експресія PNPLA3-I148M у гризунів призводить до збільшення вмісту тригліцеридів у печінці, виявлення яких більше відповідає мутації посилення функції. Мутантний білок може перешкоджати дії іншої тригліцеридної гідролази, можливо, PNPLA2 (тригліцеридна ліпаза адипоцитів) (рис. 2В). Альтернативно, він може секвеструвати кофактор, необхідний для підтримки гомеостазу тригліцеридів у печінці (рис. 2С). Експресія мутантного ферменту може генерувати нову сигнальну молекулу, яка або інгібує ліполіз, або сприяє осадженню тригліцеридів (рис. 2D). Нарешті, мутантний білок може сприяти утворенню тригліцеридів (рис. 2Е) або токсичного ліпіду, що сприяє як стеатозу, так і ушкодженню печінки [14].
/72.jpg)
У багатоетнічній когорті фактори генетичного ризику для стеатозу печінки мали найбільшу поширеність серед осіб, які мають латиноамериканську етнічну приналежність, алель PNPLA3 rs738409 не асоціювалася з печінковою жировою фракцією серед інших осіб, незважаючи на частоту 0,23 для алелі ризику [15].
Вільні жирні кислоти (ВЖК) з тригліцеридів (ТГ), що містяться в ліпідних краплях, або PNPLA3 можуть бути залучені до конверсії ацилгліцеринів до тригліцеридів, тим самим сприяючи осадженню ТГ. Заміна метіоніну на ізолейцин у залишку 148 (PNPLA3-I148M) скасовує активність гідролази ТГ, що дозволяє припустити, що PNPLA3-I148M — це мутація втрати функції (A). Однак надмірна експресія PNPLA3-I148M у печінці мишей призводить до стеатозу. Ці результати більш узгоджуються з варіантом, який має збільшення. Мутантний білок може перешкоджати дії іншої ліпази (В) або секвеструвати кофактор, необхідний для підтримки гомеостазу тригліцеридів у печінці (С). Альтернативно, експресія гена може сприяти генерації нової сигнальної молекули, яка інгібує ліполіз (D) або сприяє утворенню тригліцеридів (Е) [14].
TM6SF2 (Transmembrane 6 superfamily member 2) — це ще один ген, поліморфізм якого був пов’язаний з тяжкістю захворювання та впливом на ліпідний транспорт з печінки. TM6SF2 сприяє секреції ліпопротеїнів дуже низької щільності (ЛПДНЩ) з печінки (рис. 3). У мишей зниження вмісту TM6SF2 збільшує вміст тригліцеридів у печінці при зниженні ліпідів у крові. І навпаки, надекспресія TM6SF2 людини у мишей підвищує рівень ліпідів у сироватці крові. Алель TM6SF2 rs58542926-T є варіантом втрати функції, що призводить до того, що білок зазнає прискореної деградації. Механізм, що спричинює зниження секреції частинок ЛПДНЩ, обумовлений дефіцитом поліненасичених фосфатидилхолінів у носіїв поліморфізму TM6SF2 rs58542926-T. Ця алель асоціюється зі зниженими концентраціями декількох видів ліпідів у циркуляції, хоча не впливає на насичення жирними кислотами [16].
/73.jpg)
Ще одним поліморфізмом генів, який може відіграти роль у разі НАЖХП, є поліморфізм rs12979860 в гені IFNL3, який, як було показано, асоціюється з посиленням печінкового запалення та фіброзу в пацієнтів, які не страждають від ожиріння [6, 17].
Перенесення холестерилового ефіру (CETP) відіграє важливу роль у транспортуванні холестерину з периферичної тканини назад до печінки. Було встановлено, що два SNP-гена для гена CETP, а саме rs12447924 та rs12597002, пов’язані з підвищеним ризиком розвитку стеатозу печінки, особливо в осіб, які не страждають від ожиріння. В осіб без генетичного варіанта ризику поширеність НАЖХП становить лише 3–5 %, тоді як гомозиготна експресія варіанта ризику має тенденцію щодо збільшення поширеності НАЖХП до 25–33 % [16].
Фактор, що зв’язує стерольний регулятор (SREBF): SREBF відіграє важливу роль у синтезі, поглинанні та секреції внутрішньоклітинного холестерину. Підвищена експресія SREBF-2 пов’язана з більш тяжким гістологічним варіантом НАЖХП. Зокрема, експресія SREBF збільшується у пацієнтів, які не страждають від ожиріння та не мають цукрового діабету, пацієнти з експресією SREBF мають більше шансів щодо розвитку НАСГ протягом тривалого періоду часу (коефіцієнт шансів 2,9; 95% ДІ: 2,1–4,2) [5].
Нарешті, нещодавнє дослідження на тваринних моделях висунуло гіпотезу, що дефіцит фосфатидилетаноламіну N-метилтрансферази (ФЕМТ) може відіграти ключову роль у розвитку НАСГ в осіб без ожиріння. ФЕМТ — фермент, що бере участь у синтезі фосфатидилхоліну в клітинах печінки [18]. ФЕМТ-нокаутні миші на дієті з високим умістом сахарози та жиру не мали ожиріння чи інсулінорезистентності порівняно з контрольною групою [13].
Ген LYPLAL1 (Lysophospholipase like 1) може сприяти змінам рівня циркулюючого та печінкового тригліцеридів, регулюючи метаболізм глюкози в печінці, як і GCKR. Це підтверджується відкриттям Ahn та співавт., які продемонстрували, що інгібування LYPLAL1 призводить до збільшення вироблення глюкози в гепатоцитах людини, щурів та мишей [16].
Печінка здатна до ліпогенезу de novo, синтезовані жирні кислоти надходять у басейн печінкових жирних кислот, який також поповнюється за рахунок харчових жирів та циркулюючих вільних жирних кислот, отриманих здебільшого завдяки ліполізу жирової тканини або впливу ліпопротеїнової ліпази. Жирні кислоти підлягають окислювальному шляху або естерифікуються до тригліцеридів, які можуть зберігатися у вигляді крапель та/або використовуватися для синтезу ЛПДНЩ для секреції з печінки. Відповідно до цього GCKR rs1260326-T, що підсилює ліпогенний шлях, надаючи більше субстратів для біосинтезу жирних кислот, збільшує ризик cтеатозу печінки та підвищує концентрацію всіх апоБ-умісних ліпопротеїнів. LYPLAL1 може функціонувати за тим же шляхом печінкового метаболізму глюкози та ліпогенезу, оскільки метаболічні ефекти GCKR rs1260326-T та LYPLAL1 rs12137855-C дуже схожі. TM6SF2 rs58542926-T змінює секреторний шлях, що призводить до накопичення ліпідів у печінці та зниження рівня циркулюючих ліпідів та ліпопротеїдів. PNPLA3 rs738409-G, у свою чергу, підсилює накопичення тригліцеридів за рахунок зменшення гідролізу тригліцеридів до жирних кислот, але безпосередньо не сприяє секреції ЛПДНЩ і, таким чином, не призводить до серйозних наслідків для циркуляції.
Інсулінорезистентність
Цілком імовірно, що значна частина пацієнтів з НАЖХП, які не мають ожиріння, належать до фенотипу суб’єктів з метаболічним ожирінням із нормальною вагою (МОНВ), описаних щонайменше у 5 % популяції, які демонструють змінену чутливість до інсуліну та підвищений серцево-судинний ризик [19].
При порівнянні метаболічно здорових та метаболічно «нездорових» суб’єктів з нормальною вагою остання популяція продемонструвала підвищення вмісту жиру в печінці, збільшення вісцеральної жирової маси та товщини комплексу інтими-медії (cIMT), але нижчу підшкірну жирову масу, чутливість до інсуліну та секрецію інсуліну. Збільшення жиру в печінці, ймовірно, пов’язане зі зниженою здатністю до зберігання жиру в підшкірній жировій тканині, поєднаній зі зниженою мітохондріальною функцією та посиленням ліпогенезу de novo в печінці. Крім того, в осіб з МОНВ також наявний прозапальний стан, який характеризується зниженою концентрацією адипонектину [5].
Етнічна приналежність суттєво впливає на поширеність MOНВ за даними досліджень [13].
У спектрі МОНВ можна виділити фенотип ліподистрофії. Ці суб’єкти, як правило, демонструють відсутність жиру в класичному підшкірному депо, але характеризуються великим ектопічним скупченням ліпідів у скелетній мускулатурі та печінці, пов’язаним з вираженою резистентністю до інсуліну [20].
Важливість складу тіла у виникненні та прогресуванні НАЖХП також підтверджується тим фактом, що саркопенія, визначена як прогресуюча і генералізована втрата скелетної м’язової маси, сили та функції, є фактором ризику розвитку НАЖХП [21]. Резистентність до інсуліну в жировій тканині виникає на етапі внутрішньоутробного розвитку плода і зберігається в неонатальний період і в зрілому віці.
Італійська група вчених описала зв’язок затримки внутрішньоутробного розвитку з НАЖХП у дітей та більш серйозною активністю захворювання за даними морфології, незалежно від резистентності до інсуліну. У середньому віці 11 років більшість досліджуваних (80 %) мали інсулінорезистентність, незважаючи на нормальний ІМТ та дуже низьку поширеність метаболічних порушень [22].
Дослідження виявили, що резистентність до інсуліну пов’язана з великим розміром підшкірних адипоцитів, і це свідчить про те, що магістральний жир може відігравати більшу роль у розвитку НАЖХП, ніж надлишок вісцерального жиру. У дорослому віці гіпертрофія є основним механізмом підвищення маси жирової тканини. Вікова залежність механізмів, за допомогою яких маса жирової тканини зростає, може бути актуальною в різних соціально-економічних контекстах. Наприклад, в країнах, що розвиваються в економічному відношенні, доступ до надмірних калорій часто виникає в зрілому віці після тривалого періоду дитячого недоїдання, тоді як гіперкалорійна дієта та відповідно ожиріння часто розвиваються в дитинстві у країнах Заходу. Наявність меншої кількості адипоцитів протягом дитинства дозволила популяції з нормальною вагою здебільшого змінити об’єм адипоцитів у дорослому віці, розвиваючи особливості МС при меншій жировій масі, чим частково пояснюється, чому у цих осіб легко розвивається НАЖХП [19].
Дієта та фізична активність
Взагалі навіть серед популяції з нормальною вагою особи, які страждають від НАЖХП, зазвичай споживають більшу кількість калорій. Сидячий спосіб життя, як відомо, пов’язаний зі збільшенням поширеності інсулінорезистентності, у пацієнтів з нормальною вагою встановлено роль малорухливого способу життя у виникненні НАЖХП [5].
Мікробіом
Нині існує значна кількість джерел, що вказують на ключову роль мікробіому кишечника в регуляції метаболічного гомеостазу. На склад мікробіому впливають вік, стать, раса, гормональний статус та особливості дієти. У мікробіомі за наявності ожиріння відбуваються багатогранні зміни, включаючи підвищення рівня протеобактерій та зміну співвідношення «фірмікути/бактероїди». Cтеатоз печінки був пов’язаний з меншою часткою Bacteroides та більшою часткою Prevotella та Porphyromonas, а також більшою кількістю етанол-продукуючих бактерій [23].
Дослідження мікробіому кишечника у пацієнтів з НАЖХП без ожиріння порівняно з пацієнтами з ожирінням виявило тенденцію до якісних відмінностей групи НАЖХП порівняно з ожирінням, із трикратною меншою чисельністю видів Fecalibacterium і Ruminococcus та відносним дефіцитом лактобактерій [24].
Duarte та співавт. описали той факт, що у підгрупі худорлявих хворих з НАСГ відзначалась менша кількість румінококів і дефіцит лактобактерій порівняно з пацієнтами з надмірною вагою та ожирінням з НАСГ [25].
Дані щодо метаболому у пацієнтів з нормальною вагою та НАЖХП обмежені. Дослідження показали, що НАЖХП у осіб без ожиріння може мати чіткий метаболомічний профіль, при цьому рівень лізофосфатидилхоліну, фосфатидилхоліну, тирозину та валіну відрізняється від рівня групи пацієнтів з НАЖХП та ожирінням [26].
Особливості клінічного профілю НАЖХП у пацієнтів без ожиріння
У більшості пацієнтів відсутні специфічні симптоми або ознаки НАЖХП. Втома, дискомфорт у правому підребер’ї, випадкове виявлення гіпертрансаміназемії або печінкового стеатозу при ультразвуковому дослідженні, за винятком вторинних причин стеатозу, залишаються найпоширенішими методами попередньої діагностики НАЖХП [5]. Немає даних, які б свідчили про те, що худі особи з НАЖХП мають відмінності у клінічній симптоматиці. Порушення повсякденної діяльності зазвичай не відбувається, аж допоки не розвинеться цироз.
Як видно, поширеність супутніх захворювань, що наявні у пацієнтів з НАЖХП та ожирінням, таких як цукровий діабет 2 типу, гіпертонія та дисліпідемія, аналогічно підвищена серед осіб з нормальною вагою та НАЖХП [27].
Антропометричні дані у хворих з НАЖХП без ожиріння різняться залежно від наявності основного ліподистрофічного розладу та загального збільшення вісцеральної жирової тканини [5].
Лабораторні ознаки
Відомо, що порівняно з пацієнтами з ожирінням без НАЖХП пацієнти з НАЖХП без ожиріння мають схожий ступінь дисліпідемії та гіпертригліцеридемії [5]. Такі пацієнти також мають більш високий рівень феритину в сироватці крові, гемоглобіну та гематокриту порівняно з пацієнтами з ожирінням без НАЖХП [28]. Епідеміологічне дослідження, проведене в Індії, повідомляє про сільську громаду, представники якої не страждають від ожиріння (середній ІМТ (19,6 ± 6,6) кг/м2), серед них є особи з НАЖХП, які мають більш високий рівень тригліцеридів, більш високий рівень глюкози в крові та більше підшкірного жиру, ніж ті, які не мають НАЖХП [29].
Гістологічний спектр та прогноз захворювання
Гістологію печінки можна розглядати з двох позицій:
1) загальні риси НАЖХП;
2) висновки, що свідчать про унікальні відмінності у пацієнтів з НАЖХП без ожиріння.
Більшість робіт свідчить, що дані морфологічного дослідження печінки пацієнтів з нормальною вагою ідентичні відповідним змінам у пацієнтів з НАЖХП та ожирінням. Хоча є роботи, в яких продемонстровано виражене лобулярне запалення та балонування у пацієнтів з НАЖХП і нормальною вагою, навіть порівняно з пацієнтами з надмірною вагою з НАЖХП [30].
Інше дослідження, за участю 430 морфологічно підтверджених випадків НАЖХП, показало, що 55 % пацієнтів без вісцерального ожиріння мали НАСГ та фіброз F2, незважаючи на більш м’які метаболічні зміни [5]. Навпаки, в іншій ретроспективній серії, включаючи 669 пацієнтів з морфологічно підтвердженою НАЖХП, порівняно з пацієнтами з надмірною вагою та ожирінням у суб’єктів із НАЖХП з ІМТ < 25 кг/м2 спостерігалась менша частота МС та діабету, менш виражені зміни з боку серцево-судинної системи, оцінювані за товщиною комплексу інтими-медії, а також поширеність каротидних бляшок та менша поширеність гістологічно підтвердженого НАСГ та фіброзу ступеня F2 або вище [31].
Отже, пацієнти з нормальною вагою та НАЖХП можуть мати більш легкий ступінь морфологічних змін або виявляти однакові характеристики порівняно з хворими на ожиріння та НАЖХП, але в цілому можуть мати весь спектр ураження печінки. Це говорить про те, що ризик виникнення цирозу для хворих з НАЖХП та нормальною вагою може не сильно відрізнятись від такого у пацієнтів з ожирінням, і що після встановлення діагнозу НАСГ ожиріння може не бути головним рушієм прогресування фіброзу.
Діагностичний підхід та терапевтична тактика
Важливо діагностувати та лікувати специфічні етіології НАЖХП у осіб з нормальною вагою у разі їх наявності. Адже інші менш поширені специфічні стани можуть спричинити стеатоз печінки. Це целіакія, муковісцидоз, інфекція вірусом гепатиту С, різке зниження ваги, білково-енергетична недостатність, хвороба Вільсона, прийом деяких стеатогенних лікарських засобів тощо. Оцінюючи пацієнта з НАЖХП без ожиріння, необхідно виключати ці етіологічні чинники, оскільки вони можуть вимагати іншого підходу до діагностики та лікування [5]. В інших випадках діагностичний підхід орієнтований на виявлення ступеня накопичення жиру в печінці та оцінку наявності фіброзу. Супутні захворювання повинні бути ретельно оцінені та підлягати корекції, оскільки суттєво впливають на загальну смертність.
НАЖХП зазвичай розглядається як діагноз виключення у пацієнтів з ожирінням/надмірною вагою зі стеатозом печінки, виявленим за допомогою методів візуалізації, та за відсутності інших захворювань печінки. Такий підхід не є раціональним, коли йдеться про НАЖХП у пацієнтів без ожиріння. Низка авторів пропонують використовувати для діагностики НАЖХП у дітей без ожиріння критерії, викладені у табл. 1 [32].
Жирова фракція печінки, виміряна за допомогою МРТ-спектроскопії, стала добрим неінвазивним інструментом для кількісної оцінки стеатозу при НАЖХП [33]. Використання контрольованого параметра ультразвукового затухання (CAP) разом із транзієнтною еластографією забезпечує широко доступний та відносно недорогий спосіб діагностики печінкового стеатозу [34].
DEXA-сканування дозволяє провести аналіз складу тіла, що служить незалежним інструментом у плані контролю за зменшенням жирової маси. Загальне споживання калорій повинно відповідати індивідуальним потребам пацієнта, щоб зменшити масу жирової тканини та підтримати або відновити м’язову масу. Втрата ваги та фізична підготовка взаємопов’язані, і поєднання змін у харчуванні та фізичних навантажень має велике значення. Ці дані також підтверджуються іншими дослідженнями, де зроблено висновок, що зміна маси тіла є потужним незалежним фактором для регресії НАЖХП у людей, які не страждають від ожиріння, незалежно від базового ІМТ [35].
Зниження ваги більше ніж на 5 % було пов’язане з поліпшенням загального показника гістологічної активності при НАЖХП незалежно від ваги тіла, не виявляючи значного покращення індивідуальних показників. Але зниження ваги на ≥ 7 % не було пов’язане з подальшим поліпшенням показника гістологічної активності у пацієнтів з нормальною вагою [36].
Хоча покращення показника гістологічної активності відзначено в обох групах пацієнтів (з НАЖХП та ожирінням/без ожиріння), жодна група не досягла зменшення ступеня фіброзу зі зниженням ваги протягом року. Це може вказувати на те, що вплив втрати ваги на фіброз менший, ніж вплив на загальну гістологічну активність, або що для виявлення змін показників фіброзу потрібна тривалість спостереження більше року [5].
Важливо акцентувати увагу пацієнтів на необхідності регулярного фізичного навантаження, оскільки воно може специфічно знижувати вміст вісцерального жиру [37].
Фармакологічна терапія призначається для пацієнтів з активним НАСГ та фіброзом щонайменше 2 стадії. Доказів щодо ефективної фармакотерапії у худорлявих пацієнтів з НАСГ залишається недостатньо.
Лікування тіазолідиндіоном піоглітазоном також знижує ризик діабету та покращує секрецію інсуліну у суб’єктів, що не страждають від ожиріння, з порушенням толерантності до глюкози. Лікування на основі інкретину може бути більш ефективним для осіб, які мають надмірну вагу та страждають від ожиріння, ніж для людей із нормальною вагою, оскільки його ефективність пов’язана з втратою ваги [38].
Експериментальні моделі НАЖХП продемонстрували терапевтичний ефект використання пробіотиків при НАЖХП. Пропонується, що використання синбіотиків може бути ефективним у лікуванні пацієнтів з НАЖХП без ожиріння [39]. Крім того, оскільки більшість клінічних випробувань пов’язані з розробкою лікарських препаратів для пацієнтів з НАЖХП або НАСГ із вираженим ожирінням, то незрозуміло, чи буде терапевтичний підхід однаково ефективний для пацієнтів з НАЖХП, які не страждають від ожиріння.
Отже, особи з номальною вагою та НАЖХП є чітко визначеною групою пацієнтів порівняно зі здоровими людьми, в осіб з номальною вагою та НАЖХП наявними є фактори метаболічного ризику (дисліпідемія, артеріальна гіпертензія, діабет та інсулінорезистентність), ймовірно, через більш розвинену дисфункціональну жирову тканину, не обмежену її вісцеральним компонентом. Хоча дані літератури свідчать про те, що ці пацієнти мають більш сприятливі метаболічні характеристики порівняно з хворими на ожиріння, дані про довгострокову виживаність та смертність є недостатніми та суперечливими. Застосування чітко детермінованих стратегій фенотипізації в клінічних випробуваннях для розподілення суб’єктів, які страждають від ожиріння та які не страждають від нього, допоможе точніше зрозуміти патофізіологію захворювань печінки.
Висновки
1. Наявність НАЖХП у суб’єктів із ІМТ в межах етнічного специфічного 25 кг/м2 на кавказькій популяції та 23 кг/м2 в азіатській популяції була визначена як НАЖХП у осіб з номальною вагою.
2. НАЖХП у осіб з номальною вагою була спочатку описана серед населення Азії; вона може бути діагностована приблизно у 5–26 % загальної чисельності населення Азії та 7–20 % у західних країнах.
3. Патофізіологічні механізми повністю не вивчені й можуть включати дисфункціональну жирову тканину, змінений склад тіла, генетичні мутації, епігенетичні зміни, що відбуваються на етапі внутрішньоутробного розвитку, та зміни з боку мікробіоти кишечника.
4. Для діагностики НАЖХП у пацієнтів з нормальною вагою критично важливим є виявлення вторинної етіології стеатозу печінки.
5. Хоча цей фенотип, як правило, має більш сприятливий метаболічний профіль порівняно з пацієнтами, які мають ожиріння, у пацієнтів з НАЖХП та нормальною вагою може розвинутися повний спектр ураження печінки.
6. Дані щодо тривалого прогнозу цієї групи пацієнтів є недостатніми та суперечливими, але дозволяють припустити, що НАЖХП у пацієнтів з нормальною вагою не є «доброякісною» хворобою.
7. Диференціальних схем терапії пацієнтів з НАЖХП та нормальною вагою досі не розроблено, як терапія першої лінії розглядається модифікація способу життя.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.

/71.jpg)
/72.jpg)
/73.jpg)
/76.jpg)