Резюме
Актуальність. Актуальність проблеми післяопераційної когнітивної дисфункції (ПОКД) обумовлена високою частотою розвитку (до 30 % у некардіохірургічних пацієнтів), істотними економічними витратами на відновлення когнітивних функцій, а також потребою в соціальній адаптації таких пацієнтів. Мета: визначити актуальність проблеми ПОКД для отоларингологічних пацієнтів після виконання оперативних втручань в умовах загальної анестезії з використанням керованої артеріальної гіпотензії та дослідити ефективність профілактики ПОКД призначенням холіну альфосцерату та етилметилгідроксипіридину сукцинату. Матеріали та методи. У дослідження включено 127 хворих (74 чоловіки, 53 жінки) — отоларингологічних пацієнтів, яким були проведені оперативні втручання під загальною анестезією з використанням керованої гіпотензії. Пацієнтів розподілили на 4 групи: група 1 — контролю (n = 33), група 2 — етилметилгідроксипіридину сукцинату (n = 32), група 3 — холіну альфосцерату (n = 30), група 4 — холіну альфосцерату в комбінації з етилметилгідроксипіридину сукцинатом (n = 32). Результати. В групі контролю ПОКД діагностували у 39,4 % пацієнтів. Встановлено, що у пацієнтів контрольної групи в ранньому післяопераційному періоді підвищення продуктів пероксидації (карбонільних груп протеїнів, дієнових кон’югатів, малонового діальдегіду) та інтерлейкіну-18) було більшим, ніж у групах пацієнтів, які отримували етилметилгідроксипіридину сукцинат. У групах пацієнтів, які отримували холіну альфосцерат, не виявлено вірогідного збільшення рівня нейронспецифічної єнолази порівняно з групами пацієнтів, які не отримували холіну альфосцерат. Призначення холіну альфосцерату асоціювалося з вірогідним зниженням ризику виникнення ПОКД з 39,4 до 16,7 % (відношення шансів (ВШ) 3,25; 95% довірчий інтервал (ДІ) [1,40–10,65]; p < 0,05), а холіну альфосцерат у комбінації з етилметилгідроксипіридину сукцинатом — з 39,4 до 12,5 % (ВШ 4,55; 95% ДІ [1,29–16,02]), p < 0,05). Висновки. Призначення холіну альфосцерату в комбінації з етилметилгідроксипіридину сукцинатом дозволяє знизити ризик розвитку ПОКД в ранньому післяопераційному періоді.
Актуальность. Актуальность проблемы послеоперационной когнитивной дисфункции (ПОКД) обусловлена высокой частотой развития (до 30 % у некардиохирургических пациентов), существенными экономическими затратами на восстановление когнитивных функций, а также необходимостью социальной адаптации таких пациентов. Цель: определить актуальность проблемы ПОКД для отоларингологических пациентов после выполнения оперативных вмешательств в условиях общей анестезии с использованием управляемой артериальной гипотензии, а также исследовать эффективность профилактики ПОКД назначением холина альфосцерата и этилметилгидроксипиридина сукцината. Материалы и методы. В исследование включены 127 больных (74 мужчины, 53 женщины) — отоларингологических пациентов, которым были проведены оперативные вмешательства под общей анестезией с использованием управляемой гипотензии. Пациентов распределили на 4 группы: группа 1 — контроль (n = 33), группа 2 — этилметилгидроксипиридина сукцината (n = 32), группа 3 — холина альфосцерата (n = 30), группа 4 — холина альфосцерата в комбинации с этилметилгидроксипиридина сукцинатом (n = 32). Результаты. В группе контроля ПОКД диагностировали у 39,4 % пациентов. Установлено, что у пациентов контрольной группы в раннем послеоперационном периоде уровень продуктов пероксидации (карбонильных групп протеинов, диеновых конъюгатов, малонового диальдегида) и интерлейкина-18 был выше, чем в группах пациентов, получавших этилметилгидроксипиридина сукцинат. В группах пациентов, получавших холина альфосцерат, не обнаружено достоверного увеличения уровня нейронспецифической енолазы по сравнению с группами пациентов, не получавших холина альфосцерат. Назначение холина альфосцерата ассоциировалось с достоверным снижением риска развития ПОКД с 39,4 до 16,7 % (ОШ (отношение шансов) 3,25; 95% доверительный интервал (ДИ) [1,40–10,65]; p < 0,05), а холина альфосцерата в сочетании с этилметилгидроксипиридина сукцинатом — с 39,4 до 12,5 % (ОШ 4,55; 95% ДИ [1,29–16,02]), p < 0,05). Выводы. Назначение холина альфосцерата в комбинации с этилметилгидроксипиридина сукцинатом позволяет снизить риск развития ПОКД в раннем послеоперационном периоде.
Background. The urgency of the problem of postoperative cognitive dysfunction (POCD) is due to the high frequency of its development (up to 30 % in non-cardiac surgery patients), which entails a number of psychosomatic complications with the need for social adaptation of such people, as well as significant economic costs for their treatment. The purpose of the study was to determine the relevance of the problem of postoperative cognitive dysfunction for otolaryngological patients after surgery under general anesthesia with controlled arterial hypotension and to investigate the effectiveness of POCD prevention by administering choline alfoscerate and ethylmethylhydroxypyridine succinate. Materials and methods. The study included 127 otolaryngological patients (74 men, 53 women) who underwent surgery under general anesthesia with controlled hypotension. Patients were divided into 4 groups: group 1 — controls (n = 33), group 2 — ethylmethylhydroxypyridine succinate (n = 32), group 3 — choline alfoscerate (n = 30), group 4 — patients who were administered choline alfoscerate in combination with ethylmethylhydroxypyridine succinate (n = 32). Results. POCD was diagnosed in 39.4 % of patients in the control group. Patients in the control group in the early postoperative period were found to have higher levels of peroxidation products (carbonyl groups of proteins, diene conjugates, malondialdehyde) and interleukin 18 than in the groups of patients receiving ethylmethylhydroxypyridine succinate. No significant increase in the level of neuron specific enolase was found in the groups of patients who received choline alfoscerate in comparison with the groups of patients who did not receive it. The administration of choline alfoscerate was associated with a significant reduction in the risk of POCD — from 39.4 to 16.7 % (odds ratio (OR) 3.25; 95% confidence interval (CI) [1.40–10.65]; p < 0.05), and choline alfoscerate in combination with ethylmethylhydroxypyridine succinate — from 39.4 to 12.5 % (OR 4.55; 95% CI [1.29–16.02], p < 0.05). Conclusions. The administration of choline alfoscerate in combination with ethylmethylhydroxypyridine succinate reduces the risk of developing POCD in the early postoperative period.
Вступ
Протягом останніх років післяопераційна когнітивна дисфункція (ПОКД) через її високу поширеність та багатофакторність залишається актуальною проблемою сучасної анестезіології, адже захист центральної нервової системи від пошкоджуючих факторів і збереження її регулюючої функції є одним із найважливіших і найскладніших аспектів роботи лікаря-анестезіолога [3]. Тож, якщо вести відлік від 1955 року, коли була опублікована стаття P.D. Bedford «Adverse cerebral effects of anaesthesia on old people» у журналі Lancet, то можна говорити, що ця проблема вже понад 60 років залишається у фокусі уваги клініцистів, перш за все через високу частоту ускладнень, дискутабельність питання її профілактики та корекції, збільшення термінів перебування в стаціонарі та витрат на лікування, зниження якості життя пацієнтів і виживаності протягом одного року після операції, збільшення (в західних країнах) числа і розмірів судових позовів з приводу анестезіологічних помилок [4].
L.S. Rasmussen у 2001 році запропонував визначення післяопераційної когнітивної дисфункції як когнітивного розладу, який розвивається в ранньому і зберігається у віддаленому післяопераційному періоді, що клінічно проявляється порушенням пам’яті та інших когнітивних функцій і підтверджується зниженням когнітивних функцій не менше ніж на 10 % від рівня, що був перед операцією, даними нейропсихологічного тестування [16]. Робоча група, що складається з фахівців різних спеціальностей, на початку 2018 року запропонувала термін «періопераційні нейрокогнітивні розлади» [9, 11, 12]. Згідно зі статистичними даними, частота виникнення ПОКД варіює від 7 до 83 % залежно від виду хірургічного втручання [4, 6].
Згідно з результатами дослідження ISPOCD I [13], виникнення післяопераційних когнітивних розладів має мультимодальний генез з наступними провідними патогенетичними факторами: похилий вік, тривалість анестезії, низький рівень освіти, повторна операція, післяопераційні інфекції, респіраторні ускладнення. Результати експериментальних досліджень, перші з яких були проведені ще понад два десятиліття тому, показали негативний ефект ішемічно-гіпоксичних змін у головному мозку, які включають декілька механізмів: ураження клітин, викликане вільними радикалами, оксидативний стрес, ексайтотоксичність, запалення й імунна патологія, секвестрація молекул і т.п. у різних видів тварин, включаючи приматів. Ці зміни, імовірно, є важливою ланкою патогенезу різного роду порушень, зокрема ПОКД [3, 4, 6, 8] і пояснюють той факт, що приблизно у третини пацієнтів, яким проводилась загальна анестезія з використанням керованої артеріальної гіпотензії, відзначаються когнітивні порушення у вигляді зниження пам’яті, складності концентрації уваги, швидкої втомлюваності.
Тому метою нашого дослідження було визначити актуальність проблеми ПОКД для отоларингологічних пацієнтів різного віку після виконання оперативних втручань в умовах загальної анестезії з використанням керованої артеріальної гіпотензії, а також дослідити ефективність профілактики ПОКД призначенням холіну альфосцерату та етилметилгідроксипіридину сукцинату.
Матеріали та методи
На базі отоларингологічного відділення КНП «Вінницька обласна клінічна лікарня ім. М.І. Пирогова ВОР» проведено проспективне контрольоване дослідження, в якому взяли участь 127 хворих (74 чоловіки, 53 жінки) — отоларингологічних пацієнтів, яким були здійснено оперативні втручання під загальною анестезією з використанням керованої гіпотензії. Вік хворих був від 18 до 65 років (у середньому — 39,47 ± 14,79 року; медіана віку — 38,0, інтерквартильний розмах — 25-й та 75-й процентилі — 26,0–54,0 року).
Критеріями включення в дослідження були: вік понад 18 років; заплановане отоларингологічне оперативне втручання під загальною анестезією тривалістю 1 година або більше із застосуванням керованої гіпотензії; анестезіологічний ризик за ASA — ІІ/ІІІ; відсутність у пацієнтів супутніх вад слуху та зору; захворювань нервової системи (деменція, гостре порушення мозкового кровообігу та ін.), деменції різного генезу (вихідна оцінка за шкалою MMSE — менше 23 балів), психічних захворювань; інформована згода хворого на участь у дослідженні.
Отоларингологічні оперативні втручання проводилися з приводу викривлення перегородки носа та хронічного гіпертрофічного/вазомоторного риніту, гострого пансинуситу/гемісинуситу, хронічного поліпозного пансинуситу, хронічного декомпенсованого тонзиліту, гострого гнійного середнього отиту, ускладненого мастоїдитом, хронічного мезотимпаніту, хронічного епітимпаніту, сторонніх предметів та остеом навколоносових пазух.
Всі оперативні втручання були проведені під інгаляційним ендотрахеальним севофлюрановим наркозом у комбінації з фентанілом та недеполяризуючими міорелаксантами. Згідно з даними наркозних карт прооперованих пацієнтів, для анестезіологічного забезпечення використовувались однакові методики наркозу. Для досягнення керованої артеріальної гіпотензії під час операції використовували інфузію 0,5% розчину урапідилу.
Пацієнтів розподілили на 4 групи: група 1 — контрольна — без призначення досліджуваних препаратів для профілактики ранньої ПОКД (n = 33); група 2 — пацієнтам призначали антиоксидант — етилметилгідроксипіридину сукцинат дозою 300 мг у 200 мл 0,9% розчину натрію хлориду внутрішньовенно (в/в) краплинно зі швидкістю 40–60 крапель на хвилину під час оперативного втручання після завершення введення препарату для керованої артеріальної гіпотензії, потім — внутрішньом’язово (в/м) по 100 мг 2 рази на добу протягом 2–4 днів (n = 32); група 3 — пацієнтам призначали парасимпатоміметик — холіну альфосцерат дозою 2000 мг в/в за 20 хвилин до завершення оперативного втручання та 1000 мг в/в через 24 години після операції (n = 30); група 4 — пацієнтам призначали комбіновано парасимпатоміметик і антиоксидант у наведених вище дозуваннях (n = 32).
Після отримання інформованої згоди пацієнта за день до операції проводили тестування когнітивних функцій з використанням тесту П’єрона-Рузера для вивчення рівня концентрацiї уваги, коректурної проби (тест Бурдона) для дослідження розумової працездатності та обсягу уваги, тесту Лурія для оцінки стану короткострокової механічної пам’яті. Повторну оцінку когнітивних функцій здійснювали на 3-й день після операції. Діагноз ПОКД встановлювали згідно з рекомендаціями Міжнародної робочої групи з номенклатури періопераційних когнітивних розладів (International Working Party for Nomenclature of Perioperative Cognitive Disorders), якщо когнітивне зниження виявлялося нижче від порогового значення на 10 % та більше [4].
Стан ферментативної антиоксидантної системи вивчали за активністю супероксиддисмутази та рівнем протеїнових сульфгідрильних груп (SH-групи). Активність супероксиддисмутази визначали за ступенем гальмування окислення кверцетину. Рівень SH-груп у сироватці крові визначали за реакцією з реактивом Елмана — 5,5’-дитіобіс(2-нітробензоатом).
Активність вільнорадикального окислення ліпідів оцінювали за вмістом первинних та вторинних продуктів ліпопероксидації відповідно — дієнових кон’югатів та малонового діальдегіду в крові, а активність процесів окисної модифікації протеїнів оцінювали на основі визначення вмісту карбонільних груп протеїнів у сироватці крові. Вміст дієнових кон’югатів оцінювали за світлопоглинанням ліпідного екстракту крові в ультрафіолетовій ділянці спектра. Рівень малонового діальдегіду визначали за реакцією з тіобарбітуровою кислотою за набором «ТБК-Агат» («Биоконт», РФ), а рівень карбонільних груп окисно-модифікованих протеїнів — за реакцією з 2,4-динітрофенілгідразином.
Рівень інтерлейкіну-18 (ІЛ-18) у сироватці крові визначали імуноферментним методом згідно з інструкцією до готового комерційного набору «Интерлейкин-18-ИФА-БЕСТ» («Вектор-БЕСТБ», РФ), а вміст нейрон-специфічної єнолази в сироватці крові — імуноферментним методом за набором «НСЕ-ІФА» («Хема», Україна) відповідно до інструкції фірми-виробника.
Статистична обробка отриманих даних виконувалася у статистичному пакеті SPSS 2» (SPSS Inc.) з використанням параметричних та непараметричних методів оцінки отриманих результатів. Кількісні параметри подані у вигляді M ± σ (середнє значення ± середнє квадратичне відхилення). Для порівняння непараметричних даних застосовували методи Краскела — Уолліса (для декількох груп) та Манна — Уїтні для двох груп незалежних сукупностей. Порівняння зв’язаних вибірок проводили за допомогою критерію Вілкоксона.
Результати та обговорення
Окремі характеристики досліджуваних груп, які подані в табл. 1, свідчать про те, що виділені нами групи статистично не відрізнялися за статтю, середнім віком і відповідали критеріям включення в дослідження (табл. 1).
За результатами оцінки когнітивних функцій перед операцією середня оцінка концентрації уваги за тестом П’єрона — Рузера у групі 1 становила 74,07 ± 20,59, у групі 2 — 73,59 ± 12,39, у групі 3 — 77,66 ± 12,73 та в групі 4 — 74,23 ± 14,54; продуктивності уваги (коректурна проба) — 14,91 ± 2,19; 14,47 ± 2,78; 15,53 ± 2,81 та 15,22 ± 2,11; за тестом Лурія середній показник становив відповідно 6,96 ± 1,14; 7,18 ± 1,07; 7,20 ± 0,68 та 7,16 ± 0,94, що свідчить про статистично вірогідну однорідність груп (р > 0,05; критерій Краскела — Уолліса).
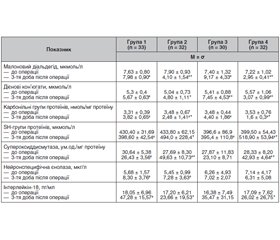
У доопераційному періоді міжгрупових відмінностей у концентрації показників інтенсивності вільно-радикальних процесів виявлено не було (р > 0,05; критерій Краскела — Уолліса) (табл. 2).
На 3-тю добу у пацієнтів групи 1 (контроль) у післяопераційному періоді після загальної анестезії в умовах керованої гіпотензії виявлена статистично значуща активація генерації вільних радикалів та активних форм кисню, про що свідчить вірогідне збільшення рівнів карбонільних груп протеїнів, дієнових кон’югатів, малонового діальдегіду та зміни редокс-статусу протеїнів порівняно з вихідними показниками до операції (відповідно: р < 0,001, р = 0,005 та р = 0,001; критерій Манна — Уїтні). Процеси інтенсифікації генерації активних форм кисню супроводжувалися паралельним зниженням активності антиоксидантної системи з розвитком антиоксидантного дисбалансу. Так, у групі 1 активність супероксиддисмутази в крові була вірогідно нижчою в післяопераційному періоді порівняно з доопераційними показниками (відповідно: р = 0,001 та р < 0,001; критерій Манна — Уїтні) (табл. 2).
/89.jpg)
Водночас аналіз показав, що в групах 2 та 4, в яких пацієнти отримували антиоксидант — етилметилгідроксипіридину сукцинат під час операції після припинення введення препарату для керованої артеріальної гіпотензії та в ранньому післяопераційному періоді рівні продуктів перекисного окислення білків і ліпідів були вірогідно нижчими як порівняно з відповідними доопераційними показниками (р < 0,05; критерій Вілкоксона), так і з аналогічними показниками групи 1 (р < 0,05; критерій Манна — Уїтні) (табл. 2). В обох цих групах також виявлена більш висока активність супероксиддисмутази та рівні SH-груп протеїнів у крові після операції, ніж у пацієнтів групи 1 (р < 0,05; критерій Краскела — Уолліса).
Згідно з табл. 2, при порівнянні груп не було виявлено вірогідних відмінностей у вихідних середніх значеннях нейронспецифічної єнолази та ІЛ-18, тоді як у ранньому післяопераційному періоді в усіх досліджуваних групах мали місце зміни рівнів цих лабораторних показників. Так, у пацієнтів груп 3 та 4, які отримували парасимпатоміметик — холіну альфосцерат, в ранньому післяопераційному періоді виявили тенденцію до більш низьких рівнів нейронспецифічної єнолази порівняно з пацієнтів груп 1 та 2, які не отримували холіну альфосцерат (р > 0,05; критерій Краскела — Уолліса), також у групах 2, 3 та 4 були вірогідно нижчими показники ІЛ-18 (р < 0,05; критерій Краскела — Уолліса).
Збільшення концентрації ІЛ-18 і нейронспецифічної єнолази в крові на 3-тю добу після операції асоціювалося зі зниженням швидкості реакції в нейродинамічних тестах. Так, збільшення концентрації ІЛ-18 у крові на 3-тю добу після операції було асоційоване з меншою кількістю перероблених знаків у тесті коректурної проби Бурдона (r = –0,309; p < 0,001). Крім цього, висока концентрація нейронспецифічної єнолази в крові була асоційована з меншою кількістю запам’ятованих слів (тест Лурія) (r = –0,412; p < 0,001) та також меншою кількістю опрацьованих знаків у тесті коректурної проби (r = –0,478; p < 0,001).
Зниження показника однієї/декількох аналізованих когнітивних функцій мали 13 із 33 пацієнтів групи 1, що становило 39,4 %. Ранню ПОКД діагностували у 9 (28,1 %) пацієнтів із групи 2, у 5 (16,7 %) пацієнтів із групи 3 та у 4 (12,5 %) пацієнтів із групи 4. Порівняно з групою 1 (контроль) різниця між інцидентністю ранньої ПОКД була статистично вірогідною в групах 3 та 4 (відповідно відношення шансів (ВШ) 3,25; 95% довірчий інтервал (ДІ) [1,40–10,65]; p = 0,046 та ВШ 4,55; 95% ДІ [1,29–16,02]; p = 0,013). Значення ВШ свідчить про те, що ризик виникнення ранньої ПОКД у контрольній групі вірогідно перевищував такий у групах 3 та 4 у 3,25 та 4,55 раза.
Обговорення
Проблема синдрому ПОКД як прояву ураження центральної нервової системи в умовах загальної анестезії є однією з найактуальніших в анестезіології протягом останніх десятиріч. Згідно з результатами нашого дослідження, частота виникнення ранньої ПОКД може становити до 39,4 % в отоларингологічних хворих, яким проведено оперативні втручання в умовах загальної анестезії в поєднанні з медикаментозною гіпотензією. Реальну поширеність ПОКД складно оцінити, адже далеко не завжди здійснюється нейропсихологічне обстеження пацієнтів у періопераційному періоді, легкі та середні форми ПОКД можуть не діагностуватися. За даними різних авторів, частота ранньої ПОКД у хірургічній практиці сягає 30 %, а стійкі когнітивні розлади у віддаленому післяопераційному періоді спостерігаються у 6–14 % пацієнтів [3, 8]. У більшості хворих покращення когнітивної функції відбувається протягом наступних 3 місяців, проте існує прямий зв’язок між розвитком ПОКД і збільшенням тривалості госпіталізації, зниженням задоволеності пацієнтів якістю надання допомоги, погіршенням їх працездатності та якості життя, а також підвищенням летальності у людей похилого віку [15].
У патогенезі ПОКД беруть участь численні фактори, зокрема метаболічні, гемореологічні, гіпоксичні, токсичні, що призводять до пошкодження стінок церебральних судин на рівні мікроциркуляторного русла, порушення обміну внутрішньоклітинного кальцію, порушення асоціативних і міжнейрональних зв’язків на рівні різноманітних структур головного мозку. В нашій попередній роботі [1] при дослідженні показників вільнорадикального процесу та антиоксидантного захисту в отоларингологічних хворих після оперативного втручання в умовах загальної анестезії з використанням керованої гіпотензії було встановлено, що в ранньому післяопераційному періоді у пацієнтів із ПОКД відзначалося вірогідне збільшення показників вільнорадикального окислення білків і ліпідів та зниження показників антиоксидантного захисту, що підтверджувалось вірогідно нижчим рівнем на 33,2 % для супероксиддисмутази порівняно з пацієнтами без ПОКД. Крім цього, гірші нейропсихологічні показники у наших пацієнтів були асоційовані з більш високою концентрацією прозапального ІЛ-18. Взаємозв’язок між частотою виникнення ПОКД і рівнем запальних медіаторів, які є незалежними факторами стрес-реакції, підтверджують і інші дослідники [10, 14]. Крім того, чимало досліджень продемонстрували асоціацію ПОКД із тривалими ефектами анестетиків у формі антихолінергічної або антикатехоламінергічної активності [14]. Зважаючи на ці дані, ми припустили можливість профілактики ПОКД при одночасному застосуванні антиоксиданту — етилметилгідроксипіридину сукцинату та нейропротектора — холіну альфосцерату, що є носієм холіну і попереднім агентом фосфатидилхоліну. Досліджувані нами групи вірогідно не відрізнялися за статтю, віком, результатами передопераційного нейропсихологічного тестування, типом та тривалістю операції, типом анестезії та післяопераційної анальгезії, тривалістю інтраопераційної керованої гіпотензії. Проте частота виникнення ранньої ПОКД вірогідно відрізняється у групах: призначення холіну альфосцерату та комбінації етилметилгідроксипіридину сукцинату з холіном альфосцератом знижує ризик виникнення ранньої ПОКД у 3,25 та 4,55 раза відповідно.
Отже, одним із методів запобігання розвитку ПОКД є періопераційне призначення нейропротекторів, зокрема похідних екзогенного холіну (холіну альфосцерат), що корелює з результатами наших попередніх досліджень і даними інших авторів [2, 4, 5, 7]. І хоча холіну альфосцерат сам по собі здійснює антиоксидантну дію [4], але результати цього дослідження свідчать про потенційне підвищення ефективності профілактики ПОКД шляхом призначення холіну альфосцерату в комбінації з етилметилгідроксипіридину сукцинатом. Останнє, ймовірно, можна пояснити різними механізмами антиоксидантної дії обох препаратів. Проте для остаточних висновків необхідне проведення подальших досліджень на великих вибірках пацієнтів.
Висновки
1. Післяопераційна когнітивна дисфункція у ранньому післяопераційному періоді (після оперативних втручань) в умовах загальної анестезії з використанням керованої гіпотензії виявляється у 39,4 % отоларингологічних пацієнтів.
2. Встановлено, що в групі пацієнтів, які не отримували холіну альфосцерат та/або етилметилгідроксипіридину сукцинат, в ранньому післяопераційному періоді підвищення нейронспецифічної єнолази та прозапального ІЛ-18 порівняно з групами пацієнтів, які отримували ці препарати, було більшим, також частіше відзначалося підвищення рівнів продуктів пероксидації — карбонільних груп протеїнів, дієнових кон’югатів та малонового діальдегіду в крові. Водночас при порівнянні показників антиоксидантного захисту — супероксиддисмутази та SH-груп протеїнів динаміка була протилежною. Підвищення концентрацій супероксиддисмутази та SH-груп протеїнів у групах пацієнтів, які отримували етилметилгідроксипіридину сукцинат, було статистично значущим порівняно з групою контролю.
3. Частота діагностованої післяопераційної когнітивної дисфункції в групі пацієнтів, яким призначали холіну альфосцерат або холіну альфосцерат у комбінації з етилметилгідроксипіридину сукцинатом, була вірогідно нижчою, ніж у групі контролю, та становила відповідно 16,7 та 12,5 % проти 39,4 % (ВШ 3,25; 95% ДІ [1,40–10,65] та ВШ 4,55; 95% ДІ [1,29–16,02]) (p < 0,05).
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.

/88.jpg)
/89.jpg)