Актуальність
Нейропатичний біль (НБ) — це гострий чи хронічний біль, викликаний ушкодженням периферичної і/або центральної нервової системи при розвитку дисфункції ноцицептивної та антиноцицептивної систем. Патофізіологічною основою нейропатичного болю є гіперзбудливість нейронів, що виникає внаслідок пластичних змін у структурах, пов’язаних із проведенням і обробкою ноцицептивних сигналів. Таким є біль при діабетичній нейропатії, постгерпетичній невралгії і невралгії трійчастого нерва. Нейропатичний біль підсилюється вночі, послаблюється під час рухів. Характерні й інші прояви сенсорної нейропатії: оніміння, печіння, парестезії. Часто — підвищена реакція на больове подразнення (гіпералгезія) або доторкання (гіперестезія), а також сприйняття небольового подразнення як больового (алодинія). Гіперестезію, гіпералгезію та алодинію об’єднують терміном «гіперпатія». Із метою верифікації нейропатичного болю проводиться оцінка чутливості (вібраційної, тактильної, температурної) або електронейроміографія.
Поширеність НБ у популяції пацієнтів із хронічним болем оцінювали переважно на підставі досліджень спеціалізованих центрів у різних країнах (Великобританія, США, Франція, Бразилія), згідно з якими поширеність хронічного болю з нейропатичними характеристиками оцінюють у діапазоні 7–10 % (Torrance N. et al., 2006; Bouhassira D., Attal N., 2011). Імовірно, поширеність НБ буде збільшуватися внаслідок глобального старіння населення, підвищення захворюваності на цукровий діабет, поліпшення виживаності хворих онкологічного профілю після хіміо-терапії. Хронічний НБ частіше відмічають у жінок (8 % проти 5,7 % у чоловіків) і пацієнтів віком > 50 років (8,9 % проти 5,6 % осіб віком < 49 років) із найчастішим ураженням нижньої ділянки спини і нижніх кінцівок, шиї та верхніх кінцівок (Bouhassira D. et al., 2008). Найчастішою причиною хронічного НБ є, імовірно, болісні поперекові та шийні радикулопатії. Відповідно до цих даних, проведене у Німеччині обстеження > 12 тис. пацієнтів із хронічним болем як ноцицептивного, так і нейропатичного типу показало, що у 40 % осіб наявні принаймні деякі характеристики НБ (печіння, оніміння, поколювання), особливо в пацієнтів із хронічним болем у спині та радикулопатією (Freynhagen R. et al., 2006).
Нейропатичний біль поділяється на периферичний та центральний.
Периферичний нейропатичний біль, пов’язаний з травмою та пошкодженням нерва, поділяється на бiль травматичної етіології, компресійної етіології та інфекційної етіології. Також є алгічні форми нейропатій та змішані причини.
У цій статті ми хочемо виствітлити виникнення нейропатичного болю інфекційної етіології. Дві найбільш часті інфекційні причини виникнення болю — вірус герпесу та нейробореліоз.
Постгерпетична невралгія (ПГН) — найбільш часте ускладнення Herpes zoster, що спостерігається у 10–20 % пацієнтів. Для цього ускладнення характерна пряма кореляція частоти розвитку і тривалості ПГН із віком. Понад 50 % пацієнтів із ПГН старші за 60 років, 75 % відносяться до вікової групи понад 75 років. Половина пацієнтів із ПГН віком понад 60 років відчувають постійний біль протягом більше 6 міс. проти 10 % хворих у віковій групі 30–50 років [6].
Найчастіше постгерпетичний біль визначають як біль, що зберігається більше ніж 3–4 міс. Інші дослідники використовують це поняття в більш ранніх стадіях захворювання. Звідси суперечливість відомостей про частоту розвитку ПГН. У випадках визначення ПГН як болю, що зберігається 3–4 тижні після загоєння висипу, поширеність його становить 8 %. Коли біль зберігається протягом 2 міс., його частота дорівнює 4,5 % [7]. Постійний біль протягом 1 міс. після висипу відчувають до 15 % нелікованих пацієнтів, близько 25 % (4 % від загальної кількості) пацієнтів відзначають збереження болю протягом року [8].
До основних факторів ризику виникнення ПГН відносять вік, жіночу стать, наявність болю в продромальний період, вираженість гострих шкірних висипань, тяжкість болю в гострому періоді.
Усі ці фактори взаємозалежні, тому більшість пацієнтів віком 50 років і старше відчувають тяжкий, нестерпний біль і мають значні шкірні висипання від гострого Herpes zoster, що набагато частіше призводить до ПГН.
Механізм розвитку ПГН до кінця не відомий, але ясно, що пошкодження нерва викликане запаленням у гострому періоді Herpes zoster. Поява нейропатичного болю обумовлена порушенням взаємодії ноцицептивних й антиноцицептивних систем, механізмів контролю збудливості ноцицептивних нейронів у ЦНС.
ПГН займає третє місце за частотою серед всіх типів нейропатичного болю і поступається в цьому тільки болям у нижній частині спини і діабетичній нейропатії.
Це ускладнення зазвичай супроводжується безліччю соматосенсорних розладів, включаючи дизестезію (неприємні патологічні відчуття, які можуть бути спонтанними або викликаними), алодинію (біль, викликаний зазвичай нешкідливим стимулом типу легкого контакту) і гіпералгезію (біль перебільшеної інтенсивності у відповідь на звичайне болісне подразнення).
ПГН прямо впливає на різні сторони життя пацієнтів, особливо похилого віку:
1) фізичний стан — хронічна втома, зниження маси тіла, фізичної активності, інсомнія;
2) психічний стан — занепокоєння, тривога, депресія, утруднення концентрації уваги;
3) соціальний статус — зниження соціальної активності, зміна соціальної ролі;
4) щоденне функціонування — одягання, прий-няття душу, їжа та ін.
В одному з досліджень було показано, що 59 % пацієнтів, які страждають від ПГН, відчували обмеження в повсякденній активності протягом більше ніж 16 років [9].
Лікувальна тактика при Herpes zoster включає два основні напрямки: противірусну терапію і купірування нейропатичного болю.
Найбільш широке застосування знайшли такі специфічні протигерпетичні препарати, як ацикловір, фамцикловір і валацикловір, які, будучи нуклеозидними аналогами, блокують вірусну реплікацію. Важливо, що противірусне лікування проявляє найвищу активність, якщо призначене протягом 72 годин від початку герпетичних висипань. У порівняльному дослідженні ацикловіру й валацикловіру показана еквівалентна ефективність щодо скорочення тривалості нейропатичної ПГН [10]. В іншому клінічному випробуванні встановлена терапевтична еквівалентність фамцикловіру й валацикловіру для неускладненого герпесу [11].
Слід звернути увагу на те, що при оперізуючому герпесі потрібно своєчасне проведення противірусної терапії в адекватній дозі, з обов’язковим парентеральним введенням препаратів, особливо у тяжких випадках, що розвинулися на тлі порушень імунної системи. Так, ацикловір необхідно вводити дорослим і дітям віком понад 12 років внутрішньовенно по 5–10 мг/кг 3 рази на день (кожні 8 год). Курс лікування в середньому становить 5 днів, плюс 3 дні після зникнення герпетичної висипки. Виявлено, що така комбінація ефективніша від монотерапії противірусними препаратами, особливо для лікування гострого болю й корекції різних аспектів якості життя пацієнтів. Комбінація ацикловір + преднізолон значно швидше усуває гостру невралгію і повертає пацієнта до звичайного життя. Щодо нейропатичного болю при ПГН, то в даний час виділяють 5 основних груп лікарських засобів: антиконвульсанти, трициклічні антидепресанти, пластир з лідокаїном, капсаїцин, опіоїдні анальгетики.
Габапентин і прегабалін — два антиконвульсанти, що найбільш часто використовуються для купірування нейропатичного болю, пов’язаного з ПГН. Препарати частіше застосовуються на початку розвитку ПГН для зменшення гострого компонента нейропатичного болю.
Препарати з доведеною ефективністю (клас А) — терапія першої лінії:
1) габапентин 1200–3600 мг/день, прегабалін 150–600 мг/день. Більш ефективна комбінація габапентину і морфіну, ніж їх роздільне застосування; прегабалін більш ефективний в монотерапії;
2) трициклічні антидепресанти — індивідуальні дози 10–250 мг/день під контролем їх концентрації в плазмі крові;
3) лідокаїн 5% місцево — до трьох пластирів на день (особливо для літніх);
4) селективні інгібітори зворотного захвату норадреналіну (СІЗЗН) — венлафаксин 200–225 мг/день, дулоксетин 60–120 мг/день.
Терапія другої лінії (клас В):
1) опіоїди (оксикодон 40–60 мг/день, трамадол), СІЗЗН, ламотриджин;
2) антиаритміки (мексилетин 450–750 мг/день — побічні ефекти з боку серця і шлунково-кишкового тракту), капсаїцин, СІЗЗН (пароксетин, флуоксетин, циталопрам).
Не отримано доказів щодо карбамазепіну, топірамату й окскарбазепіну. Установлено негативний результат застосування декстрометорфану й мемантину (антагоністів NMDA); показана неефективність низьких доз СІЗЗН (75 мг венлафаксину і 20 мг дулоксетину).
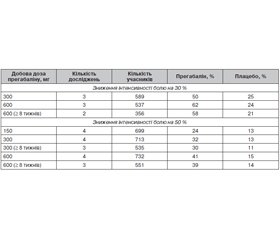
За даними кокрейнівського огляду 2019 року «Прегабалін при нейропатичному болі в дорослих», застосування високих доз прегабаліну збільшувало ефективність лікування постгерпетичної невралгії.
При болях після оперізувального лишаю в 3 із 10 осіб біль зменшувався наполовину або більше при застосуванні прегабаліну в дозі 300 мг або 600 мг на добу, у 2 із 10 — при прийомі плацебо.
Біль зменшувався на третину або більше у 5 із 10 осіб при застосуванні прегабаліну в дозі 300 мг або 600 мг щодня, у 3 із 10 — при прийомі плацебо (табл. 1) [13].
У даний час акцент робиться на профілактиці герпетичної інфекції і ПГН. Все ширше застосовується вакцинація населення, особливо літніх осіб. Зниження смертності спостерігалось в усіх вікових групах до 50 років, але найбільша зміна (на 92 %) відзначена серед дітей від 1 до 4 років. Отримані в США дані підтверджують ефективність загальної вакцинації від вітряної віспи, що слід взяти на озброєння і в інших країнах [12].
Підсумовуючи отримані дані, важливо наголосити на необхідності призначення в гострому періоді Herpes zoster противірусної терапії, особливо в перші 72 год появи герпетичних висипань. Важливо пам’ятати про обов’язковість проведення повного курсу їх парентерального введення. У групі ризику пацієнтів старшого віку найбільш ефективним є використання комбінації противірусних препаратів і кортикостероїдів.
Таким чином, до препаратів першого вибору з високим рівнем доказовості в лікуванні гострої, підгострої і хронічної ПГН відносяться сучасні антиконвульсанти: габапентин і прегабалін. Відповідно до даних про можливості запобігання розвитку ПГН за допомогою цих препаратів максимально раннє призначення прегабаліну(Габани) в комбінації з противірусною терапією не тільки забезпечує ефективне купірування інфекційного процесу, а й дозволяє запобігти розвитку такого грізного ускладнення оперізувального лишаю (Herpes zoster), як постгерпетична невралгія.
Іншою найбільш поширеною інфекційною причиною нейропатичного болю є нейробореліоз.
Частота хвороби Лайма (ХЛ) в різних областях залежить від частоти виявлення кліщів, які переносять борелії (від 0 до 40 %), та способу життя населення. Хворобу викликає приблизно 1 укус кліща з 50. Через подорожі та довгий латентний період пізніх стадій хвороби пацієнти з хворобою Лайма можуть зустрічатися в будь-якій точці Європи. Унаслідок потепління кліщі живуть у більш північних районах, ніж це було раніше. Про хворобу Лайма повідомляли у Північній Америці, по всій Європі та в частині Азії.
Збудником хвороби Лайма є спірохета Borrelia burgdorferi sensu lato та її підвиди. У Європі найпоширеніші такі види: B. afzelii, B. garinii і B. burgdorferi sensu stricto, а також недавно описані B. bavariense і B. spielmanii. У США майже всі випадки спричинені B. burgdorferi sensu stricto. Нові та потенційно патогенні види борелій, які знайшли у кліщів, це B. valaisana з групи B. burgdorferi s.l. і B. miyamotoi з групи поворотних гарячок. Борелії переносяться дорослими кліщами та німфами, яких складніше виявити. Личинки рідко діють як переносники борелій. У більшості випадків спочатку інфекція не викликає жодних симптомів. Інфекція розвивається повільно, у проміжку між 12 та 72 годинами після укусу. Повторне зараження може викликати повторне захворювання, оскільки інфікування бореліями не веде до формування імунітету.
Збудник нейробореліозу поширюється лімфогенним, гематогенним і периневральним шляхами та уражає ЦНС. Це спричиняє каскадну систему реакцій з апоптозом дефектних нейронів. Продукти розпаду нейротканини, які імунна система не розпізнає, стають нейроспецифічними антигенами, що запускають автоімунні механізми патогенезу нейробореліозу. Різноманітність клінічних виявів захворювання ускладнює своєчасну діагностику і, як наслідок, лікування. Ранній нейробореліоз є найбільш поширеною клінічною формою дисемінованої інфекції, він виникає через 6 місяців після укусу, часто вже на стадії мігруючої еритеми. Інфекція пошкоджує периферичні та черепні нерви, найчастіше у вигляді аксонального мононевриту, але також у вигляді невриту, вражаючи плечове і попереково-крижове сплетення, до цих симптомів можуть додаватися артритичні прояви та ураження суглобів, дерматоміозит, поліміозит; рідко Лайм-артрит зустрічається в декількох суглобах одночасно. При ураженні ЦНС інфекція проявляється як менінгіт з незначними симптомами або як болісний менінгорадикуліт (синдром Баннварта). Рідкісною, але важливою формою гострого бореліозу є церебральний васкуліт, що пов’язаний із порушеннями кровообігу і викликає транзиторні ішемічні атаки або симптоми інсульту. На діагностування бореліозу може наштовхнути плеоцитоз у цереброспінальній рідині (ЦСР). Енцефаліт, який виявляють на МРТ, або мієліт, що проявляється симптомами, виникає у менше ніж 10 % пацієнтів із нейробореліозом. Параліч лицевого нерва, спричинений борелією, є формою периферичного нейробореліозу; приблизно двоє з трьох пацієнтів мають лімфоцитарний менінгіт. Необхідне негайне протимікробне лікування. Його треба диференціювати з паралічем Белла, який потребує зовсім іншої терапії (негайного призначення кортикостероїдів). Нейробореліоз вважається пізнім, якщо без лікування симптоми тривають більше ніж 6 місяців.
Найтиповішою маніфестацією бореліозу нервової системи є параліч лицевого нерва. Він може проявитися невдовзі після зараження одночасно із появою мігруючої еритеми (МЕ) або при атиповому перебігу без явної мігруючої еритеми, коли сироваткові антитіла IgG можуть ще залишатись негативними, це може наштовхнути на хибний шлях діагностики та лікування. Позитивні IgM антитіла можуть наштовхнути на думку, але також не підходять для встановлення діагнозу в даному випадку. Важливим є аналіз ЦСР і дослідження продукції інтратекальних антитіл. Для диференціальної діагностики з іншими видами пошкодження периферичних нервів потрібні, наприклад, електрофізіологічні дослідження (наприклад, ЕМГ). При нейробореліозі довготривало може спостерігатися больовий феномен унаслідок ураження нервових стовбурів. Біль часто має нейропатичний характер і продовжується після вдало проведеної антибактеріальної терапії. Нейропатичний біль часто може бути єдиним наслідком перенесеної інфекції.
Для встановлення нейробореліозу центральної нервової системи потрібно дослідити ЦСР, у якій наявний лімфоцитарний плеоцитоз. Потрібно дослідити концентрації IgG антитіл до борелії в сироватці і ЦСР. Концентрація сироваткових IgG антитіл завжди підвищена через 4 тижні від початку симптомів. Слід вирахувати вироблення інтратекальних антитіл. При нейробореліозі ЦНС цей показник підвищений протягом 10–14 днів від початку симптомів. Після нейробореліозу показник може залишатися підвищеним протягом декількох років, що знижує його діагностичну цінність. Підвищена концентрація хемокіну CXCL13 в ЦСР є інформативною ознакою запальної активності, при нейробореліозі ЦНС концентрації чітко підвищені. Його можна виявити раніше, ніж плеоцитоз і підвищений показник антитіл, і це значно допомагає в діагностиці. Незначне збільшення спостерігається також у пацієнтів із розсіяним склерозом, клінічно-ізольованим синдромом та оптичним нейромієлітом, а також при вірусних та бактеріальних менінгітах. Також, окрім бореліозу, високі рівні зустрічаються при сифілісі і менінгеальній лімфомі. Для диференціальної діагностики варто розглядати проведення візуалізаційних методів обстеження (МРТ черепа).
Імовірність хвороби Лайма слід оцінювати завчасно згідно з розробленими принципами Баєса, тобто з урахуванням епідеміологічної ситуації, часу від зараження до симптомів та клінічної картини. Імовірність низька (20 %), якщо клінічна картина є невизначеною та не існує анамнезу контакту з кліщами [1]. Імовірність є помірною (50 %), якщо в анамнезі є контакт з кліщем та наявні неврологічні або суглобові симптоми. Імовірність висока (80 %), якщо, крім контакту та симптомів, наявні укус кліща і МЕ (табл. 2). Якщо ймовірність перевищує 80 %, лікування слід розпочати негайно.
Лабораторні дослідження: визначення специфічних маркерів запального процесу в крові. Для верифікації діагнозу хвороби Лайма проводиться визначення антитіл класу IgM та IgG до Borrelia burgdorferi високочутливим тестом ELISA; ЕМГ; аналіз на HLA B*27-антиген, антинуклеарні антитіла; антитіла до циклічного цитрулінового пептиду; загальний аналіз крові; дослідження ЦСР.
Лікування: амоксицилін 500 мг 3 рази на добу для пацієнтів із масою тіла менше 70 кг, 1 г 3 рази на день для тих, хто важить більше ніж 70 кг [2]. Більш рівномірний рівень у плазмі досягається шляхом дозування тричі, а не двічі на день. Доксициклін 100 мг (для пацієнтів із масою тіла менше ніж 70 кг) або 150 мг (для тих, хто важить понад 70 кг) двічі на день [2]. Феноксиметилпеніцилін (пеніцилін V) не рекомендується, тому що спірохети можуть поширюватися в кровотік та в центральну нервову систему вже на стадії МЕ, а пеніцилін V не досягне достатньої концентрації в ЦНС. Також рекомендується цефтріаксон по 2 грами на добу протягом 14–21 дня. Реакція Яріша — Геркс-геймера виникає через кілька годин після початку лікування специфічними антибіотиками хворих на спірохетози, пов’язана зі швидким вивільненням антигенів, ендотоксинів при масовій загибелі бактерій, що призводить до неконтрольованої імунної відповіді. Проявляється підвищенням температури, ознобом, зниженням артеріального тиску, тахікардією, нудотою, головним болем, болем у м’язах, посиленням існуючих або появою нових симптомів основного захворювання. Не є алергічною реакцією на введення антибіотиків — непотрібно припиняти антибіотикотерапію. Терапія і профілактика: застосування ГКС.
Нейропатичний біль часто залишається після вдалого антибактеріального лікування. Особливо резистентним є біль у пацієнтів із хронічним атрофічним акродерматитом. Відповідно до всіх світових рекомендацій для лікування нейропатичного болю препаратами вибору є габапентин та прегабалін. В Україні використовується препарат Габана (Корпорація «Артеріум»). Треба зазначити, що на відміну від габапентину відношення доза/ефект прегабаліну прямо пропорційне. Тому збільшення дози прегабаліну збільшує знеболюючий ефект. Вибір дози є індивідуальним, але неповна ефективність дози 75 мг або 150 мг на добу є показником для збільшення до 300–450 мг на добу. Одним із супутніх ефектів прегабаліну є сонливість, тому пацієнти часто відмовляються від прийому відносно високих доз. Для запобігання відміні препарату та оптимального комплаєнсу ми рекомендуємо початковий прийом до 75 мг ввечері, а при досягненні повного ефекту при титруванні до 300 мг перевести прийом всієї дози 300 мг також на вечірній час. Даний метод прийому зменшить супутні небажані ефекти прегабаліну. Треба відмітити, що 1 капсула препарату Габана містить 300 мг діючої речовини, що зручно для пацієнта і сприяє збільшенню комплаєнсу, а отже, і вищій ефективності лікування.
Висновки
1. В гострому періоді Herpes zoster важливо призначати противірусну терапію, особливо в перші 72 год появи герпетичних висипань.
2. Максимально раннє призначення прегабаліну (Габани) в комбінації з противірусною терапією не тільки забезпечує ефективне купірування інфекційного процесу, а й дозволяє запобігти розвитку такого грізного ускладнення оперізувального лишаю (Herpes zoster), як постгерпетична невралгія.
3. Чітким показанням до обстеження на хворобу Лайма є симптоми нетипової неврологічної симптоматики в осіб, які проживають в ендемічній зоні.
4. Особливу увагу потрібно звертати на місце проживання хворого, на його анамнез, чи був укус кліща або німфи, наявність мігруючої еритеми.
5. Спірохети здатні уражати різноманітні системи людського організму. Ці ураження проявляються від шкірних реакцій (мігруюча еритема) до уражень опорно-рухового апарату, неврологічної симптоматики (уражається як периферична, так і центральна нервова система людини).
6. Антибактеріальна терапія є найефективнішою в боротьбі з бореліозом.
Конфлікт інтересів. Не заявлений.

/57_21.jpg)
/58_21.jpg)