Международный неврологический журнал Том 16, №5, 2020
Місце дулоксетину в терапії психічних розладів
Резюме
Сучасна медицина, у тому числі психіатрія, орієнтована на мультидисциплінарний персоналізований підхід до курації хворого. Терапія психічних розладів, особливо коморбідних з іншою психічною або соматичною патологією, зокрема хронічним болем, вимагає таргетної терапії відповідно до клінічних особливостей пацієнта й стандартів доказової медицини. Психоосвіта, психотерапія, психофармакотерапія і соціальна підтримка є мінімально необхідним комплексом втручань при всіх психічних розладах. При визначенні оптимальної тактики психофармакотерапії варто розглянути доцільність призначення антидепресанту класу інгібіторів зворотного захвату серотоніну та норадреналіну дулоксетину, що є дієвим і схвалений для лікування великого депресивного розладу, генералізованого тривожного розладу, діабетичного периферичного невропатичного болю, фіброміалгії і хронічного м’язово-скелетного болю. Причому вищий рівень прихильності пацієнтів до терапії дулоксетином психічних розладів, зокрема депресії, забезпечується за рахунок редукції соматичних хворобливих проявів, зокрема больового синдрому, і навпаки. У межах персоніфікованої терапії хронічного болю дулоксетин може використовуватись у монотерапії високими дозами або в комбінації з прегабаліном залежно від фенотипу невропатичного болю. Дулоксетин може бути ефективним засобом для лікування афективних розладів, панічного розладу, кількох кластерів симптомів межового розладу особистості та як допоміжний препарат при шизофренії. Були виявлені помірні або суперечливі результати щодо ефективності дулоксетину при обсесивно-компульсивних розладах, посттравматичних стресових розладах, розладах харчової поведінки і сексуальних розладах, що обумовлює проведення подальших досліджень у цих сферах. У всіх оглянутих дослідженнях дулоксетин, як правило, мав добру переносимість; більшість побічних явищ, про які повідомлялося, відповідали відомому профілю безпеки дулоксетину, були дозозалежними, виникали переважно на початку терапії і здебільшого редукувались у межах 1–2 тижнів. Отже, як видно на прикладі дулоксетину, обізнаність лікаря щодо фармакокінетичних, фармакодинамічних та клінічних якостей препарату, включно з його психотропними й соматотропними ефектами, дозволяє призначити дієве лікування, уникнути поліфармації і забезпечити створення терапевтичного альянсу з пацієнтом.
Современная медицина, в том числе психиатрия, ориентирована на мультидисциплинарный персонализированный подход к курации больного. Терапия психических расстройств, особенно коморбидных с другой психической или соматической патологией, в частности хронической болью, требует таргетной терапии в соответствии с клиническими особенностями пациента и стандартами доказательной медицины. Психообразование, психотерапия, психофармакотерапия и социальная поддержка являются минимально необходимым комплексом вмешательств при всех психических расстройствах. При определении оптимальной тактики психофармакотерапии стоит рассмотреть целесообразность назначения антидепрессанта класса ингибиторов обратного захвата серотонина и норадреналина дулоксетина, который доказал свою эффективность и одобрен для лечения большого депрессивного расстройства, генерализованного тревожного расстройства, диабетической периферической невропатической боли, фибромиалгии и хронической мышечно-скелетной боли. Причем высокий уровень комплаентности пациентов при терапии дулоксетином психических расстройств, в частности депрессии, обеспечивается за счет редукции соматической патологии, в частности болевого синдрома, и наоборот. В рамках персонифицированной терапии хронической боли дулоксетин может использоваться в качестве монотерапии высокими дозами или в комбинированной с прегабалином терапии в зависимости от фенотипа невропатической боли. Дулоксетин может быть эффективным средством для лечения аффективных расстройств, панического расстройства, нескольких кластеров симптомов пограничной личности и как вспомогательный препарат при шизофрении. Были обнаружены умеренные или противоречивые результаты по эффективности дулоксетина при обсессивно-компульсивных расстройствах, посттравматических стрессовых расстройствах, расстройствах пищевого поведения и сексуальных расстройствах, что обусловливает проведение дальнейших исследований в этих сферах. Во всех проанализированных исследованиях дулоксетин, как правило, имел хорошую переносимость; большинство описанных побочных явлений соответствовали известному профилю безопасности дулоксетина, были дозозависимыми, проявлялись преимущественно в начале терапии и часто редуцировались в пределах 1–2 недель. Итак, как видно на примере дулоксетина, осведомленность врача в отношении фармакокинетических, фармакодинамических и клинических свойств препарата, включая его психотропные и соматотропные эффекты, позволяет назначить действенное лечение, избежать полифармации и обеспечить создание терапевтического альянса с пациентом.
Modern medicine, including psychiatry, focuses on a multidisciplinary personalized approach to patient care. The treatment of mental disorders, especially comorbid with other mental or somatic pathology, in particular chronic pain, requires targeted therapy following the patient’s clinical characteristics and evidence-based medicine standards. Psychoeducation, psychotherapy, psychopharmacotherapy, and social support are the minimum necessary interventions for all mental disorders. When determining the optimal psychopharmacotherapy, consideration should be given to prescribing duloxetine, a serotonin-norepinephrine reuptake inhibitor antidepressant that is effective and approved for the treatment of major depressive disorder, genera-lized anxiety disorder, diabetic peripheral neuropathic pain, fibromyalgia, and chronic musculoskeletal pain. Moreover, a higher level of patients’ adherence to duloxetine therapy for mental disorders, especially depression, is provided by reducing somatic symptoms, in particular chronic pain, and vice versa. As a part of personalized chronic pain therapy, duloxetine can be used in high-dose monotherapy or combination with pregabalin therapy, depending on the phenotype of neuropathic pain. Duloxetine may be an effective treatment for affective disorders, panic disorder, multiple clusters of borderline personality symptoms, and as an adjunct in schizophrenia. Moderate or conflicting results have been found regarding the efficacy of duloxetine in obsessive-compulsive disorder, post-traumatic stress disorder, eating disorders, and sexual disorders, which leads to further researches in these areas. Duloxetine generally had good tolerability in all reviewed studies; most of the reported adverse events were consistent with the known safety profile of duloxetine, were dose-dependent and predominantly at the beginning of treatment, and were generally reduced within 1–2 weeks. Thus, as can be seen from the example of duloxetine, the physician’s awareness of the pharmacokinetic, pharmacodynamic, and clinical properties of the drug, including its psychotropic and somatotropic effects, allows prescribing effective treatment, avoid polypharmacy and ensure a therapeutic alliance with the patient.
Ключевые слова
психічні розлади; таргетна терапія; депресія; тривога; хронічний біль; дулоксетин; ефективність; безпека
психические расстройства; таргетная терапия; депрессия; тревога; хроническая боль; дулоксетин; эффективность; безопасность
mental disorders; targeted therapy; depression; anxiety; chronic pain; duloxetine, efficacy; safety
Принципи діагностики та терапії психічних розладів на прикладі депресії
Пацієнти з психічними розладами, зокрема з депресією, потребують індивідуалізованого підходу до лікування з урахуванням тяжкості й перебігу самого розладу та психосоціальних особливостей. Як було зазначено на Європейському конгресі психіатрії у 2020 році, сучасна медицина [1], зокрема психіатрія, має бути цільовою (таргетною) і повинна поєднувати чотири риси: бути персоналізованою, визначати прогноз захворювання, запобігати загостренню й рецидивам, а також залучати широке коло фахівців, забезпечуючи мультидисциплінарний підхід до терапії.
Першим кроком алгоритму курації і запорукою ефективності подальшого втручання є встановлення й підтримання терапевтичного альянсу з пацієнтом, необхідного на всіх етапах курації — діагностики, терапії і реабілітації [2].
Наступним кроком є ретельна діагностика хворобливого стану з урахуванням усього комплексу діагностичних критеріїв. Розглянемо особливості діагностики депресивних розладів. Так, відповідно до Міжнародної класифікації хвороб (МКХ) 11-го видання [3], яка після десятирічної розробки була представлена ВООЗ на Всесвітній асамблеї охорони здоров’я 20 травня 2019 р. і набере чинності після погодження з усіма країнами ВООЗ орієнтовно з 1 січня 2022 року, для діагностики депресивного розладу потрібно мінімум п’ять із десяти симптомів, а не чотири з дев’яти можливих симптомів, зазначених в МКХ-10, що підвищує узгодженість МКХ-11 із класифікацією DSM-5. Обов’язковими критеріями залишаються знижений щодня настрій або зниження інтересу до діяльності протягом не менше ніж двох останніх тижнів. Увесь спектр депресивної симптоматики стратифіковано в три кластери: афективний, когнітивний і нейровегетативний. Безнадія була додана як додатковий когнітивний симптом через переконливі докази її прогностичної цінності при діагностиці депресивних розладів. Утома входить до складу нейровегетативного кластера симптомів, але більше не вважається самостійним симптомом початкового рівня. МКХ-11 також дає чіткі вказівки щодо диференціації культурно-нормативних реакцій горя і симптомів, які вимагають розгляду при діагностиці депресивного епізоду в контексті тяжкої втрати (рис. 1).
/110.jpg)
Варто зауважити, що наведені дані щодо діагностики депресивного розладу за МКХ-11 мають попередній, ознайомлювальний характер, тому що за наступні майже півтора року в Україні мають бути вироблені плани щодо використання нової МКХ-11, підготовлені її офіційні переклади й проведена ретельна загальнонаціональна підготовка фахівців охорони здоров’я.
Після верифікації хворобливого стану переходимо до етапу терапії. Усім пацієнтам із психічними розладами, зокрема депресією, починаючи з рівня первинної допомоги рекомендовані заходи немедикаментозної корекції з докладним обґрунтуванням їх необхідності: дотримуватись режиму дня, гігієни сну, засад раціонального харчування, режиму регулярної фізичної активності тощо.
Узагалі терапія всіх психічних і соматичних розладів має починатися з психоосвіти пацієнта і (бажано) членів його родини; депресія також не є винятком [4]. У межах психоосвіти із залученням елементів мотиваційного інтерв’ю пацієнту в доступній для нього формі надається інформація про сам психічний розлад, стан здоров’я самого пацієнта, імовірні варіанти перебігу захворювання й рекомендації щодо немедикаментозного й медикаментозного лікування в усній і письмовій формі. Бажано надати пацієнту інформаційний лист для пацієнта про певний розлад, прикладом якого є додаток 2 «Інформаційний лист для пацієнта про депресію» в Уніфікованому клінічному протоколі «Депресія», що значно збільшує комплаєнс [5].
Загальні принципи психофармакотерапії були сформульовані Ф.Дж. Яничак і надалі удосконалювались [6]. Було зазначено, що основоположним є процес моніторингу стану пацієнта з метою постійного уточнення клініко-діагностичної оцінки, а для повного одужання пацієнта необхідне приєднання до психофармакотерапії психотерапії і соціальної реабілітації. Початок і тривалість психофармакотерапії обумовлені нозологічною приналежністю, стадією захворювання і ступенем його прогредієнтності. При складанні плану лікування завжди потрібно зважувати на співвідношення передбачуваної вигоди для пацієнта та ступеня ризику негативних наслідків терапії.
Первинний вибір препаратів визначається анамнестичними даними (у тому числі родинним анамнезом) щодо переносимості пацієнтом певних ліків. Терапія має бути спрямована на ключові симптоми розладу, що підлягають моніторингу й оцінці їх динаміки протягом усього курсу лікування разом з можливими проявами побічної дії ліків. Особливо пильний моніторинг має запроваджуватись щодо особливих груп пацієнтів: дітей і підлітків, вагітних жінок і жінок, які годують груддю, осіб похилого віку та хворих із супутньою соматичною патологією.
Загальна характеристика дулоксетину
Так, у терапії депресії ми прагнемо знайти «ідеальний» антидепресант для кожного конкретного пацієнта, добре розуміючи недосяжність абсолютної ефективності й безпеки. У будь-якому разі ми орієнтуємось на розширення кількості мішеней втручання й зменшення питомої ваги побічної дії (рис. 2).
Дулоксетин є антидепресантом, що входить до фармакологічного класу інгібіторів зворотного захвату серотоніну та норадреналіну (ІЗЗСН), який також включає венлафаксин, десвенлафаксин, мілнаципран і лівомілнаципран. Дулоксетин відомий із 2004 року, коли він спочатку був схвалений для терапії великого депресивного розладу (ВДР) Американською адміністрацією з питань харчових продуктів і медикаментів (FDA), а згодом Комітетом з лікарських засобів для використання в людині у Європі. Згодом перелік показань для застосування дулоксетину в низці країн було розширено за рахунок генералізованого тривожного розладу (ГТР), діабетичного периферичного невропатичного болю, фіброміалгії, хронічного м’язово-скелетного болю, а також у Європі — за рахунок стресового нетримання сечі [7]. Крім того, він виявився дієвим щодо індукованих хіміотерапією невропатій [8] і хронічного післяопераційного болю [9].
/111.jpg)
Дулоксетин демонструє лінійну кінетику в терапевтичних дозах (60–120 мг/добу), має пероральну біодоступність від 32 до 80 %, досягаючи максимальної концентрації в плазмі приблизно через 6 годин. Середній період напіввиведення становить приблизно 12 годин, середній час адсорбції — 2 години [10]. Дулоксетин потужно зв’язується з білками плазми (переважно з альбуміном або α1-кислотним глікопротеїном — 96 %), широко розподіляється по тканинах і метаболізується ізоферментами 1A2 і 2D6 цитохрому P450 (який також інгібується молекулою) до неактивних метаболітів у печінці [11, 12], тому будь-який ступінь печінкової недостатності є протипоказанням до лікування.
Екскреція відбувається через сечу (70 %) і фекалії (20 %). Оскільки ниркова екскреція відіграє важливу роль у катаболізмі дулоксетину, пацієнтам з кліренсом креатиніну < 30 мл/хв і пацієнтам, які страждають від помірного або тяжкого порушення функції нирок, слід призначати скориговані дози дулоксетину й уважно стежити за ними під час лікування. Той факт, що ця молекула інтенсивно метаболізується цитохромом Р450, означає, що слід бути обережним при одночасному застосуванні із субстратами ізоферменту, такими як трициклічні антидепресанти, фенотіазин та антиаритмічні засоби типу 1С [13, 14]. Подібно до інших засобів класу ІЗЗСН дулоксетин може брати участь у фармакодинамічних лікарських взаємодіях; зокрема, комбінація препарату з інгібіторами моноаміноксидази протипоказана через можливий розвиток серотонінового синдрому.
На основі визначеної ВООЗ добової дози низьким дозуванням дулоксетину вважається < 60 мг/добу, стандартним дозуванням є діапазон 60–90 мг/добу, а висока доза — понад 90 мг/добу [15].
Дулоксетин, як правило, безпечний і добре переноситься за всіма затвердженими показаннями в дорослих у дозах від 60 до 120 мг/добу, хоча потенційні терапевтичні переваги високих доз дулоксетину пов’язані з появою побічних ефектів: нудота, сухість у роті, сонливість, запор, зниження апетиту й гіпергідроз виникають переважно на початку терапії і редукуються в межах 1–2 тижнів [16]. При більш тривалій терапії (принаймні від 6 місяців до 1 року) побічними явищами, що спостерігалися в дорослих пацієнтів, були серцебиття, затуманення зору, запаморочення, збільшення/втрата ваги, озноб/сухість і свербіж. Варто зазначити, що вони також дозозалежні й у більшості випадків не призводять до припинення терапії. Нечасті випадки пошкодження печінки, спричиненого дулоксетином, також спостерігаються в пацієнтів з уже наявним захворюванням печінки або хронічним вживанням алкоголю [17]. Дулоксетин має помірний вплив на частоту серцевих скорочень та артеріальний тиск; він не має клінічно значущого впливу на показники електрокардіограми. Метааналіз відмінностей у частоті й результатах суїцидальної поведінки не виявив жодних доказів збільшення або зменшення ризику суїцидальних подій при лікуванні дулоксетином [34], але суїцидальний ризик був вищим на початку лікування, на етапах зменшення дози й після відміни препарату.
Застосування дулоксетину при великому депресивному розладі
Відповідно до результатів систематичного огляду й мережевого метааналізу порівняльної ефективності й переносимості 21 антидепресанту, що застосовуються для терапії великого депресивного розладу в дорослих, при прямому порівнянні агомелатин, амітриптилін, есциталопрам, міртазапін, пароксетин, венлафаксин, вортіоксетин були ефективнішими за інші антидепресанти (співвідношення шансів (СШ) 1,19–1,96); агомелатин, циталопрам, есциталопрам, флуоксетин, сертралін, вортіоксетин мали кращу переносимість порівняно з іншими антидепресантами (СШ 0,43–0,77) [18]. Непряме порівняння в цьому ж дослідженні дає можливість побачити рейтинг антидепресантів за їх ефективністю (рис. 3).
Зараз очікується мережевий метааналіз профілю побічних ефектів і порівняльної переносимості 21 антидепресанту при терапії гострої фази великої депресії в дорослих, протокол якого був поданий у травні 2019 року [19].
Більш докладно порівняння дулоксетину з іншими антидепресантами в терапії депресії подано в кохранівському систематичному огляді 2012 року, куди включено 16 рандомізованих контрольованих досліджень (РКД), загалом 5735 учасників. Статистично значущих відмінностей в ефективності й переносимості при порівнянні дулоксетину та інших антидепресантів не було виявлено [20]. Був також проведений систематичний огляд досліджень, що зосереджувались на застосуванні дулоксетину при депресії в осіб похилого віку. Виявилося, що ефективність і безпека дулоксетину порівнянні з цими показниками в дорослих пацієнтів з депресією, а редукція больового синдрому, часто притаманного особам похилого віку, дозволила більш чітко намалювати клінічний портрет депресивного пацієнта, для якого дулоксетин є препаратом вибору [21].
Застосування дулоксетину при генералізованому тривожному розладі
Відповідно до клінічної настанови Всесвітньої федерації біологічної психіатрії (2012) [22], Канадської настанови з клінічної практики (2014) [23] щодо терапії тривожних, посттравматичних стресових та обсесивно-компульсивних розладів (ОКР) дулоксетин входить до числа препаратів терапії першої лінії при генералізованому тривожному розладі (категорія доказовості: А; рекомендаційна оцінка: 1).
За останні п’ять років було опубліковано два метааналізи щодо ефективності й переносимості дулоксетину при лікуванні ГТР [24, 25]. Y. Zhang з співавторами підтвердили значну перевагу дулоксетину над плацебо як щодо зменшення симптомів тривоги за шкалою Гамільтона (р < 0,0001), так і щодо швидкості настання ремісії (р < 0,001). Дулоксетин також статистично збільшував загальний бал за шкалою інвалідності Шихана (р < 0,001) [24]. У метааналізі X. Li з співавторами щодо короткочасного лікування дулоксетином дорослих із ГТР середні зміни за підшкалою тривоги HADS (P < 0,00001) і показник фактора психічної тривожності HAM-A були значно більшими в пацієнтів із ГТР, які отримували дулоксетин, порівняно з тими, хто отримував плацебо (P < 0,00001). Однак не було виявлено різниці середньої зміни показника фактора соматичної тривожності HAM-A (P < 0,00001), що свідчило про дещо відтермінований ефект дулоксетину саме щодо соматизованої тривоги [25].
Застосування дулоксетину при афективних розладах
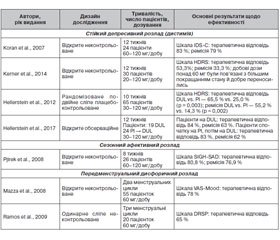
Призначення антидепресантів при психічних розладах, крім ВДР і ГТР, є звичайною практикою. Нижченаведені дані свідчать, що дулоксетин може бути потенційним засобом для лікування різних психічних розладів. Ефективність дулоксетину в пацієнтів з афективними розладами, відмінними від ВДР, була оцінена в семи клінічних дослідженнях (табл. 1) [26].
/114.jpg)
У присвяченому терапії дистимії 12-тижневому дослідженні L.M. Koran із співавторами [27] пацієнти отримували дулоксетин 60 мг/добу протягом 6 тижнів із збільшенням дози до 120 мг/добу протягом решти часу для тих, хто в першій половині показав часткову відповідь на лікування. Серед учасників дослідження рівень терапевтичної відповіді за шкалою IDS-C становив 89 %, а рівень ремісії — 84 %. Наступне дослідження N. Kerner зі співавторами [28] оцінило ефективність дулоксетину при дистимії в 30 літніх осіб (середній вік 70,7 року). Дулоксетин призначали в гнучких дозах, починаючи з 20 мг/добу в перший тиждень і підвищуючи дозу до 120 мг/добу. Частота терапевтичної відповіді становила 53,3 %, частота ремісії — 33,3 %, причому добові дози понад 60 мг/добу були пов’язані з більшим покращанням стану й добре переносились.
У 10-тижневому рандомізованому контрольованому дослідженні щодо ефективності дулоксетину при дистимії (діапазон дозування 30–120 мг/добу) [29] було відмічено його дієвість за шкалою HDRS із 24 пунктів (р = 0,003) із частотою терапевтичної відповіді 65,5 % (р = 0,003) і рівнем ремісії 55,2 % (р = 0,002). Утім, за шкалою депресії Бека (BDI) і Глобальною оцінкою функціонування і шкалою соціальної адаптації (SAS) значущого ефекту від терапії дулоксетином не було помічено. У додатковій 12-тижневій відкритій фазі продовження дослідження [30] стійке покращання симптомів спостерігалось уже у 84 % пацієнтів, а 63 % пацієнтів відповідали критеріям ремісії наприкінці дослідження (22-й тиждень). Проте в довгостроковій перспективі в пацієнтів лише помірно покращилося соціальне й когнітивне функціонування, при цьому 66,7 % пацієнтів продовжували залишатися в порушеному діапазоні функціонування згідно із SAS.
Отже, лікування дулоксетином виявилося ефективним, із задовільним профілем переносимості при дистимії в дорослих і дистимії з початком у пізньому віці, що характеризується відсутністю супутніх психічних захворювань і гіршою терапевтичною відповіддю. Був отриманий позитивний результат як при короткочасному лікуванні, так и при тривалій терапії з більш вагомим впливом на загальні аспекти функціонування й соціальну адаптацію.
Було проведене 8-тижневе відкрите дослідження ефективності й переносимості 60–120 мг/день дулоксетину при сезонному афективному розладі [31], яке довело його дієвість за шкалою SIGH-SAD (р < 0,001), терапевтичною відповіддю (80,8 %) і ремісією (76,9 %). Також пацієнти продемонстрували помітне покращання показників вторинного результату соціального функціонування. Під час цього дослідження в частини пацієнтів були зареєстровані побічні ефекти, 47,3 % з яких були класифіковані як легкі (серцебиття, тремор, седація, втрата ваги), 38,2 % — як помірні (головний біль, безсоння, внутрішня напруга) і 14,5 % — як тяжкі (сухість у роті, гіпергідроз, запор).
Два дослідження оцінювали ефективність і безпеку дулоксетину при передменструальному дисфоричному розладі. У відкритому дослідженні з фіксованою дозою (60 мг/добу), що тривало 2 менструальних цикли [32], терапевтична відповідь за ВАШ-настрій становила 78 % із супутнім покращанням симптомів тривоги й загального функціонування. У дослідженні тривалістю 3 менструальних цикли [33] частота відповіді на лікування становила 65 %; у пацієнток також спостерігалося значне зменшення функціональних порушень, пов’язаних із передменструальними симптомами дратівливості, афективної лабільності, напруги, пригніченого настрою тощо. Поширеними та, як правило, тимчасовими побічними ефектами в першому циклі лікування були розлади шлунково-кишкового тракту й зниження апетиту, тоді як головний біль, зниження лібідо, безсоння й потовиділення зберігалися протягом усіх циклів лікування.
Застосування дулоксетину при інших психічних розладах
Ефективність дулоксетину в пацієнтів з іншими психічними розладами оцінювалась у 12 клінічних дослідженнях (табл. 2) [26].
Використання дулоксетину в лікуванні пацієнтів з обсесивно-компульсивним розладом було оцінено у двох дослідженнях. 17-тижневе відкрите дослідження Dougherty et al. [35] показало, що дулоксетин у діапазоні 60–120 мг/добу був ефективним для зменшення тяжкості симптомів ОКР, яку оцінювали за обсесивно-компульсивною шкалою Єля — Брауна (Y-BOCS) (Р < 0,001) і шкалою CGI (P < 0,001). Повними респондерами виявилися 58,3 % пацієнтів, нон-респондерами — 25 %. У порівняльному РКД дулоксетину (діапазон доз 20–60 мг/добу; середня доза 44,4 мг/добу) із сертраліном (діапазон доз 50–200 мг/добу; середня доза 123,8 мг/добу) в пацієнтів із резистентними ОКР, які отримували СІЗЗС або флувоксамін, обидва препарати продемонстрували порівнянну дієвість у майже 2/3 респондерів [36].
Дулоксетин (30–120 мг/добу; середня доза 94 мг/добу) показав ефективність щодо панічного розладу зі значним покращанням тяжкості симптомів (усі первинні й вторинні показники р < 0,01), причому 1/2 пацієнтів не зазнавали повних панічних атак за останні 2 тижні, а 1/4 досягли повної ремісії [37]. Посттравматичний стресовий розлад (ПТСР) у військових ветеранів виявився більш непіддатливим до терапії дулоксетином (середня добова доза 81 мг/добу) із терапевтичною відповіддю 45 % і ремісією 5 % за шкалою CAPS [38]. Варто зауважити, що цьому розладу взагалі притаманний високий рівень нон-респондерів незалежно від терапевтичної стратегії, а лікування першої і другої лінії здебільшого діє шляхом зменшення вираженості симптомів ПТСР, а не досягнення ремісії та профілактики рецидивів.
/115.jpg)
У терапії розладів харчової поведінки з високою харчовою імпульсивністю гнучкі дози дулоксетину у відкритому дослідженні (60–120 мг/добу) [39] і РКД (30–120 мг/добу) [40] обумовили значне зниження показників за шкалою обжерливості (BES), кількості нападів переїдання, маси тіла, індексу маси тіла й депресії за шкалою депресії Бека (BDI).
При шизофренії результати двох РКД [41, 42] зафіксували значний ефект дулоксетину як додаткового лікування щодо впливу на негативні й загальні психопатологічні симптоми. При додаванні дулоксетину 60 мг/добу до клозапіну в пацієнтів із неповною терапевтичною відповіддю на монотерапію клозапіном відмічалась позитивна динаміка за PANSS і BPRS щодо загальних психопатологічних і негативних, але не когнітивних симптомів [41]. В іншому РКД додавання дулоксетину 60 мг/добу до рисперидону (діапазон доз 4–6 мг/добу) також продемонструвало вірогідно позитивну динаміку за субшкалами загальної психопатології і негативних симптомів за PANSS [42]. Побічні ефекти не відрізнялися між групами дулоксетину та групами плацебо.
Два РКД оцінювали ефективність і безпеку дулоксетину при лікуванні передчасної еякуляції [43, 44]. У дослідженні Athanasios et al. [43] середній час затримки інтравагінальної еякуляції (IELT) значно збільшився в групі дулоксетину порівняно з плацебо (129,34 ± 67,58 проти 38,61 ± 16,99; р < 0,001). Побічними ефектами були нудота й сухість у роті в трьох пацієнтів активної групи й надмірне потовиділення в одного пацієнта з групи плацебо; жоден пацієнт не вибув з кожної групи лікування через несприятливі явища. В іншому РКД з активним компаратором [44] дулоксетин і пароксетин були ефективними в збільшенні показника IELT (117 % у групі дулоксетину, р < 0,001, і 126 % у групі пароксетину, р < 0,001; статистичних відмінностей між двома групами щодо збільшення показника IELT не було виявлено). Обидва способи лікування також були ефективними в зменшенні середніх балів особистого стресу та міжособистісних труднощів, пов’язаних з еякуляцією (р < 0,001), і добре переносились (ніхто з пацієнтів не відмовився від дослідження).
При емоційно нестабільному (межовому) розладі особистості за даними дослідження Bellino et al. [45] дулоксетин у дозі 60 мг/день за 12 тижнів посприяв редукції кількох основних симптомів розладу, таких як спалахи гніву (р = 0,0005), афективна нестабільність (р = 0,001) та імпульсивність (р = 0,028), а також редукції тяжкості межового розладу особистості за шкалою BPDSI (р = 0,001). Вірогідна позитивна динаміка була також відмічена за декількома іншими шкалами: шкалою загального клінічного враження CGI-S (р = 0,002), короткою психіатричною оціночною шкалою BPRS (р = 0,001), шкалою депресії Гамільтона HAM-D (р = 0,035), шкалою оцінки функціонування SOFAS (р = 0,0005) та оцінкою соматизації за контрольним списком симптомів Хопкінса HSCL-90 SOM (р = 0,0005). Такі обнадійливі дані вказують на можливість використання дулоксетину щонайменше в підгрупі пацієнтів з межовим розладом особистості, які мають саме такі помітні клінічні симптоми.
Застосування дулоксетину при хронічному болі
Для фахівців з охорони психічного здоров’я важливо пам’ятати, що дулоксетин не тільки має офіційні показання і здебільшого є терапією першої лінії щодо діабетичного периферичного невропатичного болю, фіброміалгії, хронічного м’язово-скелетного болю відповідно до клінічних настанов, але й забезпечує вищий рівень прихильності до терапії депресії за рахунок редукції больового синдрому. Дулоксетин, який в основному призначають пацієнтам з афективними розладами із психічною/соматичною супутньою патологією і в поєднанні з іншими лікарськими засобами, виявляється добре переносимим, демонструючи обмежені показники побічних ефектів легкої інтенсивності [46].
На початку лікування пацієнта з хронічним невропатичним болем ми зазвичай визначаємо особливості його емоційного стану, призначаючи надалі дулоксетин при переважанні депресії і прегабалін — при переважанні тривоги. Утім, нас не завжди задовольняє інтенсивність знеболювання, тому виникає запитання: продовжувати монотерапію цими препаратами у високих дозах або застосувати їх комбінацію?
Відповідь на це запитання дає РКД COMBO-DN, у якому брали участь 804 пацієнти з діабетичним периферичним невропатичним болем [47]. Автори зазначили, що не було значущих відмінностей між комбінованою терапією (60 мг/добу дулоксетину + 300 мг/добу прегабаліну) і високою дозою монотерапії (120 мг/добу дулоксетину або 600 мг/добу прегабаліну) щодо середнього показника зміни болю за шкалою BPI-MSF (середня зміна: комбінація: –2,35; монотерапія високими дозами: –2,16; р = 0,370), однак послідовно сприятливою виявилася саме комбінована терапія.
Терапевтична відповідь становила 52,1 % для комбінованого лікування і 39,3 % для монотерапії високими дозами (р = 0,068). Щодо перших 8 тижнів терапії, не скоригованої для багаторазових порівнянь, було встановлено, що 60 мг/добу дулоксетину за ефективністю перевершує 300 мг/добу прегабаліну (р < 0,001). Як препарати, так і їх поєднання добре переносились. Було зауважено, що хоча комбінована терапія суттєво не перевершує монотерапію у високих дозах, вона є ефективною, безпечною і добре переноситься.
Продовженням дослідження COMBO-DN було проведення фенотипування невропатичного болю з метою визначення предикторів реакції на лікування при больовій діабетичній нейропатії за допомогою Невропатичного списку симптомів болю (NPSI) [48]. Виявилося, що в пацієнтів, які не реагували на початкові 60 мг/добу дулоксетину, додавання 300 мг/добу прегабаліну для комбінованого лікування було особливо ефективним щодо давлючого й ноцицептивного болю, тоді як максимізація дози дулоксетину до 120 мг/добу виявилася більш вигідною при парестезії/дизестезії. На відміну від цього додавання 60 мг/добу дулоксетину до 300 мг/до-бу прегабаліну в разі відсутності відповіді на початкову терапію прегабаліном привело до більш значущої редукції больового синдрому порівняно з максимізацією дози прегабаліну до 600 мг/добу. Причому в пацієнтів із сильним болем ефект лікування показав тенденцію на користь монотерапії високими дозами, тоді як комбінована терапія виявилася більш корисною для пацієнтів з помірним і легким болем. Автори дійшли висновку, що сенсорне фенотипування може призвести до більш стратифікованого лікування та, можливо, до персоналізованої терапії болю.
Висновки
Терапія психічних розладів без коморбідності або розладів, коморбідних з іншою психічною або соматичною патологією, зокрема хронічним болем, є серйозним завданням для лікаря, орієнтованого на таргетний мультидисциплінарний персоналізований підхід до курації хворого. Психоосвіта, психотерапія, соціальна підтримка пацієнта разом із сучасною психофармакотерапією становлять мінімально необхідний комплекс втручань, здатний відновити психічне здоров’я або хоча б зупинити погіршення психосоматичного стану.
Доказова медицина, втілена в клінічні настанови й стандарти терапії, дозволяє визначити оптимальний обсяг втручань для кожного пацієнта. А подальший розвиток медичної науки надає нові можливості удосконалення терапевтичної тактики, як це доведено на прикладі антидепресанту класу ІЗЗСН дулоксетину, що є дієвим і схвалений для лікування ВДР, ГТР, діабетичного периферичного невропатичного болю, фіброміалгії і хронічного м’язово-скелетного болю. Причому вищий рівень прихильності пацієнтів до терапії дулоксетином психічних розладів, зокрема депресії, забезпечується за рахунок редукції соматичних хворобливих проявів, зокрема больового синдрому, і навпаки. У межах персоніфікованої терапії хронічного болю дулоксетин може використовуватись у монотерапії високими дозами або в комбінації з прегабаліном залежно від фенотипу невропатичного болю.
Дулоксетин може бути ефективним засобом для лікування афективних розладів, панічного розладу, кількох кластерів симптомів межового розладу особистості й використовуватись як допоміжний препарат при шизофренії. Були виявлені помірні або суперечливі результати щодо ефективності дулоксетину при ОКР, ПТСР, розладах харчової поведінки та сексуальних розладах, що обумовлює проведення подальших досліджень у цих сферах.
У всіх оглянутих дослідженнях дулоксетин, як правило, мав добру переносимість; більшість побічних явищ, про які повідомлялося, відповідали відомому профілю безпеки дулоксетину, були дозозалежними, виникали переважно на початку терапії і здебільшого редукувались у межах 1–2 тижнів.
Отже, як видно на прикладі дулоксетину, обізнаність лікаря щодо фармакокінетичних, фармакодинамічних і клінічних якостей препарату, включно з його психотропними і соматотропними ефектами, дозволяє призначити дієве лікування, уникнути поліфармації і забезпечити створення терапевтичного альянсу з пацієнтом.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Sagner M., McNeil A., Puska P., Auffray C., Price N.D., Hood L., Lavie C.J., Han Z.G., Chen Z., Brahmachari S.K., McEwen B.S. The P4 health spectrum — a predictive, preventive, personalized and participatory continuum for promoting healthspan. Progress in cardiovascular diseases. 2017 Mar 1. 59(5). 506-21.
2. Чабан О., Хаустова О., Сак Л. Психосоматичний підхід до діагностики та терапії тривоги у пацієнтів з хронічними неінфекційними захворюваннями. Psychosomatic Medicine and General Practice. 2020 May 21. 5(1). e0501229. URL: https://uk.e-medjournal.com/index.php/psp/article/view/229.
3. ICD-11 for Mortality and Morbidity Statistics (Version: 09/2020). URL: https://icd.who.int/browse11/l-m/en.
4. Хаустова О.О. Психосоматичні маски тривоги. Український медичний часопис. 2019. 4(1). 53-60.
5. Чабан О.С., Хаустова О.О., Мамчур A.Й., Ніколенко А.Є., Барна O.М. Сучасні реалії в наданні допомоги пацієнтам з депресією: підсумки першого року впровадження національного протоколу. Ліки України. 2016. 1–2. 197-8.
6. Хаустова Е.А. Современная стратегия диагностики и терапии депрессий. Ліки України. 2012. 9. 48-52.
7. Sansone R.A., Sansone L.A. Serotonin norepinephrine reuptake inhibitors: a pharmacological comparison. Innov. Clin. Neurosci. 2014. 11. 37-42.
8. Farshchian N., Alavi A., Heydarheydari S., Moradian N. Comparative study of the effects of venlafaxine and duloxetine on chemotherapy-induced peripheral neuropathy. Cancer Chemother. Pharmacol. 2018. 82. 787-93. DOI: 10.1007/s00280-018-3664-y.
9. Bedin A., Caldart Bedin R.A., Vieira J.E., Ashmawi H.A. Duloxetine as an analgesic reduces opioid consumption after spine surgery: a randomized, double-blind, controlled study. Clin. J. Pain. 2017. 33. 865-9. DOI: 10.1097/AJP.0000000000000471.
10. Bymaster F.P., Dreshfield-Ahmad L.J., Threlkeld P.G., Shaw J.L., Thompson L., Nelson D.L. et al. Comparative affinity of duloxetine and venlafaxine for serotonin and norepinephrine transpor-ters in vitro and in vivo, human serotonin receptor subtypes, and other neuronal receptors. Neuropsychopharmacol. 2001 25. 871-80. DOI: 10.1016/S0893-133X(01)00298-6.
11. Vaishnavi S.N., Nemeroff C.B., Plott S.J., Rao S.G., Kranzler J., Owens M.J. Milnacipran: a comparative analysis of human monoamine uptake and transporter binding affinity. Biol. Psychiatry. 2004. 55. 320-2. DOI: 10.1016/j.biopsych.2003.07.006.
12. Deecher D.C., Beyer C.E., Johnston G., Bray J., Shah S., Abou-Gharbia M. et al. Desvenlafaxine succinate: a new serotonin and norepinephrine reuptake inhibitor. J. Pharmacol. Exp. Ther. 2006. 318. 657-65. DOI: 10.1124/jpet.106.103382.
13. Bruno A., Morabito P., Spina E., Muscatello M.R. The role of levomilnacipran in the management of major depressive disorder: a comprehensive review. Curr. Neuropharmacol. 2016. 14. 191-9. DOI: 10.2174/1570159X14666151117122458.
14. Karpa K.D., Cavanaugh J.E., Lakoski J.M. Duloxetine pharmacology: profile of a dual monoamine modulator. CNS Drug Rev. 2002. 8. 361-76. DOI: 10.1111/j.1527-3458.2002.tb00234.x.
15. WHO Collaborative Centre for Drug Statistics Methodology ATC/DDD Index. 2009. URL: http://www.whocc.no/atcddd/ 2009.
16. Hudson J.I., Wohlreich M.M., Kajdasz D.K., Mallinckrodt C.H., Watkin J.G., Martynov O.V. Safety and tolerability of duloxetine in the treatment of major depressive disorder: analysis of pooled data from eight placebo-controlled clinical trials. Hum Psychopharmacol. 2005. 20. 327-41.
17. Park Y.M., Lee B.H., Lee H.J., Kang S.G. Cholestatic jaundice induced by duloxetine in a patient with major depressive disorder. Psychiatry Investig. 2010. 7. 228-30.
18. Cipriani A., Furukawa T.A., Salanti G., Chaimani A., Atkinson L.Z., Ogawa Y., Leucht S., Ruhe H.G., Turner E.H., Higgins J.P., Egger M. Comparative efficacy and acceptability of 21 antidepressant drugs for the acute treatment of adults with major depressive disorder: a systematic review and network meta-analysis. Focus. 2018 Oct. 16(4). 420-9.
19. Tomlinson A., Efthimiou O., Boaden K., New E., Mather S., Salanti G., Imai H., Ogawa Y., Tajika A., Kishimoto S., Kikuchi S. Side effect profile and comparative tolerability of 21 antidepressants in the acute treatment of major depression in adults: protocol for a network meta-analysis. Evidence-Based Mental Health. 2019 May 1. 22(2). 61-6.
20. Cipriani A., Koesters M., Furukawa T.A., Nosè M., Purgato M., Omori I.M., Trespidi C., Barbui C. Duloxetine versus other anti-depressive agents for depression. The Cochrane database of systema-tic reviews. 2012. 10. CD006533. https://doi.org/10.1002/14651858.CD006533.pub2.
21. Del Casale A., Girardi P., Brugnoli R., Sani G., Di Pietro S., Brugnoli C., Caccia F., Angeletti G., Serata D., Rapinesi C., Tatarelli R. Duloxetine in the treatment of elderly people with major depressive disorder. Rivista di psichiatria. 2012 Nov 1. 47(6). 479-88.
22. Bandelow B., Sher L., Bunevicius R., Hollander E., Kasper S., Zohar J., Möller H.J., WFSBP Task Force on Mental Disorders in Primary Care, WFSBP Task Force on Anxiety Disorders, OCD and PTSD. Guidelines for the pharmacological treatment of anxiety disorders, obsessive-compulsive disorder and posttraumatic stress disorder in primary care. International journal of psychiatry in clinical practice. 2012 Jun 1. 16(2). 77-84.
23. Katzman M.A., Bleau P., Blier P., Chokka P., Kjernisted K., Van Ameringen M. Canadian clinical practice guidelines for the ma-nagement of anxiety, posttraumatic stress and obsessive-compulsive disorders. BMC psychiatry. 2014 Jul 1. 14(S1). S1
24. Zhang Y., Huang G., Yang S., Liang W., Zhang L., Wang C. Duloxetine in treating generalized anxiety disorder in adults: A meta-analysis of published randomized, double-blind, placebo-controlled trials. Asia-Pacific Psychiatry. 2016 Sep. 8(3). 215-25.
25. Li X., Zhu L., Zhou C., Liu J., Du H., Wang C. et al. Efficacy and tolerability of short-term duloxetine treatment in adults with ge-neralized anxiety disorder: A meta-analysis. PLoS ONE. 2018. 13(3). e0194501. https://doi.org/10.1371/journal.pone.0194501.
26. Muscatello M., Zoccali R.A., Pandolfo G., Mangano P., Lorusso S., Cedro C., Battaglia F., Spina E., Bruno A. Duloxetine in Psychiatric Disorders: Expansions Beyond Major Depression and Generalized Anxiety Disorder. Frontiers in psychiatry. 2019. 10. 772. https://doi.org/10.3389/fpsyt.2019.00772.
27. Koran L.M., Aboujaoude E.N., Gamel N.N. Duloxetine treatment of dysthymia and double depression: an open-label trial. J. Clin. Psychiatry. 2007. 68. 761-5. DOI: 10.4088/JCP.v68n0514.
28. Kerner N., D’Antonio K., Pelton G.H., Salcedo E., Ferrar J., Roose S.P. et al. An open treatment trial of duloxetine in elderly patients with dysthymic disorder. SAGE Open Med. 2014. 2. 1-6. DOI: 10.1177/2050312114533536.
29. Hellerstein D.J., Stewart J.W., McGrath P.J., Deliyannides D.A., Batchelder S.T., Black S.R. et al. A randomized controlled trial of duloxetine versus placebo in the treatment of nonmajor chronic depression. J. Clin. Psychiatry. 2012. 73. 984-91. DOI: 10.4088/JCP.11m07230.
30. Hellerstein D.J., Hunnicutt-Ferguson K., Stewart J.W., McGrath P.J., Keller S., Peterson B.S. et al. Do social functioning and symptoms improve with continuation antidepressant treatment of persistent depressive disorder? An observational study. J. Affect. Disord. 2017. 210. 258-64. DOI: 10.1016/j.jad.2016.12.026.
31. Pjrek E., Willeit M., Praschak-Rieder N., Konstantinidis A., Semlitsch H.V., Kasper S. et al. Treatment of seasonal affective disorder with duloxetine: an open-label study. Pharmacopsychiatry. 2008 41. 100-5. DOI: 10.1055/s-2008-1058103.
32. Mazza M., Harnic D., Catalano V., Janiri L., Bria P. Duloxe-tine for premenstrual dysphoric disorder: a pilot study. Expert Opin. Pharmacother. 2008. 9. 517-21. DOI: 10.1517/14656566.9.4.517.
33. Ramos M.G., Hara C., Rocha F.L. Duloxetine treatment for women with premenstrual dysphoric disorder: a single-blind trial. Int. J. Neuropsychopharmacol. 2009. 12. 1081-8. DOI: 10.1017/S1461145709000066.
34. Acharya N., Rosen A.S., Polzer J.P., D’Souza D.N., Perahia D.G,. Cavazzoni P.A. et al. Duloxetine: meta-analyses of suicidal behaviors and ideation in clinical trials for major depressive disorder. J. Clin. Psychopharmacol. 2006. 26. 587-94. DOI: 10.1097/01.jcp.0000246216.26400.db.
35. Dougherty D.D., Corse A.K., Chou T., Duffy A., Arulpraga-sam A.R., Deckersbach T. et al. Open-label study of duloxetine for the treatment of obsessive-compulsive disorder. Int. J. Neuropsychopharmacol. 2015. 18. 1-4. DOI: 10.1093/ijnp/pyu062.
36. Mowla A., Boostani S., Dastgheib S.A. Duloxetine augmentation in resistant obsessive-compulsive disorder: a double-blind controlled clinical trial. J. Clin. Psychopharmacol. 2016. 36. 720-3. DOI: 10.1097/JCP.0000000000000592.
37. Simon N.M., Kaufman R.E., Hoge E.A., Worthington J.J., Herlands N.N., Owens M.E. et al. Open-label support for duloxetine for the treatment of panic disorder. CNS Neurosci Ther. 2009. 15. 19-23. DOI: 10.1111/j.1755-5949.2008.00076.x.
38. Villarreal G., Cañive J.M., Calais L.A., Toney G., Smith A.K. Duloxetine in military posttraumatic stress disorder. Psychopharmacol. Bull. 2010. 43. 26-34.
39. Leombruni P., Lavagnino L., Gastaldi F., Vasile A., Fassino S. Duloxetine in obese binge eater outpatients: preliminary results from a 12-week open trial. Hum. Psychopharmacol. 2009. 24. 483-8. DOI: 10.1002/hup.1040.
40. Guerdjikova A.I., McElroy S.L., Winstanley E.L., Nelson E.B., Mori N., McCoy J. et al. Duloxetine in the treatment of binge eating disorder with depressive disorders: a placebo-controlled trial. Int. J. Eat. Disord. 2012. 45. 281-9. DOI: 10.1002/eat.20946.
41. Micò U., Bruno A., Pandolfo G., Maria Romeo V., Mallamace D., D’Arrigo C. et al. Duloxetine as adjunctive treatment to clozapine in patients with schizophrenia: a randomized, placebo-controlled trial. Int. Clin. Psychopharmacol. 2011. 26. 303-10. DOI: 10.1097/YIC.0b013e32834bbc0d.
42. Nikbakhat M.-R., Arabzadeh S., Zeinoddini A., Khalili Z., Rezaei F., Mohammadinejad P. et al. Duloxetine add-on to risperidone for treatment of negative symptoms in patients with stable schizophrenia: randomized double-blind placebo-controlled study. Pharmacopsychiatry. 2016. 49. 162-9. DOI: 10.1055/s-0042-101557.
43. Athanasios Z., Polyanthi P., George K. The efficacy of duloxetine in the treatment of premature ejaculation. Int. Urol. Nephrol. 2007. 39. 115-8. DOI: 10.1007/s11255-006-6659-2.
44. Ozcan L., Polat E.C., Otunctemur A., Ozbek E. Duloxetine, dual serotonin and norepinephrine reuptake inhibitor, versus paroxetine, selective serotonin reuptake inhibitor, in the treatment for premature ejaculation. Int. Urol. Nephrol. 2015. 47. 283-7. DOI: 10.1007/s11255-014-0905-9.
45. Bellino S., Paradiso E., Bozzatello P., Bogetto F. Efficacy and tolerability of duloxetine in the treatment of patients with borderline personality disorder: a pilot study. J. Psychopharmacol. (Oxford). 2010. 24. 333-9. DOI: 10.1177/0269881108095715.
46. Dell’osso B., Camuri G., Dobrea C., Buoli M., Serati M., Altamura A.C. Duloxetine in affective disorders: a naturalistic study on psychiatric and medical comorbidity, use in association and tolerabi-lity across different age groups. Clin. Pract. Epidemiol. Ment. Health. 2012. 8. 120-125. DOI: 10.2174/1745017901208010120.
47. Tesfaye S., Wilhelm S., Lledo A. et al. Duloxetine and pregabalin: high-dose monotherapy or their combination? The “COMBO-DN study” — a multinational, randomized, double-blind, parallel-group study in patients with diabetic peripheral neuropathic pain. Pain. 2013. 154(12). 2616-2625. DOI: 10.1016/j.pain.2013.05.043.
48. Bouhassira D., Wilhelm S., Schacht A. et al. Neuropathic pain phenotyping as a predictor of treatment response in painful diabetic neuropathy: data from the randomized, double-blind, COMBO-DN study. Pain. 2014. 155(10). 2171-2179. DOI: 10.1016/j.pain.2014.08.020.

/110.jpg)
/111.jpg)
/113.jpg)
/114.jpg)
/115.jpg)