Журнал «Здоровье ребенка» Том 15, №6, 2020
Вернуться к номеру
Сучасна нейропротекція в педіатрії
Авторы: Хайтович М.В.
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
У статті наведено основні механізми дії нейропротекторів і сучасні стратегії нейропротекції. Доведено, що в першу чергу ефективність нейропротекторів обумовлена антиексайтотоксичним ефектом, перериванням швидких реакцій глутамат-кальцієвого каскаду, блокадою прозапальних цитокінів і молекул адгезії, гальмуванням прооксидантних ферментів, посиленням трофічного забезпечення, запобіганням апоптозу. Описано нейропротекторні властивості комплексних препаратів Сілента і Когівіс. Висока ефективність у педіатрії обумовлена потенціюванням дії їх компонентів, а безпека — низькими дозами кожного компонента.
В статье представлены основные механизмы действия нейропротекторов и современные стратегии нейропротекции. Доказано, что в первую очередь эффективность нейропротекторов обусловлена антиэксайтотоксичным эффектом, прерыванием быстрых реакций глутамат-кальциевого каскада, блокадой провоспалительных цитокинов и молекул адгезии, торможением прооксидантных ферментов, усилением трофического обеспечения, предупреждением апоптоза. Описаны нейропротекторные свойства комплексных препаратов Силента и Когивис. Высокая эффективность в педиатрии обусловлена потенцированием действия их компонентов, а безопасность — низкими дозами каждого компонента.
The article deals with the main mechanisms of neuroprotectors action and modern strategies of neuroprotection. It is proved that the effectiveness of neuroprotectors is primarily due to the anti-excitotoxic effect, interruption of rapid reactions of the glutamate-calcium cascade, blockade of pro-inflammatory cytokines and adhesion molecules, inhibition of pro-oxidant enzymes, increased trophic supply, prevention of apoptosis. The neuroprotective properties of complex drugs Silenta and Kogivis are described. Their high efficiency in pediatrics is due to the potentiation of the action of their components, and safety is due to the low doses of each of the components.
діти; нейропротекція; Когівіс; Сілента
дети; нейропротекция
children; neuroprotection; Kogivis; Silenta
- Кирилова Л.Г., Мірошников О.О. Нейропротекторна терапія при неврологічних ураженнях у дітей раннього віку з пре- та перинатальною патологією. Український медичний часопис. 2015. 108(4). 37-42. http://nbuv.gov.ua/UJRN/UMCh_2015_4_14.
- Свістільнік Т.В. Феномен ексайтотоксичності. Механізми виникнення, значення в розвитку нейронального пошкодження та можливості його корекції при патологіях ЦНС. Biomedical and biosocial anthropology. 2013. 20. 207-215. URL: http://nbuv.gov.ua/UJRN/bba_2013_20_56.
- Messina F., Cecconi F., Rodolfo C.D. You Remember Mitochondria? Front. Physiol. 2020. 11. 271. doi: 10.3389/fphys.2020.00271. eCollection 2020.
- Путилина М.В. Комбинированная нейропротекторная терапия острых нарушений мозгового кровообращения. Український журнал екстремальної медицини імені Г.О. Можаєва. 2011. 12(3). 112-121. URL: http://nbuv.gov.ua/UJRN/Ujem_2011_12_3_24.
- Chang R.C.-C., Ho Y.-S. Introductory Chapter: Concept of Neuroprotection — A New Perspective. 2019. DOI: 10.5772/intechopen.85631.
- Фролова Н.Ю., Бурякина А.В., Мельникова Т.И. Нейропротекторы в педиатрической практике. Ремедиум. 2015. 9. 54-60. URL: https://cyberleninka.ru/article/n/neyroprotektory-v-pediatricheskoy-praktike.
- Nielsen F.H. Magnesium deficiency and increased inflammation: current perspectives. J. Inflamm. Res. 2018. № 11. P. 25-34. doi: 10.2147/JIR.S136742.
- Magnesium in the Central Nervous System. Edited by R. Vink, M. Nechifor. 2011. URL: https://www.adelaide.edu.au/press/titles/magnesium/magnesium-ebook.pdf.
- Chollat C., Sentilhes L., Marret S. Protection of brain development by antenatal magnesium sulphate for infants born preterm. Dev. Med. Child Neurol. 2019. 61(1). 25-30. doi: 10.1111/dmcn.14038.
- Galinsky R., Dean J.M., Lingam I. et al. A Systematic Review of Magnesium Sulfate for Perinatal Neuroprotection: What Have We Learnt From the Past Decade? Front. Neurol. 2020. 11. 449. doi: 10.3389/fneur.2020.00449. eCollection 2020.
- McNally M.A., Soul J.S. Pharmacologic Prevention and Treatment of Neonatal Brain Injury. Clin. Perinatol. 2019. 46(2). 311-325. doi: 10.1016/j.clp.2019.02.006.
- Tsakiridis I., Mamopoulos A., Athanasiadis A. et al. Antenatal Corticosteroids and Magnesium Sulfate for Improved Preterm Neonatal Outcomes: A Review of Guidelines. Obstet. Gynecol. Surv. 2020. 75(5). 298-307. doi: 10.1097/OGX.0000000000000778.
- Wolf H.T., Huusom L.D., Henriksen T.B. et al. Magnesium sulphate for fetal neuroprotection at imminent risk for preterm delivery: a systematic review with meta-analysis and trial sequential analysis. BJOG. 2020. doi: 10.1111/1471-0528.16238.
- Фіцнер О.А., Хайтович М.В. Квантово-фармакологічне дослідження антиоксидантних властивостей мелатоніну. Фармакологія та лікарська токсикологія. 2017. 55(4-5). 89-95. URL: http://nbuv.gov.ua/UJRN/flt_2017_4-5_13.
- Фіцнер О.А., Хайтович М.В., Рижко І.М., Голопихо Л.І. Вплив мелатоніну та N-ацетилцистеїну на стан орієнтовно-дослідницької активності щурів за умов експериментального цукрового діабету. Клінічна фармація. 2018. 3. 38-45. URL: http://nbuv.gov.ua/UJRN/KlPh_2018_22_3_8.
- Temirova O., Khaitovych M., Burlaka A., Vovk A. Redox-dependet mechanisms of brain neuroprotection of rats with experimental diabetes mellitus. ScienceRise: Pharmaceutical Science. 2018. 5(15). 39-46. URL: http://nbuv.gov.ua/UJRN/texcfarm_2018_5_8.
- Che D.N., Cho B.O., Kim J-S. et al. Luteolin and Apigenin Attenuate LPS-Induced Astrocyte Activation and Cytokine Production by Targeting MAPK, STAT3, and NF-κB Signaling Pathways. Inflammation. 2020. doi: 10.1007/s10753-020-01245-6.
- Aziz N., Kim M.-Y., Cho J.Y. Anti-inflammatory effects of luteolin: A review of in vitro, in vivo, and in silico studies. J. Ethnopharmacol. 2018. 225. 342-358. doi: 10.1016/j.jep.2018.05.019.
- Park H.-S., Lee K., Kim S.-H et al. Luteolin improves hypercholesterolemia and glucose intolerance through LXRα-dependent pathway in diet-induced obese mice. J. Food. Biochem. 2020. e13358. doi: 10.1111/jfbc.13358.
- Yahyazadeh A., Altunkaynak B.Z. Neuroprotective efficacy of luteolin on a 900-MHz electromagnetic field-induced cerebellar alteration in adult male rat. Brain Res. 2020. 1744. 146919. doi: 10.1016/j.brainres.2020.146919.
- Baty R.S., Hassan K.E., Alsharif K.F. et al. Neuroprotective role of luteolin against lead acetate-induced cortical damage in rats. Hum. Exp. Toxicol. 2020. 960327120913094. doi: 10.1177/0960327120913094.
- Sedighi M., Faghihi M., Rafieian-Kopaei M. et al. Cardioprotective Effect of Ethanolic Leaf Extract of Melissa Officinalis L Against Regional Ischemia-Induced Arrhythmia and Heart Injury after Five Days of Reperfusion in Rats. Iran. J. Pharm. Res. 2019. 18(3). 1530-1542. doi: 10.22037/ijpr.2019.1100761.
- Heshmati J., Morvaridzadeh M., Sepidarkish M. et al. Effects of Melissa officinalis (Lemon Balm) on cardio-metabolic outcomes: A systematic review and meta-analysis. Phytother. Res. 2020. doi: 10.1002/ptr.6744.
- Borgonetti V., Governa P., Biagi M., Galeotti N. Novel Therapeutic Approach for the Management of Mood Disorders: In Vivo and In Vitro Effect of a Combination of L-Theanine, Melissa officinalis L. and Magnolia officinalis Rehder & E.H. Wilson. Nutrients. 2020. 12(6). 1803. doi: 10.3390/nu12061803.
- Almeida M.R., Mabasa L., Crane C. et al. Maternal vitamin B6 deficient or supplemented diets on expression of genes related to GABAergic, serotonergic, or glutamatergic pathways in hippocampus of rat dams and their offspring. Mol. Nutr. Food Res. 2016 Jul. 60(7). 1615-24. doi: 10.1002/mnfr.201500950.
- Kumar N. Nutrients and Neurology. Continuum (Minneap. Minn). 2017 Jun. 23 (3, Neurology of Systemic Disease). 822-861. doi: 10.1212/01.CON.0000520630.69195.90.
- Szymańska K., Kuśmierska K., Demkow U. Inherited disorders of brain neurotransmitters: pathogenesis and diagnostic approach. Adv. Exp. Med. Biol. 2015. 837. 1-8. doi: 10.1007/5584_2014_86.
- Dakshinamurti S., Dakshinamurti K. Antihypertensive and neuroprotective actions of pyridoxine and its derivatives. Can. J. Physiol. Pharmacol. 2015 Dec. 93(12). 1083-90. doi: 10.1139/cjpp-2015-0098.
- Abraham P.M., Kuruvilla K.P., Mathew J. et al. Alterations in hippocampal serotonergic and INSR function in streptozotocin induced diabetic rats exposed to stress: neuroprotective role of pyridoxine and Aegle marmelose. J. Biomed. Sci. 2010 Sep 25. 17. 78. doi: 10.1186/1423-0127-17-78.
- Wei Y., Lu M., Mei M. et al. Pyridoxine induces glutathione synthesis via PKM2-mediated Nrf2 transactivation and confers neuroprotection. Nat. Commun. 2020. 11(1). 941. doi: 10.1038/s41467-020-14788-x.
- Coqueiro A.Y., Rogero M.M., Tirapegui J. Glutamine as an Anti-Fatigue Amino Acid in Sports Nutrition. Nutrients. 2019. 11(4):863. doi: 10.3390/nu11040863.
- Shah A.M., Wang Z., Ma J. Glutamine Metabolism and Its Role in Immunity, a Comprehensive Review. Animals (Basel). 2020. 10(2). 326. doi: 10.3390/ani10020326.
- Ahmadi A.R., Rayyani E., Bahreini M., Mansoori A.The effect of glutamine supplementation on athletic performance, body composition, and immune function: A systematic review and a meta-analysis of clinical trials. Clin. Nutr. 2019. 38(3). 1076-1091. doi: 10.1016/j.clnu.2018.05.001.
- Petry E-R., Cruzat V.F., Heck T.G. et al. L-glutamine supplementations enhance liver glutamine-glutathione axis and heat shock factor-1 expression in endurance-exercise trained rats. Int. J. Sport Nutr. Exerc. Metab. 2015. 25(2). 188-197. doi: 10.1123/ijsnem.2014-0131.
- Raizel R., Leite J.S.M., Hypólito T.M. et al. Determination of the anti-inflammatory and cytoprotective effects of l-glutamine and l-alanine, or dipeptide, supplementation in rats submitted to resistance exercise. Br. J. Nutr. 2016. 116(3). 470-479. doi: 10.1017/S0007114516001999.
- Berndsen C.E., Wiener R., Yu I.W. et al. A conserved asparagine has a structural role in ubiquitin-conjugating enzymes. Nat. Chem. Biol. 2013. 9(3). 154-156. doi: 10.1038/nchembio.1159.
- El-Hattab A.W. Serine biosynthesis and transport defects. Mol. Genet. Metab. 2016 Jul. 118(3). 153-9. doi: 10.1016/j.ymgme.2016.04.010.
- Tabatabaie L., Klomp L.W., Berger R., de Koning T.J. L-serine synthesis in the central nervous system: a review on serine deficiency disorders. Mol. Genet. Metab. 2010 Mar. 99(3). 256-62. doi: 10.1016/j.ymgme.2009.10.012.
- Квашніна Л.В., Майдан І.С., Ігнатова Т.Б. Можливі шляхи корекції порушень вегетативного гомеостазу в дітей молодшого шкільного віку. Здоровье ребенка. 2019. 14(2). 2-7. URL: http://www.mif-ua.com/archive/article/48328.

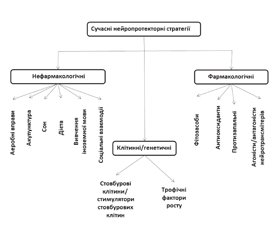
/70.jpg)
/71.jpg)