Журнал «Здоровье ребенка» Том 15, №6, 2020
Вернуться к номеру
Антибиопленочные эффекты муколитических лекарственных средств
Авторы: Абатуров А.Е., Русакова Е.А.
ГУ «Днепропетровская медицинская академия МЗ Украины», г. Днепр, Украина
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
Муколітичні лікарські засоби мають здатність порушувати структуру матриксу й руйнувати сформовані бактеріальні біоплівки. Найбільш вивченим є N-ацетилцистеїн. Уперше антибіоплівкова активність N-ацетилцистеїну була продемонстрована Ciro Pérez-Giraldo і співавт. у 1997 році. Вони показали, що речовина інгібує ріст бактерій і сприяє диспергуванню біоплівок, утворених бактеріями Staphylococcus epidermidis. Сьогодні встановлено, що N-ацетилцистеїн має виражену активність, спрямовану проти біоплівок, сформованих різними грампозитивними та грамнегативними бактеріями, у тому числі й антибіотикорезистентними бактеріальними штамами метицилінрезистентного золотистого стафілокока і хінолонрезистентних синьогнійних паличок. N-ацетилцистеїн сприяє проникненню пеніцилінів, поліміксинів, фторхінолонів у найглибші шари біоплівки, долаючи антибіотикорезистентність причинно-значущих бактеріальних агентів. N-ацетилцистеїн може застосовуватися як антибіоплівковий лікарський засіб при хронічних бактеріально-асоційованих захворюваннях, зокрема при епізодах респіраторних інфекцій у хворих на муковісцидоз, хронічному бронхіті, хронічній обструктивній хворобі легень. Вважають, що N-ацетилцистеїн має чудовий профіль безпеки та ефективності при лікуванні захворювань, що супроводжуються утворенням бактеріальних біоплівок. N-ацетилцистеїн і нанотехнологічні лікарські засоби, в яких його молекули скомбіновані з частинками галію або срібла, можуть стати препаратами вибору, що диспергують біоплівки і підсилюють ефективність антибактеріальної терапії, особливо при захворюваннях, викликаних антибіотикорезистентними штамами мікроорганізмів.
Муколитические лекарственные средства обладают способностью нарушать структуру матрикса и разрушать сформированные бактериальные биопленки. Наиболее изученным является N-ацетилцистеин. Впервые антибиопленочная активность N-ацетилцистеина была продемонстрирована Ciro Pérez-Giraldo и соавт. в 1997 году. Они показали, что вещество оказывает ингибирующее действие на рост бактерий и способствует диспергированию биопленок, образованных бактериями Staphylococcus epidermidis. В настоящее время установлено, что N-ацетилцистеин обладает выраженной активностью, направленной против биопленок, сформированных различными грамположительными и грамотрицательными бактериями, в том числе и антибиотикорезистентными бактериальными штаммами метициллинрезистентного золотистого стафилококка и хинолонрезистентных синегнойных палочек. N-ацетилцистеин способствует проникновению пенициллинов, полимиксинов, фторхинолонов в самые глубокие слои биопленки, преодолевая антибиотикорезистентность причинно-значимых бактериальных агентов. N-ацетилцистеин может применяться как антибиопленочное лекарственное средство при хронических бактериально-ассоциированных заболеваниях, в частности при эпизодах респираторных инфекций у больных муковисцидозом, хроническом бронхите, хронической обструктивной болезни легких. Полагают, что N-ацетилцистеин обладает превосходным профилем безопасности и эффективности при лечении заболеваний, которые сопровождаются образованием бактериальных биопленок. N-ацетилцистеин и нанотехнологические лекарственные средства, в которых его молекулы скомбинированы с частицами галлия или серебра, могут стать средствами выбора, диспергирующими биопленки и усиливающими эффективность антибактериальной терапии, особенно при заболеваниях, вызванных антибиотикорезистентными штаммами микроорганизмов.
Mucolytic drugs have the ability to disrupt the structure of the matrix and destroy the formed bacterial biofilms. The most studied is N-acetylcysteine. Ciro Pérez-Giraldo et al. first demonstrated the antibiofilm activity of N-acetylcysteine in 1997, which showed that it has an inhibitory effect on bacterial growth and induces the dispersion of biofilms formed by bacteria Staphylococcus epidermidis. N-acetylcysteine has been established to have a pronounced activity against biofilms formed by various gram-positive and gram-negative bacteria, including antibiotic-resistant bacterial strains of methicillin-resistant Staphylococcus aureus and quinolone-resistant Pseudomonas aeruginosa. N-acetylcysteine promotes penetration of penicillins, polymyxins, fluoroquinolones into the deepest layers of the biofilm, overcoming the antibiotic resistance of causative bacterial agents. N-acetylcysteine can be used as an antibiotic drug for chronic bacterial-associated diseases, in particular, episodes of respiratory infections in patients with cystic fibrosis, chronic bronchitis, and chronic obstructive pulmonary disease. N-acetylcysteine is believed to be a drug with an excellent safety and efficacy profile in the treatment of diseases that are accompanied by the formation of bacterial biofilms. N-acetylcysteine and nanotechnological drugs, in which its molecules are combined with gallium or silver particles, are medicines that can become the drugs of choice that disperse biofilms and enhance the effectiveness of antibiotic therapy, especially for diseases caused by antibiotic-resistant strains of microorganisms.
бактеріальні біоплівки; диспергування; N-ацетилцистеїн
бактериальные биопленки; диспергирование; N-ацетилцистеин
bacterial biofilms; dispersion; N-acetylcysteine
Введение
Антибиопленочные механизмы действия N-ацетилцистеина
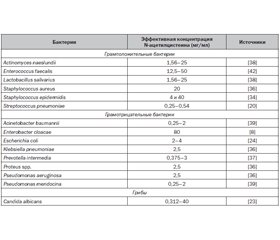
Антибиопленочная активность N-ацетилцистеина по отношению к биопленкам, сформированным различными микроорганизмами
Эффективность N-ацетилцистеина как антибиопленочного лекарственного средства
Новые лекарственные средства, созданные на основе N-ацетилцистеина
Выводы
- Абатуров А.Е., Волосовец А.П., Борисова Т.П. Медикаментозное управление окислительно-восстановительным состоянием организма при заболеваниях органов дыхания (часть 3). Здоровье ребенка. 2018. № 5 (13). С. 197-202. DOI: 10.22141/2224-0551.13.5.2018.141574.
- Ивашев М.Н., Сергиенко А.В. Клиническая фармакология ацетилцистеина. Успехи современного естествознания. 2013. № 5. С. 116-117.
- Adegoke A.A., Stenström T.A., Okoh A. Stenotrophomonas maltophilia as an Emerging Ubiquitous Pathogen: Looking Beyond Contemporary Antibiotic Therapy. Front. Microbiol. 2017 Nov 30. 8. 2276. doi: 10.3389/fmicb.2017.02276.
- Adil M., Amin S.S., Mohtashim M. N-acetylcysteine in dermatology. Indian. J. Dermatol. Venereol. Leprol. 2018 Nov-Dec. 84 (6). 652-659. doi: 10.4103/ijdvl.IJDVL_33_18.
- Ahearn C.P., Gallo M.C., Murphy T.F. Insights on persistent airway infection by non-typeable Haemophilus influenzae in chronic obstructive pulmonary disease. Pathog. Dis. 2017 Jun 1. 75 (4). doi: 10.1093/femspd/ftx042.
- Albini E., Belluco G., Berton M., Schioppacassi G., Ungheri D. In vitro antibacterial activity of thiamphenicol glycinate acetylcysteinate against respiratory pathogens. Arzneimittelforschung. 1999 Jun. 49 (6). 533-7. PMID: 10417871.
- Aldini G., Altomare A., Baron G., Vistoli G., Carini M., Borsani L., Sergio F. N-Acetylcysteine as an antioxidant and disulphide breaking agent: the reasons why. Free Radic. Res. 2018 Jul. 52 (7). 751-762. doi: 10.1080/10715762.2018.1468564.
- Aslam S., Darouiche R.O. Role of antibiofilm-antimicrobial agents in controlling device-related infections. Int. J. Artif. Organs. 2011 Sep. 34 (9). 752-8. doi: 10.5301/ijao.5000024.
- Balsamo R., Lanata L., Egan C.G. Mucoactive drugs. Eur. Respir. Rev. 2010 Jun. 19 (116). 127-33. doi: 10.1183/09059180.00003510.
- Bear C.E. 50 years ago in the Journal of Pediatrics: the effect of N-acetylcysteine on the viscosity of tracheobronchial secretions in cystic fibrosis of the pancreas. J. Pediatr. 2013 Jan. 162 (1). 85. doi: 10.1016/j.jpeds.2012.08.006.
- Blasi F., Page C., Rossolini G.M., Pallecchi L., Matera M.G., Rogliani P., Cazzola M. The effect of N-acetylcysteine on biofilms: Implications for the treatment of respiratory tract infections. Respir. Med. 2016 Aug. 117. 190-7. doi: 10.1016/j.rmed.2016.06.015.
- Calzetta L., Matera M.G., Rogliani P., Cazzola M. Multifaceted activity of N-acetyl-l-cysteine in chronic obstructive pulmonary disease. Expert. Rev. Respir. Med. 2018 Aug. 12 (8). 693-708. doi: 10.1080/17476348.2018.1495562.
- Cantu-Gonzalez G. 50 years ago in The Journal of Pediatrics: The use of N-acetylcysteine in the treatment of cystic fibrosis. J. Pediatr. 2014 Oct. 165 (4). 721. doi: 10.1016/j.jpeds.2014.04.028.
- Cataldi M., Sblendorio V., Leo A., Piazza O. Biofilm-dependent airway infections: a role for ambroxol? Pulm. Pharmacol. Ther. 2014 Aug. 28 (2). 98-108. doi: 10.1016/j.pupt.2013.11.002.
- Cazan D., Klimek L., Sperl A., Plomer M., Kölsch S. Safety of ambroxol in the treatment of airway diseases in adult patients. Expert Opin. Drug Saf. 2018 Dec. 17 (12). 1211-1224. doi: 10.1080/14740338.2018.1533954.
- Chertoff J. N-Acetylcysteine's Role in Sepsis and Potential Benefit in Patients With Microcirculatory Derangements. J. Intensive Care Med. 2018 Feb. 33 (2). 87-96. doi: 10.1177/0885066617696850.
- Chughlay M.F., Kramer N., Spearman C.W., Werfalli M., Cohen K. N-acetylcysteine for non-paracetamol drug-induced liver injury: a systematic review. Br. J. Clin. Pharmacol. 2016 Jun. 81 (6). 1021-9. doi: 10.1111/bcp.12880.
- Ciacci N., Boncompagni S., Valzano F., Cariani L., Aliberti S., Blasi F., Pollini S., Rossolini G.M., Pallecchi L. In Vitro Synergism of Colistin and N-acetylcysteine against Stenotrophomonas maltophilia. Antibiotics (Basel). 2019 Jul 25. 8 (3). pii: E101. doi: 10.3390/antibiotics8030101.
- Del Prado G., Ruiz V., Naves P., Rodríguez-Cerrato V., Soriano F., del Carmen Ponte M. Biofilm formation by Streptococcus pneumoniae strains and effects of human serum albumin, ibuprofen, N-acetyl-l-cysteine, amoxicillin, erythromycin, and levofloxacin. Diagn. Microbiol. Infect. Dis. 2010 Aug. 67 (4). 311-8. doi: 10.1016/j.diagmicrobio.2010.03.016.
- Dinicola S., De Grazia S., Carlomagno G., Pintucci J.P. N-acetylcysteine as powerful molecule to destroy bacterial biofilms. A systematic review. Eur. Rev. Med. Pharmacol. Sci. 2014 Oct. 18 (19). 2942-8. PMID: 25339490.
- Domenech M., García E. N-Acetyl-l-Cysteine and Cysteamine as New Strategies against Mixed Biofilms of Nonencapsulated Streptococcus pneumoniae and Nontypeable Haemophilus influenza. Antimicrob. Agents Chemother. 2017 Jan 24. 61 (2). pii: e01992-16. doi: 10.1128/AAC.01992-16.
- El-Baky R.M.A., El Ela D.M.M.A., Gad G.F.M. N-acetylcysteine inhibits and eradicates Candida albicans biofilms. J. Infect. Dis. Microbiol. 2014. 2 (5). 122e130. doi: 10.12691/ajidm-2-5-5.
- El-Feky M.A., El-Rehewy M.S., Hassan M.A., Abolella H.A., Abd El-Baky R.M., Gad G.F. Effect of ciprofloxacin and N-acetylcysteine on bacterial adherence and biofilm formation on ureteral stent surfaces. Pol. J. Microbiol. 2009. 58 (3). 261-7. PMID: 19899620.
- Eroshenko D., Polyudova T., Korobov V. N-acetylcysteine inhibits growth, adhesion and biofilm formation of Gram-positive skin pathogens. Microb. Pathog. 2017 Apr. 105. 145-152. doi: 10.1016/j.micpath.2017.02.030.
- Ershad M., Vearrier D. N-acetylcysteine. Stat. Pearls [Internet]. Treasure Island (FL): Stat. Pearls Publishing. 2019.
- Fowdar K., Chen H., He Z., Zhang J., Zhong X., Zhang J., Li M., Bai J. The effect of N-acetylcysteine on exacerbations of chronic obstructive pulmonary disease: A meta-analysis and systematic review. Heart Lung. 2017 Mar-Apr. 46 (2). 120-128. doi: 10.1016/j.hrtlng.2016.12.004.
- Hamed S., Emara M., Shawky R.M., El-Domany R.A., Youssef T. Silver nanoparticles: Antimicrobial activity, cytotoxicity, and synergism with N-acetyl cysteine. J. Basic. Microbiol. 2017 Aug. 57 (8). 659-668. doi: 10.1002/jobm.201700087.
- Jun Y., Youn C.K., Jo E.R., Cho S.I. In vitro inhibitory activity of N-acetylcysteine on tympanostomy tube biofilms from methicillin-resistant Staphylococcus aureus and quinolone-resistant Pseudomonas aeruginosa. Int. J. Pediatr. Otorhinolaryngol. 2019 Nov. 126. 109622. doi: 10.1016/j.ijporl.2019.109622.
- Kundukad B., Schussman M., Yang K., Seviour T., Yang L., Rice S.A., Kjelleberg S., Doyle P.S. Mechanistic action of weak acid drugs on biofilms. Sci Rep. 2017 Jul 6. 7 (1). 4783. doi: 10.1038/s41598-017-05178-3.
- Kyd J.M., McGrath J., Krishnamurthy A. Mechanisms of bacterial resistance to antibiotics in infections of COPD patients. Curr. Drug Targets. 2011 Apr. 12 (4). 521-30. DOI: 10.2174/138945011794751519.
- Landini G., Di Maggio T., Sergio F., Docquier J.D., Rossolini G.M., Pallecchi L. Effect of High N-Acetylcysteine Concentrations on Antibiotic Activity against a Large Collection of Respiratory Pathogens. Antimicrob. Agents Chemother. 2016 Nov 21. 60 (12). 7513-7517.
- Lee C.R., Lee J.H., Park M., Park K.S., Bae I.K., Kim Y.B., Cha C.J., Jeong B.C., Lee S.H. Biology of Acinetobacter baumannii: Pathogenesis, Antibiotic Resistance Mechanisms, and Prospective Treatment Options. Front. Cell. Infect. Microbiol. 2017 Mar 13. 7. 55. doi: 10.3389/fcimb.2017.00055.
- Leite B., Gomes F., Teixeira P. et al. Combined effect of linezolid and N-acetylcysteine against Staphylococcus epidermidis biofilms. Enferm. Infecc. Microbiol. Clin. 2013 Dec. 31 (10). 655-9. doi: 10.1016/j.eimc.2012.11.011.
- Minarini A., Ferrari S., Galletti M., Giambalvo N., Perrone D., Rioli G., Galeazzi G.M. N-acetylcysteine in the treatment of psychiatric disorders: current status and future prospects. Expert Opin. Drug Metab. Toxicol. 2017 Mar. 13 (3). 279-292. doi: 10.1080/17425255.2017.1251580.
- Mohsen A., Gomaa A., Mohamed F. et al. Antibacterial, anti-biofilm activity of some non-steroidal anti-inflammatory drugs and N-acetyl cysteine against some biofilm producing uropathogens. Am. J. Epidemiol. Infect. Dis. 2015. 3. 1-9. doi: 10.12691/ajeid-3-1-1.
- Moon J.H., Jang E.Y., Shim K.S., Lee J.Y. In vitro effects of N-acetyl cysteine alone and in combination with antibiotics on Prevotella intermedia. J. Microbiol. 2015 May. 53 (5). 321-9. doi: 10.1007/s12275-015-4500-2.
- Moon J.H., Choi Y.S., Lee H.W., Heo J.S., Chang S.W., Lee J.Y. Antibacterial effects of N-acetylcysteine against endodontic pathogens. J. Microbiol. 2016 Apr. 54 (4). 322-9. doi: 10.1007/s12275-016-5534-9.
- Olofsson A.C., Hermansson M., Elwing H. N-acetyl-L-cysteine affects growth, extracellular polysaccharide production, and bacterial biofilm formation on solid surfaces. Appl. Environ. Microbiol. 2003 Aug. 69 (8). 4814-22. doi: 10.1128/AEM.69.8.4814-4822.2003.
- Onger M.E., Gocer H., Emir D., Kaplan S. N-acetylcysteine eradicates Pseudomonas aeruginosa biofilms in bone cement. Scanning. 2016 Nov. 38 (6). 766-770. doi: 10.1002/sca.21326.
- Palaniswamy U., Lakkam S.R., Arya S., Aravelli S. Effectiveness of N-acetyl cysteine, 2 % chlorhexidine, and their combination as intracanal medicaments on Enterococcus faecalis biofilm. J. Conserv. Dent. 2016 Jan-Feb. 19 (1). 17-20. doi: 10.4103/0972-0707.173186.
- Parry M.F., Neu H.C. Effect of N-acetylcysteine on antibiotic activity and bacterial growth in vitro. J. Clin. Microbiol. 1977 Jan. 5 (1). 58-61. PMID: 401831.
- Pei Y., Liu H., Yang Y., Yang Y., Jiao Y., Tay F.R., Chen J. Biological Activities and Potential Oral Applications of N-Acetylcysteine: Progress and Prospects. Oxid. Med. Cell. Longev. 2018 Apr 22. 2018. 2835787. doi: 10.1155/2018/2835787.
- Pérez-Giraldo C., Rodríguez-Benito A., Morán F.J., Hurtado C., Blanco M.T., Gómez-García A.C. Influence of N-acetylcysteine on the formation of biofilm by Staphylococcus epidermidis. J. Antimicrob. Chemother. 1997 May. 39 (5). 643-6. DOI: 10.1093/jac/39.5.643.
- Pollini S., Boncompagni S., Di Maggio T., Di Pilato V., Spanu T., Fiori B., Blasi F., Aliberti S., Sergio F., Rossolini G.M., Pallecchi L. In vitro synergism of colistin in combination with N-acetylcysteine against Acinetobacter baumannii grown in planktonic phase and in biofilms. J. Antimicrob. Chemother. 2018 Sep 1. 73 (9). 2388-2395. doi: 10.1093/jac/dky185.
- Pollini S., Di Pilato V., Landini G., Di Maggio T., Cannatelli A., Sottotetti S., Cariani L., Aliberti S., Blasi F., Sergio F., Rossolini G.M., Pallecchi L. In vitro activity of N-acetylcysteine against Stenotrophomonas maltophilia and Burkholderia cepacia complex grown in planktonic phase and biofilm. PLoS One. 2018 Oct 1. 13 (10). e0203941. doi: 10.1371/journal.pone.0203941.
- Poole P., Sathananthan K., Fortescue R. Mucolytic agents versus placebo for chronic bronchitis or chronic obstructive pulmonary disease. Cochrane Database Syst. Rev. 2019 May 20. 5. CD001287. doi: 10.1002/14651858.CD001287.pub6.
- Ramachandran A., Jaeschke H. Acetaminophen Toxicity: Novel Insights Into Mechanisms and Future Perspectives. Gene Expr. 2018 Mar 21. 18 (1). 19-30. doi: 10.3727/105221617X15084371374138.
- Rasmussen K., Nikrad J., Reilly C., Li Y., Jones R.S. N-Acetyl-l-cysteine effects on multi-species oral biofilm formation and bacterial ecology. Lett. Appl. Microbiol. 2016 Jan. 62 (1). 30-8. doi: 10.1111/lam.12513.
- Rhodes K.A., Schweizer H.P. Antibiotic resistance in Burkholderia species. Drug Resist. Updat. 2016 Sep. 28. 82-90. doi: 10.1016/j.drup.2016.07.003.
- Riise G.C., Larsson S., Larsson P., Jeansson S., Andersson B.A. The intrabronchial microbial flora in chronic bronchitis patients: a target for N-acetylcysteine therapy? Eur. Respir. J. 1994 Jan. 7 (1). 94-101. DOI: 10.1183/09031936.94.07010094.
- Riise G.C., Qvarfordt I., Larsson S., Eliasson V., Andersson B.A. Inhibitory effect of N-acetylcysteine on adherence of Streptococcus pneumoniae and Haemophilus influenzae to human oropharyngeal epithelial cells in vitro. Respiration. 2000. 67 (5). 552-8. DOI: 10.1159/000067473.
- Šalamon Š., Kramar B., Marolt T.P., Poljšak B., Milisav I. Medical and Dietary Uses of N-Acetylcysteine. Antioxidants (Basel). 2019 Apr 28. 8 (5). pii: E111. doi: 10.3390/antiox8050111.
- Sanguinetti C.M. N-acetylcysteine in COPD: why, how, and when? Multidiscip. Respir. Med. 2016 Feb 3. 11. 8. doi: 10.1186/s40248-016-0039-2.
- Snell G., Reed A., Stern M., Hadjiliadis D. The evolution of lung transplantation for cystic fibrosis: A 2017 update. J. Cyst. Fibros. 2017 Sep. 16 (5). 553-564. doi: 10.1016/j.jcf.2017.06.008.
- Trifonova A., Strateva T. Stenotrophomonas maltophilia — a low-grade pathogen with numerous virulence factors. Infect Dis (Lond). 2019 Mar. 51 (3). 168-178. doi: 10.1080/23744235.2018.1531145.
- Vardakas K.Z., Voulgaris G.L., Samonis G., Falagas M.E. Inhaled colistin monotherapy for respiratory tract infections in adults without cystic fibrosis: a systematic review and meta-analysis. Int. J. Antimicrob. Agents. 2018 Jan. 51 (1). 1-9. doi: 10.1016/j.ijantimicag.2017.05.016.
- Young M., Ozcan A., Lee B., Maxwell T., Andl T., Rajasekaran P., Beazley M.J., Tetard L., Santra S. N-acetylcysteine Coated Gallium Particles Demonstrate High Potency against Pseudomonas aeruginosa PAO1. Pathogens. 2019 Aug 1. 8 (3). pii: E120. doi: 10.3390/pathogens8030120.
- Zhan S.H., French L. Sequence similarity searches for morphine biosynthesis enzymes in bacteria yield putative targets for understanding associations between infection and opiate administration. J. Med. Microbiol. 2019 Jun. 68 (6). 952-956. doi: 10.1099/jmm.0.001001.
- Zhao T., Liu Y. N-acetylcysteine inhibit biofilms produced by Pseudomonas aeruginosa. BMC Microbiol. 2010 May 12. 10. 140. doi: 10.1186/1471-2180-10-140.
- Zheng C.H., Ahmed K., Rikitomi N., Martinez G., Nagatake T. The effects of S-carboxymethylcysteine and N-acetylcysteine on the adherence of Moraxella catarrhalis to human pharyngeal epithelial cells. Microbiol. Immunol. 1999. 43 (2). 107-13. DOI: 10.1111/j.1348-0421.1999.tb02381.x.

/110.jpg)