Вступ
Рак молочної залози (РМЗ) — одне з найбільш поширених злоякісних новоутворень у жінок. Захворюваність на РМЗ у 2018 році становила приблизно 2,1 млн нових випадків, а смертність — приблизно 630 тис. випадків у всьому світі [1].
В Україні загальна захворюваність на РМЗ за 2018 рік становить 41,9 випадку на 100 тис. населення (грубий показник) і продовжує невпинно зростати (+3,3 % порівняно з минулим роком). Український стандартизований за віком показник становить 38,4, тоді як світовий стандарт — 25,8 на 100 тис. населення). Смертність за 2018 р. становила 16,0 на 100 тис. населення. Даний показник є вищим як від українського (14,2), так і від світового (8,7 на 100 тис.) стандарту [2].
Таким чином, рак молочної залози посідає перше місце серед жінок віком 30–75 років за рівнем захворюваності та жінок віком 30–75+ років за рівнем смертності в Україні.
Рівень смертності від РМЗ знизився останніми десятиліттями завдяки ранній діагностиці та всебічному підходу до лікування. У результаті пацієнти нерідко помирають в результаті неонкологічних захворювань (як правило, захворювань серцево-судинної системи) [3, 26]. Ураховуючи подовження очікуваної тривалості життя, необхідно приділяти пильну увагу хронічним захворюванням пацієнтів, таким як дисліпідемія, ішемічна хвороба серця, гіпертензія тощо.
Питома вага гормончутливого раку молочної залози становить більше 60 %, а в жінок у постменопаузі цей процент є ще вищим. Блокування естрогенової стимуляції, що досягається за допомогою ендокринної терапії, робить вкрай важливий внесок у лікування гормончутливого раку молочної залози.
Активне використання ендокринотерапії в ад’ювантній терапії РМЗ призвело до збільшення загальної та безрецидивної виживаності [4]. Однак деякі публікації наголошують, що ендокринотерапія чинить значний побічний вплив на рівень ліпідів сироватки, що може зменшувати чи навіть нейтралізувати переваги ендокринної терапії [21, 28–30].
Стандартна ад’ювантна ендокринотерапія для пацієнток у постменопаузі включає:
— upfront therapy — монотерапія інгібітором ароматази чи тамоксифеном протягом 5 років;
— switching therapy:
- послідовне використання тамоксифену протягом 2–3 років із наступним переключенням на інгібітор ароматази протягом ще 3 чи 2 років відповідно;
- послідовне використання інгібітора ароматази протягом 2–3 років із наступним переключенням на тамоксифен протягом ще 3 чи 2 років відповідно;
— еxtended therapy — подовження прийому тамоксифену чи інгібітора ароматази до 8–10 років;
— extended after switch — прийом тамоксифену протягом 2–3 років із переключенням на інгібітор ароматази на період до 5 років — сумарна тривалість лікування 7–8 років [5, 41].
Захворювання серцево-судинної системи, важливим компонентом яких є атеросклеротичне ураження судин, є причиною більше ніж 4 мільйонів смертей на рік в одній лише Європі. Вони стають причиною смерті більшої кількості жінок (2,2 мільйона), ніж чоловіків (1,8 мільйона), хоча смерть від серцево-судинних подій у віці до 65 років більш характерна для чоловіків (490 тисяч смертей серед чоловіків проти 193 тисяч серед жінок) [6].
Важливість профілактики атеросклеротичної хвороби серця (ASCVD) залишається безперечною як для загальної популяції, так і для осіб із високим ризиком розвитку захворювань серцево-судинної системи.
Ліпопротеїни плазми транспортують ліпіди тканинам, що використовують їх для отримання енергії, накопичення, продукції стероїдних гормонів та формування жовчних кислот. Ліпопротеїни складаються з етерифікованого та неетерифікованого холестеролу, тригліцеридів, фосфоліпідів та білкових компонентів — аполіпопротеїнів, які відіграють роль структурних компонентів, лігандів для рецепторів та ферментів-активаторів чи інгібіторів.
Важливим питанням є визначення того, які з показників ліпідного обміну мають найбільше значення в розвитку серцево-судинної патології.
Численні епідеміологічні та рандомізовані клінічні дослідження довели логарифмічне відношення між абсолютною кількістю ліпопротеїдів низької щільності (ЛПНЩ) та ризиком розвитку атеросклерозу (ASCVD) [7–9]. Результати цих досліджень є надзвичайно послідовними, мають біологічне й експериментальне підтвердження. На їх основі можна зробити висновок, що підвищений рівень ЛПНЩ асоціюється з підвищенням ризику розвитку атеросклерозу; зниження цього ризику пропорційно досягнутому зниженню ЛПНЩ.
Підвищений рівень тригліцеридів сироватки також асоціюється зі збільшенням ризику розвитку атеросклеротичного ураження серцево-судинної системи, проте, чи є цей зв’язок причинно-наслідковим, достеменно не встановлено. У рекомендаціях Європейського товариства кардіологів та Європейського товариства атеросклерозу (ESC/EAS) із лікування дисліпідемій [6], які ґрунтуються на численних дослідженнях, стверджується, що ризик розвитку атеросклерозу (ASCVD) визначається концентрацією усіх циркулюючих часточок, що містять аполіпопротеїн В (включаючи ЛПНЩ), а не концентрацією самих тригліцеридів. Таким чином, безперечно визначена кореляція, але не причинно-наслідковий зв’язок.
Щодо ліпопротеїдів високої щільності (ЛПВЩ) негативний зв’язок між їх концентрацією та ризиком розвитку атеросклерозу підтверджується в епідеміологічних дослідженнях [10, 11], але не в дослідженнях із менделєєвською рандомізацією [12, 13]. Клінічні рекомендації ESC/EAS пропонують ставитись до протективних властивостей ЛПВЩ з обережністю, адже в епідеміологічних дослідженнях їх підвищення часто асоціюється з протилежними змінами в рівнях ЛПНЩ та тригліцеридів. Лікування далцетрапібом — препаратом, що ізольовано підвищує ЛПВЩ, не призвело до зменшення ризику серцево-судинних подій [14]. Таким чином, зараз відсутні рандомізовані дослідження чи генетичні докази того, що підвищення ЛПВЩ плазми може знижувати ризик серцево-судинних подій.
Більшість сучасних настанов із запобігання розвитку атеросклерозу та серцево-судинних подій пропонує використовувати шкали оцінки серцево-судинного ризику. Наприклад, шкала SCORE, що оцінює десятирічний ризик виникнення фатальних захворювань серцево-судинної системи, враховує такі показники, як стать, вік, систолічний артеріальний тиск, рівень загального холестерину та наявність фактора паління.
Шкала оцінки загального серцево-судинного ризику, що використовується для стратификації груп ризику та призначення відповідного лікування, враховує вік, наявність симптомної, задокументованої серцево-судинної патології, відсоток за шкалою SCORE, наявність сімейної гіперхолестеринемії, хронічної хвороби нирок, рівень загального холестерину та ліпопротеїдів низької щільності.
Таким чином, такі показники, як тригліцериди сироватки та ліпопротеїди високої щільності, є важливими в оцінці ліпідного профілю, але на відміну від загального холестерину та ЛПНЩ не враховуються при визначенні ризику розвитку серцево-судинних подій.
Вплив гіперхолестеринемії на організм людини не обмежується підвищенням серцево-судинного ризику. Метаболіт холестерину, 27-гідроксихолестерол –(27-HC), може виступати лігандом естрогенових рецепторів та печінкового рецептора Х (liver X receptor — LXR) завдяки своїй структурній подібності до них. Холестерин конвертується у 27-НС за допомогою цитохрому P450, а саме його оксидази CYP27A1. Цікаво також, що рівень експресії CYP27A1 корелює зі ступенем злоякісності пухлини [15]. Таким чином, гіперхолестеринемія може мати проестрогенний вплив, що, зі свого боку, призводить до зниження ефективності ендокринної терапії або навіть резистентності до неї [16].
Існують також підтвердження імунного впливу 27-гідроксихолестеролу [17] та іншого метаболіту холестерину, 27-HC [18]. За даними цих досліджень метаболіти холестерину впливають на клітини імунної системи, чинять прозапальний та навіть прометастатичний вплив. Звісно, що останні дослідження є виключно преклінічними.
Деякі дослідники також пов’язують гіперхолестеринемію з більш високою стадією раку молочної залози при діагностиці [19], більшою частотою рецидивів та загалом гіршим прогнозом щодо загальної виживаності [20], тоді як призначення гіполіпідемічних препаратів (статинів) у дослідженні BIG 1-98 асоціювалось із подовженням безрецидивної виживаності (DFS) та виживання без прогресування (PFS) [21].
Метою роботи є вивчення та аналіз даних сучасної літератури щодо впливу засобів ендокринотерапії раку молочної залози на рівень ліпідів сироватки крові та клінічного значення дисліпідемій серед пацієнток у постменопаузі.
Матеріали та методи
У роботі використовувались дані клінічних випробувань із пошукового ресурсу PubMed, отримані за ключовими словами: «гормончутливий рак молочної залози», «дисліпідемія», «ліпідний профіль сироватки», «ад’ювантна ендокринотерапія раку молочної залози», «селективні модулятори естрогенових рецепторів» (SERM), «інгібітори ароматази»; клінічні рекомендації NCCN; клінічні рекомендації ESC/EAS із лікування дисліпідемій.
Для вивчення були відібрані 13 повнотекстових публікацій, які відповідали таким критеріям: 1) за дизайном дослідження були рандомізованими плацебо-контрольованими або когортними; 2) досліджувались жінки в постменопаузі з гормончутливим раком молочної залози I–IIIA стадії, які отримували ендокринотерапію в ад’ювантному режимі; 3) протягом дослідження пацієнтки не отримували інших препаратів, які впливають на рівень ліпідів сироватки, або такі пацієнтки виключались із дослідження.
Теоретична частина
Відомо, що жінки мають нижчий рівень серцево-судинної захворюваності порівняно з чоловіками того ж віку. У жінок симптомні захворювання серцево-судинної системи проявляються загалом на 10 років пізніше [22].
Цей ефект прийнято пояснювати протективним впливом естрогену, адже після настання менопаузи жінки хворіють на серцево-судинну захворюваність частіше, незалежно від того, чи є менопауза природньою, патологічною, медикаментозною чи хірургічною. Естроген захищає організм від ішемічної хвороби серця й атеросклерозу шляхом посилення ангіогенезу та вазодилатації, зниження оксидативного стресу та фіброзу, а також модифікації обміну ліпідів.
Під впливом естрогену відбувається збільшення кількості рецепторів до ЛПНЩ у печінці, що призводить до підвищення кліренсу ЛПНЩ, прискорення перетворення холестерину на жовчні кислоти і, як наслідок, зниження ЛПНЩ у плазмі. Естроген гальмує активність печінкової тригліцеридліпази, що призводить до підвищення рівня ЛПВЩ через затримку їх кліренсу [23].
Тамоксифен — селективний модулятор естрогенових рецепторів, що чимало років залишається золотим стандартом у лікуванні гормончутливого раку молочної залози. Будучи агоністом-антагоністом, тамоксифен чинить тканинспецифічний проестрогеновий вплив, з яким пов’язані такі його побічні ефекти, як гіперплазія ендометрія та можливий розвиток раку ендометрія (найбільш виражені у жінок у пременопаузі), тромбоз глибоких вен, розвиток неалкогольної жирової хвороби печінки.
Проте агоністичним впливом тамоксифену можна пояснити і деякі його позитивні ефекти, наприклад вплив на ліпідний профіль та метаболізм кісток.
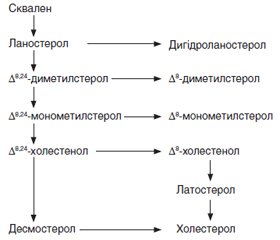
У роботі фінських авторів 1995 року [24] був досліджений інший ймовірний механізм холестеринзнижуючого ефекту селективних модуляторів естрогенових рецепторів (тамоксифену та тореміфену) — інгібування конвертації Δ8-холестенолу у ланостерол. Рівень Δ8-холестенолу сироватки в пацієнтів, які отримували лікування тамоксифеном та тореміфеном, був підвищений, а рівень ланостеролу знижений, що свідчить про інгібування тамоксифеном та тореміфеном перетворення Δ8-холестенолу на ланостерол.
Іншим можливим механізмом впливу тамоксифену на ліпідний обмін може бути модифікація активності lipid transfer protein I плазми (LTP I). Цей білок бере участь у транспорті складних ефірів холестерилу (сholesteryl ester transfer protein — СETP) та фосфоліпідів (phospholipid transfer protein — PLTP) проти градієнта концентрації. Мутації в генах, що кодують цю групу білків, асоційовані з високим ризиком розвитку атеросклерозу [25].
Інгібітори ароматази (ІА) третього покоління, як стероїдні (екземестан), так і нестероїдні (летрозол, анастрозол), широко використовуються в лікуванні гормончутливого раку молочної залози в жінок у постменопаузі.
Найпростішим поясненням впливу ІА на показники ліпідного профілю може бути його пряма дія — зниження рівня естрогенів шляхом інгібування ароматази, адже навіть у період постменопаузи естрогени відіграють певну роль у регуляції метаболізму ліпідів. Як альтернатива або в додаток до цього інгібітори ароматази можуть впливати на ферментні шляхи в печінці, як у разі тамоксифену, що інгібує перетворення –Δ8-холестенолу на ланостерол.
Вплив нестероїдних інгібіторів ароматази на метаболізм ліпідів може відрізнятись від такого стероїдних ІА, таких як екземестан, через необернений зв’язок останніх з ароматазою та їх потенційний андрогенний ефект [27].
Фульвестрант є селективним інгібітором естрогенових рецепторів. Він виступає конкурентним антагоністом естрогену та на відміну від тамоксифену не має естрогенподібної активності.
У даній роботі вплив фульвестранту на ліпідний профіль не розглянутий, адже в терапії першої лінії раннього раку молочної залози він рутинно не застосовується.
Поєднання інгібіторів ароматази та фульвестранту з інгібіторами циклінзалежних кіназ та іншими таргетними препаратами інтенсивно вивчається в клінічних дослідженнях та все ширше використовується в клінічній практиці.
Результати
N-SAS BC 04 (National Surgical Adjivant Study BC 04) — рандомізоване мультицентрове дослідження, що мало основний протокол (Tamoxifen and Exemestane Adjuvant Multicenter international — TEAM international) та численні другорядні (19), включаючи TEAM Japan, який і є одним з об’єктів даного огляду [28].
Основний протокол TEAM мав на меті оцінити безрецидивну виживаність у жінок у постменопаузі з гормончутливим РМЗ, які отримували ад’ювантну терапію тамоксифеном (2,5–3 роки), після чого отримували екземестан (2,5–3 роки) або тільки екземестан протягом 5 років.
Sub-study ТEAM Japan було сплановано з метою порівняння впливу послідовного лікування тамоксифеном (2,5–3 роки) й екземестаном (2,5–3 роки) із лікуванням виключно екземестаном (5 років) чи виключно анастрозолом (5 років) на рівень ліпідів сироватки та мінеральну щільність кісток.
Первинними кінцевими точками були визначені рівні ліпідів сироватки та щільності кісткової тканини, як вторинна кінцева точка була обрана якість життя, пов’язана зі здоров’ям (HRQOL — health ralated quаlity of life).
Для дослідження були відібрані 154 японські жінки в постменопаузі після операції з приводу гормончутливого раку молочної залози I–IIIA стадії, які мали задовільний рівень ліпідів сироватки (загальний холестерин — < 260 мг/дл та тригліцериди < 300 мг/дл) та ніколи раніше не отримували лікування з приводу порушень ліпідного обміну.
Протягом року вимірювались десять параметрів ліпідного обміну: загальний холестерин (TC), ліпопротеїди високої щільності (HDL-C), ліпопротеїди низької щільності (LDL-C), тригліцериди (TG), холестерин-ремнантні часточки (RLP-C), ліпопротеїн (a) (Lp(a)), аполіпопротеїн A1 (Apo-A1), Apo-B, Apo-C2, та співвідношення Apo-B/Apo-A1. Вимірювання проводились до початку лікування та через 3, 6, 12 місяців.
Лікування тамоксифеном призводило до різкого зниження рівня тригліцеридів та ліпопротеїдів на відмітці 3 місяці. Після року в групі тамоксифену відзначалось зниження TC, LDL-C, при цьому рівень HDL-C суттєво не змінювався, а рівень TG підвищувався.
У групі екземестану відзначалось незначне зниження ліпопротеїдів високої щільності, яке було статистично значущим порівняно з групою анастрозолу. Порівняно з групою тамоксифену рівень тригліцеридів був нижчим.
Таким чином, за результатами дослідження TEAM Japan, вплив тамоксифену на ліпідний профіль був оцінений як позитивний, незважаючи на деяке підвищення рівня тригліцеридів. Автори також дійшли висновку, що екземестан та анастрозол суттєво не впливають на ліпідний профіль, при цьому анастрозол не викликав зниження рівня протективних ліпопротеїдів високої щільності (HDL-C) (табл. 1).
У TEAM Greek sub-study — рандмізованому паралельному клінічному дослідженні вивчався вплив 5-річної терапії екземестаном порівняно зі стандартною 5-річною терапією тамоксифеном на ліпідний профіль пацієнтів [29].
У дослідження були включені 176 жінок у постменопаузі з гормончутливим раннім раком молочної залози. Загальний холестерин, ліпопротеїди низької та високої щільності та тригліцериди сироватки вимірювались перед початком дослідження та кожні 3 місяці протягом 1 року.
У групі тамоксифену спостерігалися тенденція до зниження ЛПНЩ та стабільне підвищення рівня тригліцеридів протягом усього дослідження. У групі екземестану була виявлена тенденція до зниження тригліцеридів, на відмітках у 3 та 6 місяців визначалось підвищення рівня ліпопротеїдів низької щільності, що при подальших вимірюваннях не зберігалося. Зміни в рівнях інших показників були статистично незначущими. В обох групах спостерігалася тенденція до зниження загального холестерину.
Автори оцінюють вплив тамоксифену на ліпідний профіль як загалом позитивний, а екземестану — як нейтральний, при цьому відзначають переваги екземестану над тамоксифеном у зниженні рівня тригліцеридів. У публікації наголошено на можливій різниці між впливом на ліпідний обмін екземестану як стероїдного необоротного інгібітора ароматази та нестероїдних інгібіторів ароматази (летрозол, анастрозол) (табл. 2).
Вплив екземестану та летрозолу на ліпідний профіль жінок у постменопаузі з раннім раком молочної залози досліджувався в мультицентровому проспективному рандомізованому дослідженні 2012 року [30].
Для дослідження були відібрані 246 жінок у постменопаузі з раком молочної залози I–IIIA cтадії, які раніше не отримували інгібіторів ароматази. У дослідження були включені як жінки, для яких інгібітор ароматази був першою ланкою системної терапії, так і ті, які раніше отримували хіміотерапію та/або тамоксифен у неоад’ювантному чи ад’ювантному режимі. Пацієнтки, які почали приймати препарати, що знижують рівень ліпідів сироватки, не виключались із дослідження, але оцінювались окремо.
Загальний холестерин, ліпопротеїди низької та високої щільності та тригліцериди вимірювались до початку лікування та через 3 місяці.
У групі екземестану рівень загального холестерину та ліпопротеїдів високої щільності зменшився, показник тригліцеридів значно зменшився, а зміни рівня ліпопротеїдів низької щільності були статистично незначущими.
У групі летрозолу рівень загального холестерину та ліпопротеїдів низької щільності збільшився, рівень ліпопротеїдів високої щільності та тригліцеридів не змінився.
Автори зауважують, що збільшення рівня ЛПНЩ спостерігалося переважно в групі осіб, які раніше приймали тамоксифен. Тобто частково цей ефект можна пояснити відміною тамоксифену і зникненням того впливу, що він мав на ліпідний профіль сироватки. На жаль, дизайн цього дослідження не дозволяє чітко визначити причинно-наслідковий зв’язок.
Прийом холестеринзнижуючих препаратів (використовувались статини, фібрати та езетиміб) разом з екзместаном та летрозолом позитивно впливав на ліпідний профіль, але не захищав від зниження рівня ЛПВЩ у групі екземестану та підвищення рівня ЛПНЩ у групі пацієнток, які раніше приймали тамоксифен (табл. 3).
Ретроспективне когортне дослідження впливу інгібіторів ароматази (летрозолу, анастрозолу й екземестану) на ліпідний профіль було проведено в Китаї [31].
Для дослідження були відібрані 116 жінок у постменопаузі з раннім гормончутливим раком молочної залози, які отримували інгібітори ароматази як первинну ад’ювантну терапію або послідовно після терапії тамоксифеном, а також не отримували препаратів, що впливають на рівень ліпідів сироватки крові. Було виділено три групи пацієнток: 38 приймали летрозол, 51 — анастрозол, 27 — екземестан.
Рівні загального холестерину, ліпопротеїдів низької та високої щільності, тригліцеридів та показники метаболізму кісток вимірювались перед дослідженням, через 3, 6, 12 та 24 місяці.
Зміни рівня загального холестерину були визнані статистично незначущими в усіх трьох групах. Рівень ліпопротеїдів низької щільності незначно знизився в групі анастрозолу, тоді як у групах летрозолу й екземестану цей показник незначно збільшився. Різниця між групами була статистично незначущою. Рівень ЛПВП дещо знизився в групі екземестану та, навпаки, підвищився в групах летрозолу й анастрозолу. Різниця між групами була статистично значущою на відмітках 3, 6 та 12 місяців, проте на відмітці у 24 місяці суттєвої статистичної різниці визначено не було. Рівень тригліцеридів сироватки знизився в усіх трьох групах, найбільший ефект спостерігався в групі екземестану.
У публікації наголошено, що інгібітори ароматази не чинять клінічно значущого впливу на рівень ліпідів сироватки східнокитайських жінок у постменопаузі. Вплив різних препаратів цієї групи на ліпідний профіль є еквівалентним чи майже еквівалентним (табл. 4).
MA.17 L — субдослідження MA.17 подвійного сліпого рандомізованого плацебо-контрольованого дослідження, в якому вивчали подовжену ад’ювантну терапію летрозолом після 5 років терапії тамоксифеном [32].
Для дослідження були відібрані 183 жінки в постменопаузі, які не мали дисліпідемії і не приймали препаратів, що знижують рівень ліпідів сироватки. Загальний холестерин, ліпопротеїди низької та високої щільності, тригліцериди та ліпопротеїн (а) вимірювались до початку лікування, через 6, 12, 24, 36, 48 та 60 місяців.
Після 5 років терапії тамоксифеном пацієнтки, які отримували летрозол, мали значне підвищення загального холестерину, ліпопротеїдів низької щільності та ліпопротеїну (а), але без статистично значущих змін у рівні тригліцеридів. Із них 20,9 % пацієнтів почали отримувати терапію статинами. Результати дослідження залишились незмінними після виключення з розрахунків пацієнтів, які отримували гіполіпідемічні препарати.
Автори дослідження не наполягають на тому, що погіршення показників ліпідного профілю є клінічно важливим, лише статистично значущим порівняно з тим рівнем, що був визначений після 5 років терапії тамоксифеном. У публікації припущено, що тамоксифен має більш сприятливий вплив на ліпідний профіль, ніж летрозол, і наголошено, що терапія летрозолом потребує контролю рівня ліпідів сироватки та за потреби їх корекції (табл. 5).
Вплив летрозолу на ліпідний профіль сироватки досліджували на невеликій вибірці у 2001 році [33].
Дослідження тривало 16 тижнів. Були відібрані 20 жінок у постменопаузі з гормончутливим раком молочної залози I–III стадії, які раніше не приймали препаратів, що впливають на обмін ліпідів.
Рівні загального холестерину, ліпопротеїдів низької та високої щільності та тригліцеридів вимірювались перед початком дослідження, через 8 та 16 тижнів.
Через 16 тижнів рівень загального холестерину та ліпопротеїдів високої щільності в пацієнток, які приймали летрозол, підвищився порівняно з вихідним рівнем. Рівень тригліцеридів не змінився, також визначалась тенденція до підвищення ліпопротеїдів високої щільності.
Автори публікації оцінюють вплив летрозолу на ліпідний профіль сироватки як загалом негативний, проте не роблять остаточного висновку щодо клінічної значущості цього впливу, враховуючи невелику вибірку пацієнтів та незначну тривалість дослідження (табл. 6).
У проспективному рандомізованому дослідженні у II фазі в Японії [34] розглянутий вплив летрозолу порівняно з тореміфеном в ад’ювантному режимі на ліпідний профіль та метаболізм кісток у жінок у постменопаузі з гормончутливим раком молочної залози I–II cтадії.
Для дослідження були відібрані 54 жінки, які раніше не отримували системної протипухлинної терапії або будь-якої терапії, що могла б вплинути на ліпідний профіль та/або кістковий метаболізм. Пацієнтки, які демонстрували рівень тригліцеридів 350 мг/дл чи більше та/або рівень ліпопротеїдів низької щільності 200 мг/дл чи вище протягом року лікування, були виключені з дослідження та почали отримувати знижуючу рівень ліпідів терапію.
Рівні загального холестерину, ЛПНЩ, ЛПВЩ, тригліцеридів та показники метаболізму кісток вимірювались перед дослідженням, через 6, 12 та 24 місяці.
У групі тореміфену рівні загального холестерину та ліпопротеїдів низької щільності знизились на 6,5 та 14,0 % відповідно порівняно з першим вимірюванням. Зміни ліпідного профілю в групі летрозолу були статистично незначущими порівняно з першим вимірюванням. При порівнянні двох груп статистично значущі відмінності були визначені в рівнях загального холестерину та ліпопротеїдів низької щільності на відмітках у 12 та 24 місяці.
Тореміфен сприятливо впливав на ліпідний профіль (а також метаболізм кісток) порівняно як з періодом до лікування, так і з групою летрозолу.
Автори дослідження пропонують використовувати тореміфен як препарат вибору для жінок у постменопаузі, якщо вони також мають гіперліпідемію та/або остеопороз (табл. 7).
Ще в одному японському мультицентровому рандомізованому дослідженні [35] вивчався вплив тореміфену й анастрозолу на ліпідний профіль та показники метаболізму кісток у жінок у постменопаузі з гормончутливим раком молочної залози.
Для дослідження були відібрані 69 пацієнток у постменопаузі з гормончутливим раком молочної залози. Пацієнтки раніше не отримували лікування з приводу гіперліпідемії чи остеопорозу. Пацієнтки, які демонстрували рівень тригліцеридів 350 мг/дл чи більше та/або рівень ліпопротеїдів низької щільності 200 мг/дл чи вище протягом року лікування були виключені з дослідження та почали отримувати знижуючу рівень ліпідів терапію.
Рівні загального холестерину, ліпопротеїдів низької та високої щільності, тригліцеридів, аполіпопротеїнів А1 та В, а також показники метаболізму кісток вимірювались перед початком дослідження, через 6, 12 та 24 місяці.
Сироваткові рівні загального холестерину, ліпопротеїдів низької щільності, тригліцеридів та аполіпопротеїну В значно знизились у групі тореміфену. Через 6 місяців від початку дослідження різниця становила 6,2, 12,9 та 13,8 % відповідно, а через 24 місяці — 7,2, 11,3 та 15,7 % порівняно з вимірюванням до прийому тореміфену. Зміни цих показників у групі анастрозолу не були статистично значущими.
Сироваткові рівні ліпопротеїдів високої щільності й аполіпопротеїну А1 значно підвищились у групі тореміфену: через 6 місяців — на 17,1 та 16,3 %, а через 24 місяці — на 22 та 18,4 % відповідно порівняно з вимірюванням до початку дослідження. У групі анастрозолу ці показники залишались незмінними з транзиторним підвищенням сироваткового аполіпопротеїну А1 на відмітці у 12 місяців.
За результатами даного дослідження, тореміфен сприятливо впливав на метаболізм ліпідів у жінок у постменопаузі. Вплив анастрозолу на ліпідний профіль був нейтральним (табл. 8).
Вплив анастрозолу та та тамоксифену на метаболізм ліпідів у японських жінок у постменопаузі з раннім гормончутливим раком молочної залози досліджувався в рандомізованому клінічному дослідженні 2005 року [36], що тривало 12 тижнів.
Для дослідження були відібрані 49 жінок, які відповідали наведеним вище критеріям та раніше не приймали препаратів, що впливають на ліпідний обмін.
Перед початком дослідження та через 12 тижнів вимірювались показники загального холестерину, ліпопротеїдів низької та високої щільності, тригліцеридів, аполіпопротеїнів А, В, С та Е, а також статевих гормонів (фолікулінстимулюючого гормона й естрадіолу).
Через 12 тижнів у групі тамоксифену рівень загального холестерину знизився на 13,4 %, а рівень ліпопротеїдів низької щільності — на 23,5 % порівняно з базовим рівнем, визначеним перед початком дослідження. Рівень ЛПВЩ у групі тамоксифену не змінився. Рівень тригліцеридів збільшився на 21,7 %.
У групі анастрозолу не спостерігалось жодних змін у показниках загального холестерину та ліпопротеїдів низької щільності. Рівень ліпопротеїдів високої щільності збільшився на 10,2 % порівняно з базовим рівнем. Рівень тригліцеридів у пацієнток, які приймали анастрозол, знизився на 20,1 %. Різниця між групами для наведених вище показників була статистично значущою.
Автори оцінюють вплив анастрозолу на метаболізм ліпідів як більш позитивний за рахунок зниження рівня тригліцеридів сироватки та підвищення ліпопротеїдів високої щільності. Але сучасний погляд на розвиток атеросклерозу та ризик виникнення серцево-судинних подій ставить на перше місце в лікуванні дисліпідемії зниження ліпопротеїдів низької щільності та загального холестерину [6] (табл. 9).
У рандомізованому паралельному клінічному дослідженні К. Anan, S. Mitsuyama, Y. Yanagita et al. [37] вивчався вплив тореміфену та тамоксифену на ліпідний профіль жінок у постменопаузі хворих на рак молочної залози I–II A стадії.
У дослідженні брали участь 65 японських жінок, які раніше не отримували гіполіпідемічних засобів. Автори відмічають, що хоча розвиток гіперліпідемії був критерієм виключення з дослідження, жодній пацієнтці не довелося призначати препаратів для корекції ліпідного обміну.
Рівні загального холестерину, ліпопротеїдів низької та високої щільності, тригліцеридів, аполіпопротеїнів А1 та В та ліпопротеїну (а) вимірювались перед початком дослідження, через 3, 6 та 12 місяців.
В обох групах відзначалось статистично значуще зниження загального холестерину, ліпопротеїдів низької щільності, ліпопротеїну (а) та аполіпопротеїну В. Тільки в групі тореміфену спостерігалось підвищення ліпопротеїдів високої щільності. На відмітці 12 місяців у групі тамоксифену визначалось підвищення рівня тригліцеридів, тоді як у групі тореміфену — його зниження.
Таким чином, вплив двох селективних модуляторів естрогенових рецепторів на метаболізм ліпідів виявився схожим із деякою перевагою тореміфену, що позитивно впливав на рівень протективних ліпопротеїдів високої щільності та на відміну від тамоксифену не викликав підвищення рівня тригліцеридів. Автори пропонують віддавати перевагу тореміфену в ад’ювантній терапії в пацієнтів із високим риском серцево-судинних подій (табл. 10).
Публікація Takeshi Tominaga і співавт. [38] також порівнює вплив тамоксифену та тореміфену на метаболізм ліпідів у жінок у постменопаузі з раком молочної залози I–II стадії. Як і дослідження, описане вище, це рандомізоване клінічне дослідження III фази, що проводилось на території Японії.
Для дослідження були відібрані 243 жінки в постменопаузі віком молодше 76 років із гормончутливим раннім раком молочної залози після мастектомії чи органозберігаючої операції. Критеріям включення відповідали також жінки з невідомим статусом рецепторів.
Рівні загального холестерину, ліпопротеїдів низької та високої щільності і тригліцеридів сироватки вимірювалися до початку дослідження, через 3, 6, 12 та 24 місяці від початку ад’ювантної терапії.
Порівняно з вихідним рівнем, в обох групах спостерігалось значне зниження рівня загального холестерину, ліпопротеїдів низької щільності. У групі тореміфену відзначалось значне підвищення ліпопротеїдів високої щільності, рівень тригліцеридів суттєво не змінився. У групі тамоксифену не було помічено статистично значущих змін у рівнях тригліцеридів чи ліпопротеїдів високої щільності.
Автори дослідження відмічають, що епідеміологічно для популяції Японії характерні вищі, ніж в осіб європеоїдної раси, рівні загального холестерину та ліпопротеїдів низької щільності, проте значно вищий рівень ліпопротеїдів високої щільності. Саме їх протективним впливом можна пояснити нижчі рівні серцево-судинної захворюваності і смертності серед населення Японії.
З огляду на те, що терапія тореміфеном призводила до підвищення рівня ліпопротеїдів високої щільності, автори вважають, що вплив тореміфену на ліпідний профіль перевершує відповідний вплив тамоксифену і пропонують проведення подальших досліджень (табл. 11).
Перехресне рандомізоване дослідження впливу тореміфену та тамоксифену на ліпідний профіль жінок у постменопаузі, хворих на гормончутливий рак молочної залози I–II стадії, було проведено в Японії з 1997 по 2001 рік [39].
Для дослідження були відібрані 197 жінок, які відповідали наведеним вище критеріям. Якщо пацієнтки демонстрували рівень тригліцеридів 350 мг/дл чи більше та/або рівень ліпопротеїдів низької щільності 200 мг/дл чи вище протягом 6 місяців лікування, вони були виключені з дослідження та почали отримувати знижуючу ліпіди терапію.
Пацієнтки були рандомно розподілені на дві групи: 121 пацієнтка отримувала тамоксифен у дозі 20 мг, ще 76 пацієнток — тореміфен у дозі 40 мг. Після 1 року лікування в групі тамоксифену спостерігалось 57 випадків порушення ліпідного обміну метаболізму ліпідів, а в групі тореміфену — 23. Для цих пацієнтів групи були перехрещені, і дані щодо їх ліпідного профілю наведені окремо.
Рівні загального холестерину, ліпопротеїдів високої щільності та тригліцеридів вимірювались перед початком дослідження, через 12 та 24 місяці від початку лікування.
Після першого року рівні загального холестерину знизились відносно першого вимірювання в обох групах без статистично значущої різниці між ними. У групі тамоксифену визначалось зниження ЛПВП та підвищення рівня тригліцеридів, тоді як у групі тореміфену спостерігалось підвищення ЛПВП та зниження рівня тригліцеридів сироватки. Різниця між групами була визнана статистично значущою (табл. 12).
В обох перехресних групах рівень загального холестерину перевищував нормальний рівень ще до початку лікування без статистично значущої різниці між групами. При цьому через 12 місяців від початку дослідження рівень загального холестерину знизився в групі тамоксифену та суттєво не змінився в групі тореміфену зі статистично значущою різницею між групами. Через рік після перехреста (на відмітці 24 місяці) у групі TAM TOR відзначалось підвищення загального холестерину до базового рівня, а в групі TOR TAM — його значне зниження.
Рівень ліпопротеїдів високої щільності був вищим у групі тамоксифену до початку лікування, через 12 місяців цей показник суттєво знизився, але після перехресту значно підвищився. У групі тореміфену показник підвищився відносно базового рівня на відмітці 12 місяців та навіть після перехресту не зменшився.
Рівень тригліцеридів був вищим у групі тореміфену до початку лікування, через 12 місяців він суттєво зменшився, а після перехресту знову збільшився. У групі тамоксифену рівень тригліцеридів збільшився через 12 місяців та суттєво зменшився після перехресту.
За результатами цього дослідження обидва селективні модулятори естрогенових рецепторів мали схожий вплив на загальний холестерин сироватки. При цьому тамоксифен та тореміфен мали протилежний вплив на рівень тригліцеридів та ліпопротеїдів високої щільності з деякою перевагою тореміфену над тамоксифеном. Вплив тореміфену на ліпопротеїди високої щільності зберігався навіть через 1 рік після заміни його на тамоксифен. При цьому в групі первинно гіперліпідемічних хворих позитивний вплив тамоксифену на зниження рівня загального холестерину переважав над таким тореміфену.
Автори дослідження вважають вплив тореміфену на ліпідний профіль більш сприятливим, а також наголошують на важливості саме показника ліпопротеїдів високої щільності в запобіганні розвитку серцево-судинних подій.
Дослідження впливу тамоксифену та тореміфену на ліпідний профіль жінок також проводилось у Фінляндії ще в 1994–1995 роках [24].
Для дослідження були відібрані 24 жінки в постменопаузі з раннім гормончутливим раком молочної залози, які не приймали гіполіпідемічних препаратів. Подвійним сліпим методом вони були рандомізовані на дві групи: одна приймала тамоксифен у дозі 40 мг/добу, інша — тореміфен у дозі 60 мг/добу.
Рівні загального холестерину, ліпопротеїдів низької та високої щільності і тригліцеридів вимірювались перед початком дослідження, через 2, 6 та 12 місяців. Додатково визначались рівні прекурсорів холестерину (Δ8-холестенол, десмостерол, латостерол), які відображають біосинтез холестерину.
Через 12 місяців в обох групах визначалось зниження загального холестерину, ліпопротеїдів низької щільності на 16 % у групі тамоксифену та 15 % у групі тореміфену без статистично значущих змін у рівнях ліпопротеїдів високої щільності та тригліцеридів.
Сироватковий рівень Δ8-холестенолу був підвищений, а рівень ланостеролу знижений в обох групах, що свідчить про зниження рівня холестерину шляхом інгібування тамоксифеном та тореміфеном перетворення Δ8-холестенолу на ланостерол (табл. 13).
Отже, вплив тамоксифену на обмін ліпідів був розглянутий у 7 дослідженнях, тореміфену — у 6, летрозолу — у 5, анастрозолу — у 4 та в 4 публікаціях оцінений вплив екземестану.
За даними цих досліджень, тамоксифен знижує рівні загального холестерину та ліпопротеїдів низької щільності. Також тамоксифен вірогідно підвищує рівень тригліцеридів та суттєво не впливає на рівень ліпопротеїдів високої щільності.
Вплив тореміфену на рівні загального холестерину та ліпопротеїдів низької щільності аналогічний впливу тамоксифену. Тореміфен вірогідно підвищує рівень ліпопротеїдів високої щільності. За наявних даних його вплив на тригліцериди сироватки достовірно оцінити важко.
Летрозол підвищує рівень ліпопротеїдів низької щільності. Суттєво не впливає на рівень тригліцеридів. Його вплив на загальний холестерин різні дослідження оцінюють як нейтральний чи дещо негативний. Дані щодо впливу на ліпопротеїди високої щільності є суперечливими.
Анастрозол має переважно нейтральний вплив на рівні загального холестерину та ліпопротеїдів низької щільності. Вплив на ліпопротеїди високої щільності та рівень тригліцеридів сироватки вірогідно оцінити не вдалося.
Маємо суперечливі дані щодо впливу екземестану на рівень загального холестерину: за результатами одних досліджень цей вплив є позитивним, за результатами інших — нейтральним. Екземестан вірогідно не впливає на рівень ЛПНП та знижує рівні ЛПВП і тригліцеридів сироватки.
Результати цих досліджень можна ще раз наочно оцінити в табл. 14.
Таким чином, дані щодо впливу засобів ендокринної терапії на ліпідний профіль є суперечливими. Але деякі аспекти цього впливу послідовно підтвердились у різних дослідженнях і не суперечать один одному.
Селективні модулятори естрогенових рецепторів знижують рівень загального холестерину та ліпопротеїдів низької щільності. Жодне дослідження не суперечить даній тезі.
Імовірно, що тамоксифен підвищує рівень тригліцеридів. Також імовірно, що з перерахованих інгібіторів ароматази летрозол має найбільш негативний вплив на ліпідний профіль сироватки, тоді як вплив екземетану й анастрозолу можна оцінити скоріше як нейтральний.
Обговорення
З усіх 13 наведених досліджень були виключені пацієнтки із симптомною серцево-судинною патологією. Жінки, у яких розвинулась клінічно значуща гіперліпідемія, що потребувала призначення терапії інгібіторами HMG-CoA редуктази (статинами), були виключені з дослідження та/або не враховувались при статистичних розрахунках. Через це оцінити вплив ендокринотерапії на ліпідний профіль жінок, які і є цільовою групою для пильного контролю за даними показниками в межах цього обзору, неможливо.
Також важливо відмітити, що дослідження щодо позитивного впливу тореміфену на ліпідний профіль сироватки проводились у Фінляндії, де цей препарат і був розроблений, та Японії (5 досліджень із 6). Ці дослідження показали, що тореміфен має еквівалентний тамоксифену вплив на загальний холестерин та ЛПНЩ, не підвищує рівень тригліцеридів та, найімовірніше, підвищує рівень ЛПВЩ. Проте екстраполювати дані японської популяції на українські реалії треба з обережністю.
Нещодавні епідеміологічні дослідження показали, що для населення Японії характерні вищі, ніж у європейців та американців, рівні загального холестерину та ЛПВЩ, проте нижчі рівні ЛПНЩ. При цьому поширеність ішемічної хвороби серця та кальцинозу коронарних судин в Японії залишається досить низькою [40].
Важливим пунктом в обговоренні є також те, що вважати за покращання ліпідного профілю. Автори публікацій залишали за собою право вирішувати, які з показників ліпідного обміну є найбільш важливими стосовно впливу на розвиток атеросклерозу та серцево-судинної захворюваності. Частково це можна пояснити тим, що деякі публікації виходили до того, як у світі встановилась чітка думка щодо прогностичного значення показників ліпідного профілю.
Останні рекомендації Європейського товариства кардіологів та Європейського товариства атеросклерозу [6] із лікування дисліпідемій виділяють рівень загального холестерину та ЛПНЩ як найбільш атерогенні фактори. Рівень ЛПВЩ та тригліцеридів сироватки не використовуються як прогностичні фактори для оцінки серцево-судинного ризику.
Висновки
1. Селективні модулятори естрогенових рецепторів позитивно впливають на ліпідний профіль шляхом зниження рівнів загального холестерину і ліпопротеїдів низької щільності та можуть бути препаратами вибору для пацієнток у постменопаузі з гіперліпідемією (окрім пацієнток з ізольованою тригліцеридемією).
2. Тореміфен, імовірно, має перевагу над тамоксифеном щодо впливу на рівні ліпопротеїдів високої щільності та тригліцеридів сироватки, але ця перевага може бути популяційно лімітованою (екстраполювати дані японських досліджень на європеоїдну популяцію необхідно з обережністю).
3. Використання інгібіторів ароматази повинно супроводжуватись більш пильним контролем показників ліпідного обміну і може потребувати додаткового призначення препаратів для корекції дисліпідемії (статини, фібрати, секвестранти жовчних кислот, езетиміб тощо).
4. Необхідне додаткове вивчення впливу ендокринотерапії раку молочної залози на ліпідний профіль та клінічної значущості цього впливу.
5. Значення ендокринотерапії раку молочної залози стосовно захворюваності та смертності від серцево-судинних захворювань не встановлено.
6. Необхідне дослідження результатів ендокринотерапії раку молочної залози в поєднанні з холестеринзнижуючими препаратами.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Список литературы
1. Bray F., Ferlay J., Soerjomataram I. et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J. Clin. 2018. 68. Р. 394-424.
2. Bulletin of national cancer registry of Ukraine № 21, Kyiv, 2020.
3. Chapman J.A., Meng D., Shepherd L. et al. Competing causes of death from a randomized trial of extended adjuvant endocrine therapy for breast cancer. J. Natl Cancer Inst. 2008. 100(4). Р. 252-260.
4. Fietz T., Tesch H., Rauh J. et al. Palliative systemic therapy and overall survival of 1,395 patients with advanced breast cancer — results from the prospective German TMK cohort study. Breast. 2017. 34. Р. 122-130.
5. NCCN guidelines for breast cancer version 4.2020 — May 8, 2020.
6. Baigent C., Mach F., Catapano A.L. et al. ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur. Heart J. Aug. 31, 2019. doi: 10.1093/eurheartj/ehz455.
7. Cholesterol Treatment Trialists Collaboration. Baigent C., Blackwell L., Emberson J. et al. Efficacy and safety of more intensive lowering of LDL cholesterol: a metaanalysis of data from 170,000 participants in 26 randomised trials. Lancet. 2010. 376. 16701681.
8. Cholesterol Treatment Trialists Collaboration. Fulcher J., O’Connell R., Voysey M. et al. Efficacy and safety of LDL-lowering therapy among men and women: meta-analysis of individual data from 174,000 participants in 27 randomised trials. Lancet. 2015. 385. 13971405.
9. Cholesterol Treatment Trialists Collaboration. Mihaylova B., Emberson J., Blackwell L. et al. The effects of lowering LDL cholesterol with statin therapy in people at low risk of vascular disease: meta-analysis of individual data from 27 randomised trials. Lancet. 2012. 380. 581590.
10. Emerging Risk Factors Collaboration. Di Angelantonio E., Gao P., Pennells L. et al. Lipid-related markers and cardiovascular disease prediction. JAMA. 2012. 307. 24992506.
11. Prospective Studies Collaboration. Lewington S., Whitlock G., Clarke R. et al. Blood cholesterol and vascular mortality by age, sex, and blood pressure: a meta-analysis of individual data from 61 prospective studies with 55,000 vascular deaths. Lancet. 2007. 370. 18291839.
12. Holmes M.V., Asselbergs F.W., Palmer T.M. et al. Mendelian randomization of blood lipids for coronary heart disease. Eur. Heart J. 2015. 36. 539550.
13. Frikke-Schmidt R., Nordestgaard B.G., Stene M.C. et al. Association of loss-of-function mutations in the ABCA1 gene with high-density lipoprotein cholesterol levels and risk of ischemic heart disease. JAMA. 2008. 299. 25242532.
14. Schwartz G.G., Olsson A.G., Abt M. et al. Effects of dalcetrapib in patients with a recent acute coronary syndrome. N. Engl. J. Med. 2012. 367. 20892099.
15. Nelson E.R., Wardell S.E., Jasper J.S. et al. 27-Hydroxycholesterol links hypercholesterolemia and breast cancer pathophysiology. Science. 2013. 342(6162). Р. 1094-1098. doi: 10.1126/science.1241908.
16. Simigdala N., Gao Q., Pancholi S. et al. Cholesterol biosynthesis pathway as a novel mechanism of resistance to estrogen deprivation in estrogen receptor-positive breast cancer. Breast Cancer Res. 2016. 18(1). 58. Published 2016, Jun 1. doi: 10.1186/s13058-016-0713-5.
17. Baek A.E., Yu Y.A., He S. et al. The cholesterol metabolite 27 hydroxycholesterol facilitates breast cancer metastasis through its actions on immune cells. Nat. Commun. 2017. 8(1). 864. Published 2017, Oct 11. doi: 10.1038/s41467-017-00910-z.
18. Cyster J., Dang E., Reboldi A. et al. 25-Hydroxycholesterols in innate and adaptive immunity. Nat. Rev. Immunol. 2014. 14. Р. 731-743. https://doi.org/10.1038/nri3755.
19. Raza, Uzma et al. Hyperlipidemia and hyper glycaemia in Breast Cancer Patients is related to disease stage. Pakistan Journal of Medical Sciences. 2018. Vol. 34. 1. Р. 209-214. doi:10.12669/pjms.341.14841
20. Bahl M. et al. Serum lipids and outcome of early-stage breast cancer: results of a prospective cohort study. Breast Cancer Res. Treat. 2005. 94. Р. 135-144. doi: 10.1007/s10549-005-6654-9.
21. Borgquist S., Giobbie-Hurder A., Ahern T.P. et al. Cholesterol, Cholesterol-Lowering Medication Use, and Breast Cancer Outcome in the BIG 1-98 Study. J. Clin. Oncol. 2017. 35(11). Р. 1179-1188. doi: 10.1200/JCO.2016.70.3116.
22. Wake R., Yoshiyama M. Gender differences in ischemic heart disease. Recent Pat. Cardiovasc. Drug Discov. 2009 Nov. 4(3). Р. 234-240.
23. Iorga A., Cunningham C.M., Moazeni S., Ruffenach G., Umar S., Eghbali M. The protective role of estrogen and estrogen receptors in cardiovascular disease and the controversial use of estrogen therapy. Biol. Sex Differ. 2017. 8(1). Р. 33. Published 2017, Oct 24. doi: 10.1186/s13293-017-0152-8.
24. Gylling H., Pyrhönen S., Mäntylä E., Mäenpää H., Kangas L., Miettinen T.A. Tamoxifen and toremifene lower serum cholesterol by inhibition of delta 8-cholesterol conversion to lathosterol in women with breast cancer. J. Clin. Oncol. 1995. 13(12). Р. 2900-2905. doi: 10.1200/JCO.1995.13.12.2900.
25. Wasan K.M., Ramaswamy M., Haley J., Dunn B.P. Administration of long-term tamoxifen therapy modifies the plasma lipoprotein-lipid concentration and lipid transfer protein I activity in postmenopausal women with breast cancer. J. Pharm. Sci. 1997. 86(7). Р. 876-879. doi: 10.1021/js970097w.
26. Berglund A., Wigertz A., Adolfsson J. et al. Impact of comorbidity on management and mortality in women diagnosed with breast cancer. Breast Cancer Res. Treat. 2012. 135. Р. 281-289.
27. Ariazi E.A., Leitão A., Oprea T.I. et al. Exemestane’s 17-hydroxylated metabolite exerts biological effects as an androgen. Mol. Cancer Ther. 2007. 6(11). Р. 2817-2827. doi: 10.1158/1535-7163.MCT-07-0312.
28. Hozumi Y., Suemasu K., Takei et al. The effect of exemestane, anastrozole, and tamoxifen on lipid profiles in Japanese postmenopausal early breast cancer patients: final results of National Surgical Adjuvant Study BC 04, the TEAM Japan sub-study. Annals of Oncology. 2011. 22(8). Р. 1777-1782. doi: 10.1093/annonc/mdq707.
29. Markopoulos C., Polychronis A., Zobolas V. et al. The Effect of Exemestane on the Lipidemic Profile of Postmenopausal Early Breast Cancer Patients: Preliminary Results of the TEAM Greek Sub-study. Breast Cancer Res. Treat. 2005. 93. Р. 61-66. https://doi.org/10.1007/s10549-005-3783-0.
30. Bell L.N., Nguyen A.T., Li L. et al. Comparison of changes in the lipid profile of postmenopausal women with early stage breast cancer treated with exemestane or letrozole. J. Clin. Pharmacol. 2012. 52(12). Р. 1852-1860. doi: 10.1177/0091270011424153.
31. Tian W., Wu M., Deng Y. Comparison of Changes in the Lipid Profiles of Eastern Chinese Postmenopausal Women With Early-Stage Breast Cancer Treated With Different Aromatase Inhibitors: A Retrospective Study. Clin. Pharmacol. Drug. Dev. 2018. 7(8). Р. 837-843. doi: 10.1002/cpdd.420.
32. Wasan K.M., Goss P.E., Pritchard P.H. et al. Lipid concentrations in postmenopausal women on letrozole after 5 years of tamoxifen: an NCIC CTG MA.17 sub-study. Breast Cancer Res. Treat. 2012. 136. Р. 769-776. https://doi.org/10.1007/s10549-012-2294-z.
33. Elisaf M.S., Bairaktari E.T., Nicolaides C. et al. Effect of letrozole on the lipid profile in postmenopausal women with breast cancer. Eur. J. Cancer. 2001. https://doi.org/10.1016/s0959-8049(01)00155-1.
34. Shien T., Doihara H., Sato N. et al. Serum lipid and bone metabolism effects of Toremifene vs. Letrozole as adjuvant therapy for postmenopausal early breast cancer patients: results of a multicenter open randomized study. Cancer Chemother. Pharmacol. 2018. 81. Р. 269-275. https://doi.org/10.1007/s00280-017-3491-6.
35. Anan K., Mitsuyama S., Yanagita Y. et al. Effects of toremifene and anastrozole on serum lipids and bone metabolism in postmenopausal females with estrogen receptorpositive breast cancer: the results of a 2-year multicenter open randomized study. Breast Cancer Res. Treat. 2011. 128. Р. 775-781. https://doi.org/10.1007/s10549-011-1608-x.
36. Shojiro Sawada, Kazuhiko Sato, Masatoshi Kusuhara et al. Effect of anastrozole and tamoxifen on lipid metabolism in Japanese postmenopausal women with early breast cancer. Acta Oncologica. 2005. 44. 2. Р. 134-141. doi: 10.1080/02841860510007585.
37. Kusama M., Miyauchi K., Aoyama H. et al. Effects of toremifene (TOR) and tamoxifen (TAM) on serum lipids. Breast Cancer Res. Treat. 2004. 88. Р. 1-8. https://doi.org/10.1007/s10549-004-4384-z.
38. Takeshi Tominaga, Izo Kimijima, Morihiko Kimura et al. Effects of Toremifene and Tamoxifen on Lipid Profiles in Post-menopausal Patients with Early Breast Cancer: Interim Results from a Japanese Phase III Trial. Japanese Journal of Clinical Oncology. July 2010. Vol. 40. Is. 7. P. 627-633. https://doi.org/10.1093/jjco/hyq021.
39. Kusama M., Kaise H., Nakayama S. et al. Crossover trial for lipid abnormality in postmenopausal breast cancer patients during selective estrogen receptor modulators (SERMs) administrations. Breast Cancer Res. Treat. 2004. 88. Р. 9-16. https://doi.org/10.1007/s10549-004-5449-8.
40. Iwao N., Iwao S., Muller D.C. et al. Differences in the relationship between lipid CHD risk factors and body composition in Caucasians and Japanese. Int. J. Obes. 2005. 29. Р. 228-235.
41. Zotov О.S., Hryvkova L.V., Zaiveleva Y.І. et al. Endocrine therapy for breast cancer: doctor’s manual. Ed. by O.S. Zotov. 2 ed. Кiev: Publiher A.Y. Zaslavskyi, 2018.
/47.jpg)

/48.jpg)
/49.jpg)
/50.jpg)
/51.jpg)
/52.jpg)
/53.jpg)
/54.jpg)