Резюме
Актуальність. Висока частота захворюваності на тяжку пневмонію при інфікуванні грипом H5N1, A/H1N1, SARS, MERS та COVID-19 привертає особливу увагу та змушує переглядати та вдосконалювати сучасні ланки комплексної інтенсивної терапії. Мета: проаналізувати основні ланки інтенсивної терапії клінічного випадку тяжкої негоспітальної вірусно-бактеріальної пневмонії, наголосити на основні проблеми та запропонувати шляхи вирішення. Матеріали та методи. Ми проаналізували клінічний випадок лікування тяжкої негоспітальної вірусно-бактеріальної пневмонії пацієнта, який перебував на лікуванні у ВАІТ КНП «Клінічна лікарня швидкої медичної допомоги» м. Львів, та виділили основні ключові аспекти інтенсивної терапії: респіраторну терапію, неінвазивну штучну вентиляцію легень (ШВЛ), вчасність інтубації, протективну ШВЛ та початок відлучення; cедацію, анальгезію та міорелаксацію; оцінку волемічного статусу, інфузійну терапію й ентеральне харчування. Результати. Загальний термін проведення ШВЛ становив 26 днів. З 16-го дня розпочато процес відлучення, який становив 10 днів. Основні режими ШВЛ, які застосовувались, такі: SIMV-PC (8 днів), BIPPV (7 днів), CPAP+PS (10 днів). Період застосування дексмедетомідину становив 12 днів. Використання NIV не забезпечило належного ефекту, про що свідчить погіршення стану пацієнта після 24 годин даної респіраторної підтримки. Волемічний статус у критичному періоді (перші 48 годин після інтубації) оцінювався за допомогою ультрасонографії функції серця та стану магістральних судин, що виявилось дуже ефективним. Висновки. Пацієнти з тяжкою негоспітальною вірусною пневмонією потребують раннього початку ШВЛ та обов’язкового застосування протективної стратегії. Саме респіраторна терапія є основною та першочерговою ланкою інтенсивної терапії. Забезпечення адекватної та комфортної седації для пацієнта є однією з важливих ланок комплексу інтенсивної терапії, яка вирішує проблему асинхронії. Ультразвукове дослідження дозволяє провести неінвазивну оцінку волемічного статусу, ризику набряку легень та передбачити відповідь пацієнта на інфузійну терапію. З цією метою слід проводити комплексний УЗД-моніторинг нижньої порожнистої вени, легень та серця у всіх пацієнтів у критичному стані, яким планується чи вже налагоджена інфузійна терапія.
Актуальность. Высокая частота заболеваемости тяжелой пневмонией при инфицировании гриппом H5N1, A/H1N1, SARS, MERS и COVID-19 привлекает особое внимание и заставляет пересматривать и совершенствовать современные элементы комплексной интенсивной терапии. Цель: проанализировать основные элементы интенсивной терапии клинического случая тяжелой внебольничной вирусно-бактериальной пневмонии, подчеркнуть основные проблемы и предложить пути решения. Материалы и методы. Мы проанализировали клинический случай лечения тяжелой внебольничной вирусно-бактериальной пневмонии пациента, находившегося на лечении в ОАИТ КНП «Клиническая больница скорой медицинской помощи» г. Львова, и выделили основные ключевые аспекты интенсивной терапии: респираторную терапию, неинвазивную искусственную вентиляцию легких (ИВЛ), своевременность интубации, протективную ИВЛ и начало отлучения; cедацию, анальгезию и миорелаксацию; оценку волемического статуса, инфузионную терапию и энтеральное питание. Результаты. Общий срок проведения ИВЛ составил 26 дней. С 16-го дня начат процесс отлучения, который составлял 10 дней. Основные режимы ИВЛ, которые применялись, следующие: SIMV-PC (8 дней), BIPPV (7 дней), CPAP+PS (10 дней). Период применения дексмедетомидина составлял 12 дней. Использование NIV не обеспечило должного эффекта, о чем свидетельствует ухудшение состояния пациента после 24 часов данной респираторной поддержки. Волемический статус в критическом периоде (первые 48 часов после интубации) оценивался с помощью ультрасонографии функции сердца и состояния магистральных сосудов, что оказалось очень эффективно. Выводы. Пациенты с тяжелой внебольничной вирусной пневмонией требуют раннего начала ИВЛ и обязательного применения протективной стратегии. Именно респираторная терапия является основным и первоочередным звеном интенсивной терапии. Обеспечение адекватной и комфортной седации является одним из важных элементов комплекса интенсивной терапии, который решает проблему асинхронии. Ультразвуковое исследование позволяет провести неинвазивную оценку волемического статуса, риска отека легких и предусмотреть ответ пациента на инфузионную терапию. С этой целью следует проводить комплексный УЗИ-мониторинг нижней полой вены, легких и сердца у всех пациентов в критическом состоянии, которым планируется или уже налажена инфузионная терапия.
Background. The high incidence of severe community-acquired pneumonias due to H5N1, A/H1N1, SARS, MERS and COVID-19 has attracted particular attention and has made us to revise and refine modern-day methods of treatment in the intensive care units. Objective: to analyze the main links of intensive care in the clinical case of severe community-acquired viral-bacterial pneumonia, to emphasize the main problems and suggest solutions. Materials and methods. We analyzed the clinical case of severe community-acquired viral and bacterial pneumonia in a 60-year-old patient, who was treated at the intensive care unit of Clinical Emergency Hospital in Lviv, and identified the main key aspects of intensive care: respiratory therapy, non-invasive ventilation, timely intubation, protective ventilation and the beginning of weaning; sedation, analgesia and muscle relaxation; assessment of volemic status, infusion therapy and enteral nutrition. Results. The total duration of ventilation was 26 days. From day 16, the weaning process has been started, it lasted for 10 days. Main regimens of ventilation and their duration: SIMV-PC (8 days), BIPPV (7 days), CPAP + PS (10 days). We used dexmedetomidine for sedation during 12 days. Non-invasive ventilation was not effective as evidenced by the deterioration of the patient’s condition after 24 hours of this respiratory support. We assessed volemic status in the critical period (first 48 hours after intubation) by ultrasonography of cardiac activity and condition of the main vessels, which proved to be very effective. Conclusions. Patients with severe community-acquired viral pneumonia require early onset of mechanical ventilation and mandatory protective strategy. Respiratory therapy, using protective strategy of ventilation, is a main part of treatment. One of the keys to success is adequate and comfortable sedation of patient. An ultrasound examination allows for non-invasive assessment of volemic status, risk of pulmonary edema, and predicts the patient’s response to infusion therapy. We must perform a comprehensive ultrasound monitoring of the inferior vena cava, lungs, and heart in all critically ill patients who need infusion therapy and mechanical ventilation.
Вступ
Вірусні інфекції є причиною 5–15 % усіх випадків негоспітальних пневмоній [5]. Результати проведених останнім часом досліджень переконливо свідчать про те, що віруси посідають 2-ге місце серед причин виникнення тяжких негоспітальних пневмоній [11]. Висока частота розвитку тяжкого гострого респіраторного дистрес-синдрому при інфікуванні грипом H5N1, A/H1N1, SARS, MERS та COVID-19 привертає особливу увагу. Згідно з даними, опублікованими 4 березня 2020 року, спалах COVID-19 призвів до виникнення 80 409 діагностованих випадків, із них 3012 смертельних, на території материкового Китаю. Приблизно 3,2 % пацієнтів із COVID-19 потребували проведення інтубації й інвазивної вентиляції легень [2].
У даній статті ми спробуємо комплексно підійти до основних етапів та складу інтенсивної терапії тяжких вірусних пневмоній на прикладі успішного клінічного випадку. Опишемо респіраторну терапію та окремо розглянемо питання седації й асинхронії пацієнтів при проведенні інвазивної штучної вентиляції легень (ШВЛ) як важливих ланок комплексної інтенсивної терапії. На жаль, дана тема недостатньо висвітлена у світовій літературі і потребує подальших досліджень. Вибір препаратів для седації пацієнта при проведенні інвазивної ШВЛ також залишається окремим питанням, що традиційно не висвітлюється. Окрім цього, важливими питаннями є оцінка волемічного статусу пацієнтів із вірусною пневмонією та забезпечення їх нутритивною підтримкою.
Мета: проаналізувати основні ланки інтенсивної терапії клінічного випадку тяжкої негоспітальної вірусно-бактеріальної пневмонії, наголосити на основні проблеми та запропонувати шляхи їх вирішення.
Матеріали та методи
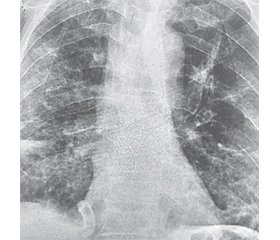
21.02.2020 р. пацієнт 60 років зі скаргами на підвищення температури тіла, малопродуктивний кашель та помірну задишку надійшов у клінічну лікарню швидкої медичної допомоги міста Львова та був первинно госпіталізований у терапевтичне відділення з первинним діагнозом «негоспітальна двобічна вірусна (?) пневмонія, 3-тя клінічна група». На момент надходження загальний стан пацієнта був середньої тяжкості, обумовлений проявами помірної дихальної недостатності (частота дихання — 20–22/хв, сатурація (SpO2) 92 %, без оксигенотерапії). Температура тіла субфебрильна. Гемодинаміка пацієнта стабільна. Первинна антибіотикотерапія — левофлоксацин 750 мг/добу та цефепім 1 г двічі на добу. Лейкоцитоз відсутній. Рівень прокальцитоніну в межах норми. За час перебування в терапевтичному відділенні, незважаючи на антибіотикотерапію, стан пацієнта погіршується.
24.02.2020 р. у зв’язку з погіршенням стану, обумовленим прогресуванням дихальної недостатності, пацієнт переводиться у відділення анестезіології та інтенсивної терапії (ВАІТ). Клінічний діагноз при переводі: тяжка негоспітальна двобічна пневмонія, 4-та клінічна група. На момент переводу пацієнт притомний, частота дихання — 26–28/хв, SpO2 — 84–86 % (без оксигенотерапії), гемодинаміка стабільна. З урахуванням тяжкості стану вирішено розпочати неінвазивну штучну вентиляцію легень (NIV) за допомогою апарата ШВЛ Utas Uvent T та лицевої маски FaceFit NIV у режимі CPAP+PS. Змінено антибактеріальну терапію на меропенем, 1 г тричі на добу.
/128.jpg)
25.02.2020 р., незважаючи на проведення респіраторної терапії, прогресує дихальна недостатність та долучаються ознаки енцефалопатії. Прийнято рішення щодо переводу пацієнта на інвазивну штучну вентиляцію легень. Режим вентиляції SIMV-PC. Параметри виставлено згідно з принципами протективної ШВЛ [1]. У зв’язку з гемодинамічною нестабільністю розпочато пролонговану інфузію норадреналіну. Обрано рестриктивний тип інфузійної терапії й ентеральне харчування з розрахунку 35–40 ккал/кг/добу. Протягом двох діб пацієнт перебував у повній нейроміоплегії (використовувались наркотичні анальгетики (морфій) та седація (ГОМК), міорелаксація (атракурій).
27.02.2020 р. пацієнту провели трахеостомію, враховуючи прогнозовану тривалу ШВЛ, та вперше використали prone-позицію, враховуючи припинення інфузії норадреналіну та гемодинамічну стабільність. З метою седації обрано пролонговану інфузію дексмедетомідину.
02.03.2020 р. пацієнта переведено на режим вентиляції BIPPV із параметрами протективної ШВЛ.
08.03.2020 р. з урахуванням позитивної динаміки ініційовано початок відлучення від ШВЛ. Пацієнта переведено на допоміжний режим вентиляції CPAP+PS. Седація дексмедетомідином припинена напередодні.
18.03.2020 р. у пацієнта згідно з даними комп’ютерної томографії діагностовано спонтанний пневмоторакс, обумовлений абсцесом легені, та проведено дренування плевральної порожнини.
19.03.2020 р. пацієнта відлучено від апарату ШВЛ та припинена респіраторна підтримка, за виключенням оксигенотерапії. Пацієнт самостійно дихав через трахеостомічну трубку.
21.03.2020 р. пацієнт переведений із ВАІТ.
30.03.2020 р. пацієнт виписаний додому.
Пацієнту неодноразово проводилось дослідження газового складу артеріальної крові, а отримані дані згруповані в табл. 1.
Результати
Проаналізувавши перебіг захворювання та етапи лікування, ми отримали такі результати.
1. Загальний термін проведення штучної вентиляції легень становив 26 днів. Із 16-го дня розпочато процес відлучення від вентиляції. Період відлучення становив 10 днів.
2. У гострому періоді респіраторної терапії основним режимом вентиляції був синхронізований інтермітуючий режим із контролем вдиху за тиском — SIMV-PC, що використовувався протягом 8 днів. Режим BIPPV прийшов на заміну попередньому після отримання позитивної клінічної та лабораторної динаміки (підвищення загального тораколегеневого комплаєнсу більше 50 мл/смH2O, РaO2 > 75 мм рт.ст.). Тривалість вентиляції в цьому режимі становила 7 днів.
3. Протягом періоду відлучення викорстовувався допоміжний режим CPAP+PS, рівень підтримуючого тиску обирався відповідно до потреб та комфорту пацієнта.
4. Період застосування дексмедетомідину становив 12 днів.
5. Використання NIV не забезпечило належного ефекту, про що свідчать погіршення стану пацієнта після 24 годин даної респіраторної підтримки та відсутність динаміки в показниках парціального тиску кисню в артеріальній крові (42 → 44 мм рт.ст.).
6. Волемічний статус у критичному періоді (перші 48 годин після інтубації) оцінювався ультрасонографією діяльності серця та стану магістральних судин. Діаметр нижньої порожнистої вени (НПВ) 1,6 мм під час вдиху та 1,0 см під час видиху (пацієнт перебував на ШВЛ). Відповідно, дихальна екскурсія була дещо знижена — в межах 40 %. Ознак набряку легень виявлено не було (в певних сегментах — типові для пневмонії зміни). Серце: збережена функція обох шлуночків (фракція викиду лівого шлуночка в межах 55 % у зв’язку з постійною формою фібриляції передсердь), VTI в горизонтальному положенні 14,23. Зважаючи на незначно збільшений діаметр НПВ та знижену дихальну екскурсію і при цьому відсутність ознак збільшеного тиску в правих камерах серця, ми зробили висновок про помірну гіперволемію в пацієнта. У такому разі слід обрати обережну тактику в плані інфузійної терапії. Після проведення проби з пасивним підняттям ніг було виявлено, що пацієнт позитивно толерує зростання переднавантаження в межах 300 мл — VTI зріс до 16,95 (+19 %). Тому нами була продовжена інфузійна терапія.
Обговорення
На нашу думку, у даному розділі слід висвітлити основні ланки інтенсивної терапї тяжкої вірусної пневмонії та проаналізувати їх на основі даного клінічного випадку. Отже, ми виділили основні складові:
— Респіраторна терапія. Неінвазивна ШВЛ, вчасність інтубації, протективна ШВЛ та початок відлучення.
— Седація, анальгезія та міорелаксація.
— Оцінка волемічного статусу, інфузійна терапія й ентеральне харчування.
Основні питання респіраторної терапії
Одразу після переводу у ВАІТ ми налагодили пацієнту неінвазивну ШВЛ, що тривала 24 години, проте виявилась абсолютно неефективною, незважаючи на добру співпрацю пацієнта. На сьогодні немає чітких рекомендацій щодо ефективності NIV у разі тяжкої вірусної пневмонії [1, 4, 7]. Стан пацієнта за час її проведення не покращився. Саме тому ми вважаємо її налагодження помилкою, а час інтубації, можливо, запізнілим.
Щодо протективної ШВЛ, то ми керувались такими правилами [3, 6, 10]:
— Volume tidal = 6–8 мл/кг (розрахунок на ідеальну масу тіла).
— P.peak < 35 смH2O.
— P.plato < 30 смH2O.
— FiO2 < 60 %.
— Допускається пермісивна гіперкапнія.
— Підбір PEEP титраційно відповідно до респіраторних та гемодинамічних показників.
— PH не нижче 7,15.
— ΔP не більше 15 смH2O.
— Період відлучення становив 10 днів та близько 40 % часу респіраторної терапії.
Седація, анальгезія та міорелаксація
Згідно із сучасними рекомендаціями, перші 48 годин після інтубації та початку ШВЛ пацієнт перебував у повній нейроміоплегії [1]. Рекомендовано призначення безперервної інфузії міорелаксанту цисатракурію безилату протягом 48 год пацієнтам, яких перевели на інвазивну вентиляцію, із початковим помірним та тяжким гострим респіраторним дистрес-синдромом. Анальгезія забезпечувалась використанням наркотичних анальгетиків (морфій), а седація — гамма-оксимасляною кислотою.
На сьогодні не було опубліковано жодних рекомендацій, заснованих на даних доказової медицини, щодо вибору препаратів для седації в пацієнтів із гострим респіраторним дистрес-синдромом, а наявні дані найчастіше лише вказують на недостатню кількість та вірогідність проведених досліджень. Із 3-ї доби ШВЛ пацієнту було обрано задля постійної седації та часткової анальгезії препарат дексмедетомідин. Рівень седації оцінювали згідно зі шкалою RAMSAY (Ramsay M. et al., 1974) та намагались забезпечити її на рівні 4–6 балів. Дозу інфузії титрували від 0,2 до 1 мкг/кг/год, залежно від гемодинаміки пацієнта. Дексмедетомідин забезпечив комфорт пацієнту та виявився ефективним засобом подолання асинхронії.
Оцінка волемічного статусу, інфузійна терапія й ентеральне харчування
Згідно з останніми рекомендаціями ми дотримувались рестриктивної стратегії інфузійної терапії, що включає обмеження введення рідини для уникнення розвитку позитивного водного балансу, застосування діуретиків та альбуміну. Ентеральне харчування проводилось із розрахунку 35–40 ккал/кг/добу [8].
Надмірна інфузія є небезпечною для осіб у критичному стані. Понад 50 % нестабільних пацієнтів погано реагують на інфузійну терапію. Лише клінічний огляд не дозволяє передбачити реакцію на подальшу довенну інфузію.
Згідно із законом Франка — Старлінга зростання переднавантаження призводить до зростання ударного об’єму серця. Але цей закон має своє обмеження, коли ударний об’єм перестає зростати при збільшенні переднавантаження.
Доступним методом оцінки переднавантаження є стан нижньої порожнистої вени — дихальна екскурсія та діаметр. При спонтанному диханні під час вдиху її діаметр зменшується, а під час видиху — зростає (при вентиляції з позитивним тиском динаміка обернена). У нормі дихальна екскурсія НПВ становить понад 50 %. Діаметр судини рекомендовано вимірювати 2–3 см дистальніше з’єднання з печінковою веною. Доведено, що діаметр НПВ менше 1,5 см та дихальна екскурсія понад 50 % є ознакою нормоволемії та доброї толерантності до інфузійної терапії. Якщо діаметр НПВ понад 2 см, а колабування під час дихання менше 50 %, пацієнт може гірше зреагувати на інфузію, проте певний об’єм інфузійної терапії все-таки може бути корисним.
Другим компонентом оцінки волемічного статусу є УЗД легень. Метод швидко розвивається та впроваджується в клінічну практику. Критерієм набряку легень є поява понад 3 В-ліній у полі сканування.
Третім компонентом оцінки гемодинаміки є функція серця — розмір та скоротливість шлуночків, співвідношення правих камер до лівих, важливою є участь міжшлуночкової перетинки в систолі лівого шлуночка (відсутність її парадоксального руху). Аналіз діаметра НПВ проводиться також у контексті змін зі сторони серця — при обструктивному шоці (тромбоемболія легеневої артерії, перикардіальний випіт) відбувається передача тиску на НПВ зі зростанням діаметра та зниженням екскурсії. У певних ситуаціях можна вираховувати серцевий викид. Проте це дещо клопітка методика. Для оцінки реакції пацієнта на болюс рідини достатньо вирахувати динаміку інтегралу часу швидкості (velocity time integral — VTI) на аортальному клапані, обвівши курсором графік викиду в аорту. Для більшої вірогідності результату вираховується середнє значення трьох послідовних скорочень, а при порушеннях ритму (наприклад, фібриляція передсердь) — п’яти скорочень. Вказаний параметр дозволяє передбачити, чи відповість пацієнт зростанням серцевого викиду у відповідь на інфузію. Методика полягає в проведенні проби з пасивним підняттям ніг, що мобілізує кров із нижніх кінцівок і призводить до зростання переднавантаження до 300 мл. Слід акцентувати на тому, що таке зростання є оберненим після опускання ніг. Суть проби така: пацієнту в горизонтальному положенні пасивно піднімають обидві нижні кінцівки на 30 с до рівня 45°. Зростання VTІ понад 15 % свідчить, що особа матиме позитивну відповідь на болюс рідини [9].
Висновки
1. Пацієнти з тяжкою негоспітальної вірусною пневмонією потребують раннього переводу на штучну вениляцію легень, допоки компенсаторні можливості організму ще збережені, та обов’язкового застосування принципів протективної ШВЛ. Саме респіраторна терапія є основною та першочерговою ланкою інтенсивної терапії.
2. У даному клінічному випадку застосування неінвазивної ШВЛ виявилось неефективним та відтермінувало інтубацію пацієнта та початок протективної ШВЛ.
3. Забезпечення адекватної та комфортної седації для пацієнта є однією з важливих ланок комплексу інтенсивної терапії, яка вирішує проблему асинхронії. Завдяки використанню дексмедетомідину вдалось уникнути застосування наркотичних анальгетиків та препаратів бензодіазепінової групи.
4. Ультразвукове дослідження дозволяє провести неінвазивну оцінку волемічного статусу, ризику набряку легень та передбачити відповідь пацієнта на інфузійну терапію. З цією метою слід проводити комплексний УЗД-моніторинг нижньої порожнистої вени, легень та серця в динаміці усім пацієнтам у критичному стані, яким планується чи вже налагоджена інфузійна терапія.
5. Інтенсивна терапія тяжкої негоспітальної пневмонії є складним, дорогим та тривалим процесом, що перебігає з безліччю ускладнень. Саме тому анестезіологу необхідно постійно вдосконалювати свої знання та навики респіраторної терапії.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.

/128.jpg)
/129.jpg)
/130.jpg)