Вступ
Захворювання нирок посідають 12-те місце у світі серед найпоширеніших причин смерті й призводять до близько 1,1 млн смертей на рік [1]. Поширеність хронічної хвороби нирок різного ступеня тяжкості серед населення в усьому світі становить майже 13 % [2], а щорічна потреба пацієнтів у донорських нирках в Україні становить близько 5–6 тисяч, що робить дану проблему надзвичайно актуальною, оскільки оптимальним методом лікування термінальної ниркової недостатності залишається трансплантація нирки [3]. Але брак донорських органів, висока смертність у періоді їх очікування, низька якість життя пацієнтів на діалізі дуже обмежують застосування цього методу лікування.
Незважаючи на значний прогрес трансплантології, появу нових медичних препаратів і хірургічних технік, довгострокові результати виживання ниркових трансплантатів залишаються незадовільними, оскільки протягом 10 років втрачається до 50 % трансплантатів [4]. Сучасні протоколи імуносупресивної терапії (ІСТ) знижують частоту гострого відторгнення, проте ІСТ залишається нефротоксичною і сама може скорочувати час життя трансплантата. Оптимальна індукційна терапія повинна запобігати не тільки відстроченню функції трансплантата, але й розвитку гострого чи хронічного відторгнення трансплантата в майбутньому з мінімальною кількістю побічних ефектів. Це змушує вдосконалювати існуючі протоколи індукційної ІСТ.
Останнім часом з’явилося чимало досліджень щодо використання мезенхімальних стовбурових клітин (МСК) у різних експериментальних моделях хронічної ниркової недостатності (ХНН), таких як діабетична, гіпертонічна нефропатія і хронічна нефропатія трансплантата [5], а також щодо можливості їх застосування при алотрансплантації нирки (АТН).
Зростаюча кількість досліджень з оцінки ефективності до- та клінічного застосування стовбурових клітин при АТН вказує на їх потенційну перевагу порівняно з традиційними схемами ІСТ завдяки плейотропним ефектам і здатності модулювати різні ланки імунної системи або безпосередньо, або шляхом вивільнення паракринних факторів.
При проведенні літературного аналізу доклінічної ефективності застосування МСК при ХНН та АТН у лабораторних тварин виявили їх унікальний потенціал щодо покращення функції і відновлення пошкодженої нирки, а також наявність імуносупресивних ефектів, що включають пригнічення проліферації Т-клітин і дозрівання дендритних клітин та індукцію Т-регуляторних клітин [6]. Регенеративні ефекти МСК спочатку були пов’язані з їх диференціацією, але останнім часом набула популярності ідея про те, що МСК виділяють фактори росту, які індукують проліферацію і диференціювання більш віддалених клітин-попередників. У поєднанні із запропонованою низькою імуногенністю МСК здаються ідеальними кандидатами для клітинної терапії. Вплив МСК досліджено в декількох доклінічних моделях гострого ураження нирок [7], і було доведено, що вони можуть послабити процес інтерстиціального фіброзу та атрофії ниркових канальців (ІФ/КА), зменшити інфільтрацію макрофагів, експресію запального цитокіну й посилити протизапальні фактори в моделі алотрансплантата нирок щурів [6, 8].
Дослідження Prodromidi et al. [9] показали здатність цих клітин не лише до диференціації, але й до продукування паракринних факторів. В експериментах на тваринах МСК завдяки таким цитокінам, як BMP-7 і HGF, зменшували фіброз у серці, легенях, печінці й нирках [10, 11]. Також було доведено зменшення прогресування ІФ/КА, навіть коли цей процес уже почався [8]. Крім того, у тварин, яким уводили МСК, відмічалося зменшення числа макрофагів, які проникають у паренхіму трансплантата, і зменшення експресії запальних цитокінів при одночасному збільшенні експресї протизапальних факторів [8]. Зменшення пошкодження ендотелію графту й відновлення мікросудинного русла запобігає фіброзу тканини й покращує роботу трансплантата [12]. У різних моделях було показано, що екзосоми, які продукують МСК, мають функції, аналогічні самим МСК, а саме: відновлення пошкоджених тканин і моделювання імунної системи [13].
Незважаючи на те, що початкові випробування показали безпеку, можливість і доцільність лікування МСК при трансплантації нирок, залишається малодослідженою їх здатність запобігати як довготривалому виживанню трансплантата, так і гострому відторгненню, а також є дискусійними терміни, спосіб і частота введення, дозування препаратів, що може мати негативний вплив на клінічне застосування МСК [14–17].
Відносно доступними джерелами МСК при трансплантації нирки можна вважати жирову тканину (ЖТ), кістковий мозок (КМ), пуповинну кров (ПК) і плацентарні стовбурові клітини (ПСК).
КМ містить 2 основні популяції стовбурових клітин, а саме гемопоетичні стовбурові клітини (ГСК) і мезенхімальні стовбурові клітини [18]. ГСК можна отримати шляхом аспірації КМ або з периферичної крові завдяки лейкоферезу після застосування гранулоцитарного колонієстимулюючого фактора (G-CSF), завдяки якому збільшується кількість циркулюючих стовбурових клітин у периферичній крові.
Можливість застосування КМ-МСК показали у своїй роботі S. Choi et al. [19]. У восьмитижневих щурів Спрег-Доулі виконували нефректомію справа, а ліву ниркову артерію перетискали на 40 хв, після чого кровотік відновлювали. Щури були розподілені на дві групи: ті, які отримували МСК, і група контролю. МСК, добуті зі стегнової і великогомілкової кісток 6-тижневих щурів-самців, у дозі 1 × 106 клітин вводили у хвостову вену щуру-реципієнту через 1 день після операції. Аналізи крові й сечі збирали через 7 днів і в кінці кожного місяця після операції. Щури були виведені з експерименту в різні інтервали часу (1, 2, 3, 4, 5 і 6 місяців) відразу після 24-годинного збору сечі й забору крові для аналізів. Нирки були видалені для патогістологічного дослідження. Рівні цитокіну вимірювали, використовуючи систему трансформації фактора росту (TGF) β1 і фактора росту судинних ендотеліальних факторів відповідно до інструкцій виробника. Попередньо використовували фарбування Y-хромосоми з використанням флюоресцентної гібридизації для підтвердження наявності чоловічих МСК у нирках реципієнтів жіночої статі. Через 1 місяць після початку експерименту рівні судинних ендотеліальних факторів росту були значно вищими у тварин, яким вводили МСК. Ніякої особливої різниці в концентрації азоту сечовини й креатиніну крові між досліджуваною групою і групою контролю не відмічалося, проте через 4 місяці відмічалося вірогідне збільшення ваги щурів у групі, якій вводили МСК, і зменшення рівня протеїнурії. Гістологічний аналіз показав зменшення розвитку гломерулосклерозу у групі щурів, яким вводили МСК. Крім того, Y-хромосома була знайдена в нирках тварин, яким вводили МСК.
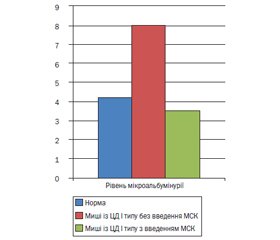
F. Ezquer et al. [20] моделювали діабет І типу шляхом введення стрептозотоцину в мишей C57BL/6, унаслідок чого в мишей відмічалися альбумінурія, гіперглікемія. Було показано, що навіть одна внутрішньовенна доза КМ-МСК (0,5 × 106) приводила до регенерації бета-панкреатичних острівців підшлункової залози й запобігала пошкодженню нирок при діабеті І типу, сприяла зниженню гіперглікемії, глюкозурії і альбумінурії до 3,5 мкг/мг ± 0,9 SE на 87-й день спостереження на відміну від групи мишей, яким не вводили МСК (рис. 1).
Крім того, у мишей з діабетичною нефропатією, які отримували лікування MСК, при гістологічному дослідженні відзначалася нормальна структура клубочків, а в групі без МСК — наявність гломерулярного гіалінозу й мезангіальної інфільтрації (рис. 2).
Як показують результати дослідження Franquesa et al. [8], навіть одне введення МСК є ефективним для довготривалого захисту ниркового алотрансплантата. Одинична доза КМ-МСК через 11 тижнів після трансплантації нирки в щурів зменшила інтерстиціальний фіброз, атрофію канальців, інфільтрацію Т-клітин і макрофагів та експресію прозапальних цитокінів. Зниження рівня прозапальних і профіброзних цитокінів у тварин, які отримували МСК, було пов’язане зі збільшенням протизапального цитокіну IL-10, хоча жодні ін’єкційні МСК не були виявлені через 7 днів після введення. Ці спостереження вказують на те, що позитивний вплив даних клітин на цей параметр пов’язаний перш за все з їх імуномодулюючими властивостями, а не з довгостроковим перебуванням самих стовбурових клітин в організмі.
W. Ge і J. Jiang et al. [21] вводили КМ-МСК у дозі 1 × 106 внутрішньовенно після ортотопічної трансплантації нирки. Щури-реципієнти отримували толерантність до алотрансплантата. У них відзначалися підвищений рівень кінуреніну й більша частота толерогенних дендритних клітин. У них була значно слабша відповідь CD4+ T-клітин, що включала знижену донор-специфічну проліферативну здатність і Th2-домінантний цитокіновий зсув. Крім того, було виявлено високу частоту CD4+CD25+Foxp3+ регуляторних T-клітин (Tregs) у селезінці реципієнта й алотрансплантаті зі зменшенням CD25+, що підтверджує важливу роль T-regs клітин у розвитку МСК-індукованої толерантності. W. Ge і J. Jiang показали, що використання донорських МСК викликає толерантність і зростання Т-регуляторних клітин шляхом індукції експресії індолеаміну 2,3-діоксигенази.
/64.jpg)
S. Zonta et al. [22], De Martino et al. [23] показали, що алогенні МСК посилюють функціональне відновлення й послаблюють прояви гострого відторгнення шляхом зменшення клітинної інфільтрації, що було підтверджено гістологічно як для сингенної, так і для алогенної моделей трансплантації нирок.
Велика кількість робіт присвячена КМ-МСК, оскільки показано, що вони мають потенціал до проліферації в культурі упродовж тривалого часу без втрати здатності до диференціювання.
В експериментах in vitro та in vivo було показано, що жирова тканина також є добрим джерелом МСК, які можна легко виділити, сортувати й індукувати певними факторами росту до диференціювання в інші клітини. Цей факт спонукав наукову спільноту до активного дослідження їх регенеративного потенціалу на тваринних моделях з нирковою недостатністю і дав можливість проводити клінічні дослідження в контексті створення альтернативної індукційної терапії при трансплантації нирки. Жировим МСК притаманні антиапоптотичні властивості, здатність до диференціювання, хомінгу й реваскуляризації [24].
Цікавим є дослідження Souza et al. [25], у якому автори оцінювали відновлення нирок у щурів після змодельованої ішемії нирок з подальшим введенням жирових мезенхімальних стовбурових клітин. Гістологічно менший ступінь некрозу й більш висока васкуляризація канальців спостерігалися в групах, які отримували жирові МСК, що показало ефективність їх трансплантації та сприяння заміщенню некротичної тканини клітинами ниркових канальців, васкуляризації ниркової паренхіми та відновленню функції органа. Жирові МСК порівняно зі стовбуровими клітинами, добутими з кісткового мозку, демонструють нижчу імуногенність, оскільки вони не експресують головний комплекс гістосумісності (ГКГС) II та експресують на низькому рівні ГКГС I. Більше того, у щурів, яким вводили жирові МСК, не утворювалися донор-специфічні антитіла (ДСА) в ранні терміни після трансплантації, а щури, які отримували КМ-МСК, мали високий рівень ДСА проти ГКГС I протягом першого тижня після введення клітин. За даними дослідження, жирові МСК запобігають дисфункції ниркового трансплантата. Усіх тварин спостерігали протягом 24 тижнів після трансплантації. Через тиждень після лікування не було різниці між функціями нирок у щурів, які отримували КМ-МСК або жирові МСК. З 12-го тижня у тварин, яким не вводили стовбурові клітини, розвивалася прогресивна протеїнурія і ниркова недостатність. У щурів, яким вводили КМ-МСК або жирові МСК, протеїнурія не збільшувалася і зберігався нормальний рівень креатиніну сироватки крові. Через 24 тижні спостереження гістологічне дослідження трансплантата щурів, які не отримували МСК, показало велику тубулярну атрофію зі значно поширеним інтерстиціальним фіброзом і помірною дифузною інтерстиціальною інфільтрацією. Хоча ці ниркові трансплантати відображали пошкодження різного ступеня, більшість з них мали найвище значення ІФ/АК серед 3 груп щурів. Графти з МСК показали нормальний гістологічний рисунок з мінімальною трубчастою атрофією, інтерстиціальним фіброзом і клітинною інфільтрацію, унаслідок цього ІФ/АК в цій групі був дуже низьким. Графти щурів, які отримали КМ-МСК, мають неоднорідні гістологічні пошкодження нирок за шкалою ІФ/АК, причому значно вищі, ніж у щурів групи з жировими МСК, але нижчі, ніж у щурів, які не отримували МСК. Незважаючи на те, що 3-тя група (група з жировими МСК) показала схожий початковий ІФ/АК через 12 тижнів, лікування МСК зменшило кількість інфільтраційних клітин протягом першого тижня після терапії порівняно з іншими 2 групами, і, що цікаво, КМ-МСК дещо збільшили запалення в інтерстиції, головним чином за рахунок макрофагів ED1+. Варто зазначити, що ін’єкція жирових МСК запобігає інфільтрації запалення через 24 тижні й підтримує нижчі значення ІФ/АК до кінця дослідження, що свідчить про профілактичну, а не корекційну роль цієї клітинної терапії. Обидва види клітин знижують ураження судин через 24 тижні. Автори відмічають, що клітинна терапія також зупинила розвиток прогресуючого гломерулосклерозу.
Іншим легкодоступним і безпечним джерелом стовбурових клітин, яке становить особливий інтерес, не пов’язане з порушенням етичних норм і юридичних аспектів, має високий проліферативний і регенеративний потенціал і можливість негайного застосування «на вимогу», є плацента людини. Плацента — це високоспеціалізований орган, що відіграє важливу роль у підтриманні нормальної вагітності й забезпечує нормальний ріст і розвиток плода. Плацента має материнську й плодову частини. Компонент плода включає амніон і хоріон, а також хоріонічну мембрану, з якої розширюються хоріонічні ворсини й тісно контактують з decidua матки під час вагітності; материнська частина плаценти — це decidua basalis, що походить з ендометрію. З різних регіонів плаценти можуть бути виділені різні типи клітин: амніотичні епітеліальні клітини людини (human amniotic epithelial cells — hAECs), амніотичні мезенхімальні стромальні клітини людини (human amniotic mesenchymal stromal cells — hAMSCs), хоріонічні мезенхімальні стромальні клітини людини (human chorionic mesenchymal stromal cells — hCMSCs), хоріонічні клітини трофобласту людини (human chorionic trophoblastic cells — hCTCs) [26]. Клітини, отримані з плаценти (МСК-Пл, рlacenta-derived stem cells — PDSCs), мають низку переваг перед іншими типами клітин: після їх застосування не зафіксовано жодного випадку утворення тератом або тератокарцином у людей [27]. Клітини, отримані з плаценти, забезпечують виняткові можливості для алогенної трансплантації завдяки високому потенціалу диференціації і проліферації та здатності модулювати імунну реакцію [28] завдяки відсутності експресії ГКГС ІІ і костимуляторних молекул [29]. Крім того, ці клітини мають виражені імуносупресивні властивості й можуть інгібувати проліферацію та функцію основних популяцій імунокомпетентних клітин, до яких належать дендритні клітини, Т-клітини, В-клітини й природні кілери (NK), завдяки як міжклітинній взаємодії, так і вивільненню розчинних факторів, таких як 2,3-діоксигеназа, TGF-β, IL-10 [30, 31]. Завдяки цим властивостям плацентарні клітини людини, трансплантовані імунокомпетентним тваринам (кролі, мавпи, мурчаки), виживали в організмі тварин, не відбувалось їх імунологічного відторгнення [32–35].
Дані доклінічних досліджень свідчать про здатність до міграції, або хомінгу, стовбурових клітин, отриманих з плаценти, в ушкоджену тканину експериментальних тварин і їх функціональну активність in vivo. Так, Takashima et al. [36] показали, що після трансплантації клітин, культивованих з амніотичної мембрани людини в очеревину SCID мишей, у сироватці крові й перитонеальній рідині цих тварин з 1-го дня до 7-го дня виявляли людський альбумін. N. Sakuragawa et al. [37] показали, що при трансплантації генетично модифікованих hAECs, які містили ген β-галактозидази, в печінку SCID-мишей вони інтегрувались у паренхіму печінки й проявляли імунореактивність альбуміну та α-фетопротеїну, при цьому жодних ознак гострого відторгнення алотрансплантата не було виявлено.
МСК з плаценти людини супресують не тільки мітоген-індуковану проліферацію лімфоцитів, але й проліферацію алогенних лімфоцитів, зокрема популяції CD4 і CD8. Більше того, імуносупресія, яка спостерігалася при застосуванні МСК-Пл, була виражена набагато сильніше, ніж при застосуванні КМ-МСК. Вважається, що пригнічення реактивності лімфоцитів при трансплантації МСК-Пл відбувається не за рахунок загибелі клітин, а за рахунок зменшення проліферації клітин і збільшення кількості регуляторних Т-клітин.
Також чимало досліджень [38] продемонстрували чудовий терапевтичний ефект, який дають МСК людини, виділені з пуповини й пуповинної крові. Було показано, що при системному введенні МСК пуповинної крові мали ренопротекторні властивості при гострому пошкодженні нирок. Вони індукували проліферацію канальцевих клітин і пригнічували їх апоптоз. Завдяки своїм паракринним ефектам МСК ПК змогли обмежити окиснювальні процеси, які виникали у відповідь на пошкодження, спричинені цисплатином, та активувати фактор виживання Akt, який захищав канальцеві клітини від апоптозу [39]. Те, що людські МСК ПК створюють прорегенеративне середовище, спостерігалося також у спільній культурі in vitro, де додавання МСК ПК людини до пошкоджених цисплатином проксимальних канальцевих клітин посилювало вивільнення мітогенних і прожиттєвих факторів, таких як FGF, HB-EGF, VEGF і HGF, і пригнічення запальних цитокінів IL-1β і фактора некрозу пухлини (TNF) α. Нещодавно було відзначено новий механізм, за допомогою якого МСК ПК людини сприяють відновленню нирок у мишей після індукованого цисплатином гострого пошкодження, індукуючи глобальне метаболічне перепрограмування пошкоджених трубчастих клітин для підтримання енергозабезпечення. Зокрема, терапія на основі МСК ПК зберігала мітохондріальну масу й функції, регулюючи мітохондріальний обмін між сусідніми трубчастими клітинами [40]. Крім того, лікування МСК ПК стимулювало в пошкоджених проксимальних канальцях мітохондріальний біогенез, антиоксидантний захист і вироблення енергії через Sirtuin-3-залежний механізм. Відповідно до цього Fang et al. [41] продемонстрували, що ін’єкція людських МСК ПК у моделі гострого пошкодження нирок фолієвою кислотою сприяла проліферації канальцевих ниркових клітин і зменшенню апоптозу за допомогою модуляції мітохондріального механізму.
Внутрішньоочеревинне введення стовбурових клітин пуповини діабетичним імунодефіцитним мишам з гострою печінковою недостатністю не тільки сприяло відновленню тканини печінки, а й знижувало смертність серед цих тварин [42].
Важливим є питання щодо оптимального шляху введення з метою отримання максимального терапевтичного ефекту від трансплантованих МСК, на сьогодні воно залишається одним з основних невирішених питань і є предметом дебатів.
Дослідницькою групою Wei Zhao [43] та іншими було проведено порівняльний аналіз ефективності лікування при різних шляхах введення МСК на регрес фіброзу печінки в щурів із CСl4-індукованим фіброзом, що буде актуально і для щурів з нирковою недостатністю. Так, при порівнянні внутрішньовенного, внутрішньопаренхіматозного й внутрішньоперитонеального шляхів введення стовбурових клітин, отриманих з кісткового мозку, найбільш ефективним виявився внутрішньовенний. Це пояснюють тим, що при такому способі введення відбувається істотне підвищення сироваткового рівня IL-10, який є інгібітором багатьох прозапальних цитокінів (IL-1β, IL-6, TNF-α, TGF-β), що є промоутерами фіброзу. Внутрішньовeнне введення МСК може ефективно модулювати імунну відповідь реципієнта завдяки вивільненню простагландину Е2 з МСК кісткового мозку завдяки взаємодії з рецепторами макрофагів ЕР2 і ЕР4, унаслідок чого відбувається стимуляція продукції і вивільнення IL-10 [44], що може бути ефективним і в моделі з нирковим трансплантатом.
Крім того, різні експериментальні дослідження показали, що МСК потрапляють у легені, де викликають системну відповідь, і не мігрують в інші органи. Причому механізми МСК значною мірою не залежать від взаємодії споріднених МСК Т-клітин. Відповідно ті самі механізми будуть спостерігатися з автологічними й алогенними МСК.
Слід окремо зазначити, що процедура виділення автологічних клітин як з кісткового мозку, так і з жирової тканини є інвазивною, потребує додаткових витрат і залучення спеціалiстів вузького профілю, а нарощування необхідної кількості клітин вимагає певного часу. Крім того, тенденція до кровотечі у хворих з нирковою недостатністю, на діалізі та їх загальний незадовільний стан, вторинна анемія часто є перешкодою для виділення автологічного матеріалу для автологічної трансплантації клітин.
Reinders et al. [45] продемонстрували, що передтрансплантаційна інфузія МСК самого реципієнта була такою ж ефективною у віддалених результатах, як і донорських МСК. Однократна інфузія МСК, отриманих реципієнтом після трансплантації, була незначно ефективною, а однократна доза, отримана через 1 день після трансплантації, не була ефективною взагалі. Те саме в моделі на щурах показали Casiraghi et al. [46]: інфузія МСК після алотрансплантації нирки призводила до передчасної дисфункції трансплантата. Проте передопераційне введення МСК значно подовжувало виживання ниркового трансплантата шляхом індукції регуляторних Т-клітин.
Отже, терапевтичне використання імуномодулюючих властивостей МСК залежить від часу їх інфузії, що, швидше за все, зв’язано з необхідністю відповідного мікросередовища, щоб МСК змогли набути своїх імуносупресивних властивостей [47].
Імунне середовище впливає на терапевтичну ефективність МСК. Було показано, що як запальні цитокіни, так і ліганди Toll-подібного рецептора (TLR) посилюють регуляторні механізми МСК [48]. Дослідження in vivo показали, що активація ІФН-γ МСК підвищує їх терапевтичну ефективність [49]. Доведено, що TNF-α індукує імуносупресивну активність за допомогою МСК шляхом продукції простагландину PGE2 і циклооксигенази-2. У моделі відторгнення алотрансплантата гуманізованої миші алореактивність проявлялася вираженою CD45+ T-клітинною інфільтрацією, що відбувалося за рахунок CD4+ і CD8+ T-клітин і підвищеної експресії IFN-γ у трансплантатах шкіри, які були інгібовані як КМ-МСК, так і жировими МСК [50].
Як ми бачимо, більшість проведених досліджень сконцентровані на покращенні результатів довгострокового виживання й зменшенні реакцій відторгнення трансплантата [51, 52].
У більшості проаналізованих досліджень доза й частота введення МСК вибираються емпірично. У дослідженнях з трансплантації нирок в основному призначали 0,5 × 106 — 5,0 × 106 МСК на кілограм, ще вище від мінімальної ефективної і нижче від потенційно небезпечної дози. Однак в інших дослідженнях було застосоване й більше дозування (0,4–9,0 × 106) [46]. Крім того, L.M. Ball et al. [53] відзначають, що повторне введення може мати кращі результати порівняно з однократною інфузією. Внутрішньовенний шлях введення використовувався в більшості клінічних досліджень, у тому числі при трансплантації нирок, і довів свою безпеку, проте МСК також можна вводити безпосередньо в нирку або під капсулу нирки з перевагою прямого наведення й відсутності побічних ефектів від попадання в легені.
Важливо також, щоб було обрано оптимальний паралельний режим імуносупресивної терапії, при якому препарати не мають негативного впливу на функцію МСК, і навпаки [54]. Різні дослідження in vitro і кілька досліджень на тваринах показують взаємодію МСК з одночасним пригніченням імунітету [55–58].
Показано, що комбінація МСК з мікофенолату мофетилом значно подовжує виживання алотрансплантатів порівняно лише з МСК [58].
На підставі того, що МСК сприяють зростанню Т-reg клітин, стримуючи проліферацію Т-клітини пам’яті, та обнадійливих даних експериментальних моделей трансплантації нирки Casiraghi et al. [59] провели клінічне дослідження фази I, використовуючи автологічні КМ-МСК у реципієнтів ниркового алотрансплантата, і показали безпеку й можливість їх застосування без шкоди для реципієнта й трансплантата.
Висновки
Отже, узагальнюючи отримані результати досліджень, можна зробити висновок, що МСК є важливою популяцією стовбурових клітин з мультипотентними властивостями, які мають великий потенціал для клінічного застосування при різних захворюваннях, але особливий інтерес вони становлять у трансплантології. Завдяки своїм вираженим імуносупресивним властивостям, паракринним ефектам, потенціалу щодо мультилінійного диференціювання й можливості отримання їх у короткі строки вони можуть покращити віддалені результати алотрансплантації нирки, проте це потребує подальших досліджень.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів і власної фінансової зацікавленості при підготовці даної статті.
Внесок авторів у підготовку статті: Зограб’ян Р.О. — концепція і дизайн дослідження; Вороняк О.С. — збирання й обробка матеріалів, написання тексту.
Список литературы
1. Neuen B.L., Chadban S.J., Demaio A.R., Johnson D.W., Perkovic V. Chronic kidney disease and the global NCDs agenda. BMJ Glob. Health. 2017 Jul 6. 2(2). e000380. doi: 10.1136/bmjgh-2017-000380. PMID: 29225940; PMCID: PMC5717948.
2. Hill N.R., Fatoba S.T., Oke J.L., Hirst J.A., O’Callaghan C.A., Lasserson D.S., Hobbs F.D. Global Prevalence of Chronic Kidney Disease — A Systematic Review and Meta-Analysis. PLoS One. 2016 Jul 6. 11(7). e0158765. doi: 10.1371/journal.pone.0158765. PMID: 27383068; PMCID: PMC4934905.
3. Tonelli M., Wiebe N., Knoll G., Bello A., Browne S., Jadhav D., Klarenbach S., Gill J. Systematic review: kidney transplantation compared with dialysis in clinically relevant outcomes. Am. J. Transplant. 2011 Oct. 11(10). 2093-109. doi: 10.1111/j.1600-6143.2011.03686.x. Epub 2011 Aug 30. PMID: 21883901.
4. Coemans M., Süsal C., Döhler B., Anglicheau D., Giral M., Bestard O., Legendre C., Emonds M.P., Kuypers D., Molenberghs G., Verbeke G., Naesens M. Analyses of the short- and long-term graft survival after kidney transplantation in Europe between 1986 and 2015. Kidney Int. 2018 Nov. 94(5). 964-973. doi: 10.1016/j.kint.2018.05.018. Epub 2018 Jul 24. PMID: 30049474.
5. Eirin A., Lerman L.O. Mesenchymal stem cell treatment for chronic renal failure. Stem Cell Res. Ther. 2014 Jul 4. 5(4). 83. doi: 10.1186/scrt472. PMID: 25158205; PMCID: PMC4097822.
6. Hoogduijn M.J., Popp F.C., Grohnert A., Crop M.J., van Rhijn M., Rowshani A.T., Eggenhofer E., Renner P., Reinders M.E., Rabelink T.J., van der Laan L.J., Dor F.J., Ijzermans J.N., Genever P.G., Lange C., Durrbach A., Houtgraaf J.H., Christ B., Seifert M., Shagidulin M., Donckier V., Deans R., Ringden O., Perico N., Remuzzi G., Bartholomew A., Schlitt H.J., Weimar W., Baan C.C., Dahlke M.H.; MISOT Study Group. Advancement of mesenchymal stem cell therapy in solid organ transplantation (MISOT). Transplantation. 2010 Jul 27. 90(2). 124-6. doi: 10.1097/TP.0b013e3181ea4240. PMID: 20606604.
7. Rosenberg M.E. Cell-based therapies in kidney disease. Kidney Int. Suppl. (2011). 2013 Dec. 3(4). 364-367. doi: 10.1038/kisup.2013.78. PMID: 25019020; PMCID: PMC4089669.
8. Franquesa M., Herrero E., Torras J., Ripoll E., Flaquer M., Gomà M., Lloberas N., Anegon I., Cruzado J.M., Grinyó J.M., Herrero-Fresneda I. Mesenchymal stem cell therapy prevents interstitial fibrosis and tubular atrophy in a rat kidney allograft model. Stem Cells Dev. 2012 Nov 20. 21(17). 3125-35. doi: 10.1089/scd.2012.0096. Epub 2012 May 18. PMID: 22494435; PMCID: PMC3495114.
9. Prodromidi E.I., Poulsom R., Jeffery R., Roufosse C.A., Pollard P.J., Pusey C.D., Cook H.T. Bone marrow-derived cells contribute to podocyte regeneration and amelioration of renal disease in a mouse model of Alport syndrome. Stem Cells. 2006 Nov. 24(11). 2448-55. doi: 10.1634/stemcells.2006-0201. Epub 2006 Jul 27. PMID: 16873763.
10. Reinders M.E., de Fijter J.W., Rabelink T.J. Mesenchymal stromal cells to prevent fibrosis in kidney transplantation. Curr. Opin. Organ Transplant. 2014 Feb. 19(1). 54-9. doi: 10.1097/MOT.0000000000000032. PMID: 24275894.
11. Souidi N., Stolk M., Seifert M. Ischemia-reperfusion injury: beneficial effects of mesenchymal stromal cells. Curr. Opin. Organ Transplant. 2013 Feb. 18(1). 34-43. doi: 10.1097/MOT.0b013e32835c2a05. PMID: 23254704.
12. Chen J., Park H.C., Addabbo F., Ni J., Pelger E., Li H., Plotkin M., Goligorsky M.S. Kidney-derived mesenchymal stem cells contribute to vasculogenesis, angiogenesis and endothelial repair. Kidney Int. 2008 Oct. 74(7). 879-89. doi: 10.1038/ki.2008.304. Epub 2008 Jul 2. PMID: 18596729; PMCID: PMC2782525.
13. Tomasoni S., Longaretti L., Rota C., Morigi M., Conti S., Gotti E., Capelli C., Introna M., Remuzzi G., Benigni A. Transfer of growth factor receptor mRNA via exosomes unravels the regenerative effect of mesenchymal stem cells. Stem Cells Dev. 2013 Mar 1. 22(5). 772-80. doi: 10.1089/scd.2012.0266. Epub 2012 Dec 21. PMID: 23082760; PMCID: PMC3578372.
14. Perico N., Casiraghi F., Introna M., Gotti E., Todeschini M., Cavinato R.A., Capelli C., Rambaldi A., Cassis P., Rizzo P., Cortinovis M., Marasà M., Golay J., Noris M., Remuzzi G. Autologous mesenchymal stromal cells and kidney transplantation: a pilot study of safety and clinical feasibility. Clin. J. Am. Soc. Nephrol. 2011 Feb. 6(2). 412-22. doi: 10.2215/CJN.04950610. Epub 2010 Oct 7. PMID: 20930086; PMCID: PMC3052234.
15. Tan J., Wu W., Xu X., Liao L., Zheng F., Messinger S., Sun X., Chen J., Yang S., Cai J., Gao X., Pileggi A., Ricordi C. Induction therapy with autologous mesenchymal stem cells in living-related kidney transplants: a randomized controlled trial. JAMA. 2012 Mar 21. 307(11). 1169-77. doi: 10.1001/jama.2012.316. PMID: 22436957.
16. Reinders M.E., de Fijter J.W., Roelofs H., Bajema I.M., de Vries D.K., Schaapherder A.F., Claas F.H., van Miert P.P., Roelen D.L., van Kooten C., Fibbe W.E., Rabelink T.J. Autologous bone marrow-derived mesenchymal stromal cells for the treatment of allograft rejection after renal transplantation: results of a phase I study. Stem Cells Transl. Med. 2013 Feb. 2(2). 107-11. doi: 10.5966/sctm.2012-0114. Epub 2013 Jan 24. PMID: 23349326; PMCID: PMC3659754.
17. Casiraghi F., Perico N., Cortinovis M., Remuzzi G. Mesenchymal stromal cells in renal transplantation: opportunities and challenges. Nat. Rev. Nephrol. 2016 Apr. 12(4). 241-53. doi: 10.1038/nrneph.2016.7. Epub 2016 Feb 8. PMID: 26853275.
18. Méndez-Ferrer S., Michurina T.V., Ferraro F., Mazloom A.R., Macarthur B.D., Lira S.A., Scadden D.T., Ma’ayan A., Enikolopov G.N., Frenette P.S. Mesenchymal and haematopoietic stem cells form a unique bone marrow niche. Nature. 2010 Aug 12. 466(7308). 829-34. doi: 10.1038/nature09262. PMID: 20703299; PMCID: PMC3146551.
19. Choi S., Park M., Kim J., Hwang S., Park S., Lee Y. The role of mesenchymal stem cells in the functional improvement of chronic renal failure. Stem Cells Dev. 2009 Apr. 18(3). 521-9. doi: 10.1089/scd.2008.0097. PMID: 18647091.
20. Ezquer F.E., Ezquer M.E., Parrau D.B., Carpio D., Yañez A.J., Conget P.A. Systemic administration of multipotent mesenchymal stromal cells reverts hyperglycemia and prevents nephropathy in type 1 diabetic mice. Biol. Blood Marrow Transplant. 2008 Jun. 14(6). 631-40. doi: 10.1016/j.bbmt.2008.01.006. Epub 2008 Apr 14. PMID: 18489988.
21. Ge W., Jiang J., Arp J., Liu W., Garcia B., Wang H. Regulatory T-cell generation and kidney allograft tolerance induced by mesenchymal stem cells associated with indoleamine 2,3-dioxygenase expression. Transplantation. 2010 Dec 27. 90(12). 1312-20. doi: 10.1097/TP.0b013e3181fed001. PMID: 21042238.
22. Zonta S., De Martino M., Bedino G., Piotti G., Rampino T., Gregorini M., Frassoni F., Dal Canton A., Dionigi P., Alessiani M. Which is the most suitable and effective route of administration for mesenchymal stem cell-based immunomodulation therapy in experimental kidney transplantation: endovenous or arterial? Transplant. Proc. 2010 May. 42(4). 1336-40. doi: 10.1016/j.transproceed.2010.03.081. PMID: 20534295.
23. De Martino M., Zonta S., Rampino T., Gregorini M., Frassoni F., Piotti G., Bedino G., Cobianchi L., Dal Canton A., Dionigi P., Alessiani M. Mesenchymal stem cells infusion prevents acute cellular rejection in rat kidney transplantation. Transplant. Proc. 2010 May. 42(4). 1331-5. doi: 10.1016/j.transproceed.2010.03.079. PMID: 20534294.
24. Ochiya T., Yamamoto Y., Banas A. Commitment of stem cells into functional hepatocytes. Differentiation. 2010 Feb. 79(2). 65-73. doi: 10.1016/j.diff.2009.10.002. Epub 2009 Nov 1. PMID: 19883970.
25. Monteiro B.S., Santos B.S.D., Almeida B.L., Hiura E., Fiorio W.A.B., Valdetaro G.P., Gonçalves D.V., Silva C.S., Champion T., Campagnol D. Adipose tissue derived mesenchymal stem cell transplantation in the treatment of ischemia/reperfusion induced acute kidney injury in rats. Application route and therapeutic window. Acta Cir. Bras. 2018 Nov. 33(11). 1016-1026. doi: 10.1590/s0102-865020180110000008. PMID: 30517328.
26. Parolini O., Alviano F., Bagnara G.P., Bilic G., Bühring H.J., Evangelista M., Hennerbichler S., Liu B., Magatti M., Mao N., Miki T., Marongiu F., Nakajima H., Nikaido T., Portmann-Lanz C.B., Sankar V., Soncini M., Stadler G., Surbek D., Takahashi T.A., Redl H., Sakuragawa N., Wolbank S., Zeisberger S., Zisch A., Strom S.C. Concise review: isolation and characterization of cells from human term placenta: outcome of the first international Workshop on Placenta Derived Stem Cells. Stem Cells. 2008 Feb. 26(2). 300-11. doi: 10.1634/stemcells.2007-0594. Epub 2007 Nov 1. PMID: 17975221.
27. Evangelista M., Soncini M., Parolini O. Placenta-derived stem cells: new hope for cell therapy? Cytotechnology. 2008 Sep. 58(1). 33-42. doi: 10.1007/s10616-008-9162-z. Epub 2008 Sep 28. PMID: 19002775; PMCID: PMC2593758.
28. Wolbank S., Stadler G., Peterbauer A., Gillich A., Karbiener M., Streubel B., Wieser M., Katinger H., van Griensven M., Redl H., Gabriel C., Grillari J., Grillari-Voglauer R. Telomerase immortalized human amnion- and adipose-derived mesenchymal stem cells: maintenance of differentiation and immunomodulatory characteristics. Tissue Eng. Part A. 2009 Jul. 15(7). 1843-54. doi: 10.1089/ten.tea.2008.0205. PMID: 19125642; PMCID: PMC3092731.
29. Chang C.J., Yen M.L., Chen Y.C., Chien C.C., Huang H.I., Bai C.H., Yen B.L. Placenta-derived multipotent cells exhibit immunosuppressive properties that are enhanced in the presence of interferon-gamma. Stem Cells. 2006 Nov. 24(11). 2466-77. doi: 10.1634/stemcells.2006-0071. PMID: 17071860.
30. Miki T. Amnion-derived stem cells: in quest of clinical applications. Stem Cell Res. Ther. 2011 May 19. 2(3). 25. doi: 10.1186/scrt66. PMID: 21596003; PMCID: PMC3152995.
31. Parolini O., Alviano F., Bergwerf I., Boraschi D., De Bari C., De Waele P., Dominici M., Evangelista M., Falk W., Hennerbichler S., Hess D.C., Lanzoni G., Liu B., Marongiu F., McGuckin C., Mohr S., Nolli M.L., Ofir R., Ponsaerts P., Romagnoli L., Solomon A., Soncini M., Strom S., Surbek D., Venkatachalam S., Wolbank S., Zeisberger S., Zeitlin A., Zisch A., Borlongan C.V. Toward cell therapy using placenta-derived cells: disease mechanisms, cell biology, preclinical studies, and regulatory aspects at the round table. Stem Cells Dev. 2010 Feb. 19(2). 143-54. doi: 10.1089/scd.2009.0404. PMID: 19947828.
32. Bailo M., Soncini M., Vertua E., Signoroni P.B., Sanzone S., Lombardi G., Arienti D., Calamani F., Zatti D., Paul P., Albertini A., Zorzi F., Cavagnini A., Candotti F., Wengler G.S., Parolini O. Engraftment potential of human amnion and chorion cells derived from term placenta. Transplantation. 2004 Nov 27. 78(10). 1439-48. doi: 10.1097/01.tp.0000144606.84234.49. PMID: 15599307.
33. Avila M., España M., Moreno C., Peña C. Reconstruction of ocular surface with heterologous limbal epithelium and amniotic membrane in a rabbit model. Cornea. 2001 May. 20(4). 414-20. doi: 10.1097/00003226-200105000-00016. PMID: 11333332.
34. Sankar V., Muthusamy R. Role of human amniotic epithelial cell transplantation in spinal cord injury repair research. Neuroscience. 2003. 118(1). 11-7. doi: 10.1016/s0306-4522(02)00929-6. PMID: 12676132.
35. Yuge I., Takumi Y., Koyabu K., Hashimoto S., Takashima S., Fukuyama T., Nikaido T., Usami S. Transplanted human amniotic epithelial cells express connexin 26 and Na-K-adenosine triphosphatase in the inner ear. Transplantation. 2004 May 15. 77(9). 1452-4. doi: 10.1097/00007890-200405150-00023. PMID: 15167605.
36. Takashima S., Ise H., Zhao P., Akaike T., Nikaido T. Human amniotic epithelial cells possess hepatocyte-like characteristics and functions. Cell Struct. Funct. 2004 Jun. 29(3). 73-84. doi: 10.1247/csf.29.73. PMID: 15528839.
37. Sakuragawa N., Enosawa S., Ishii T., Thangavel R., Tashiro T., Okuyama T., Suzuki S. Human amniotic epithelial cells are promising transgene carriers for allogeneic cell transplantation into li–ver. J. Hum. Genet. 2000. 45(3). 171-6. doi: 10.1007/s100380050205. PMID: 10807543.
38. Rota C., Morigi M., Imberti B. Stem Cell Therapies in Kidney Diseases: Progress and Challenges. Int. J. Mol. Sci. 2019 Jun 7. 20(11). 2790. doi: 10.3390/ijms20112790. PMID: 31181604; –PMCID: PMC6600599.
39. Morigi M., Rota C., Montemurro T., Montelatici E., Lo Cicero V., Imberti B., Abbate M., Zoja C., Cassis P., Longaretti L., Rebulla P., Introna M., Capelli C., Benigni A., Remuzzi G., Lazzari L. Life-sparing effect of human cord blood-mesenchymal stem cells in experimental acute kidney injury. Stem Cells. 2010 Mar 31. 28(3). 513-22. doi: 10.1002/stem.293. PMID: 20049901.
40. Perico L., Morigi M., Rota C., Breno M., Mele C., Noris M., Introna M., Capelli C., Longaretti L., Rottoli D., Conti S., Corna D., Remuzzi G., Benigni A. Human mesenchymal stromal cells transplanted into mice stimulate renal tubular cells and enhance mitochondrial function. Nat. Commun. 2017 Oct 17. 8(1). 983. doi: 10.1038/s41467-017-00937-2. PMID: 29042548; PMCID: PMC5754365.
41. Fang T.C., Pang C.Y., Chiu S.C., Ding D.C., Tsai R.K. Renoprotective effect of human umbilical cord-derived mesenchymal stem cells in immunodeficient mice suffering from acute kidney injury. PLoS One. 2012. 7(9). e46504. doi: 10.1371/journal.pone.0046504. Epub 2012 Sep 27. PMID: 23029541; PMCID: PMC3459926.
42. Di Campli C., Piscaglia A.C., Pierelli L., Rutella S., Bonanno G., Alison M.R., Mariotti A., Vecchio F.M., Nestola M., Mo–nego G., Michetti F., Mancuso S., Pola P., Leone G., Gasbarrini G., Gasbarrini A. A human umbilical cord stem cell rescue therapy in a murine model of toxic liver injury. Dig. Liver Dis. 2004 Sep. 36(9). 603-13. doi: 10.1016/j.dld.2004.03.017. PMID: 15460845.
43. Zhao W., Li J.J., Cao D.Y., Li X., Zhang L.Y., He Y., Yue S.Q., Wang D.S., Dou K.F. Intravenous injection of mesenchymal stem cells is effective in treating liver fibrosis. World J. Gastroenterol. 2012 Mar 14. 18(10). 1048-58. doi: 10.3748/wjg.v18.i10.1048. PMID: 22416179; PMCID: PMC3296978.
44. Németh K., Leelahavanichkul A., Yuen P.S., Mayer B., Parmelee A., Doi K., Robey P.G., Leelahavanichkul K., Koller B.H., Brown J.M., Hu X., Jelinek I., Star R.A., Mezey E. Bone marrow stromal cells attenuate sepsis via prostaglandin E(2)-dependent reprogramming of host macrophages to increase their interleukin-10 production. Nat. Med. 2009 Jan. 15(1). 42-9. doi: 10.1038/nm.1905. Epub 2008 Nov 21. Erratum in: Nat. Med. 2009 Apr. 15(4). 462. PMID: 19098906; PMCID: PMC2706487.
45. Reinders M.E., Roemeling-van Rhijn M., Khairoun M., Lie–vers E., de Vries D.K., Schaapherder A.F., Wong S.W., Zwaginga J.J., Duijs J.M., van Zonneveld A.J., Hoogduijn M.J., Fibbe W.E., de Fijter J.W., van Kooten C., Rabelink T.J., Roelofs H. Bone marrow-derived mesenchymal stromal cells from patients with end-stage renal disease are suitable for autologous therapy. Cytotherapy. 2013 Jun. 15(6). 663-72. doi: 10.1016/j.jcyt.2013.01.010. Epub 2013 Feb 16. PMID: 23419679.
46. Casiraghi F., Azzollini N., Todeschini M., Cavinato R.A., Cassis P., Solini S., Rota C., Morigi M., Introna M., Maranta R., Perico N., Remuzzi G., Noris M.. Localization of mesenchymal stromal cells dictates their immune or proinflammatory effects in kidney transplantation. Am. J. Transplant. 2012 Sep. 12(9). 2373-83. doi: 10.1111/j.1600-6143.2012.04115.x. Epub 2012 May 29. PMID: 22642544.
47. Bernardo M.E., Fibbe W.E. Mesenchymal stromal cells: sensors and switchers of inflammation. Cell Stem Cell. 2013 Oct 3. 13(4). 392-402. doi: 10.1016/j.stem.2013.09.006. PMID: 24094322.
48. Pevsner-Fischer M., Morad V., Cohen-Sfady M., Rousso-Noori L., Zanin-Zhorov A., Cohen S., Cohen I.R., Zipori D. Toll-like receptors and their ligands control mesenchymal stem cell functions. Blood. 2007 Feb 15. 109(4). 1422-32. doi: 10.1182/blood-2006-06-028704. Epub 2006 Oct 12. PMID: 17038530.
49. Roemeling-van Rhijn M., Reinders M.E., Franquesa M., Engela A.U., Korevaar S.S., Roelofs H., Genever P.G., Ijzermans J.N., Betjes M.G., Baan C.C., Weimar W., Hoogduijn M.J. Human Allogeneic Bone Marrow and Adipose Tissue Derived Mesenchymal Stromal Cells Induce CD8+ Cytotoxic T Cell Reactivity. J. Stem Cell Res. Ther. 2013 Dec 12. 3(Suppl 6). 004. doi: 10.4172/2157-7633.S6-004. PMID: 24729944; PMCID: PMC3982127.
50. Roemeling-van Rhijn M., Khairoun M., Korevaar S.S., Lievers E., Leuning D.G., Ijzermans J.N., Betjes M.G., Genever P.G., van Kooten C., de Fijter H.J., Rabelink T.J., Baan C.C., Weimar W., Roelofs H., Hoogduijn M.J., Reinders M.E. Human Bone Marrow- and Adipose Tissue-derived Mesenchymal Stromal Cells are Immunosuppressive In vitro and in a Humanized Allograft Rejection Model. J. Stem Cell Res. Ther. 2013 Nov 25. Suppl 6(1). 20780. doi: 10.4172/2157-7633.S6-001. PMID: 24672744; PMCID: PMC3963708.
51. Wang Y., Zhang A., Ye Z., Xie H., Zheng S. Bone marrow-derived mesenchymal stem cells inhibit acute rejection of rat liver allografts in association with regulatory T-cell expansion. Transplant. Proc. 2009 Dec. 41(10). 4352-6. doi: 10.1016/j.transproceed.2009.08.072. PMID: 20005397.
52. Le Blanc K., Frassoni F., Ball L., Locatelli F., Roelofs H., Lewis I., Lanino E., Sundberg B., Bernardo M.E., Remberger M., Dini G., Egeler R.M., Bacigalupo A., Fibbe W., Ringdén O.; Developmental Committee of the European Group for Blood and Marrow Transplantation. Mesenchymal stem cells for treatment of steroid-resistant, severe, acute graft-versus-host disease: a phase II study. Lancet. 2008 May 10. 371(9624). 1579-86. doi: 10.1016/S0140-6736(08)60690-X. PMID: 18468541.
53. Ball L.M., Bernardo M.E., Roelofs H., van Tol M.J., Contoli B., Zwaginga J.J., Avanzini M.A., Conforti A., Bertaina A., Giorgiani G., Jol-van der Zijde C.M., Zecca M., Le Blanc K., Frassoni F., Egeler R.M., Fibbe W.E., Lankester A.C., Locatelli F. Multiple infusions of mesenchymal stromal cells induce sustained remission in children with steroid-refractory, grade III-IV acute graft-versus-host disease. Br. J. Haematol. 2013 Nov. 163(4). 501-9. doi: 10.1111/bjh.12545. Epub 2013 Aug 31. PMID: 23992039.
54. Hoogduijn M.J., Crop M.J., Korevaar S.S., Peeters A.M., Eijken M., Maat L.P., Balk A.H., Weimar W., Baan C.C. Susceptibility of human mesenchymal stem cells to tacrolimus, mycophenolic acid, and rapamycin. Transplantation. 2008 Nov 15. 86(9). 1283-91. doi: 10.1097/TP.0b013e31818aa536. PMID: 19005411.
55. Eggenhofer E., Renner P., Soeder Y., Popp F.C., Hoogduijn M.J., Geissler E.K., Schlitt H.J., Dahlke M.H. Features of synergism between mesenchymal stem cells and immunosuppressive drugs in a murine heart transplantation model. Transpl. Immunol. 2011 Sep. 25(2-3). 141-7. doi: 10.1016/j.trim.2011.06.002. Epub 2011 Jun 17. PMID: 21704160.
56. Eggenhofer E., Steinmann J.F., Renner P., Slowik P., Piso P., Geissler E.K., Schlitt H.J., Dahlke M.H., Popp F.C. Mesenchymal stem cells together with mycophenolate mofetil inhibit antigen presenting cell and T cell infiltration into allogeneic heart grafts. Transpl. Immunol. 2011 Apr 15. 24(3). 157-63. doi: 10.1016/j.trim.2010.12.002. Epub 2010 Dec 29. PMID: 21194567.
57. Ge W., Jiang J., Baroja M.L., Arp J., Zassoko R., Liu W., Bartholomew A., Garcia B., Wang H. Infusion of mesenchymal stem cells and rapamycin synergize to attenuate alloimmune responses and promote cardiac allograft tolerance. Am. J. Transplant. 2009 Aug. 9(8). 1760-72. doi: 10.1111/j.1600-6143.2009.02721.x. Epub 2009 Jun 26. PMID: 19563344.
58. Zhang W., Qin C., Zhou Z.M. Mesenchymal stem cells modulate immune responses combined with cyclosporine in a rat renal transplantation model. Transplant. Proc. 2007 Dec. 39(10). 3404-8. doi: 10.1016/j.transproceed.2007.06.092. PMID: 18089393.
59. Casiraghi F., Perico N., Remuzzi G. Mesenchymal stromal cells for tolerance induction in organ transplantation. Hum. Immunol. 2018 May. 79(5). 304-313. doi: 10.1016/j.humimm.2017.12.008. Epub 2017 Dec 27. PMID: 29288697.
/63.jpg)

/64.jpg)