Вступ
Когнітивні порушення в похилому віці становлять масштабну медико-соціальну проблему, що досі не має чітко окреслених перспектив вирішення. Згідно з концепцією континууму виділяють стадію помірних когнітивних порушень (ПКП), які представлені зниженням оперативної пам’яті, уваги, розумової працездатності при збереженій адаптивній поведінці, і стадію деменції — глибокого занепаду пам’яті й інтелекту, поєднаного із соціальною дез-адаптацією. Поширеність ПКП, за різними оцінками, становить від 10 до 20 % у популяції осіб, старших за 65 років [1].
Причини когнітивного згасання в похилому віці поділяються на дві основні групи: 1) розлади метаболізму й трофіки нервової тканини, що призводять до депонування нейротоксичних продуктів (бета-амілоїду, тау-протеїну, тілець Леві); 2) різного ступеня порушення мозкового кровотоку.
Постінсультні проблеми в когнітивній сфері можуть бути не такими очевидними для пацієнтів і лікарів, як моторні і функціональні порушення. Проте, як було нещодавно встановлено в міжнародному дослідженні Консорціуму з вивчення інcульту і когніцій (STROKOG), глобальні когнітивні порушення відзначалися в 44 % пацієнтів, а порушення в окремих доменах — у 30–35 % пацієнтів у проміжку від 2 до 6 місяців після перенесеної мозкової катастрофи (рис. 1). Усього в аналіз було включено дані 3520 пацієнтів, середній вік яких становив 67 років, яких обстежували після інсульту або транзиторної ішемічної атаки в рамках 13 досліджень в Азії, Африці, Європі та США. Деменцію в постінсультному періоді за різними критеріями діагностували в 3–26 % пацієнтів, а частота виявлення ПКП становила від 26 до 67 % [2].
/77.jpg)
Судинні фактори ризику й дегенеративні зміни в центральній нервовій системі (ЦНС) мають накопичувальний ефект, конвергентними шляхами ведуть до запалення, атрофії і втрати нейронів. Точна послідовність подій у біологічних каскадах, як і внесок кожного окремого чинника в патогенез ПКП і деменції, невідомі [2]. У численних доклінічних дослідженнях виділено низку патогенетичних мішеней для розробки потенційних терапевтичних засобів. Такими мішенями є олігомери бета-амілоїду й тау-білка, прозапальні медіатори, нейротрофічні фактори та їх рецептори, сигнальні шляхи реалізації внутрішньоклітинних ефектів кальцію, гормони, аполіпопротеїни та інші молекули в метаболізмі ліпідів, система аксоплазматичного транспорту, нейротрансмітери та їх нейрональні рецептори, пріонові білки [2, 3].
Незважаючи на обнадійливі результати досліджень in vitro, підхід «одна мішень — одна молекула» виявив повну неспроможність у клініці. За останні десятиліття було проведено сотні контрольованих клінічних досліджень перспективних молекул, спрямованих на окремі вивчені ланки патогенезу когнітивних порушень, але жодне не дало результатів, які могли б радикально змінити прогноз пацієнтів [3]. Стандартний фармакологічний підхід при нейродегенеративній деменції (хворобі Альцгеймера — ХА) включає призначення інгібіторів ацетилхолінестерази (іАХЕ) та антагоніста N-метил-D-аспартатних рецепторів мемантину як підтримувальної симптоматичної терапії. Натомість проблема ПКП досі не має доказово обґрунтованих і офіційно схвалених терапевтичних рішень [4].
Уже не перший рік у спеціалізованих виданнях активно обговорюють концепцію мультитаргетного, або мережевого, підходу (network-based approach) до проблеми когнітивних порушень. Низка авторів висловлюють думку, що успіх матиме швидше комплекс втручань, спрямованих на численні відомі шляхи прогресування нейродегенерації, а не фармакологічний вплив на окремі мішені. Експериментальним підґрунтям мережевого підходу є дані про взаємозв’язки й конвергенцію різних патологічних метаболічних шляхів, які ведуть до атрофії і нейродегенерації. Відповідно, ефекти впливу на різні патогенетичні мішені можуть додаватися, множитися, але в будь-якому разі очікується їх синергія [3, 5, 6].
У контексті мережевого підходу зростає інтерес дослідників до напрямків нутрицевтики й фітотерапії, засобів із різноспрямованим впливом на метаболічні процеси в ЦНС. На рівні сучасних технологій проводяться дослідження аюрведичних екстрактів лікарських рослин, які століттями емпірично застосовувалися як підсилювачі пам’яті й розумової працездатності. Серед широко згадуваних у спеціалізованій літературі природних ноотропів — екстракт бакопи моньє.
Експериментальні передумови
Бакопа моньє (Bacopa monnieri) — важлива лікарська рослина в традиційній індійській аюрведичній медицині, також відома під назвою брахмі (Brahmi). Перші письмові згадки про застосування екстракту бакопи для лікування захворювань нервової системи, покращення пам’яті й розумових здібностей датуються 500 р. н.е. [7]. Фітохімічними дослідженнями визначено, що до складу екстракту бакопи входить понад 50 біологічно активних речовин, зокрема алкалоїди, сапоніни, стероли, глікозиди, амінокислоти [5, 7, 8]. Фракція тритерпенових сапонінів у спеціалізованій літературі, що позначається узагальненим терміном «бакозиди», поділяється на субфракції А і В. Пізніше з екстракту була виділена й описана ще одна фракція сапонінів з ноотропними властивостями — бакопазиди I–XII [8].
В експериментальних дослідженнях встановлено потенційні механізми ноотропних і прокогнітивних ефектів екстракту бакопи: антиоксидантна й протизапальна нейропротекція, інгібування ацетилхолін-естерази, активація ацетилтрансферази, редукція β-амілоїду, покращання мозкового кровообігу, модуляція нейротрансмітерних систем — ацетилхолінової, норадреналінової, серотонінової [5, 7, 8].
Бакозиди і бакопазиди мають експериментально підтверджені антиоксидантні властивості, які, ймовірно, відіграють важливу роль в адаптації до стресу, протидії старінню, збереженні когнітивних функцій. Екстракт бакопи має дозозалежну здатність нейтралізувати вільні радикали й захищати від ушкодження ДНК [9]. За антиоксидантним потенціалом екстракт бакопи еквівалентний удвічі меншій кількості вітаміну Е [10]. Протидія перекисному окисленню ліпідів вважається особливо важливою властивістю бакозидів у ЦНС, оскільки метаболічно активна тканина мозку багата на ненасичені ліпіди й залізо — елемент з високим окисним потенціалом [8].
Rastogi зі співавт. [11] вивчали ефекти довготривалого (200 мг/кг на день упродовж 3 місяців) вживання бакозидів на асоційоване з віком нейрозапалення в експериментальних тварин. Відмічалося статистично значуще зменшення активності прозапальних цитокінів (інтерлейкіну-1β, фактора некрозу пухлини α), збільшення експресії індуцибельної NO-синтази й редукція загального вмісту нітритів і ліпофусцину в корі головного мозку.
Kamkaew зі співавт. [12] порівнювали ефекти екстрактів бакопи (40 мг/кг) і гінкго білоби (60 мг/кг) на мозковий кровотік. Під час 8-місячного спостереження в щурів, які отримували екстракт бакопи, відбувалося статистично значуще підвищення кровотоку на 25 % порівняно з 29 % у групі гінкго (проте зважимо, що гінкго призначали у вищій на 20 мг/кг дозі). Тривале застосування бакопи не впливало на артеріальний тиск. Вважається, що бакозиди дають вазодилатуючий ефект завдяки вивільненню оксиду азоту (NO) з ендотелію і регуляції потоків іонів кальцію через мембрани саркоплазматичного ретикулуму [13].
Методом флуоресцентної мікроскопії in vitro виявлено виражений інгібуючий ефект екстракту бакопи на агрегацію вільного β-амілоїду [14]. На PSAPP-моделі ХА в мишей екстракт бакопи при застосуванні до 8 місяців зменшував щільність амілоїдних відкладень на 60 % [15]. Limpeanchob зі співавт. [16] на культурі кортикальних нейронів описали захисний ефект екстракту бакопи щодо β-амілоїдної ней-ротоксичності, що супроводжувався підвищенням активності антиоксидантних систем і інгібуванням ацетилхолінестерази. У дослідах із 3-тижневим застосуванням екстракту бакопи в щурів при токсично-індукованій ХА зафіксовано статистично значуще скорочення часу на проходження тваринами водного лабіринту Морріса, що супроводжувалося зниженням темпів втрати холінергічних нейронів [17].
Описані ефекти бакопи на експресію серотонінових рецепторів 5-HT3A, а також рівні ацетилхоліну й серотоніну під час виконання тваринами завдань із залученням гіпокампальних механізмів пам’яті й навчання [18]. Під впливом бакозидів показано суттєве інгібування механізму погіршення пам’яті, індукованого 1-(м-хлорофеніл)-бігуанідом (агоністом 5-HT3A). Порівняно з контролем у гіпокампі у тварин дослідної групи відмічали статистично значущий приріст концентрації 5-HT (39 %), ацетилхоліну (20 %), глутамату (20 %) і гамма-аміномасляної кислоти (20 %).
Визначальними є знахідки впливу екстракту бакопи на морфологічні характеристики нервової тканини. Vollala та співавт. [19] вивчали ефекти бакопи на морфологію і галуження дендритів у нервових клітинах базолатеральної мигдалини — ділянки головного мозку, яка відіграє важливу роль у забезпеченні процесів навчання та пам’яті. Результати експерименту вказують на суттєве покращення здатності до просторового навчання, запам’ятовування. Покращення когніцій у піддослідних тварин супроводжувалося збільшенням довжини і точок галуження дендритів нейронів вже через 4–6 тижнів вживання екстракту бакопи.
Jeyasri та співавт. [5] застосували новітні технології математичного моделювання й мережевого аналізу для оцінювання можливих точок впливу численних молекулярних механізмів екстракту бакопи на ланки патогенезу неврологічних захворювань, зокрема ХА. У базі даних PubChem автори ідентифікували 52 активні речовини, що входять до складу екстракту бакопи. Кожен складник має спорідненість до більше ніж 15 активних рецепторів і сигнальних білків, а всі разом 52 компоненти утворюють складну мережу взаємодії з 780 патогенетичними факторами в людському організмі. Цікаво, що мережевий аналіз передбачає нові біологічні ефекти бакопи, які ще не були визначені експериментально, а також синергічні взаємодії з іншими засобами аюрведичної і сучасної медицини. Зокрема, існують експериментальні передумови для застосування екстракту бакопи в комбінації з цитиколіном.
Цитиколін — фармацевтична субстанція (цитидин-5’-дифосфохолін), ідентична до природного попередника фосфатидилхоліну, основного фосфоліпідного компонента клітинних мембран. Нейропротективні властивості цитиколіну досліджені в численних експериментах на моделях ішемії, травми головного мозку, а також нейродегенеративної патології [20]. Основним ефектом цитиколіну є стимуляція синтезу мозкових фосфоліпідів, що підтверджено методом магнітно-резонансної спектрометрії в дослідженнях за участю людей [21]. Вважається, що таким чином цитиколін може сприяти репарації пошкоджених нейрональних мембран і підтримує функцію інтегрованих у мембрани структур — рецепторів, білків-переносників [22]. Інший механізм нейропротекції цитиколіну, виявлений на моделях інсульту, полягає в інгібуванні фосфоліпази А2 (PLA2). Пригнічення цього ферменту перешкоджає утворенню гідроксильних радикалів і втратам кардіоліпіну — фосфоліпіду внутрішніх мембран, який критично необхідний для транспортування електронів у дихальному ланцюзі мітохондрій [23].
Після перорального введення цитиколіну спостерігали активацію принаймні двох шляхів біосинтезу в головному мозку — один завершується утворенням бетаїну (важливого донора метильних груп), а інший веде до синтезу ацетилхоліну [24]. Уведення цитиколіну супроводжується підвищенням у ЦНС рівнів таких нейротрансмітерів, як норадреналін, дофамін і серотонін [25]. Нещодавно в цитиколіну був відкритий ефект активації сиртуїну-1 (SIRT1), білка, який бере участь у деацетилюванні гістонів і демонструє протективні властивості при залежних від віку захворюваннях, таких як рак, діабет, серцево-судинні й нейродегенеративні захворювання (ХА, хвороба Паркінсона). Зокрема, SIRT1 протидіє утворенню β-амілоїдних бляшок на тваринних моделях ХА і активує транскрипцію ADAM10 (α-секретаза) — неамілоїдогенний метаболічний шлях [26].
Підсумовуючи дані про вивчені властивості бакозидів і цитиколіну, можна очікувати синергію їх ефектів у ЦНС. Обидва проникають крізь гематоенцефалічний бар’єр і чинять холінергічну дію, не маючи прямої спорідненості до АХ-рецепторів. Бакопа і цитиколін є модуляторами інших нейротрансмітерів (норадреналіну, серотоніну, дофаміну), а також мають конвергентні механізми впливу на формування патологічного амілоїду. Це створює передумови для клінічного вивчення комбінації екстракту бакопи й цитиколіну при лікуванні пацієнтів із когнітивними порушеннями різного походження.
Клінічні дослідження
Шість клінічних досліджень екстракту бакопи високої методологічної якості за шкалою Jadad систематизовані в огляді Pase і співавт. [27]. Усі дослідження включали рандомізацію, плацебо-контроль і подвійне засліплення. Учасники досліджень приймали стандартизований екстракт бакопи моньє у формі двох альтернативних дієтичних добавок з концентрацією бакозидів 40–55 % у дозі 300–450 мг на добу протягом 3 місяців. Ефекти оцінювалися із застосуванням різних когнітивних тестів, що унеможливило проведення кількісного метааналізу. За висновками авторів систематичного огляду прийом бакопи покращував функцію відтворення пам’яті й здатність до навчання як у здорових добровольців без когнітивних порушень, так і в осіб похилого віку зі скаргами на погіршення пам’яті, які не досягали рівня деменції.
У метааналізі Neale та співавт. [28] порівнювали ноотропні ефекти екстракту бакопи (8 досліджень), екстракту женьшеню Panax ginseng G115 (8 досліджень) та аналептика модафінілу (7 досліджень). Тривале застосування бакопи асоціювалося з найбільш стійким і кількісно вищим впливом на когнітивні функції в різних доменах. Величина ефекту, обчислена за методом Cohen, була найбільшою щодо покращення виконання тесту на слухову пам’ять AVLT: від d = 0,23 для відстроченого парування слів до d = 0,95 для відстроченого відтворення. Меншою мірою, але також зі статистично значущими результатами прийом бакопи покращував увагу та швидкість обробки візуальної інформації в тестах Струпа та RVIP. Оптимальний режим прийому бакопи для досягнення ефекту покращення пам’яті — 300 мг на день протягом щонайменше 3 міс.
Клінічні дослідження цитиколіну проводилися за участю різноманітних груп пацієнтів із судинною, нейродегенеративною і змішаною патологією головного мозку [22]. Зараз зосередимося лише на роботах, присвячених корекції когнітивних порушень. Метааналіз 14 рандомізованих контрольованих досліджень [29, 30] тривалістю від 1 до 12 міс. підтвердив позитивний вплив цитиколіну на пам’ять і поведінку в пацієнтів похилого віку із ПКП різного походження. Вплив терапії на домен пам’яті окремо оцінювався за даними 884 пацієнтів. Ефект цитиколіну переважав ефект плацебо зі статистичною значущістю і не залежав від патогенезу ПКП (розмір ефекту 0,19; 95% довірчий інтервал (ДІ) від 0,06 до 0,32; р < 0,005). При окремому аналізі пацієнтів лише з цереброваскулярною патологією величина ефекту зберігалася (0,22; 95% ДІ від 0,07 до 0,37; р < 0,004).
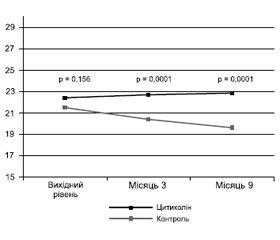
Відкрите багатоцентрове дослідження IDEALE в Італії [31] було сплановано для оцінки ефективності й безпеки перорального цитиколіну в пацієнтів похилого віку з помірними судинними когнітивними порушеннями. Було залучено 349 пацієнтів віком понад 65 років із суб’єктивними скаргами на порушення пам’яті й вихідними оцінками за мінітестом когнітивних функцій MMSE ≥ 21 (пацієнтів із вірогідною ХА не включали). Пацієнти основної групи приймали цитиколін по 500 мг двічі на день. Контрольну групу становили 84 особи відповідного віку. У результаті оцінки за MMSE через 3 і 9 місяців практично не змінилися в основній групі, натомість у контрольній групі спостерігалося прогресування когнітивних порушень. Відмінності між групами за MMSE в контрольних точках досягли статистичної значущості починаючи з 3-го місяця (рис. 2).
Досвід і перспективи комбінованої терапії
У дослідженні CITICHOLINAGE уперше показана користь комбінації іАХЕ з цитиколіном порівняно з монотерапією іАХЕ в пацієнтів із підтвердженою ХА [32]. Ретроспективне багатоцентрове дослідження типу «випадок — контроль» проводилося із 448 пацієнтами, старшими за 65 років. Динаміку когнітивного дефіциту оцінювали за MMSE. Переваги комбінованої терапії над монотерапією набули статистичної значущості вже з 3-го місяця (MMSE 17,62 vs. 15,99; p = 0,0001) і збільшилися на 9-му місяці (17,89 vs. 15,41; p = 0,0001).
У липні 2018 року на міжнародній конференції Асоціації вивчення хвороби Альцгеймера доповідали про попередні результати ретроспективного дослідження CITIMEM, що продемонструвало переваги комбінації цитиколіну з мемантином у пацієнтів із ХА та змішаною деменцією [33]. Проаналізовано дані 120 пацієнтів, середній вік яких становив 81,04 ± 5,1 року, з яких 58 отримували монотерапію мемантином (група А), а 62 — комбінацію цитиколіну в дозі 1 г/добу з мемантином у дозі 10–20 мг/добу залежно від переносимості (група В). У результаті в пацієнтів групи В порівняно з групою А відмічалося більш виражене зростання оцінок MMSE на 6-му місяці (17,40 ± 2,71 vs. 16,60 ± 2,69 відповідно; P = 0,0001), а також із 6-го по 12-й місяць (17,7 ± 2,8 vs. 17,40 ± 2,71; P = 0,0001). Зважаючи на те, що в кожній групі третина пацієнтів мала змішане походження когнітивного дефіциту, можна вважати, що синергічний ефект комбінації цитиколіну з мемантином поширюється на всю популяцію пацієнтів із деменцією.
Викликає інтерес клінічний досвід комбінованої терапії когнітивних порушень, що базується лише на метаболічно активних компонентах, без включення фармакологічних засобів. Zanotta та співавт. [1] провели проспективне когортне багатоцентрове дослідження комбінованої дієтичної добавки, що включала екстракт бакопи, астаксантин, фосфатидилсерин і вітамін Е. У 102 пацієнтів із ПКП на 60-й день відмічалося статистично значуще покращення оцінок за ADAS-cog (з 13,7 ± 5,8 до 9,7 ± 4,9), а також за тестом малювання годинника (з 8,5 ± 2,3 до 9,1 ± 1,9).
D.E. Bredesen [3] описує серію випадків успішної комплексної терапії ПКП і деменції альцгеймерівського типу. Авторська методика MEND (metabolic enhancement for neurodegeneration — активація метаболізму при нейродегенерації) полягає у виявленні всіх можливих метаболічних чинників патогенезу ХА у конкретного хворого (аполіпопротеїн, гомоцистеїн, амілоїд, гормональний дисбаланс, гіперглікемія, дефіцит вітамінів та мінералів та ін.) і застосуванні максимальної кількості доступних способів їх корекції.
Персоніфіковані програми терапії включали кілька напрямків:
— дієтотерапію (скорочення в раціоні насичених жирів і простих вуглеводів, збагачення овочами та фруктами);
— нутрицевтику (екстракт бакопи, цитиколін, залежно від виявлених дефіцитарних станів — добавки вітамінів, цинку, антиоксидантів);
— глибоку модифікацію способу життя (нормалізація режиму сну та відпочинку, фізичні вправи, стрес-менеджмент).
У результаті в 9 з 10 пацієнтів, які пройшли лікування за програмою, відмічалося суб’єктивне й об’єктивне покращення когнітивних функцій починаючи з 3–6-го місяця; 6 пацієнтів повернулися до роботи. На думку автора, лише комплексний вплив на метаболічні мішені, які формують динамічну функціональну мережу патогенезу ХА, може бути дієвим у покращенні когнітивних функцій. Ці та інші дослідники закликають продовжувати дослідження мультитаргетної терапії когнітивних порушень, вважаючи цей напрямок найбільш перспективним.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Zanotta D., Puricelli S., Bonoldi G. Cognitive effects of a dietary supplement made from extract of Bacopa monnieri, astaxanthin, phosphatidylserine, and vitamin E in subjects with mild cognitive impairment: a noncomparative, exploratory clinical study. Neuropsychiatr. Dis. Treat. 2014, Feb 3. 10. 225-30. doi: 10.2147/NDT.S51092. eCollection 2014.
2. Lo J.W. et al. Profile of and risk factors for poststroke cognitive impairment in diverse ethnoregional groups. Neuro-
logy. December 10, 2019. 93(24). DOI: https://doi.org/10.1212/WNL.0000000000008612.
3. Bredesen D.E. Reversal of cognitive decline: a novel therapeutic program. Aging (Albany NY). 2014, Sep. 6(9). 707-17.
4. Petersen R.C., Lopez O., Armstrong M.J. et al. Practice guideline update summary: Mild cognitive impairment: Report of the Guideline Development, Dissemination, and Implementation Subcommittee of the American Academy of Neurology. Neurology. 2018, Jan 16. 90(3). 126-135. doi: 10.1212/WNL.0000000000004826. Epub 2017 Dec 27.
5. Jeyasri R., Muthuramalingam P., Suba V., Ramesh M., Chen J.T. Bacopa monnieri and Their Bioactive Compounds Inferred Multi-Target Treatment Strategy for Neurological Diseases: A Cheminformatics and System Pharmacology Approach. Biomolecules. 2020, Apr 2. 10(4). pii: E536. doi: 10.3390/biom10040536.
6. Dubey T., Chinnathambi S. Brahmi (Bacopa monnieri): An ayurvedic herb against the Alzheimer's disease. Arch. Biochem. Biophys. 2019, Nov 15. 676. 108153. doi: 10.1016/j.abb.2019.108153. Epub 2019 Oct 14.
7. Kumar N. et al. Efficacy of Standardized Extract of Bacopa monnieri (Bacognize®) on Cognitive Functions of Medical Students: A Six-Week, Randomized Placebo-Controlled Trial. Evid. Based Complement Alternat. Med. 2016. 2016. 4103423. Published online 2016, Oct 10. doi: 10.1155/2016/4103423.
8. Aguiar S., Borowski T. Neuropharmacological Review of the Nootropic Herb Bacopa monnieri. Rejuvenation Res. 2013, Aug. 16(4). 313-326. doi: 10.1089/rej.2013.1431.
9. Russo A., Izzo A. A., Borrelli F., Renis M., Vanella A. Free radical scavenging capacity and protective effect of Bacopa monniera L. on DNA damage. Phytotherapy Research. 2003. 17(8). 870-875. doi: 10.1002/ptr.1061.
10. Tripathi Y. B., Chaurasia S., Tripathi E., Upadhyay A., Dubey G.P. Bacopa monniera Linn. as an antioxidant: mechanism of action. Indian Journal of Experimental Biology. 1996. 34(6). 523-526.
11. Rastogi M., Ojha R., Prabu P.C., Devi D.P., Agrawal A., Dubey G.P. Amelioration of age associated neuroinflammation on long term bacosides treatment. Neurochem. Res. 2012. 37. 869-874.
12. Kamkaew N., Scholfield N., Ingkaninan K., Taepavarapruk N., Chootip K. Bacopa monnieri increases cerebral blood flow in rat independent of blood pressure. Phytother. Res. 2013. 27. 135-138.
13. Kamkaew N., Scholfield C.N., Ingkaninan K., Maneesai P., Parkington H.C., Tare M., Chootip K. Bacopa monnieri and its constituents is hypotensive in anaesthetized rats and vasodilator in various artery types. J. Ethnopharmacol. 2011. 137. 790-795.
14. Mathew M., Subramanian M. Evaluation of the anti-amyloidogenic potential of nootropic herbal extracts in vitro. IJPSR. 2012. 3. 4276-4280.
15. Holcomb L.A., Dhanasekaran M., Hitt A.R., Young K.A., Riggs M., Manyam B.V. Bacopa monniera extract reduces amyloid levels in PSAPP mice. J. Alzheimer’s Dis. 2006. 9. 243-251.
16. Limpeanchob N., Jaipan S., Rattanakaruna S., Phrompittayarat W., Ingkaninan K. Neuroprotective effect of Bacopa monnieri on beta-amyloid-induced cell death in primary cortical culture. J. Ethnopharmacol. 2008. 30. 120. 112-117.
17. Uabundit N., Wattanathorn J., Mucimapura S., Ingkaninan K. Cognitive enhancement and neuroprotective effects of Bacopa monnieri in Alzheimer’s disease model. J. Ethnopharmacol. 2010. 8. 127. 26-31.
18. Rajan Е.K., Singh H.K., Parkavi A., Prisila D.C. Attenuation of 1-(m-chlorophenyl) biguanide induced hippocampus-dependent memory impairment by a standardised extract of Bacopa monniera. Neurochem. Res. 2011. 36. 2136-2144.
19. Vollala V.R., Upadhya S., Nayak S. Enhancement of basolateral amygdaloid neuronal dendritic arborization following Bacopa monniera extract treatment in adult rats. Clinics (Sao Paulo). 2011. 66. 663-671.
20. Secades J.J. Citicoline in the Treatment of Cognitive Impairment. J. Neurol. Exp. Neurosci. 2019. 5(1). 14-26.
21. Babb S.M., Wald L.L., Cohen B.M., Villafuerte R.A., Gruber S.A., Yurgelun-Todd D.A., Renshaw P.F. Chronic citicoline increases phosphodiesters in the brains of healthy older subjects: an in vivo phosphorus magnetic resonance spectroscopy study. Psychopharmacology (Berl). 2002. 161. 248-54.
22. Grieb P. Neuroprotective Properties of Citicoline: Facts, Doubts and Unresolved Issues. CNS Drugs. 2014. 28. 185-193. DOI 10.1007/s40263-014-0144-8.
23. Adibhatla R.M., Hatcher J.F. Citicoline decreases phospholipase A2 stimulation and hydroxyl radical generation in transient cerebral ischemia. J. Neurosci Res. 2003. 73. 308-15.
24. Weiss G.B. Metabolism and actions of CDP-choline as an endogenous compound and administered exogenously as citicoline. Life Sci. 1995. 56. 637-60.
25. Petkov V.D., Stancheva S.L., Tocuschieva L., Petkov V.V. Changes in brain biogenic monoamines induced by the nootropic drugs adafenoxate and meclofenoxate and by citicholine (experiments on rats). Gen. Pharmacol. 1990. 21. 71-75.
26. Donmez G., Outeiro T.F. SIRT1 and SIRT2: Emerging targets in neurodegeneration. EMBO Mol. Med. 2013. 5. 344-352.
27. Pase M.P., Kean J., Sarris J., Neale C., Scholey A.B., Stough C. The cognitive-enhancing effects of bacopa monnieri: a systematic review of randomized, controlled human clinical trials. Journal of Alternative and Complementary Medicine. 2012. 18(7). 647-652. doi: 10.1089/acm.2011.0367.
28. Neale C., Camfield D., Reay J., Stough C., Scholey A. Cognitive effects of two nutraceuticals Ginseng and Bacopa benchmarked against modafinil: A review and comparison of effect sizes. Br. J. Clin. Pharmacol. 2013 Mar. 75(3). 728-37. doi: 10.1111/bcp.12002.
29. Fioravanti M., Yanagi M. Cytidinediphosphocholine (CDP-choline) for cognitive and behavioural disturbances associated with chronic cerebral disorders in the elderly. Cochrane Database Syst. Rev. 2005. Apr 18 (2). CD000269.
30. Fioravanti M., Buckley A.E. Citicoline (Cognizin) in the treatment of cognitive impairment. Clin. Interv. Aging. 2006 Sep. 1(3). 247-251. Published online 2006 Sep. doi: 10.2147/ciia.2006.1.3.247.
31. Cotroneo A.M. et al. Effectiveness and safety of citicoline in mild vascular cognitive impairment: the IDEALE study. Clin. Interv. Aging. 2013. 8. 131-137. Published online 2013, Feb 5. doi: 10.2147/CIA.S38420
32. Gareri P., Castagna A. Citicoline as Add-On Treatment in Alzheimer’s Disease: Tips from the Citicholinage Study. J. Alzheimers Dis. Parkinsonism. 2017. 7. 353. doi: 10.4172/2161-0460.1000353.
33. Gareri P., Cotroneo A.M., Putignano S. The Citimem study: citicoline plus memantine in aged patients affected with Alzheimer’s disease and mixed dementia study. preliminary data. Presented at: 2018 Alzheimer’s Association International Conference. July 22–26, 2018. Chicago, IL. Abstract 24105.
/80.jpg)

/77.jpg)