Введение
Рассеянный склероз (РС) — хроническое прогрессирующее аутоиммунное заболевание центральной нервной системы, которое приводит к значительной инвалидизации, вследствие чего имеет важное медико-социальное значение [1–3].
Разнообразие клинической картины РС и нестабильное течение, сопровождающееся прогрессирующими синдромами, значительно усложняют диагностику [3, 4].
Критерии магнитно-резонансной томографии (МРТ), которые считаются золотым стандартом в диагностике РС, необходимы для определения характера патологического процесса, оценки его активности и мониторинга его развития, но возможность выявления корреляции между клиническими симптомами и параметрами нейровизуализации очень ограниченна, что является клинико-радиологическим парадоксом. Возникновение этого явления, вероятно, связано с особенностями клинической оценки, неспецифической гистопатогенностью, неполной оценкой при отсутствии внешних изменений в белом (БВ) и сером веществе (СВ) головного мозга и стертым течением кортикальной адаптации [5–8].
В литературе имеется противоречивая информация о связи между неврологическими симптомами и атрофией головного мозга. Некоторые авторы предполагают, что нет корреляции между объемом СВ и клиническими симптомами, в то время как другие авторы показывают тесную корреляцию [9, 10].
Недавние гистологические и нейровизуализационные исследования показали, что существует наибольшая корреляция между объемом СВ, БВ и объемом мозга в целом и клиническими симптомами. Также было установлено, что церебральная атрофия играет важную роль в прогрессировании как очаговых неврологических симптомов, так и когнитивных нарушений при РС [11–16].
Таким образом, выявление корреляционных связей между клиническими симптомами и нейродегенеративными изменениями при РС имеет важное значение для ранней диагностики и прогноза заболевания.
Цель работы: выявить корреляционные связи между морфометрическими параметрами церебральной атрофии и клиническими симптомами при рассеянном склерозе.
Материалы и методы
Было обследовано 88 больных с достоверным диагнозом РС согласно критериям Мак-Дональда (2010, 2017). Из них 58 (65,9 %) женщин и 30 (34,1 %) мужчин в возрасте от 18 до 60 лет. На момент обследования в возрастной группе до 30 лет находились 23 (26,1 %) больных, в группе 31–40 лет — 24 (27,2 %) больных, в возрасте 41–50 лет — 28 (31,8 %) больных, старше 51 года — 13 (14,9 %) больных.
По типу течения заболевания: у 56 (63,6 %) больных отмечался рецидив-ремиттирующий РС (РРРС), у 32 (36,4 %) — вторично-прогрессирующий РС (ВПРС). В группу контроля было включено 20 здоровых добровольцев, сопоставимых с основными группами (РРРС, ВПРС) по полу и возрасту. Пациенты были обследованы до начала терапии кортикостероидами и после субъективного уменьшения симптоматических проявлений во время последнего обострения.
Неврологический статус оценивался по EDSS (расширенная шкала инвалидизации). МРТ головного мозга была выполнена у всех пациентов. Критерии исключения для МРТ:
— соматические и наследственные патологии;
— сопутствующие заболевания головного мозга (новообразование, артериовенозные мальформации);
— аутоиммунные заболевания.
Статистическая обработка результатов проводилась с использованием программы SPM-8 (статистическое параметрическое картирование). Для сравнения показателей, не зависящих друг от друга количественно, использовался непараметрический U-критерий Манна — Уитни. Количественные показатели, которые не соответствуют законам нормального распределения, описываются с использованием медианы (Me) и квартилей (Q1, Q3). Корреляционные связи между признаками устанавливались с помощью вычисления коэффициента ранговой корреляции Спирмена.
Результаты и обсуждение
Клинические характеристики рассеянного склероза по функциональным системам (Fs) представлены в табл. 1.
Как видно из табл. 1, степень инвалидизации по шкале EDSS составила 3,5 (2,5; 4) балла у пациентов с РРРС и 5 (2,5; 6) баллов у пациентов с ВПРС и значительно различалась (P = 0,001). При оценке когнитивного теста PASAT медиана правильных ответов в процентах составила 71,5 (56; 80) у больных РРРС и 52,4 (31; 54) у пациентов с ВПРС. Медиана по Fs-нарушениям координации составила 3 (1,75; 4) балла у пациентов с ВПРС и 1 (1; 2,5) балл у пациентов с РРРС (p = 0,04). Медиана по Fs-пирамидным нарушениям составила 3 (2; 4) балла у больных с РРРС и 4 (2,5; 5) балла у пациентов с ВПРС (p = 0,002).
Результаты корреляционного анализа клинических показателей и объема мозговых структур для всех больных рассеянным склерозом представлены в табл. 2.
В нашем исследовании у больных с РРРС отрицательные корреляционные связи средней силы (r > 0,35) выявлены между сроком болезни и объемом левого таламуса (r = 0,48), между степенью инвалидизации и левым лентовидным ядром (r = –0,42). Также выявлена отрицательная корреляция средней силы между баллами по Fs-пирамидным нарушениям и объемами лентикулярных и хвостатых ядер обоих полушарий (слева r = –0,41; –0,40; р = 0,01 соответственно). Кроме того, отмечалась отрицательная достоверная корреляция между каллозальной атрофией мозга и сроками болезни (r = –0,59; р < 0,01), степенью инвалидизации (r = –0,51; р < 0,01) и стволовыми нарушениями (r = –0,65; p < 0,01). Положительная связь выявлена между Fs-2 и третьего желудочка (ТЖ) (r = 0,65; р < 0,01) и боковых желудочков (БЖ) (r = 0,68; р < 0,01).
/113.jpg)
Аналогичные связи как по направленности, так и по выраженности были выявлены у больных с ВПРС. Так, сильные отрицательные корреляции между мозолистым телом и Fs-2 (r = –0,67; p < 0,01), Fs-4 (r = –0,69; p < 0,01); сильные положительные корреляции между объемом ТЖ и Fs-1 (r = 0,68; p < 0,01), между БЖ и Fs-2 (r = 0,64; p < 0,01), объемами БЖ и Fs-6 (r = 0,68; p < 0,01) были выявлены у пациентов с ВПРС.
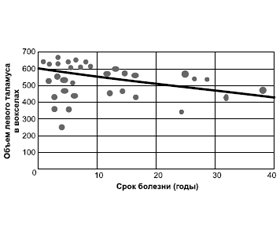
Иллюстрация взаимосвязи между нейродегенеративными показателями и клиническими симптомами при РС приведена на диаграммах «разброса» (рис. 1–3).
/114.jpg)
В нашем исследовании у пациентов с РРРС была определена достоверная обратная связь (рис. 1 и 2) между объемом левого таламуса и продолжительностью заболевания (r = –0,48; p < 0,01), между объемом левого лентикулярного ядра и степенью инвалидизации (r = –0,52; p ˂ 0,01). Отрицательная (обратная) взаимосвязь между объемом левого лентикулярного ядра и степенью инвалидизации (r = –0,49; р = 0,01) была также обнаружена у пациентов с ВПРС (рис. 3). Механизм корреляции между неврологическими симптомами и структурами левого полушария головного мозга в обеих группах пациентов до конца не изучен; это может быть связано с тем, что атрофия более выражена в левом полушарии, чем в правом. Отсутствие четкой связи между атрофией СВ и неврологическими симптомами, скорее всего, связано с однородностью выбранной группы и проявлением как легких неврологических симптомов, так и выраженных клинических манифестаций у обследованных пациентов. Положительная корреляция (r = 0,44; p ˂ 0,01) была обнаружена между продолжительностью заболевания и степенью очагового поражения головного мозга при РРРС; было отмечено, что размер очагов увеличивается с ростом продолжительности заболевания. Аналогичные отношения были установлены у пациентов с ВПРС. Существует положительная корреляция между объемами ТЖ и БЖ и степенью инвалидизации у пациентов с РРРС. Не было обнаружено корреляции между степенью очагового поражения головного мозга при РРРС и ВПРС, включая степень инвалидизации с активными очагами, поглощенными контрастным веществом. Однако у пациентов с РРРС была обнаружена отрицательная корреляция (r = –0,69; p < 0,01) между степенью очаговых поражений и когнитивной функцией (PASAT).
Выводы
1. У пациентов с рассеянным склерозом степень инвалидизации зависит не от степени очагового поражения, а от атрофии головного мозга, несмотря на выраженные изменения в белом веществе.
2. Существует четкая связь между морфометрическими показателями атрофии белого и серого вещества в головном мозге и степенью инвалидизации и функциональных нарушений при рецидивирующем и вторично-прогрессирующем рассеянном склерозе.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Информация о финансировании. Исследование не имело спонсорской поддержки.
Список литературы
1. Гусев Е.И., Завалишин И.А., Бойко А.Н. Рассеянный склероз. М., 2011. 528 с.
2. Лорина Л.В., Буршинов А.О. Актуальные вопросы этиопатогенеза, клиники, диагностики и лечения рассеянного склероза (обзор литературы и собственные данные). Российский медико-биологический вестник имени академика И.П. Павлова. 2017. 25 (2). 316-327
3. Прахова Л.Н. Атрофия коры головного мозга при рассеянном склерозе. Журнал неврологии и психиатрии. 2014. 10 (2). 43-49.
4. Кротенкова М.В., Брюхов В.В., Морозова С.Н., Кротенкова И.А. Магнитно-резонансная томография в диагностике и дифференциальной диагностике рассеянного склероза: руководство для врачей. М.: ГЭОТАР-Медиа, 2019. 160 с.
5. Повереннова И.Е., Захаров А.В., Хивинцева Е.В. Мультимодальные вызванные потенциалы в диагностике активности течения рецидивирующе-ремиттирующего рассеянного склероза. Саратовский научно-медицинский журнал. 2018. 1. 157-160.
6. BinSawad A., Seoane-Vazquez E., Rodriguez-Monguio R. et al. Evalition of the Expanted Disability Status Scale and the Multiple Sclerosis Fubctional Composite as clinical andpoints in multiple sclerosis clinical trials: quantitative metaanalyses. Curr. Med. Res. Opin. 2016 Dec. 32 (12). 1-6. DOI: 10.1080/03007995.2016.1222516
7. Кротенкова И.А., Брюхов В.В., Переседова А.В., Кротенкова М.В. Атрофия центральной нервной системы при рассеянном склерозе: данные МРТ-морфометрии. Журнал неврологии и психиатрии им. С.С. Корсакова. 2014. 114 (10–2). 50-6.
8. Serag D., Ragab E. Bi-caudate ratio as a MRI marker of white matter atrophy in multiple sclerosis and ischemic leukocencephalopathy. Egypt. J. Radiol. Nucl. Med. 2019. 50. 99. https://doi.org/10.1186/s43055-019-0104-x
9. Bermel R.A. The measurement and clinical relevance of brain atrophy in multiple sclerosis. Lancet Neurol. 2006 Feb. 5 (2). 158-70. doi: 10.1016/S1474-4422(06)70349-0.
10. Oreja-Guevara C., Rovari S.M., Jannucci G. Progressive gray matter damage in panties with relapsing- remitting multiple sclerosis: a longitudinal diffusion tensor magnetic resonance imaging study. Arch. Neurol. 2005. 2 (4). 578-84.
11. Bö L., Geurts J.J., Vander Valk Р. et al. Lack of correlation between cortical demyelination and white matter pathologic changes in multiple sclerosis. Arch. Neurol. 2007. 64 (1). 76-80.
12. Вотинцева М.В., Минеев К.К., Петров А.М., Ильвес А.Г., Резникова Т.Н., Столяров И.Д. Связь когнитивных нарушений с локализацией очагов поражения белого вещества головного мозга у больных рассеянным склерозом. Журнал неврологии и психиатрии им. С.С. Корсакова. 2014. 114 (10–2). 57-60.
13. Шмидт Т.Е. Лечение рассеянного склероза и оптикомиелита [по материалам совместного конгресса американского и европейского комитетов по изучению рассеянного склероза. Сентябрь 2014, Бостон, США (2014 Joint ACTRIMS-ECTRIMS meeting (MSJ, 2014, V. 20, № S1)]. Неврологический журнал. 2015. 20 (2). 47-57.
14. Bermel R., İnnus M.D., Tjoa C.W., Bakshi R. Selective caudate atrophy in multiple sclerosis: a 3D MRJ pаrcelation study. Neuroreport. 2009. 14 (3). 335-339.
15. Steenwijk M.D., Daams M., Pouwels P.J. et al. Unraveling the relationship between regional gray matter atrophy and patho-logy in connected white matter tracts in long-standing multiple sclerosis. Hum. Brain Mapp. 2015. 36 (5). 1796-1807. doi: 10.1002/hbm.22738
16. Céline Louapre, Sindhuja T. Govindarajan, Costanza Giannì, Julien Cohen-Adad, Michael D. Gregory, A. Scott Nielsen, Nancy Madigan, Jacob A. Sloane, Revere P. Kinkel, Caterina Mainero. Is the Relationship between Cortical and White Matter Pathologic Changes in Multiple Sclerosis Spatially Specific? A Multimodal 7-T and 3-T MR Imaging Study with Surface and Tract-based Analysis. Radiology. February 2016. 278 (2). 524-535. doi: 10.1148/radiol.2015150486

/112.jpg)
/113.jpg)
/114.jpg)