Резюме
Мета — з’ясувати особливості зв’язку між структурно-функціональними змінами лівих відділів серця та когнітивними функціями у пацієнтів з артеріальною гіпертензією (АГ). Матеріали та методи. Обстежено 90 хворих на АГ І–ІІ стадій, 2–3-го ступенів (середній вік 49,66 ± 8,74 року). Для об’єктивізації когнітивних порушень (КП) проводились нейропсихологічні тестування: шкала оцінки когнітивних функцій лікарем загальної практики (GPCOG), коротка шкала дослідження психічного статусу (Mini-Mental State Examination — MMSE), таблиці Шульте. За даними MMSE, сумарна кількість набраних балів 24–26 оцінювалась як КП. Структурно-функціональний стан серця оцінювали за допомогою ехокардіографії. Під час дослідження порівнювали показники тестувань серед пацієнтів з АГ, у яких виявлено гіпертрофію лівого шлуночка (ГЛШ), з пацієнтами з АГ та нормальним індексом маси міокарда ЛШ (ІММЛШ). ГЛШ констатували за наявності ІММЛШ ≥ 95 г/м2 у жінок і ≥ 115 г/м2 у чоловіків. Результати. У пацієнтів з АГ та гіпертрофією ЛШ істотно частіше виявляли когнітивні розлади (48,08 проти 28,95 %, р < 0,05). Сума балів за нейропсихологічними шкалами у таких пацієнтів достовірно обернено корелювала з ІММЛШ (r = –0,40, р = 0,01), товщиною міжшлуночкової перегородки (r = –0,55, р = 0,01), товщиною задньої стінки ЛШ (r = –0,49, р = 0,01). Встановлено також достовірну обернену кореляційну залежність між діастолічною дисфункцією ЛШ та сумою балів за шкалами MMSE та GPCOG (r = –0,63 та r = –0,58 відповідно, р = 0,001 для обох шкал) і пряму залежність з часом виконання проби Шульте (r = 0,39, р = 0,01). Висновки. Структурно-функціональні зміни ЛШ, а саме гіпертрофія ЛШ та його діастолічна дисфункція істотно асоціюються з когнітивними розладами у хворих на АГ. У таких пацієнтів значно нижчі показники нейропсихологічних тестів, особливо чутливими виявились домени пам’яті та рахунку.
Цель — выяснить особенности связи между структурно-функциональными изменениями левых отделов сердца и когнитивными функциями у пациентов с артериальной гипертензией (АГ). Материалы и методы. Обследовано 90 больных АГ I–II стадий, 2–3-й степени (средний возраст 49,66 ± 8,74 года). Для объективизации когнитивных нарушений (КН) проводились нейропсихологические тестирования: шкала оценки когнитивных функций врачом общей практики (GPCOG), краткая шкала исследования психического статуса (Mini-Mental State Examination — MMSE), таблицы Шульте. По данным MMSE, суммарное количество набранных баллов 24–26 оценивалось как КП. Структурно-функциональное состояние сердца оценивали с помощью эхокардиографии. В ходе исследования сравнивали показатели тестов среди пациентов с АГ, у которых обнаружили гипертрофию левого желудочка (ГЛЖ), с пациентами с АГ и нормальным индексом массы миокарда ЛЖ (ИММЛЖ). ГЛЖ констатировали при наличии ИММЛЖ ≥ 95 г/м2 у женщин и ≥ 115 г/м2 у мужчин. Результаты. У пациентов с АГ и гипертрофией ЛЖ существенно чаще выявляли когнитивные расстройства (48,08 против 28,95 %, р < 0,05). Сумма баллов по нейропсихологических шкалам у таких пациентов достоверно обратно коррелировала с ИММЛЖ (r = –0,40, р = 0,01), толщиной межжелудочковой перегородки (r = –0,55, р = 0,01), толщиной задней стенки ЛЖ (r = –0,49, р = 0,01). Установлены также достоверная обратная корреляционная зависимость между диастолической дисфункцией ЛЖ и суммой баллов по шкалам MMSE и GPCOG (r = –0,63 и r = –0,58 соответственно, р = 0,001 для обеих шкал) и прямая зависимость со временем выполнения пробы Шульте (r = 0,39, р = 0,01). Выводы. Структурно-функциональные изменения ЛЖ, а именно гипертрофия ЛЖ и его диастолическая дисфункция существенно ассоциируются с когнитивными расстройствами у больных АГ. У таких пациентов значительно ниже показатели нейропсихологических тестов, особенно чувствительными оказались домены памяти и счета.
Background. The purpose of the study was to assess the structural and functional changes of the systemic heart in hypertensive patients and their possible relationship with cognitive impairment (CI). Materials and methods. The study included 90 patients with stage 1 to 2 hypertension of 2–3 degree. The average age of hypertensive patients was 49.66 ± 8.74 years old. Neuropsychological tests such as General Practitioner Assessment of Cognition (GPCOG), Mini-Mental State Examination (MMSE), Schulte tables were used to study cognitive functions. The structural and functional state of the heart was investigated based on the echocardiography data. Results. Among hypertensive patients diagnosed with left ventricular hypertrophy (LVH), cognitive impairment was found in 25 patients (48.08 %). For comparison, the patients with cognitive impairment accounted for 11 (28.9 %) among hypertensive patients without LVH. CI was significantly associated with left ventricular myocardial mass index (r = –0.40, р = 0.01), thickness of interventricular septum (r = –0.55, р = 0.01), and back wall of the left ventricular (r = –0.49, р = 0.01). The correlation between the diastolic dysfunction of the left ventricular and the sum of the MMSE test and GPCOG test scores in hypertensive patients (r = –0.63 and r = –0.58, respectively; р = 0.001) was revealed. Conclusions. The structural and functional changes of the systemic heart, namely LVH and diastolic dysfunction of the left ventricle significantly affect cognitive functions in hypertensive patients. The significant changes in cognitive function, in particular, memory and counting were revealed.
Вступ
Артеріальна гіпертензія (АГ) — одне з найпоширеніших захворювань як в Україні, так й у світі з широким спектром небезпечних ускладнень. Поширеність АГ серед дорослого населення становить 30–45 % [1, 2], і очікується, що до 2025 року число хворих АГ збільшиться на 15–20 %, досягнувши майже 1,5 млрд [3]. Актуальність проблеми АГ обумовлена не тільки великою поширеністю, але й численними ускладненнями, пов’язаними з підвищеним артеріальним тиском (АТ). АГ є причиною виникнення таких ускладнень, як інфаркт міокарда, хронічна серцева недостатність, інсульт, судинна деменція, ниркова недостатність [4, 5]. Розвитку цих ускладнень передують безсимптомні ураження органів, опосередковані гіпертензією [6, 7].
Ураженнями серця при АГ є гіпертрофія лівого шлуночка (ГЛШ), а також діастолічна дисфункція ЛШ, що розвиваються у відповідь на постійно збільшене навантаження на серце внаслідок тривалого підвищення АТ [8]. Середня частота виявлення ознак ГЛШ серед хворих на АГ становить приблизно 50 % [9]. У короткостроковій перспективі ця структурна зміна дозволяє серцю компенсувати збільшене гемодинамічне навантаження [10], однак тривала ГЛШ є незалежним фактором ризику багатьох патологічних станів. Збільшення маси міокарда лівого шлуночка (ММЛШ) на кожні 39 г/м2 підвищує ризик ускладнень на 40 % [11]. Встановлено, що ГЛШ збільшує ризик кардіоваскулярної смерті в 1,6 раза, раптової кардіальної смерті — у 3,5 раза і частоти госпіталізацій з причини серцевої недостатності — в 1,7 раза [12].
У науковій літературі є також дані щодо зв’язку між ГЛШ та ураженнями головного мозку. За відсутності серцевої недостатності та інсульту в анамнезі підвищений ІММЛШ корелює зі змінами мікроструктури білої речовини мозку, особливо у старших пацієнтів. Зокрема, збільшення ММЛШ на кожні 25 г асоціюється з меншим об’ємом гіпокампа (відношення шансів (OR) 0,01 %; 95% довірчий інтервал (ДІ) 0,02, 0,00; p = 0,001) і більш вираженою гіперінтенсивністю білої речовини мозку (OR 0,10; 95% ДI 0,02, 0,18; p = 0,014) [13]. З кожним наступним потовщенням стінок ЛШ на 1 мм гіперінтенсивність білої речовини посилювалась на 0,66 см3 (95% ДІ 0,08–1,25); із збільшенням ІММЛШ на кожні 10 г/м2 — на 0,64 см3 (95 % ДІ 0,19–1,08) [14]. Імовірність інфаркту мозку також підвищується із потовщенням стінок ЛШ (OR 1,11, 95% ДІ 1,01–1,23 на 1 мм) та зі збільшенням ММЛШ (OR 1,08, 95% ДІ 1,00–1,17 на 10 г/м2) [15].
Оскільки когнітивні порушення (КП) є найбільш типовими клінічними проявами субклінічного ураження головного мозку, метою роботи було з’ясувати особливості зв’язку між структурно-функціональними змінами лівих відділів серця та когнітивними функціями у пацієнтів з АГ.
Матеріали та методи
Обстежено 90 хворих на АГ І–ІІ стадій, 2–3-го ступенів (середній вік 49,66 ± 8,74 року). Діагноз АГ встановлювали згідно з рекомендаціями Європейського товариства з гіпертензії та Європейського товариства кардіологів з ведення хворих на АГ, розроблених у 2013 та 2018 роках, рекомендацій комітету ВООЗ (1996) та Уніфікованого клінічного протоколу з артеріальної гіпертензії (2012). У дослідження не включали пацієнтів із АГ ІІІ стадії та вторинною АГ, порушеннями серцевого ритму (постійна форма фібриляції передсердь, часта шлуночкова або суправентрикулярна екстрасистолія), черепно-мозковими травмами в анамнезі, вадами серця, декомпенсованим цукровим діабетом, тяжкими захворюваннями печінки, нирок та органів кровотворення, онкологічними захворюваннями, психічними розладами.
Програма обстеження включала детальний збір анамнезу та основних клінічних характеристик пацієнтів на момент госпіталізації. Детально з’ясовували скарги, супутню патологію, шкідливі звички. Визначали масу тіла і зріст для обчислення індексу маси тіла (ІМТ) за формулою: ІМТ = маса тіла/(ріст)2, кг/м2. Усім пацієнтам проводились лабораторні (загальний аналіз крові, загальний аналіз сечі, біохімічний аналіз крові з визначенням рівня глюкози, креатиніну з подальшим розрахунком швидкості клубочкової фільтрації (ШКФ) за формулою CKD-EPI, калію, натрію, ліпідного спектра крові) та інструментальні (електрокардіографія, ехокардіографія (ЕхоКГ), амбулаторне моніторування артеріального тиску) дослідження.
З метою оцінки впливу структурно-функціональних змін лівого шлуночка на когнітивні функції пацієнтів з АГ ми порівняли показники тестувань серед пацієнтів з АГ, у яких виявлено ГЛШ, з пацієнтами з АГ та нормальним індексом маси міокарда ЛШ (ІММЛШ). ГЛШ констатували за наявності ІММЛШ ≥ 95 г/м2 у жінок і ≥ 115 г/м2 у чоловіків. Також порівнювався стан когнітивних функцій у пацієнтів з діастолічною дисфункцією ЛШ (Е/А < 0,8) та без такої. ЕхоКГ-дослідження проводилося на ехокардіографі Sanoline G 60 S (Siemens, Німеччина), у режимі двомірного сканування з лівого парастернального та верхівкового доступів, з аналізом стандартних позицій серця. Оцінювали структуру та функцію шлуночків і передсердь, параметри внутрішньосерцевої гемодинаміки. Вимірювали такі параметри: товщину стінок — товщину міжшлуночкової перегородки (ТМШП) та товщину задньої стінки ЛШ (ТЗСЛШ); кінцево-систолічний розмір (КСР) ЛШ; кінцево-діастолічний розмір (КДР) ЛШ; фракцію викиду (ФВ) ЛШ за допомогою модифікованого методу Сімпсона. Проводився розрахунок маси міокарда ЛШ та ІММЛШ. Оцінювання трансмітрального кровотоку проводилося в режимі імпульсного допплера з верхівкової чотирикамерної позиції. Для оцінювання діастолічної функції вимірювали такі швидкісні показники: максимальна швидкість кровотоку раннього діастолічного наповнення (Е), максимальна швидкість кровотоку під час передсердної систоли (А) і співвідношення Е/А.
Для об’єктивізації когнітивних порушень використовувались нейропсихологічні тестування: опитування пацієнтів, шкала оцінки когнітивних функцій лікарем загальної практики (GPCOG), коротка шкала дослідження психічного статусу (Mini-Mental State Examination — MMSE). Стійкість уваги та швидкість сенсомоторних реакцій оцінювали за допомогою таблиць Шульте. За даними MMSE, сумарна кількість набраних балів 24–26 оцінювалась як КП.
Статистична обробка отриманих результатів проводилася на комп’ютері з використанням пакету статистичного аналізу Microsoft Excel 2016 та програми IBM SPSS Statistics 20. Різницю між порівнюваними величинами вважали вірогідною при р < 0,05.
Результати та обговорення
Концентричну гіпертрофію ЛШ виявлено у 52 пацієнтів (57,78 %), серед них 30 (57,69 %) чоловіків та 22 (42,31 %) жінки. При цьому легку гіпертрофію діагностовано у 24 пацієнтів (46,15 %), помірну гіпертрофію — в 11 пацієнтів (21,15 %), тяжку гіпертрофію — у 17 пацієнтів (32,7 %).
Порівняльна характеристика пацієнтів з АГ та ГЛШ та без такої наведена у табл. 1.
Отже, ІММЛШ становив 133,40 ± 26,67 г/м2 у пацієнтів з АГ та ГЛШ та був достовірно вищим порівняно з пацієнтами, у яких ГЛШ не діагностовано (р = 0,001). Відповідно у таких пацієнтів були достовірно більшими розміри стінок ЛШ та КДРЛШ (р = 0,01 для всіх показників). Систолічна функція ЛШ достовірно не відрізнялася в обох групах (р = 0,18) і відповідала нормі (ФВЛШ > 50 %).
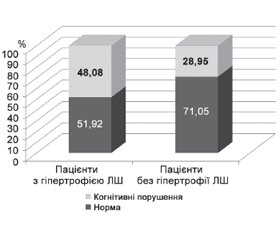
Серед пацієнтів з АГ, у яких діагностували ГЛШ, когнітивні розлади за шкалою MMSE виявлені у 25 пацієнтів (48,08 %), відповідно у 27 пацієнтів (51,92 %) когнітивні функції були не порушені. Число осіб з КП серед пацієнтів з АГ, але без ГЛШ становило 11 (28,95 %), пацієнтів без порушень когнітивних функцій було 27 (71,05 %) (рис. 1).
/10.jpg)
При порівнянні результатів нейропсихологічного тестування встановлено, що пацієнти з ГЛШ набрали достовірно меншу кількість балів за шкалами MMSE і GPCOG та потребували достовірно більше часу для проходження тесту Шульте. Зокрема, середній бал за шкалою MMSE у пацієнтів з діагностованою ГЛШ становив 26,44 ± 1,29 бала, тоді як у пацієнтів без гіпертрофії ЛШ — 27,34 ± 1,42 бала (р = 0,01) (рис. 2). При аналізі параметрів субтестів MMSE встановлено, що у пацієнтів з ГЛШ порівняно з пацієнтами без ГЛШ достовірно нижчими були результати короткотривалої пам’яті (р = 0,01), уваги та рахунку (р = 0,01), копіювання малюнка (р = 0,04).
Середній бал за шкалою GPCOG у пацієнтів з ГЛШ становив 6,21 ± 1,76 бала та був достовірно нижчим порівняно з середнім балом пацієнтів без ГЛШ — 7,21 ± 1,89 бала (р = 0,01). У пацієнтів з ГЛШ достовірно гіршими були параметри короткотривалої пам’яті (р = 0,01) та тесту малювання годинника (р = 0,01) (рис. 3).
Тест Шульте пацієнти з ГЛШ виконали за 48,24 ± 8,01 секунди, пацієнтам без ГЛШ знадобилося в середньому 44,13 ± 8,90 секунди (р = 0,03).
При цьому ступінь гіпертрофії достовірно не впливав на показники когнітивних функцій. Зокрема, за шкалою MMSE пацієнти з легкою ГЛШ набрали в середньому 26,60 ± 1,28 бала, пацієнти з помірною ГЛШ — 26,00 ± 1,74 бала (р = 0,35 порівняно з пацієнтами з легкою ГЛШ), пацієнти з тяжкою ГЛШ — 26,24 ± 0,90 бала (р = 0,65 та р = 0,86 порівняно з пацієнтами з легкою та середньою ГЛШ відповідно).
Слід також відмітити, що у 29 (32,2 %) пацієнтів з АГ за даними ЕхоКГ виявлено концентричне ремоделювання ЛШ, серед них в 11 пацієнтів (37,9 %) діагностовано КП. Серед пацієнтів з АГ та нормальною геометрією ЛШ (16,67 %) когнітивних розладів не виявлено у жодного пацієнта.
Встановлено також, що наявність діастолічної дисфункції ЛШ негативно впливає на когнітивні функції у пацієнтів з АГ. Зокрема, середній бал за шкалами MMSE та GPCOG у таких пацієнтів становив 26,19 ± 1,20 бала та 5,85 ± 1,85 бала відповідно, тоді як у пацієнтів без діастолічної дисфункції ЛШ — 28,03 ± 0,91 бала та 8,13 ± 1,12 бала відповідно (р = 0,01 для обох шкал). Достовірну різницю також виявлено між часом виконання тесту Шульте — 48,94 ± 7,62 секунди у пацієнтів з діастолічною дисфункцією ЛШ проти 41,87 ± 8,55 секунди у пацієнтів з нормальною діастолічною функцією ЛШ (р = 0,02). На основі проведеного аналізу параметрів субтестів MMSE ми виявили, що у пацієнтів з діастолічною дисфункцією ЛШ достовірно нижчими були параметри короткотривалої пам’яті (р = 0,01), орієнтування у часі (р = 0,01), лічильних функцій (р = 0,01) та копіювання малюнка (р = 0,04). Також у них були гірші результати виконання субтестів «написання речення» та «повторювання скоромовки», але показник не досяг достовірної різниці (р > 0,05).
Проведений кореляційний аналіз зв’язків між результатами нейропсихологічних шкал та показниками ЕхоКГ дозволив встановити обернену достовірну залежність між сумарними балами за шкалами MMSE і GPCOG та товщиною МШП (r = –0,55 та r = –0,47, р = 0,01 для обох показників), товщиною задньої стінки ЛШ (r = –0,49 та r = –0,43, р = 0,01 для обох показників) та ІММЛШ (r = –0,40 та r = –0,31, р = 0,01 для обох показників). Натомість розміри лівого передсердя, КСР та КДРЛШ не корелювали з балами нейропсихологічних шкал. Також констатована пряма достовірна залежність часу виконання тесту Шульте з товщиною задньої стінки ЛШ (r = 0,47, р = 0,01), товщиною МШП (r = 0,39, р = 0,01) та ІММЛШ (r = –0,40, р = 0,01).
Виявлена достовірна обернена кореляційна залежність діастолічної дисфункції ЛШ з сумою балів за шкалами MMSE та GPCOG (r = –0,63 та r = –0,58 відповідно, р = 0,001 для обох показників) та пряма залежність з часом виконання тесту Шульте (r = 0,39, р = 0,01). Рання діастолічна швидкість E прямо корелювала з балами MMSE (r = 0,55, р = 0,01) та балами GPCOG (r = 0,57, р = 0,01), обернено — з часом виконання проби Шульте (r = –0,31, р = 0,02). Достовірної залежності пізньої діастолічної швидкості А з результатами шкал не виявлено (р > 0,05).
Результати нашого дослідження частково збігаються з даними вітчизняної та іноземної літератури. Зокрема, у своїх дослідженнях О.В. Молодан та співавт. виявили кореляційну залежність між вираженістю ІММЛШ і сумою балів MoCA-тесту у хворих на АГ з КП (r = –0,31; p < 0,05) [16]. Згідно з даними О.В. Шманько, розвиток КП у хворих на АГ залежить від розмірів лівого передсердя, товщини МШП і задньої стінки лівого шлуночка та КДРЛШ [17]. У дослідженні MESA (Multi-Ethnic Study of Atherosclerosis) встановлено, що більший показник ІММЛШ (OR 1,01; 95% ДІ 1,00–1,02) і вищий показник відношення маси ЛШ до об’єму (OR 2,37; 95% ДІ 1,25–4,43) незалежно пов’язані з порушеннями когнітивних функцій та появою деменції [18].
Не менш важливою є діастолічна дисфункція ЛШ. У своїх роботах C.M. Park et al. довели, що діастолічна дисфункція ЛШ тісно пов’язана з когнітивними функціями та корелює із пам’яттю та швидкістю мовлення. Згідно із результатами дослідження, наявність діастолічної дисфункції ЛШ значно збільшує ризик КП (OR 1,29; 95% ДI 1,01–1,66; р < 0,043). При цьому із посиленням діастолічної дисфункції когнітивний дефіцит також зростає [19]. Також доведено, що ймовірність легких КП є в два рази вищою за наявності діастолічної дисфункції ЛШ (р = 0,030) [20].
Висновки
Отже, отримані нами результати доводять, що структурно-функціональні зміни ЛШ, а саме гіпертрофія ЛШ та його діастолічна дисфункція істотно асоціюються з когнітивними розладами у хворих на АГ. У пацієнтів з ГЛШ та діастолічною дисфункцією ЛШ значно нижчими були показники нейропсихологічних тестів, особливо чутливими виявились домени пам’яті та рахунку. Тому для запобігання прогресуванню та виникненню КП пацієнтів з АГ та підвищеним ІММЛШ (≥ 95 г/м2 для жінок та ≥ 115 г/м2 для чоловіків) і діастолічною дисфункцією ЛШ (Е/А < 0,8) необхідно виокремлювати у групу ризику.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Список литературы
1. NCD Risk Factor Collaboration. Worldwide trends in blood pressure from 1975 to 2015: a pooled analysis of 1479 population-based measurement studies with 19.1 million participants. NCD Risk Factor Collaboration. Lancet. 2017. Vol. 389. P. 37-55.
2. Chow C.K., Teo K.K., Rangarajan S., Islam S., Gupta R., Avezum A. et al. Prevalence, awareness, treatment, and control of hypertension in rural and urban communities in high-, middle-, and low-income countries. JAMA. 2013. Vol. 310. P. 959-968.
3. Свіщенко Є.П., Міщенко Л.А. Клініко-демографічні характеристики пацієнтів з уперше виявленою артеріальною дослідження СТАРТ. Український кардіологічний журнал. 2017. № 6. C. 14-23.
4. World Health Organization. Global Health Observatory: raised blood pressure. – 2014. http://www.who.int/gho/ncd/risk_factors/blood_pressure_prevalence_text/en/.
5. Forouzanfar M.H., Liu P., Roth G.A., Biryukov S., Marczak L., Alexander L. et al. Global burden of hypertension and systolic blood pressure of at least 110 to 115 mm Hg, 1990–2015. JAMA. 2017. Vol. 317. P. 165-182.
6. Post Hospers G., Smulders Y.M., Maier A.B., Deeg D.J., Muller M. Relation between blood pressure and mortality risk in an older population: role of chronological and biological age. J. Intern. Med. 2015. Vol. 277 P. 488-97.
7. Sverre E. Kjeldsen. Hypertension and cardiovascular risk: Ge-neral aspects. Pharmacological Research. 2018. Vol. 129. P. 95-99.
8. Lovic D., Erdine S., Catakoğlu A.B. How to estimate left ventricular hypertrophy in hypertensive patients. Anadolu Kardiyol. Derg. 2016. Vol. 14(4) P. 389-395.
9. Niki Katsiki, Dimitri P. Mikhailidis, Nikolaos Papanas. Left atrial volume: An independent predictor of cardiovascular outcomes. International Journal of Cardiology. 2018. Vol. 265 P. 234-235.
10. Aronow W.S. Hypertension and left ventricular hypertrophy. Ann. Transl. Med. 2017. Vol. 5. P. 310.
11. Padwal R., Rabi D.M., Schiffrin E.L. Recommendations for Intensive Blood Pressure Lowering in High-Risk Patients, the Canadian Viewpoint. Hypertension. 2016. Vol. 68. P. 3-5.
12. Nakanishi K., Jin Z., Homma S., Elkind M.S., Rundek T., Tugcu A. et al. Left ventricular mass-geometry and silent cerebrovascular disease: the cardiovascular abnormalities and brain lesions (CABL) study. Am. Heart J. 2017. Vol. 185. P. 85-92.
13. Johansen M.C., Shah A.M., Lirette S.T., Griswold M., Mosley T.H., Solomon S.D. et al. Associations of echocardiography markers and vascular brain lesions: the ARIC Study. J. Am. Heart Assoc. 2018. Vol. 7. Е008992.
14. Moore E.E., Liu D., Pechman K.R., Terry J.G., Nair S., Cambronero F.E. et al. Increased left ventricular mass index is associated with compromised white matter microstructure among older adults. J. Am. Heart Assoc. 2018. Vol. 7. Е009041.
15. O’Neal W.T., Almahmoud M.F., Qureshi W.T., Soliman E.Z. Electrocardiographic and Echocardiographic left ventricular hypertrophy in the prediction of stroke in the elderly. J. Stroke Cerebrovasc. Dis. 2015. Vol. 24. P. 1991-97.
16. Молодан А.В., Боев С.С., Доценко Н.Я., Шехунова И.А., Герасименко Л.В., Малиновская А.Я., Иващук В.А. Взаимосвязь когнитивных нарушений и структурно-функциональных особенностей левого желудочка сердца у больных гипертонической болезнью. Український терапевтичний журнал. 2018. № 3–4. C. 34-39.
17. Шманько О.В. Вплив структурно-функціонального стану серця на розвиток когнітивних порушень у хворих на артеріальну гіпертензію. Здобутки клінічної i експериментальної медицини. 2005. № 2–3. C. 157-162.
18. Sacre J.W., Ball J., Wong C., Chan Y.K., Stewart S., Kingwell B.A. et al. Mild cognitive impairment is associated with subclinical diastolic dysfunction in patients with chronic heart disease. Eur. Heart J. Cardiovasc. Imaging. 2018. Vol. 19 P. 285-292.
19. Park C.M., Williams E.D., Chaturvedi N., Tillin T., Ste-wart R.J., Richards M. et al. Associations between left ventricular dysfunction and brain structure and function: findings from the SABRE (Southall and Brent revisited) study. J. Am. Heart Assoc. 2017. Vol. 6(4). Е004898.
20. Julian W Sacre, Jocasta Ball, Chiew Wong, Yih-Kai Chan, Simon Stewart et al. Mild cognitive impairment is associated with subclinical diastolic dysfunction in patients with chronic heart disease. European Heart Journal — Cardiovascular Imaging. 2018. Vol. 19. P. 285-292.
/10.jpg) При порівнянні результатів нейропсихологічного тестування встановлено, що пацієнти з ГЛШ набрали достовірно меншу кількість балів за шкалами MMSE і GPCOG та потребували достовірно більше часу для проходження тесту Шульте. Зокрема, середній бал за шкалою MMSE у пацієнтів з діагностованою ГЛШ становив 26,44 ± 1,29 бала, тоді як у пацієнтів без гіпертрофії ЛШ — 27,34 ± 1,42 бала (р = 0,01) (рис. 2). При аналізі параметрів субтестів MMSE встановлено, що у пацієнтів з ГЛШ порівняно з пацієнтами без ГЛШ достовірно нижчими були результати короткотривалої пам’яті (р = 0,01), уваги та рахунку (р = 0,01), копіювання малюнка (р = 0,04).
При порівнянні результатів нейропсихологічного тестування встановлено, що пацієнти з ГЛШ набрали достовірно меншу кількість балів за шкалами MMSE і GPCOG та потребували достовірно більше часу для проходження тесту Шульте. Зокрема, середній бал за шкалою MMSE у пацієнтів з діагностованою ГЛШ становив 26,44 ± 1,29 бала, тоді як у пацієнтів без гіпертрофії ЛШ — 27,34 ± 1,42 бала (р = 0,01) (рис. 2). При аналізі параметрів субтестів MMSE встановлено, що у пацієнтів з ГЛШ порівняно з пацієнтами без ГЛШ достовірно нижчими були результати короткотривалої пам’яті (р = 0,01), уваги та рахунку (р = 0,01), копіювання малюнка (р = 0,04).
/9.jpg)