Журнал "Гастроэнтерология" Том 54, №4, 2020
Вернуться к номеру
Клініко-генетичні особливості пацієнтів з ожирінням і неалкогольною жировою хворобою печінки
Авторы: Шипулін В.П.(1), Руденко М.М.(1), Коляда О.К.(2), Мельник Н.Г.(1)
(1) — Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
(2) — Лабораторія Diagen, м. Київ, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
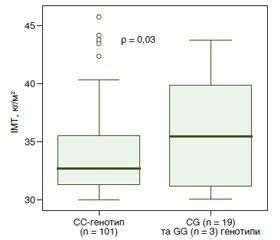
Актуальність. Нині важливе значення в патогенезі ожиріння і неалкогольної жирової хвороби печінки (НАЖХП) надається поліморфізму rs1801282 (Pro12Ala) гена PPAR-γ2 (гамма-рецептор, який активується проліфераторами пероксисом). Однак в українській популяції хворих з поєднаною патологією не вивчені клініко-лабораторні особливості пацієнтів з цим поліморфізмом. Мета — дослідити клініко-лабораторні особливості хворих на ожиріння та НАЖХП залежно від rs1801282 (Pro12Ala) поліморфізму гена PPAR-γ2. Матеріали та методи. У дослідженні брали участь 123 пацієнти з 1–3 ступенем ожиріння та НАЖХП. Усім пацієнтам проведено молекулярно-генетичне дослідження rs1801282 поліморфізму гена PPAR-γ2, а також антропометричні вимірювання, лабораторне та інструментальне обстеження (у тому числі ультразвукова стеатометрія). Результати. У хворих на ожиріння та НАЖХП з генотипами CG та GG rs1801282 поліморфізму гена PPAR-γ2 виявлено вірогідно вищі показники індексу маси тіла (p = 0,03), глюкози (p = 0,02), інсуліну (p < 0,0001) та С-пептиду натще (p = 0,02), АЛТ (p = 0,04), гамма-глутамілтранспептидази (p < 0,0001), загального холестерину (p = 0,03), тригліцеридів (p = 0,002), холестерину ліпопротеїдів низької щільності (p = 0,004), холестерину ліпопротеїдів дуже низької щільності (p = 0,001), коефіцієнта атерогенності (p < 0,0001), а показники контрольованого параметра згасання (p = 0,002), стимульованого інсуліну (p < 0,0001), сечової кислоти (p = 0,008) та холестерину ліпопротеїдів високої щільності (p < 0,0001) виявилися вірогідно нижчими порівняно з CC-генотипом. Висновки. В українській популяції хворих з поєднаним перебігом ожиріння та НАЖХП у носіїв алелі G rs1801282 поліморфізму гена PPAR-γ2 виявлено вірогідні метаболічні відмінності, які можуть бути пов’язані з захистом від розвитку стеатозу та цукрового діабету 2 типу, але водночас підвищують серцево-судинний ризик.
Актуальность. В настоящее время важное значение в патогенезе ожирения и неалкогольной жировой болезни печени (НАЖБП) придается полиморфизму rs1801282 (Pro12Ala) гена PPAR-γ2 (гамма-рецептор, активируемый пролифераторами пероксисом). Однако в украинской популяции больных с сочетанной патологией не изучены клинико-лабораторные особенности пациентов с этим полиморфизмом. Цель — исследовать клинико-лабораторные особенности больных с ожирением и НАЖБП в зависимости от rs1801282 полиморфизма гена PPAR-γ2. Материалы и методы. В исследовании приняли участие 123 пациента с 1–3 степенью ожирения и НАЖБП. Всем пациентам проведено молекулярно-генетическое исследование rs1801282 полиморфизма гена PPAR-γ2, а также антропометрические измерения, лабораторное и инструментальное обследование (в том числе ультразвуковая стеатометрия). Результаты. У больных с ожирением и НАЖБП с генотипами CG и GG rs1801282 полиморфизма гена PPAR-γ2 выявлены достоверно более высокие показатели индекса массы тела (p = 0,03), глюкозы (p = 0,02), инсулина (p < 0,0001) и С-пептида натощак (p = 0,02), АЛТ (p = 0,04), гамма-глутамилтранспептидазы (p < 0,0001), общего холестерина (p = 0,03), триглицеридов (p = 0,002), холестерина липопротеидов низкой плотности (p = 0,004), холестерина липопротеидов очень низкой плотности (p = 0,001), коэффициента атерогенности (p < 0,0001), а показатели контролируемого параметра затухания (p = 0,002), стимулированного инсулина (p < 0,0001), мочевой кислоты (p = 0,008) и холестерина липопротеидов высокой плотности (p < 0,0001) оказались достоверно ниже по сравнению с CC-генотипом. Выводы. В украинской популяции больных с сочетанием ожирения и НАЖБП у носителей аллели G rs1801282 полиморфизма гена PPAR-γ2 обнаружены достоверные метаболические различия, которые могут быть связаны с защитой от развития стеатоза и сахарного диабета 2 типа, но в то же время повышают сердечно-сосудистый риск.
Backgrounds. Currently, the rs1801282 (Pro12Ala) polymorphism in PPAR-γ2 (peroxisome proliferator-activated receptor gamma) gene is important for the pathogenesis of both obesity and non-alcoholic fatty liver disease (NAFLD). However, the clinical and laboratory characteristics in Ukrainian patients with combined pathology have not yet been studied based on this polymorphism. The purpose was to study the clinical and laboratory features of patients with obesity and NAFLD depending on rs1801282 polymorphism in PPAR-γ2 gene. Materials and methods. The study involved 123 patients with obesity 1–3 classes and NAFLD. All patients underwent a molecular genetic study of rs1801282 polymorphism in PPAR-γ2 gene, as well as anthropometric measurements, laboratory and instrumental examinations (including ultrasound (US) steatometry). Results. The study revealed in patients with CG and GG genotypes rs1801282 polymorphism of PPAR-γ2 gene significantly much higher levels of body mass index (p = 0.03), fasting glucose (p = 0.02), insulin (p < 0.0001), and C-peptide (p = 0.02), ALT (p = 0.04), GGTP (p < 0.0001), total cholesterol (p = 0.03), triglycerides (p = 0.002), low-density lipoprotein cholesterol (p = 0.004), very low-density lipoprotein cholesterol (p = 0.001), atherogenic factor (p < 0.0001), except for levels of CAP (p = 0.002), stimulated insulin (p < 0.0001), serum uric acid (p = 0.008), and high-density lipoprotein cholesterol (p < 0.0001) that were significantly less higher compared to CC genotype. Conclusions. In Ukrainians with a combined course of obesity and NAFLD, the carriers of the G allele rs1801282 polymorphism of PPAR-γ2 gene have been shown to have significant metabolic differences that might be associated with protection against the development of steatosis and type 2 diabetes, however increase cardiovascular risk.
ультразвукова стеатометрія; контрольований параметр згасання; rs1801282 (Pro12Ala) поліморфізм гена PPAR-γ2
ультразвуковая стеатометрия; контролируемый параметр затухания; rs1801282 (Pro12Ala) полиморфизм гена PPAR-γ2
ultrasound steatometry; controlled attenuation parameter; rs1801282 (Pro12Ala) polymorphism of PPAR-γ2 gene
Вступ
Матеріали та методи
Результати та обговорення
Висновки
- Alfredo J.M., Milagro F.I. Genetics of weight loss: A basis for personalized obesity management. Trends Food Sci. Technol. 2015. № 42(2). P. 97-115.
- Alonso R., Farías M., Alvarez V., Cuevas A. The Genetics of Obesity. Translational Cardiometabolic Genomic Medicine. Еd. by Rodriguez-Oquendo A. London, Elsevier, 2016. P. 161-177.
- Goodarzi M.O. Genetics of obesity: what genetic association studies have taught us about the biology of obesity and its complications. Lancet Diabetes Endocrinol. 2018. № 6(3). P. 223-236. https://doi.org/10.1016/S2213-8587(17)30200-0.
- Singh R.K., Kumar P., Mahalingam K. Molecular genetics of human obesity: A comprehensive review. C. R. Biol. 2017. № 340(2). P. 87-108.
- Walter S. et al. Association of a Genetic Risk Score With Body Mass Index Across Different Birth Cohorts. JAMA. 2016. № 316. P. 63.
- Mao L., Fang Y., Campbell M., Southerland W.M. Population differentiation in allele frequencies of obesity-associated SNPs. BMC Genomics. 2017. № 18(1). P. 861.
- Sookoian S., Pirola C.J. Genetic predisposition in nonalcoholic fatty liver disease. Clin. Mol. Hepatol. 2017. № 23(1). P. 1-12. doi: 10.3350/cmh.2016.0109.
- Dongiovanni P., Romeo S., Valenti L. Genetic Factors in the Pathogenesis of Nonalcoholic Fatty Liver and Steatohepatitis. BioMed Research. International. 2015. 10 p.
- Schwimmer J.B. et al. Heritability of nonalcoholic fatty liver disease. Gastroenterology. 2009. № 136. P. 1585-1592. doi: 10.1053/j.gastro.2009.01.050.
- Loomba R. et al. Heritability of hepatic fibrosis and steatosis based on a prospective twin study. Gastroenterology. 2015. № 149. P. 1784-1793.
- Ramos-Lopez O. et al. Guide for Current Nutrigenetic, Nutrigenomic, and Nutriepigenetic Approaches for Precision Nutrition Involving the Prevention and Management of Chronic Diseases Associated with Obesity. J. Nutrigenet. Nutrigenomics. 2017. № 10. P. 43-62.
- Kovalic A.J. et al. Genetic and Epigenetic Culprits in the Pathogenesis of Nonalcoholic Fatty Liver Disease. J. Clin. Exp. Hepatol. 2018. № 8(4). P. 390-402. doi: 10.1016/j.jceh.2018.04.001.
- Greenstein A.W. et al. Hepatocyte-specific, PPARγ-regulated mechanisms to promote steatosis in adult mice. J. Endocrinol. 2017. № 232(1). P. 107-121.
- Takahashi K. et al. Four Plasma Glucose and Insulin Responses to a 75 g OGTT in Healthy Young Japanese Women. J. Diabetes Res. 2018. 7 p.
- Maciejewska-Skrendoa A., Andrzej Pawlikb A., Sawczukc M. PPARA, PPARD and PPARG gene polymorphisms in patients with unstable angina. Gene. 2019. № 711. 143947.
- Lee Y.K., Park J.E., Lee M., Hardwicka J.P. Hepatic lipid homeostasis by peroxisome proliferator-activated receptor gamma 2. Liver Res. 2018. № 2(4). P. 209-215. Published online 2018 Dec 20.
- Wang Y., Nakajima T., Gonzalez F.J., Tanaka N. PPARs as Metabolic Regulators in the Liver: Lessons from Liver-Specific PPAR-Null Mice. Int. J. Mol. Sci. 2020. № 21. 2061.
- Barros R.K., Cotrim H.P., Daltron C.H., Olivera Y.A. Hyperferritinemia in patients with nonalcoholic fatty liver disease. Rev. Assoc. med. bras. 2017. № 63(3). P. 284-289.
- Присяжнюк В.П., Россоха З.І., Горовенко Н.Г. Асоціація Pro12Ala поліморфізму гена PPAR-γ з біохімічними показниками крові, цитокіновим і адипокіновим профілями та структурно-функціональними параметрами печінки у пацієнтів із неалкогольною жировою хворобою печінки. Укр. мед. часопис. 2017. № 5(121). С. 144-147.

/50.jpg)
/50_2.jpg)
/51.jpg)