Существует две принципиально различные стратегии лечения больных хроническим гепатитом В (ХГВ): использование пегилированного интерферона (Пег-ИФН) в надежде на развитие иммунного контроля за инфекцией и применение нуклеоз(т)идных аналогов (НА), когда контроль за заболеванием достигается непрерывным приемом противовирусных препаратов [1]. Решающим преимуществом Пег-ИФН является возможность развития иммунного контроля за инфекцией, который у части пациентов сохраняется и после прекращения лечения, а также ограниченная по времени продолжительность терапии (как правило — 48 недель). Однако рассчитывать на эффективную терапию Пег-ИФН можно лишь у ограниченного числа больных, так называемых «идеальных кандидатов» на лечение. Это, как правило, лица молодого возраста, скорее женщины, чем мужчины, с высокой гистологической активностью заболевания, отсутствием/минимальным фиброзом, низкой вирусной нагрузкой и генотипом D вируса. Кроме того, наличие большого числа противопоказаний к лечению Пег-ИФН, значимых побочных эффектов затрудняет назначение этого препарата широкому кругу больных ХГВ. Все перечисленное объясняет тот факт, что наиболее часто для лечения ХГВ во всем мире применяют НА, а не Пег-ИФН. Однако НА обеспечивают контроль над инфекцией только во время их приема, так что прекращение лечения почти неизбежно обозначает рецидив заболевания и необходимость возобновления терапии. В связи с этим большинство наднациональных руководств по лечению гепатита В рекомендует проводить лечение НА до исчезновения HBsAg. С учетом среднего темпа снижения количественного содержания HBsAg терапия НА до полного его исчезновения теоретически должна продолжаться более 35 лет, фактически — пожизненно (табл. 1) [2, 3]. По разным причинам (отсутствие финансирования государственных программ лечения больных ХГВ, необходимость планирования семьи, побочные эффекты терапии, низкая приверженность к лечению и пр.) для некоторых пациентов это является неприемлемым, в связи с чем возникает вопрос о возможности досрочного прекращения терапии НА.
/66.jpg)
Все имеющиеся на настоящий момент руководства так или иначе этот вопрос оговаривают (табл. 2). Во-первых, приоритетом остается лечение до исчезновения HBsAg, а еще лучше — до сероконверсии (появления анти-HBs). Во-вторых, досрочное прекращение лечения не может быть рекомендовано, оно может лишь рассматриваться у отдельных пациентов, имеющих определенный набор критериев. Главным из них является отсутствие цирроза печени. При его наличии какая-либо возможность преждевременной отмены терапии исключена. У НВеAg-позитивных больных непременным условием должна быть сероконверсия НВеAg (исчезновение НВеAg и появление антител к нему). Это событие является значимым в лечении данной категории пациентов, т.к. означает развитие частичного иммунного контроля над инфекцией и резко снижает вероятность рецидива заболевания после прекращения терапии. Вероятность сероконверсии НВеAg при терапии НА низкая: при лечении энтекавиром (ETV) и тенофовира дизопроксила фумаратом (TDF) — 21 %, при лечении тенофовира алафенамидом (TАF) — 10 % [1]. Обязательными дополнительными условиями являются отсутствие ДНК вируса гепатита В (ВГВ) и продолжающееся лечение НА не менее 12 месяцев после сероконверсии НВеAg.
У HBeAg-негативных пациентов ориентиров, позволяющих рассчитывать на устойчивую ремиссию после прекращения лечения НА, меньше. Видимо, поэтому AASLD вообще не рассматривает возможность досрочного прекращения лечения этой категории больных и рекомендует проводить терапию НА до сероконверсии HBsAg, аргументируя это риском вирусологического рецидива, печеночной декомпенсации, рака печени и смерти [4]. EASL и APASL такую возможность предусматривают. Условием является отсутствие ДНК ВГВ на фоне терапии не менее 3 лет, согласно рекомендациям EASL, и не менее 1,5 года — согласно рекомендациям APASL, при условии, что общая продолжительность лечения составляет не менее 2 лет. Столь полярные различия в подходе к возможности прекращения лечения НА у больных с HBeAg-негативным ХГВ связаны с тем, что прекращение репликации вируса под влиянием НА легкодостижимо, наступает у большинства больных (90, 93 и 94 % при лечении ETV, TDF и TАF соответственно) и является исключительно результатом противовирусного эффекта препаратов, а не иммунного контроля со стороны организма [1]. Видимо, именно этой причиной объясняется то внимание, которое было уделено вопросу прекращения лечения НА у HBeAg-негативных больных на последней ежегодной встрече EASL.
В исследование S. Hall c соавт. [5] было рекрутировано 111 HBeAg-негативных больных ХГВ, находившихся более 2 лет на терапии НА, у которых ДНК ВГВ отсутствовала последние 18 месяцев лечения. Авторы представили данные о частоте вирусологических и биохимических рецидивов, их тяжести, необходимости повторного назначения лечения к 48-й неделе после прекращения терапии НА.
Вирусологический рецидив развился у 107 из 111 пациентов (96,4 %). Медиана времени первой детекции ДНК ВГВ пришлась на 8-ю неделю после прекращения лечения (интервал 4–12 недель), при этом пиковых значений вирусная нагрузка достигала позже — на 12–36 неделе (медиана — 24 недели). У 21 % больных пиковые значения не превышали 2000 МЕ/мл, т.е. находились ниже уровня принятия решения о возобновлении терапии. Еще у 22 % они были в серой зоне (2000–20 000 МЕ/мл). У остальных вирусная нагрузка была высокой: выше 20 000 МЕ/мл (24 %) и выше 200 000 МЕ/мл (32 %). Интересно, что у пациентов, принимавших TDF, вирусологические рецидивы развивались раньше: уже к 8 неделе после прекращения лечения у 36 % больных определялась ДНК ВГВ, а к 16 неделе — практически у всех (93,8 %). В то время как среди получавших ETV к 16 неделе рецидив развился только у 25,8 % пациентов. Авторы не нашли каких-либо других предикторов, влиявших на время развития рецидива, кроме использованного для лечения лекарственного препарата. Это обстоятельство, очевидно, представляет для нас определенный интерес: большая часть больных ХГВ в Украине получает именно TDF.
В отличие от вирусологического биохимический рецидив с повышением трансаминаз выше 2 верхних границ показателя в норме (ВГПН) развился не у всех больных ХГВ (около 57 %). Но у 23 из них трансаминазы оказались повышены более чем в 10 раз (табл. 3). Причем у 15 пациентов пиковый уровень был достигнут между 8 и 24 неделей, еще у 8 — к концу года после прекращения лечения. Фактически первый пик совпал по времени с медианой первой детекции ДНК ВГВ, т.е. примерно с четырехнедельным запаздыванием после первого выявления ДНК, которое пришлось на 4–12 недели.
/67.jpg)
Как и в случае вирусологического рецидива, повышение трансаминаз развивалось раньше у больных, получавших TDF, чем у тех, кто получал ETV. И в этом случае авторам также не удалось найти каких-либо других предикторов, влиявших на время развития рецидива, кроме использованного для лечения лекарственного препарата. Важно, что как вирусологические, так и биохимические рецидивы, в том числе и со значительным повышением трансаминаз, могли развиваться не только непосредственно после прекращения лечения, но и в течение года, что, безусловно, требует постоянного и тщательного мониторинга показателей у больных, прервавших прием НА.
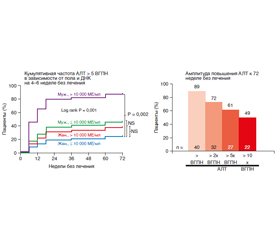
Это тем более важно, что, по данным других авторов, проводивших похожие исследования, биохимические рецидивы могут развиваться чаще, чем в рассматриваемом исследовании. Так, согласно данным Liem с соавт. [6], повышение трансаминаз после прекращения лечения НА наблюдалось у 89 % больных, причем у 61 % оно превышало 5 ВГПН, а у 49 % — 10 ВГПН. Отличием исследования Liem с соавт. был больший период наблюдения: приведенные выше данные были представлены на конец 72 недели после прекращения лечения НА.
Как известно, рецидивы после прекращения лечения могут таить в себе некоторую пользу, т.к. ведут к установлению иммунного контроля за инфекцией, а у некоторых больных — и к полной ее элиминации. В связи с этим Hall с соавт. [5], основываясь на динамике ДНК ВГВ, HBsAg и сывороточных трансаминаз, выделили два типа комбинированных рецидивов со значимым (более 5 ВГПН) повышением активности АЛТ/АСТ: «хорошие» и «плохие» (рис. 1).
/67_2.jpg)
«Хороший» рецидив отличался тем, что после вирусологического, следующего за ним биохимического рецидива наступало значимое снижение вирусной нагрузки, иногда до неопределяемого уровня, а содержание HBsAg падало более чем на 1 log. В дальнейшем уровень трансаминаз нормализовался, рецидивы заболевания не развивались и фактически речь шла об установившемся иммунном контроле за инфекцией. При «плохих» рецидивах снижение HBsAg отсутствовало или было незначительным (менее 1 log), имело место персистирующее или повторное повышение ДНК ВГВ выше 104 МЕ/мл, сопровождавшееся постоянным или периодическим повышением трансаминаз. «Хороших» рецидивов было меньше, но у 4 из 5 больных с такого типа рецидивом нормализовалась АЛТ и оставалась таковой в течение всего периода наблюдения. У большинства больных (21) были «плохие» рецидивы, причем у 5 из них было повторное повышение АЛТ выше 2 ВГПН, а у 4 повышение АЛТ выше 2 ВГПН продолжалось весь период наблюдения.
В исследовании Hall с соавт. предикторы развития клинически значимого рецидива (с повышением АЛТ > 5 ВГПН) не изучались, в то время как Liem с соавт. нашли, что такое событие более вероятно у мужчин, вирусная нагрузка у которых на 4–6 неделе после прекращения лечения НА превышает 104 МЕ/мл [6]. В этом случае кумулятивная частота рецидива составляет около 80 % (рис. 2).
/68.jpg)
Как было отмечено выше, развитие рецидива может иметь следствием установление иммунного контроля над инфекцией и даже ее полную элиминацию. В исследовании Hall с соавт. 5 из 111 пациентов утратили HBsAg (4,5 %). Это выше, чем у пациентов, которые находятся на лечении НА (0 % в регистрационных исследованиях для ETV, TDF, TAF), и описываемой при естественном течении спонтанной элиминации HBsAg (менее 1 %) [1]. Единственным предиктором описываемого события, по данным исследования Hall с соавт., был низкий уровень HBsAg (qHBsAg) на момент прекращения противовирусной терапии. На значимость уровня qHBsAg для индуцированной лечением Пег-ИФН элиминации инфекции указывали C.H. Chen с соавт.: при qHBsAg < 120 МЕ/мл вероятность исчезновения HBsAg после прекращения лечения у HBeAg-негативных больных составила 79,2 % [7]! В исследованиях Y.F. Liaw с соавт. и Y. Liang с соавт. уровень qHBsAg < 100 МЕ/мл указывал на минимальную вероятность рецидива после прекращения лечения НА [8, 9]. Интересно, что доля больных с содержанием qHBsAg < 100 МЕ/мл увеличивается после прекращения лечения НА: в исследовании Hall на момент прекращения терапии их было 18 %, к концу периода наблюдения (48 нед.) — 25 %, включая 5 % больных, утративших с сероконверсией HBsAg.
В цитируемом исследовании показаниями к возобновлению терапии были сочетание вирусологического рецидива ДНК ВГВ > 2000 МЕ/мл и повышение АЛТ > 10 ВГПН, которое продолжалось более 8 недель, или повышение АЛТ > 5 ВГПН, продолжавшееся более 16 недель [5]. Также предполагалось возобновить терапию в случае появления признаков декомпенсации функции печени (МНО > 1,5; билирубина > 2 ВГПН; асцита или печеночной энцефалопатии). К концу периода наблюдения у 11 больных терапия уже была возобновлена по тем или иным причинам. 14 пациентов имели показания к возобновлению лечения (ДНК ВГВ > 2000 МЕ/мл и повышение АЛТ > 2 ВГПН) согласно критериям EASL [1]. Не было показаний к возобновлению лечения у 33 больных. С учетом 5 пациентов, у которых исчез HBsAg, оставшиеся 37 человек находились в серой зоне (ДНК ВГВ > 2000 МЕ/мл или повышение АЛТ > 2 ВГПН). Таким образом, у 65,8 % пациентов лечение либо было возобновлено, либо они находились в окне принятия решения «лечить или не лечить».
С учетом достаточно смелых критериев для возобновления терапии в данном исследовании (повышение трансаминаз более чем в 10 раз в течение 8 недель или более чем в 5 раз в течение 16 недель) вопрос о безопасности пациентов с клинически значимыми рецидивами стоял очень остро. К счастью, только у 2 пациентов терапия была возобновлена в связи с повышением билирубина выше 2 ВГПН. Ни у одного больного не было критически значимого увеличения международного нормализованного отношения и не развились признаки декомпенсации. Не в последнюю очередь это было связано с тем, что в исследование не были включены пациенты с циррозом печени.
Приведенные данные позволяют сделать некоторые важные для повседневной практики выводы относительно возможности и перспектив прекращения лечения НА HBeAg-негативных больных с использованием критериев, приведенных в наднациональных руководствах. Во-первых, нужно отдавать себе отчет, что практически у 100 % больных разовьется вирусологический рецидив, что сразу же потребует организации динамического наблюдения за больным с целью определения значимости этого рецидива и решения вопроса о необходимости возобновления терапии. То, что вирусологический рецидив может развиваться не сразу, и даже к концу года после прекращения лечения, является дополнительным фактором неопределенности, осложняющим наблюдение за больным. Во-вторых, от 20,7 до 49 % больных, прекративших лечение, могут иметь клинически значимые рецидивы с повышением трансаминаз в 10 и более раз. В этом случае необходимо попытаться извлечь пользу из этого события и выждать максимально долго, не возобновляя противовирусную терапию. В исследовании Hall с соавт. этот период составлял 8 недель для больных с десятикратным и 16 недель — для пациентов с пятикратным повышением трансаминаз. Эти сроки не стандартизированы, и поэтому определение потенциальной пользы/риска от пролонгирования повторного назначения лечения целиком ложится на плечи лечащего врача. В-третьих, больше половины прекративших лечение пациентов будут находиться в серой зоне принятия решения о возобновлении терапии. И поскольку ни одно из наднациональных руководств строго не определяет критерии возобновления терапии, решение этого вопроса опять-таки ложится бременем на плечи наблюдающего за пациентом доктора. В-четвертых, надо отдавать себе отчет, что решение о возобновлении терапии принимается на основании лабораторных показателей, таких как вирусная нагрузка, количественное содержание HBsAg, уровень сывороточных трансаминаз. Поэтому очень важно иметь доступ к услугам современной лаборатории и проводить все исследования в одном и том же месте, чтобы обеспечить сопоставимость результатов.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
/67.jpg)

/66.jpg)
/67_2.jpg)
/68.jpg)