Журнал "Гастроэнтерология" Том 54, №4, 2020
Вернуться к номеру
Нестероїдні протизапальні засоби: сучасне уявлення про механізми ушкодження травного тракту, недоліки препаратів патогенетичного лікування та перспективи біологічної терапії НПЗЗ-індукованої езофагогастроентероколонопатії
Авторы: Гладких Ф.В.(1, 2), Чиж М.О.(1)
(1) — Інститут проблем кріобіології і кріомедицини Національної академії медичних наук України,
м. Харків, Україна
(2) — Державна установа «Інститут медичної радіології та онкології ім. С.П. Григор’єва
Національної академії медичних наук України», м. Харків, Україна
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
Актуальність. Нестероїдні протизапальні засоби (НПЗЗ) щодня застосовують понад 30 млн чоловік, а їх арсенал нараховує понад 80 препаратів та близько 1000 створених на їх основі лікарських форм. Вони широко використовуються у багатьох сферах медицини та є однією з найбільш клінічно значущих груп лікарських засобів. Однак при використанні НПЗЗ досить часто можуть виникати побічні реакції, найпоширенішими серед яких є ушкодження шлунково-кишкового тракту. Мета: охарактеризувати сучасне уявлення про механізми ушкодження травного тракту нестероїдними протизапальними засобами, оцінити недоліки існуючих препаратів патогенетичного лікування та перспективи біологічної терапії НПЗЗ-індукованої езофагогастроентероколонопатії кріоконсервованим екстрактом плаценти людини. Матеріали та методи. Проведено аналіз робіт, опублікованих у 2010–2020 рр., в яких висвітлювались відомості про епідеміологію, патогенез, діагностику і тактику лікування уражень стравоходу та шлунково-кишкового тракту, індукованих НПЗЗ, а також біологічні властивості кріоконсервованого екстракту плаценти людини як засобу біологічної терапії. Результати. Лікування НПЗЗ-індукованої езофагогастроентероколонопатії класично спрямоване на кислотосупресивну терапію (інгібітори протонної помпи, Н2-гістаміноблокатори та ін.), застосування гастроцитопротекторів (де-нол, сукральфат тощо) і препаратів, які відновлюють вміст простагландинів у слизовій оболонці (мізопростол, ребаміпід та ін.). Проте всі зазначені групи лікарських засобів недостатньо задовольняють клініцистів, оскільки спрямовані переважно на лікування власне НПЗЗ-гастропатії та мають власні побічні ефекти. Новим перспективним напрямком підвищення безпечності НПЗЗ на сьогодні є застосування засобів біологічної терапії, джерелами яких виступають мікроорганізми, органи та тканини рослинного або тваринного походження, клітини або рідини (у тому числі кров і плазма) людського або тваринного походження та біотехнологічні клітинні конструкції. Висновки. Використання НПЗЗ значно обмежується притаманними їм побічними ефектами, найпоширенішими є порушення з боку шлунково-кишкового тракту. Кріоконсервований екстракт плаценти людини є перспективним засобом біологічної терапії ульцерогенних ушкоджень шлунково-кишкового тракту, індукованих НПЗЗ.
Актуальность. Нестероидные противовоспалительные средства (НПВС) ежедневно применяют более чем 30 млн человек, а их арсенал насчитывает свыше 80 препаратов и около 1000 созданных на их основе лекарственных форм. Они широко используются во многих сферах медицины и являются одной из наиболее клинически значимых групп лекарственных средств. Однако при использовании НПВС достаточно часто могут возникать побочные реакции, наиболее распространенными из них являются повреждения желудочно-кишечного тракта. Цель: охарактеризовать современное представление о механизмах повреждения пищеварительного тракта НПВС, оценить недостатки существующих препаратов патогенетического лечения и перспективы биологической терапии НПВС-индуцированной эзофагогастроэнтероколонопатии криоконсервированным экстрактом плаценты человека. Материалы и методы. Проведен анализ работ, опубликованных в 2010–2020 гг., в которых освещались сведения об эпидемиологии, патогенезе, диагностике и тактике лечения поражений пищевода и желудочно-кишечного тракта, индуцированных НПВС, а также биологические свойства криоконсервированного экстракта плаценты человека как средства биологической терапии. Результаты. Лечение НПВС-индуцированной эзофагогастроэнтероколонопатии классически направлено на кислотосупрессивную терапию (ингибиторы протонной помпы, Н2-гистаминоблокаторы и др.), применение гастроцитопротекторов (де-нол, сукральфат и др.) и препаратов, восстанавливающих содержание простагландинов в слизистой оболочке (мизопростол, ребамипид и др.). Однако все указанные группы лекарственных средств недостаточно удовлетворяют клиницистов, поскольку направлены преимущественно на лечение НПВС-гастропатии и имеют побочные эффекты. Новым перспективным направлением повышения безопасности НПВС на сегодняшний день является применение средств биологической терапии, источниками которых выступают микроорганизмы, органы и ткани растительного или животного происхождения, клетки или жидкости (в том числе кровь и плазма) человеческого или животного происхождения и биотехнологические клеточные конструкции. Выводы. Использование НПВС значительно ограничивается присущими им побочными эффектами, наиболее распространенными являются нарушения со стороны желудочно-кишечного тракта. Криоконсервированный экстракт плаценты человека является перспективным средством биологической терапии ульцерогенных повреждений желудочно-кишечного тракта, индуцированных НПВС.
Background. Nonsteroidal anti-inflammatory drugs (NSAIDs) are used daily by more than 30 million people, and their arsenal includes more than 80 drugs and about 1,000 dosage forms based on them. They are widely used in many areas of medicine and are one of the most clinically significant groups of drugs. However, the use of NSAIDs can often cause side effects, the most common of which are damage to the gastrointestinal tract. Objective: to characterize the current understanding of the mechanisms of damage to the digestive tract by nonsteroidal anti-inflammatory drugs, to assess the shortcomings of existing pathogenetic drugs and prospects for biological therapy of NSAID-induced esophagogastroenterocolonopathy with cryopreserved human placental extract. Materials and methods. The analysis was performed of the works published in 2010–2020, which covered information on the epidemiology, pathogenesis, diagnosis and treatment of lesions of the esophagus and gastrointestinal tract induced by nonsteroidal anti-inflammatory drugs, as well as the biological properties of cryopreserved human placental extract as biological therapy. Results. Treatment of NSAID-induced esophagogastroenterocolonopathy is usually aimed at acid-suppressive therapy (proton pump inhibitors, H2-histamine blockers, etc.), the use of gastrocytoprotectors (de-nol, sucralfate, etc.) and drugs that restore the content of prostaglandins in the mucous membrane (misoprostol, rebamipide, etc.). However, all these groups of drugs do not sufficiently satisfy clinicians, as they are aimed primarily at treating NSAID gastropathy and have their own side effects. A new promising area for improving the safety of NSAIDs today is the use of biological therapies, the sources of which are microorganisms, organs and tissues of plant or animal origin, cells or fluids (including blood and plasma) of human or animal origin and biotechnological cell structures. Conclusions. The use of nonsteroidal anti-inflammatory drugs is significantly limited by their side effects, the most common of which are disorders of the gastrointestinal tract. Cryopreserved human placental extract is a promising biological therapy for ulcerogenic lesions of the gastrointestinal tract induced by nonsteroidal anti-inflammatory drugs.
нестероїдні протизапальні засоби; ульцерогенність; езофагогастроентероколонопатія; кріоконсервований екстракт плаценти
нестероидные противовоспалительные средства; ульцерогенность; эзофагогастроэнтероколонопатия; криоконсервированный экстракт плаценты
nonsteroidal anti-inflammatory drugs; ulcerogenicity; esophagogastroenterocolonopathy; cryopreserved placental extract
Вступ
Матеріали та методи
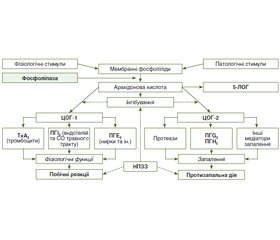
Результати та обговорення
Модифікація НПЗЗ газоподібними молекулами
Модифікація НПЗЗ наночастинками металів
Модуляція «ефекторної функції» аферентних терміналів n. vagus
Комбіновані НПЗЗ з гастро- та/або ентеропротективними препаратами
Антиульцерогенна дія засобів біологічної терапії
Висновки
- Bielsa-Fernandeza M.V., Tamayo-de la Cuestab J.L., Lizarraga-Lopezc J. et al. The Mexican consensus on the diagnosis, treatment, and prevention of NSAID-induced gastropathy and enteropathy. Revista de Gastroenterología de México. 2020. № 85(2). P. 190-206. doi: https://doi.org/10.1016/j.rgmxen.2019.11.001.
- Hladkykh F.V., Stepanyuk N.H. New approaches to reduce ulcerogenity of nonsteroidal anti-infl ammatory drugs: achievements, unsolved issues and ways to optimize. Zaporozhye Medical Journal. 2014. № 2(83). P. 82-86. (In Ukrainian). http://zmj.zsmu.edu.ua/article/viewFile/25437/22932
- Amelin A.V., Afanasiev V.V., Starikov P.V. et al. Protocol of the Council of Experts of the North-West Federal District of the Russian Federation on the rational approach in the treatment of pain syndrome and inflammation in neurology. Medical advice. 2015. № 7. P. 51-52. doi: http://dx.doi.org/10.21518/2079-701X-2015-7-51-53 (in Russian).
- Hladkykh F.V. Multimodal Analgesia: Polypharmacy in Pain Relief or Rational Use of Non-Steroidal Anti-Inflammatory Drugs to Prevent Pain Chronicity. Path of Science. 2020. № 6(7). P. 4008-4018. doi: https://doi.org/10.22178/pos.60-5.
- Lesnaya O.A., Rusanova E.I., Prokofieva E.B., Freire da Silva T. Rational use of nsaids according to clinical guidelines and data from recent studies. Difficult patient. 2019. № 17(10). P. 31-34. doi: https://doi.org/10.24411/2074-1995-2019-10072 (in Russian).
- Blackler R.W., Gemici B., Manko A., Wallace J.L. NSAID-gastroenteropathy: new aspects of pathogenesis and prevention. Curr. Opin. Pharmacol. 2014. № 19. P. 11-16. doi: https://doi.org/10.1016/j.coph.2014.05.008.
- Popov O.S. Pharmacological study of the combined nonsteroidal anti-inflammatory drug “Diclocor”: Ph.D Dissertation: Specialty “14.03.05 — Pharmacology”. National University of Pharmacy. 2017. 252 р. (In Ukrainian).
- Kursov S.V., Nikonov V.V. Cyclooxygenase: Physilogical Effects, Inhibitors Action and Perspectives of Paracetamol Usage. Emergency medicine. 2016. № 5(76). P. 27-35. doi: https://doi.org/10.22141/2224-0586.5.76.2016.76430.
- Karateev A.E., Uspensky Yu.P., Pakhomova I.G., Nasonov E.L. A short course in the history of NSAIDs. Scientific and practical rheumatology. 2012. № 52(3). P. 101-116.
- Lazebnik L.B., Belova G.V. Systemtizing classification of multifocal lesions of the mucosa of the digestive tract by non-steroidal anti-inflammatory and antitrombotic drugs (“Moscow classification”). Experimental and Clinical Gastroenterology. 2018. № 3. P. 19-27. (in Russian).
- Maev I.V., Andreev D.N., Dicheva D.T. Gastropathy, induced by non-steroidal anti-inflammatory drugs: pathogenetically grounded approaches to prevention and therapy. Pharmatec. 2016. № 2. P. 49-54. (in Russian). https://www.pharmateca.ru/ru/archive/article/32547
- Barinov E., Sulaieva O., Lyakch Y., Guryanov V., Kondratenko P., Radenko Y. Platelet aggregation measurement for assessment of hemostasis failure mechanisms in patients with gastroduodenal ulcer bleeding. Clin. Exp. Gastroenterol. 2013. № 6. P. 139-148. doi: https://doi.org/10.2147/CEG.S45685 (in Russian).
- Balukova E.V. NSAID-induced gastropathy: from an understanding of the mechanisms of development to the development of a strategy of prevention and treatment. Russian medical journal. 2017. № 10. P. 697-702. (in Russian).
- Jarosz M., Szkaradek N., Marona H., Nowak G., Młyniec K., Librowski T. Received: Evaluation of anti-inflammatory and ulcerogenic potential of zinc-ibuprofen and zinc-naproxen complexes in rats. Inflammopharmacol. 2017. 2017. № 25(6). P. 653-663. doi: http://doi.org/10.1007/s10787-017-0361-0.
- Lim Y.J., Lee J.S., Ku Y.S., Hahm K.B. Rescue strategies against non-steroidal anti-inflammatory drug-induced gastroduodenal damage. J. Gastroenterol. Hepatol. 2009. № 24. P. 1169-1178.
- Musumba C., Pritchard D.M., Pirmohamed M. Review article: cellular and molecular mechanisms of NSAID-induced peptic ulcers. Aliment. Pharmacol. Ther. 2009. № 30. P. 517-531. doi: http://doi.org/10.1111/j.1365-2036.2009.04086.x.
- Wallace J.L. Prostaglandins, NSAIDs, and gastric mucosal protection: why doesn’t the stomach digest itself? Physiol. Rev. 2008. № 88. P. 1547-1565. doi: http://doi.org/10.1152/physrev.00004.2008.
- Balabantseva A.P., Klyaritskaya I.L., Tsapyak T.A., Grigorenko E.I. Modern approaches to the primary prevention of NSAID-induced gastropathy and enteropathy. Crimean therapeutic journal. 2015. № 3. P. 31-38. (in Russian).
- Avramenko A.A., Gozhenko A.I., Goydyk V.S. Peptic ulcer disease (essays on clinical pathophysiology). Odessа, 2008. 304 p. (in Russian).
- Czimmerman Ya.S. Gastroenterology (Specialist Library: Gastroenterology, Therapy). Leadership. Moscow, 2012. 800 p. (in Russian).
- Podpletnyaya E.A., Mamchur V.I. Mechanisms of gastroduodenotoxicity of non-steroidal anti-inflammatory drugs. Journal of the Academy of Medical Sciences of Ukraine. 2005. № 1. P. 47-62. (in Russian).
- Uspensky Yu.P., Baryshnikova N.V., Orlov O.Yu., Alexandrova Yu.A. NSAID-associated pathology of the gastrointestinal tract: the choice of the drug, the tactics of patient management. Reference book of the polyclinic doctor. 2014. № 8. P. 42-47. (in Russian). https://elibrary.ru/item.asp?id=23418107
- Perez-Aisa A., Castro M., Munoz M. Risk of upper and lower gastrointestinal bleeding in patients taking nonsteroidal anti-inflammatory drugs, antiplatelet agents, or anticoagulants. Clin. Gastroenterol. Hepatol. 2015. № 13. P. 906-912. doi: https://doi.org/10.1016/j.cgh.2014.11.007.
- Sulaeva O.N., Wallace J.L. A new strategy of gastrointestinal protection with the use of gaseous mediators. Russian Journal of Gastroenterology, Hepatology, Coloproctology. 2016. № 3. P. 17-23. (in Russian). http://www.gastro-j.ru/article/832-h2-novaya-strategiya-gastrointestinalnoy-protektsii-s-ispolzovaniem-gazoobraznyih-mediatorov-h2-/show/full/
- Evseev M.A. Damage to the intestinal tube by non-steroidal anti-inflammatory drugs: clinical significance, pathogenesis, prevention possibilities. Neurology, neuropsychiatry, psychosomatics. 2013. № 1(2). P. 79-87. (in Russian).
- Bjarnason I., Takeuchi K. Intestinal permeability in the pathogenesis of NSAID-induced enteropathy. J. Gastroenterol. 2009. № 44. P. 23-29. doi: https://doi.org/10.1007/s00535-008-2266-6.
- Zayachkivska O., Bula N., Khyrivska D., Gavrilyuk E., Wallace J.L. Exposure to non-steroid anti-inflammatory drugs (NSAIDs) and suppressing hydrogen sulfide synthesis leads to altered structure and impaired function of the oesophagus and oesophagogastric junction. Inflammopharmacology. 2015. № 23(2–3). P. 91-99. doi: https://doi.org/10.1007/s10787-015-0230-7.
- Zayachkivska О.S., Bula N.S., Pavlovskiy Ya.I., Pshyk-Titko I.O., Gavriluk O.M., Grushka O.I., Wallace J.L. Effect of hydrogen sulfide-releasing aspirin on esophageal and gastric mucosa compromised by stress injury. Ukr. Biochem. J. 2017. № 89. P. 93-101. doi: https://doi.org/10.15407/ubj89.si01.093.
- Moroz E.V., Karateev A.E. Rebamipid: effective drug prevention of NSAID enteropathy is possible. Modern rheumatology. 2016. № 4. P. 97-105. (in Russian).
- Endo H., Sakai E., Kato T. et al. Small bowel injury in low-dose aspirin users. J. Gastroenterol. 2015. № 50. С. 378-386. doi: https://doi.org/10.1007/s00535-014-1028-x.
- Lipatova T.E. Modern strategy for the diagnosis and treatment of NSAID-induced enteropathy in elderly patients. Saratov Journal of Medical Scientific Research. 2015. № 11(1). P. 52-56. (in Russian).
- Maiden L. Capsule endoscopic diagnosis of nonsteroidal anti-inflammatory drug-induced enteropathy. J. Gastroenterol. 2009. № 44(19). P. 64-71.
- Klyaritskaya I.L., Balabantseva A.P., Fursova V.A. Enteropathies induced by intake of non-steroidal anti-inflammatory drugs. Crimean therapeutic journal. 2014. № 1. P. 38-44. (in Russian).
- Wallace J.L. NSAID gastropathy and enteropathy: distinct pathogenesis likely necessitates distinct prevention strategies. Br. J. Pharmacol. 2012. № 165(1). P. 67-74. doi: https://doi.org/10.1111/j.1476-5381.2011.01509.x.
- Golovanova E.V. Protection of the gastrointestinal mucosa from the damaging effects of non-steroidal anti-inflammatory drugs. Clinical gerontology. 2017. № 1–2. P. 47-51. (in Russian).
- Gubskaya O.Y., Kuzminets A.A. NSAID enterotoxicity: focus on the problem. Modern gastroenterology. 2018. № 5(103). P. 50-59. doi: http://doi.org/10.30978/MG-2018-5-50. (in Ukrainian).
- Wallace J.L. Mechanisms, prevention and clinical implications of nonsteroidal anti-inflammatory drug-eаnteropathy. World J. Gastroenterol. 2013. № 19. P. 1861-1876.
- Watanabe T., Higuchi K., Kobata A. et al. Nonsteroidal anti-inflammatory drug-induced small intestinal damage is Toll like receptor 4 dependent. Gut. 2008. № 57. P. 181-187.
- Tkach S., Onischuk L., Balabantseva A. Efficacy and safety of Rebamipide in prevention of NSAID-gastropathy. International Journal of Biomedicine. 2017. № 7(1). P. 57-59. doi: https://doi.org/10.21103/Article7(1)_ShC1.
- Zvyagintseva T.D., Chernobay A.I. Syndrome of bacterial overgrowth: modern approaches to treatment. Family medicine. 2013. № 4(48). P. 31-38. (in Russian).
- Plotnikova E.Yu. The relevance of antacids and alginates in the treatment of diseases of the digestive system. Therapist. 2015. № 2. P. 58-64. (in Russian). https://www.lvrach.ru/2015/02/15436163/
- Karateev A.E., Nasonov E.L., Radenska-Lopovok S.G. The effectiveness of bismuth tricalium dicitrate (“De-nol”) in gastropathies induced by non-steroidal anti-inflammatory drugs: an open controlled 4-week study. Gastroenterology is common. 2005. № 77(2). P. 46-49. (in Russian).
- Fomenko I.S. Influence of nonsteroidal anti-inflammatory drugs on indicators of NO and H2S systems in the mucous membrane of the colon. Bulletin of the Taras Shevchenko National University of Kyiv. 2015. № 18(1). P. 45-47. (in Russian).
- Lim Y.J., Yang C.H. Non-steroidal anti-inflammatory drug-induced enteropathy. Clin. Endosc. 2012. № 45. P. 138-144. doi: https://doi.org/10.5946/ce.2012.45.2.138.
- Chuan-Guo G., Wai K.L. Potential strategies in the prevention of nonsteroidal anti-inflammatory drugs-associated adverse effects in the lower gastrointestinal tract. Gut Liver. 2020. № 14(2). P. 179-189. doi: https://doi.org/10.5009/gnl19201.
- Dydykina I.S., Kovalenko P.S. Main aspects of prevention and treatment of NSAIDs gastropathy in the light of new ideology of the modern medicine. Therapy. 2019. № 1(27). P. 182-192. doi: https://dx.doi.org/10.18565/ (in Russian).
- Lazebnik L.B., Golovanova E.V., Alekseenko S.A. et al. Recommendations for the prevention and treatment of esophagogastro-entero-colopathy induced by nonsteroidal antiinfl ammatory drugs “NSAID”. Experimental and Clinical Gastroenterology. 2018. № 151(3). P. 4-18. (in Russian).
- Tomash O.V., Rudenko N.N., Yurenko E.A. Antisecretory therapy in real clinical practice: from habitual stereotypes to evidentiary standards. Ukrainian therapeutic journal. 2011. № 2. P. 103-114. (in Russian).
- Dikareva E.A. The influence of antisecretory therapy adherence on the risk of the development of gastropathy induced by the administration of nonsteroidal anti-inflammatory agents. Bulletin of Vitebsk state medical university. 2019. № 18(4). P. 60-66. doi: https://doi.org/10.22263/2312-4156.2019.4.60. (in Russian).
- Marlicz W., Loniewski I., Grimes D.S. et al. Nonsteroidal Anti-inflammatory Drugs, Proton Pump Inhibitors, and Gastrointestinal Injury: Contrasting Interactions in the Stomach and Small Intestine. Mayo Clin. Proc. 2014. № 89(12). P. 1699-1709. doi: http://dx.doi.org/10.1016/j.mayocp.2014.07.015.
- Karateev A.E. Modification of traditional NSAIDs as a method to improve their safety and ease of use. Russian medical journal. 2015. № 7. P. 392-396. (in Russian).
- Fornai M., Colucci R., Antonioli L. Effects of esomeprazole on healing of nonsteroidal anti-inflammatory drug (NSAID)-induced gastric ulcers in the presence of a continued NSAID treatment: Characterization of molecular mechanisms. Pharmacol Res. 2011. № 63(1). P. 59-67. doi: https://doi.org/10.1016/j.phrs.2010.10.013.
- Scheiman J., Hindley C. Strategies to optimize treatment with NSAIDs in patients at risk for gastrointestinal and cardiovascular adverse events. Clinical Therapeutics. 2010. № 32(4). P. 667-677. doi: https://doi.org/10.1016/j.clinthera.2010.04.009.
- Akhmedov V.A., Nozdryakov V.A. Current views on the safety of long-term therapy with proton pump inhibitors. Literature review. Russian medical journal. Gastroenterology. 2017. № 10. P. 765-767. (in Russian).
- Blackler R.W., Palma G.De., Manko A. et al. Deciphering the pathogenesis of NSAID enteropathy using proton pump inhibitors and a hydrogen sulfide-releasing NSAID. Am. J. Physiol. Gastrointest. Liver Physiol. 2015. № 308. P. 994-1003. doi: https://doi.org/10.1152/ajpgi.00066.2015.
- Hladkykh F.V. Preventive and therapeutic strategies for the pharmaco-correction of gastropathy induced by non-steroidal anti-inflammatory drugs. Reviews on clinical pharmacology and drug therapy. 2017. № 4. P. 14-23. doi: http://dx.doi.org/10.17816/RCF15414-23. (in Russian).
- Andersen J.T., Mastrogiannis D., Andersen N.L. et al. Diclofenac/misoprostol during early pregnancy and the risk of miscarriage: a Danish nationwide cohort study. Arch. Gynecol. Obstet. 2016. № 294(2). P. 245-250. doi: https://doi.org/10.1007/s00404-015-3966-9.
- Efimov A.L., Sigua B.V., Filaretova L.P. Acute ulcers and erosions of the gastrointestinal tract, induced by non-steroidal anti-inflammatory drugs: etiology, pathogenesis, therapeutic tactics. Bulletin of the Russian Military Medical Academy. 2017. № 1(57). P. 198-204. (in Russian). https://www.vmeda.org/wp-content/uploads/2017/04/vestnik1.17.pdf
- Satoh H., Takeuchi K. Management of NSAID/aspirin-induced small intestinal damage by GI-sparing NSAIDs, anti-ulcer drugs and food constituents. Current Medicinal Chemistry. 2012. № 19(1). P. 82-89.
- Motta J.P., Flannigan K.L., Agbor T.A. et al. Hydrogen sulfide protects from colitis and restores intestinal microbiota biofilm and mucus production. Inflamm. Bowel. Dis. 2015. № 21(5). P. 1006-1017. doi: https://doi.org/10.1097/MIB.0000000000000345.
- Magierowski M., Magierowska K., Kwiecien S., Brzozowski T. Gaseous mediator’s nitric oxide and hydrogen sulfide in the mechanism of gastrointestinal ntegrity, protection and ulcer healing. Molecules. 2015. № 20. P. 9099-123. doi: https://doi.org/10.3390/molecules20059099.
- Zanellato I., Bonarrigo I., Ravera M., Gabano E., Gust R., Osella D. The hexacarbonyldicobalt derivative of aspirin acts as a CO-releasing NSAID on malignant mesothelioma cells. Metallomics. 2013. № 5. P. 1604-1613. doi: https://doi.org/10.1039/c3mt00117b.
- Moncada S., Higgs E.A. The discovery of nitric oxide and its role in vascular biology. Br. J. Pharmacol. 2006. № 147(1). P. 193-201.
- Wallace J.L., Wang R. Hydrogen sulfide-based therapeutics: exploiting a unique but ubiquitous gasotransmitter. Nat. Rev. Drug. Discov. 2015. № 14. P. 329-345. doi: https://doi.org/10.1038/nrd4433.
- Wallace J.L., Caliendo G., Santagada V., Cirino G. Markedly reduced toxicity of a hydrogen sulphide-releasing derivative of naproxen (ATB‑346). Br. J. Pharmacol. 2010. № 159. P. 1236-1246. doi: https://doi.org/10.1111/j.1476-5381.2009.00611.x.
- Zanardo R.C., Brancaleone V., Distrutti E., Fiorucci S., Cirino G., Wallace J.L. Hydrogen sulfide is an endogenous modulator of leukocyte-mediated inflammation. Federation of American Societies for Experimental Biology J. 2006. № 20. P. 2118-2120.
- Gemici B., Elsheikh W., Feitosa K.B., Costa S.K., Muscara M.N., Wallace J.L. H2S-releasing drugs: anti-inflammatory, cytoprotective and chemopreventative potential. Nitric Oxide. 2015. № 46. P. 25-31. doi: https://doi.org/10.1016/j.niox.2014.11.010.
- Dillon C.T., Hambley T.W., Kennedy B.J. et al. Gastrointestinaltoxicity, antiinflammatory activity, and superoxide dismutaseactivity of copper and zinc complexes of the antiinflammatorydrug indomethacin. Chem. Res. Toxicol. 2003. № 16. P. 28-37. doi: https://doi.org/10.1021/tx020078o.
- Garg A., Shoeb A., Subramanya Moodahadu L., Sharma A., Gandhi A., Akku S. Amtolmetin: a reappraisal of NSAID with gastroprotection. Hindawi Publishing Corporation. Arthritis. 2016. Article ID 7103705:1-5. doi: https://doi.org/10.1155/2016/7103705.
- Shaikh Omar O.A., Bukhari H.M., El Sawy N.A. Efficacy of capsicum frutescens in curing the peptic ulcer. International Journal of Pure and Applied Sciences and Technology. 2013. № 15(1). P. 43-54.
- Hladkykh F.V. The characteristics of the mechanisms of anti-ulcerogenic action of vanilloid receptor agonists (TRPV1) on the model of gastropathy induced by acetylsalicylic acid. Pharmacy and pharmacology. 2017. № 5(3). P. 283-301. doi: http://dx.doi.org/10.19163/2307-9266-2017-5-3-283-301. (in Russian). http://www.pharmpharm.ru/jour/article/view/255.
- Mozsik G., Abdel-Salam O.M.E., Takeuchi K. Capsaicin — sensitive neural afferentation and the gastrointestinal tract: from bench to bedside. InTech, Croatia. 2014. doi: https://doi.org/10.5772/57289.
- Mozsik G. Capsaicin as a new orally applicable gastroprotective and therapeutic drug alone or in combination in human healthy subjects and in patients. Prog. Drug. Res. 2014. № 68. P. 209-258. doi: https://doi.org/10.1007/978-3-0348-0828-6_9.
- Hladkykh F.V., Stepanyuk N.H. Vinboron: The first Ukrainian gastroprotector — the vanilloid receptor agonist (TRPV1). Pharmacology and drug toxicology. 2016. № 4–5(50). P. 20-29. (in Ukrainian). http://pharmtox-j.org.ua/node/656
- Singh D.P., Borse S.P., Nivsarkar M. Co-administration of quercetin with pantoprazole sodium prevents NSAID-induced severe gastroenteropathic damage efficiently: Evidence from a preclinical study in rats. Exp. Toxicol. Pathol. 2017. № 69(1). P. 17-26. doi: https://doi.org/10.1016/j.etp.2016.10.004.
- Zupanets I.A., Shebeko S.K., Popov O.S., Shalamay A.S. Diclocor is superior to diclofenac sodium and quercetin in normalizing biochemical parameters in rats with collagen-induced ostheoarthritis. Inflammopharmacology. 2016. № 24(1). P. 53-57. doi: https://doi.org/10.1007/s10787-015-0258-8.
- Bulgakov S.A. Hexapeptide dalargin in clinical gastroenterology: 30 years of experience using the drug. Russian Journal of Gastroenterology, Hepatology, Coloproctology. 2016. № 3. P. 103-112. (in Russian).
- Ulyanina L.R., Il’in D.A., Karimova D.R. Experimental evaluation of gastroprotective activity of L-methionine and lithium L-methioninate on the model of indometacin gastric ulcer. Materials of the 88th All-Russian Scientific and Practical Conference of Students and Young Scientists, dedicated to the 200th anniversary of the Kazan State Medical University. 2014. 175. (in Russian).
- Xianfeng X., Kai F.C., Gerald Tsz Y.W. et al. Mesenchymal stem cells promote healing of nonsteroidal anti-inflammatory drug-related peptic ulcer through paracrine actions in pigs. Science Translational Medicine. 2019. № 11(516). P. 1-14. doi: https://doi.org/10.1126/scitranslmed.aat7455.
- Askarov M.B., Shumakov V.I., Onishchenko N.A. Multipotent mesenchymal stromal cells of autologous bone marrow accelerate the regeneration of long-term non-healing gastric ulcers. Bulletin of surgery. 2009. № 168(2). P. 22-26. (in Russian).
- Askarov M.B., Tsypin A.B., Trubitsyna I.E., Ivanov I.M., Onishchenko N.A. Reparative processes in long-term non-healing gastric ulcers in rats using bioregulatory peptides from the spleen tissue. Bulletin of Transplantology and Artificial Organs. 2008. № 3. P. 34-38. (in Russian).
- Lorents S.E., Zharikov A.Yu., Mazko O.N. et al. Influence of the peptide complex from pork kidneys tissues on indicators of free radical oxidation and the expression of COX-1,2 in experimental gastropathy. Experimental and Clinical Gastroenterology. 2018. № 154(6). P. 81-85. (in Russian).
- Gulevsky A.K., Abakumova E.U., Moiseeva N.N., Dolgikh O.L. Influence of cord blood fraction (up to 5 kDa) of cattle on biochemical parameters of blood in experimental subchronic gastric ulcer in rats. Ukrainian Biochemical Journal. 2008. № 80(2). P. 120-127.
- Gromova O.A., Torshin I.Yu., Dibrova E.A., Karimova I.M., Gilels A.V., Kustova E.V. World-wide experience of the use of placental extracts: results of clinical and experimental studies. Review. Plastic Surgery and Cosmetology. 2011. № 3. P. 385-576.
- Takagi K., Okabe S., Saziki R. A new method for the production of chronic gastric ulcer in rats and the effect of several drugs on its healing. Jpn. J. Pharmacol. 1969. № 19(3). P. 418-426. doi: http://doi.org/10.1254/jjp.19.418.
- Goltsev A.N., Yurchenko T.N., Blazhko E.V. et al. Placenta: cryopreservation, clinical use. Ed. by acad. NAS of Ukraine Goltseva A.N. Kharkov, 2013. 268 p. (in Russian).
- Pan S.Y., Chan M.K.S., Wong M.B.F., Klokol D., Chernykh V. Placental therapy: An insight to their biological and therapeutic properties. Journal of Medicine and Therapeutics. 2017. № 1(3). P. 1-6. doi: http://doi.org/10.15761/JMT.1000118.
- Gulida M.O., Miroshnichenko E.B., Birch N.I., Hot E.B. The use of placenta extract in the complex treatment of patients with rheumatoid arthritis. Experimental and clinical medicine. 2014. № 1(62). P. 168-171. (in Russian).
- Kapustyanska A.A. The use of the drug “Cryocell-cryoextract of the placenta” in the complex treatment of exacerbation of gouty arthritis with metabolic arthritis. Current problems of modern medicine: Bulletin of the Ukrainian Medical and Dental Academy. 2010. № 10; 2(30). P. 54-58. (in Ukrainian).
- Nasadyuk H.M. Biochemical characteristics and approaches to the use of placental extracts in medical practice. With care for the woman. 2013. № 4(43). P. 54-56. (in Ukrainian).
- Rozanova S.L., Naumenko E.I., Rozanova E.D., Nardid O.A. Changes in antioxidant properties of human placenta extracts after freezing. Cryobiology problems. 2010. № 20(3). P. 288-295. (in Russian).
- Shepitko K.V. Application of cryopreserved placenta preparations in the small intestine pathologies in rats for their further use in exigent conditions. Bulletin of problems biology and medicine. 2019. № 4(154). P. 56-61. doi: http://doi.org/10.29254/2077-4214-2019-4-2-154-56-61.
- Shevchenko N.O., Somova K.V., Volina V.V., Prokopyuk V.Yu., Prokopyuk O.S. Dynamics of activity and duration of functioning of cryopreserved cryoextract, cells and fragments of the placenta in the body of experimental animals. Morphology. 2016. № 10(2). P. 93-98. (in Ukrainian).

/81.jpg)
/82.jpg)
/85.jpg)