До індукторів (лат. inducere — збільшувати, посилювати) апоптозу відносять фактор некрозу пухлини альфа (TNF-α) — позаклітинний білок, багатофункціональний прозапальний цитокін, що утворюється переважно моноцитами і макрофагами. Відомо, що TNF-α здатний запускати каскад синтезу прозапальних цитокінів ІЛ-1, -6, -8, інтерферон-γ (ІФН-γ), а також викликати експресію молекул адгезії на поверхні ендотеліальних клітин, активувати лейкоцити, брати участь у регуляції апоптозу. При вивченні особливостей зміни експресії членів суперродини TNF-α було встановлено, що внаслідок гіпоксії ЦНС значно посилюється експресія TRAIL ліганда (англ. TNF-related apoptosis-inducing ligand — цитокін суперродини факторів некрозу пухлини, ліганд, що викликає апоптоз) на клітинах мікроглії. Це супроводжується підвищенням вмісту TNF-α в крові [32].
Збільшення концентрації TNF-α в пуповинній крові може бути раннім діагностичним маркером гіпоксичних змін в організмі новонародженої дитини [8].
Установлено, що в доношених новонароджених дітей із гіпоксично-ішемічним ушкодженням ЦНС рівень TNF-α в лікворі вищий (14,7 пг/мл), ніж у конт-рольній групі (0,16 пг/мл) [47].
До індукторів апоптозу можна також віднести й молекулу міжклітинної адгезії 1-го типу (ICAM-1, від англ. Intercellular adhesion molecule type 1), що забезпечує міцне прилипання лейкоцитів до ендотелію.
Молекули міжклітинної адгезії — це пов’язані з плазматичною мембраною білки, які забезпечують механічну взаємодію клітин одна з одною. Часто це молекули, які пронизують мембрану і приєднані до цитоскелета. За допомогою них клітини при русі можуть «підтягуватися» до інших клітин або переміщатися по позаклітинному матриксу. У багатьох випадках окрема молекула міжклітинної адгезії здатна взаємодіяти не з одним, а з декількома лігандами, для чого існують різні ділянки зв’язування. Хоча зв’язування індивідуальних молекул адгезії зі своїми лігандами зазвичай відбувається з низькою авідністю, взаємодія може бути досить високою, тому що молекули адгезії розташовані на поверхні клітин кластерами й утворюють ділянки міцного зв’язування [5, 54].
Найбільш вивчені Р- і Е-селектини, які беруть участь у першій стадії міграції лейкоцитів із судинного русла у вогнище запалення — «ролінгу» уздовж судинного ендотелію; молекула адгезії судинного ендотелію 1-го типу (VCAM-1, від англ. vascular cell adhesion molecule type 1) і молекула міжклітинної адгезії 1-го типу (ICAM-1 від англ. intercellular adhesion molecule type 1), що забезпечують міцне прилипання лейкоцитів до ендотелію; під впливом тромбоцитарно-ендотеліальної молекули клітинної адгезії 1-го типу (PECAM-1 від англ. platelate-endothelial cell adhesion molecule) здійснюється міграція лейкоцитів із судин через міжклітинні переходи ендотеліальних клітин в інші тканини. Також добре вивчені інтегрини, що забезпечують передачу внутрішньоклітинних і міжклітинних сигналів.
Усі молекули міжклітинної адгезії можна поділити на п’ять структурних родин:
1. Інтегрини — гетеродимерні молекули, що функціонують як клітинно-субстратні, так і міжклітинні адгезивні рецептори.
2. Адгезивні рецептори суперродини імуноглобулінів, які беруть участь у міжклітинній адгезії й особливо важливі в ембріогенезі, загоєнні ран та імунній відповіді.
3. Селектин — адгезивні молекули, лектиноподібний домен яких забезпечує адгезію лейкоцитів до ендотеліальних клітин.
4. Кадгерини — залежні від кальцію гомофільні міжклітинні адгезивні білки.
5. Хомінгові рецептори — молекули, що забезпечують потрапляння лімфоцитів у специфічну лімфоїдну тканину.
Підвищення адгезивності має велике значення в патогенезі дисфункції ендотелію при запаленні, септичному шоці й інших патологічних процесах [2, 5].
ICAM-1 (CD54) належать до суперродини імуноглобулінів. У фізіологічних умовах ендотеліальні клітини практично не експресують ICAM-1. ICAM-1 погано виявляється на «спочиваючому» ендотелії. Індукторами експресії даних молекул є вільні радикали, оксид азоту (NO), ліпополісахариди, прозапальні цитокіни (інтерлейкіни-1, -6 і -8, фактор некрозу пухлини α, інтерферон γ та ін.), лейкотрієни, гістамін, тромбін та інші медіатори [44, 52].
Крім ендотеліальних клітин, ICAM-1 експресують лімфоцити, моноцити, клітини бронхоальвеолярного епітелію. Лігандами для цієї молекули на мембранах лейкоцитів слугують інтегрини: для ICAM-1 — LFA-1 (англ. Lymphocyte function associated antigen 1) і MAC-1 (англ. Macrophage-1) [45].
У сироватці крові можна виявити розчинні форми цієї молекули (sICAM-1), які утворюються внаслідок шедінгу (лущення), опосередкованого протеолітичними ферментами: нейтрофільною еластазою, ADAM17 (adisintegrin and metaloproteinase domain 17), TNF-α (tumor necrosis factor alpha) [36].
Розчинна форма молекули міжклітинної адгезії 1 (sICAM-1) ICAM-1 або CD54 становить собою одноланцюговий глікопротеїн із молекулярною масою 55 kDa. Це інтегральний мембранний білок, що містить п’ять Ig-подібних позаклітинних доменів. Ген, що кодує ICAM-1, локалізований на 19-й хромосомі.
Дані отриманих досліджень дають змогу зробити висновок, що розчинні фракції молекул клітинної адгезії можна розглядати як потенційні біомаркери ендотеліальної активації [27].
Оцінці вмісту ICAM-1 при сепсисі присвячено багато досліджень. Основну увагу приділено можливості використання отриманих даних для диференціальної діагностики сепсису й інших критичних станів, що супроводжуються розвитком системної запальної відповіді [43], а також для прогнозування ускладнень та наслідків захворювання, зокрема й ушкодження ЦНС у новонароджених.
За даними J. Edgar та ін., C.A. Hill в дітей із сепсисом, зокрема в новонароджених, рівень sICAM-1 вже з першого дня вищий, ніж у здорових однолітків або дітей із гострими запальними процесами без сепсису [24].
Водночас у дослідженні I. Bavunoglu та співавторів повідомляють, що хоча рівень цих біомаркерів у дітей першого року життя із сепсисом вищий, ніж у здорових однолітків, проте він не корелює з тяжкістю сепсису [15].
У багатьох наукових працях визначено роль асептичного запалення в розвитку гіпоксично-ішемічного ушкодження центральної нервової системи в новонароджених дітей. Проте останнім часом увагу дослідників привертає вивчення різних аспектів впливу системної фетальної запальної відповіді на виникнення інтранатальної асфіксії і розвиток гіпоксично-ішемічного ушкодження головного мозку. Дані про залучення системної фетальної запальної відповіді у формуванні церебрального паралічу вперше наведені B.H. Yoon та ін., які при обстеженні 123 дітей віком 3 роки, народжених недоношеними, виявили високу ймовірність розвитку церебрального паралічу при наявності фунікуліту (запалення пупкового канатика) і підвищення вмісту ІЛ-6 в амніотичній рідині [53]. R. Covert та ін. встановили позитивний кореляційний зв’язок між фунікулітом і таламостріальною васкулопатією в новонароджених [21].
При дослідженні вмісту маркерів системної фетальної запальної відповіді і ендотеліальної дисфункції в пуповинній крові в доношених новонароджених, які перенесли інтранатальну асфіксію, і здорових новонароджених було виявлено прямий кореляційний зв’язок між наявністю запальних змін у плаценті і кількісним рівнем вмісту молекули міжклітинної адгезії 1 (sICAM-1) у крові. До того ж вміст антигена в сироватці крові здорових доношених дітей становив у середньому 18 проти 40 нг/мл відповідно. Крім того, було встановлено, що оцінка за шкалою Апгар мала негативний кореляційний зв’язок із рівнем sICAM-1 (r = –0,796, p = 0,013 і r = –0,904, p = 0,002 на 1-й і 5-й хв відповідно). Отже, авторами було зроблено висновок, що системна фетальна запальна відповідь і пов’язана з нею ендотеліальна дисфункція можуть створювати передумови для розвитку гіпоксично-ішемічної енцефалопатії [46].
Після перенесеної гіпоксії-ішемії і запуску нейрозапальних реакцій спостерігається зменшення активності нейротрофічних факторів. Це викликає пригнічення процесів нейрогенезу. Репаративні можливості незрілої ЦНС можуть залежати як від кількості, так й активності нейротрофічних факторів росту. Зниження продукції разом із пригніченням активності цих факторів робить значний внесок у розвиток патогенетичних змін перинатального гіпоксично-ішемічного ушкодження головного мозку. Причому недостатність нейротрофічних факторів може підтримувати патологічні зміни в ЦНС кілька тижнів і бути причиною розвитку віддалених наслідків [22, 31].
Відомо кілька трофічних факторів, що мають велике значення в патогенезі гіпоксично-ішемічного ушкодження. Найчастіше називають VЕGF (англ. Vascular endothelial growth factor — фактор росту ендотелію судин) — сигнальний білок, що виробляється клітинами для стимулювання васкулогенезу (утворення ембріональної судинної системи) й ангіогенезу (ріст нових судин в уже наявній судинній системі), ВDNF (англ. Brain-Uderived neurotrophic factor — мозковий нейротрофічний фактор) — білок, що належить до нейротрофінів, речовин, які стимулюють і підтримують розвиток нейронів, і CNTF (англ. Ciliary neurotrophic factor) — білок, що за функціями належить до факторів росту, білків розвитку, задіяний у таких біологічних процесах, як диференціація клітін, нейрогенез.
Основна роль зазначених вище факторів у ЦНС полягає в регуляції функціональної активності клітин нейрональної й астрогліальної природи. Вони забезпечують особливості нейроастрогліальної взаємодії і трофіку нейронів. Доведено їх стимулюючий вплив на міграцію прогеніторних клітин, а також на процеси диференціювання і дозрівання нейронів й астроглії [6].
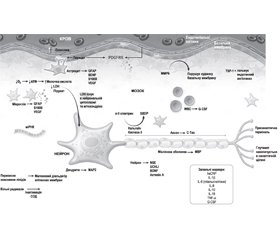
На основі сучасних патогенетичних даних ГІУ ЦНС дослідники намагаються визначити ранні діагностичні маркери ушкодження головного мозку, зокрема в новонароджених (рис. 3).
У цьому аспекті найбільш перспективним є вивчення рівня нейроспецифічних білків (НСБ) й антитіл до них.
Вміст нейроспецифічних білків у біологічних зразках (кров, ліквор) може залежати від характеру і тяжкості ушкодження ЦНС, гестаційного віку, ступеня зрілості новонародженого, наявності супутньої інфекційної і неінфекційної патології [10].
У дослідженні Н. Van Laerhoven, T.R. de Haan, М. Offringa та ін., проведеному у 2013 р., оцінювалися маркери пуповинної крові: нейронспецифічна єнолаза (Neuron-specific enolase — NSE); білок S100; гліофібрилярний кислий білок (Glial fibrillary acidic protein — GFAP), що відповідає за стабільність і міцність гліальних й ендотеліальних клітин мозку; ген, що кодує фермент, пов’язаний із ростом і розвитком нейронів — убіквітин-С-термінальна гідролаза L-1 (Ubiquitin C-terminal hydrolase L1, UCHL1); білок відповідальний за синтез мікротрубочок аксонів — білок Tау; мікроРНК, лактатдегідрогеназа і креатинфосфокіназа ВВ [49]. Саме GFAP і UCHL1 показали кращий результат як біомаркери прогнозування довгострокових неврологічних результатів.
У 2015 р. у США H. Lv, Q. Wang, S. Wu та ін. проводили дослідження, що визначило прогностичну значимість концентрації UCHL1 і GFAP у пуповинній крові новонароджених, які перенесли ГІУ ЦНС [38].
Найбільшої уваги заслуговує опублікований у 2012 р. результат метааналізу 29 досліджень, у яких проводилася оцінка 11 прогностичних факторів у дітей із ГІУ ЦНС старше 18 міс. [20].
Варто відзначити, що НСБ тканинноспецифічні для нервової системи і гістологічно належать до нейроепітеліальної тканини — нейронам і глії, тобто є нейромаркерами.
Вивільнені в результаті того чи іншого патологічного процесу в малих концентраціях, вони є сильними імуногенами, здатними при попаданні в кровоносне русло ініціювати розвиток процесів нейросенсибілізації, продукцію протимозкових антитіл або імунних комплексів, які підсилюють процеси ушкодження мозку ще до появи видимих структурних порушень [4, 26, 37, 41].
Внаслідок того, що гематоенцефалічний бар’єр (ГЕБ) починає формуватися на ранніх стадіях внутрішньоутробного розвитку паралельно з ростом і диференціюванням тканин мозку, значна частина антигенних детермінантів (передусім нейроспецифічних протеїнів) стає прихованою від контролю імунної системи, що розвивається [3, 6, 12].
У зв’язку з цим переважна більшість НСБ так чи інакше мають властивості автоантигенів, а їх контакт з імунокомпетентними клітинами за межами ГЕБ у низці випадків супроводжується утворенням автоантитіл до НСБ (ААТ до НСБ). Протимозкові антитіла, які циркулюють у крові і які належать до класу IgG, здатні як ушкоджувати ГЕБ, так і, проникаючи через ГЕБ в мозок, викликати вторинне нейроімунне ушкодження його клітин [7, 11, 12].
Походження нейромаркерів
1. Нейроцитарні:
— Нейронспецифічна єнолаза (NSE).
— Убіквітин-С-термінальна гідролаза L-1 (Ubiqitin С-terminal Hydrolase L1 — UCHL-1).
— Фосфорильований тяжкий ланцюг аксонального нейрофіламенту (Phosphorylated axonal neurofi lament heavy chain — pNF-H).
— Тау-протеїн (Tau-protein).
— Креатинкіназа BB (КК-ВВ)*.
2. Гліальні:
— Протеїн S100B (Protein S100B).
— Основний білок мієліну (Myelin basike protein — BPM).
— Креатинкіназа ВВ (КК-ВВ)*.
— Гліальний фібрилярний кислий протеїн (GFAP).
Гліальний фібрилярний кислий протеїн (GFAP) належить до проміжних філаментів цитоскелета і характерний для астроцитів, більшою мірою фібрилярних, відомий ще як астроцитспецифічний церебропротеїн (астропротеїн).
У зрілої нервової тканини гістоімунохімічними методами GFAP виявляється всередині мікрофіламентів протоплазматичних астроцитів сірої речовини й у фіброзних астроцитах білої речовини. Велика кількість антигена міститься також у субепендимальних астроцитах у перивентрикулярних ділянках. Крім того, НСБ був виявлений у незначній кількості в епіфізі, нейрогіпофізі й незрілих олігодендрогліоцитах [1, 6, 11, 12].
Виявлення надмірної кількості GFAP у крові вказує на ушкодження астроцитарних клітин [7, 11, 50].
GFAP використовують для діагностики церебрального інсульту. Під час експериментальних досліджень було встановлено, що ушкодження тканини головного мозку призводило до різкого підвищення сироваткової концентрації даного НСБ. А при морфологічному дослідженні — посилення проліферації астроцитів і підвищення синтезу ними GFAP [1, 11, 18].
У неврологічно здорових новонароджених рівень GFAP у пуповинній крові, за даними С. Ennen, підвищується до 0,2 нг/мл. У дітей із перинатальним ушкодженням головного мозку він перевищує 0,2 нг/мл. Також виявлена прогностична роль: медіана рівня GFAP у групі дітей із летальним результатом становить 0,61 нг/мл;
у групі дітей, які мають бульбарні розлади при виписці, — 0,26 ± 0,10 нг/мл; у дітей, які вигодовуються через соску, — 0,04 ± 0,06 нг/мл [25].
В іншому дослідженні встановлено, що середнє значення рівня GFAP у групі новонароджених із гіпоксично-ішемічним ушкодженням головного мозку статистично значно перевищує середнє значення в групі здорових новонароджених (0,032 ± 0,150) і становить 0,362 ± 0,150 нг/мл [9].
Дослідження М. Blennow [16] також підтверджують підвищення рівня GFAP у дітей із перенесеною асфіксією порівняно з контрольною групою, а також кореляцію з тяжкістю ураження мозку.
За даними дослідження A. Stewart та ін., у недоношених новонароджених, які перенесли асфіксію, і незрілих малюків без асфіксії рівень GFAP у лікворі був однаковий (до 0,7 і 0,56 нг/мл відповідно), але після 1-го дня життя рівень у групі недоношених із формуванням перивентрикулярної лейкомаляції був значно вищим (до 1,03 нг/мл) порівняно з контрольною групою (до 0,06 нг/мл) [48].
У низці досліджень було продемонстровано, що постійний моніторинг GFAP може бути використаний як об’єктивний критерій для контролю перебігу постгіпоксичних ушкоджень ЦНС у новонароджених дітей й оцінки ефективності проведеної терапії [7, 11, 12].
При дослідженні рівні GFAP у крові новонароджених дітей із гіпоксично-ішемічними ушкодженнями ЦНС було встановлено, що найбільш інформативним є динамічне дослідження рівнів НСБ у сироватці крові. При пролонгованому спостереженні було виявлено, що концентрація GFAP у крові корелює з тяжкістю ушкодження ЦНС, а тривале збереження високих показників GFAP у сироватці крові свідчить про несприятливий неврологічний прогноз. Протягом першого місяця життя відбувається поступове зниження рівня цього білка в крові. Водночас у дітей із геморагічними ураженнями вже з перших годин життя рівень білка в крові був значно вищим, ніж у дітей з ішемічними ураженнями головного мозку [1, 11].
Таким чином, автори зауважують, що збільшення значень GFAP у сироватці крові новонароджених слід розглядати як маркер тяжкості церебральної ішемії.
Убіквітин-карбоксил-термінальна гідролаза L1 (UCHL-1) — один із ферментів деубіквітинізуючої системи, що бере участь у регуляції внутрішньоклітинних білків шляхом відщеплення сигнального протеїну убіквітину.
Убіквітин (від англ. Ubiquitous — «всюдисущий») — невеликий (8,5 кДа) консервативний білок еукаріот, що бере участь у регуляції процесів внутрішньоклітинної деградації білків, а також у модифікації їх функцій. Він наявний майже у всіх тканинах багатоклітинних еукаріотів, а також в одноклітинних еукаріотичних організмах. Убіквітин був відкритий у 1975 році Г. Голдштейном та ін. [29] й охарактеризований у 70–80-х роках XX століття [51]. У геномі людини є чотири гени, що кодують убіквітин: UBB, UBC , UBA52 і RPS27A [35].
Убіквітинування — це приєднання ферментами убіквітинлігазами одного або декількох мономерів убіквітину. Приєднання убіквітину може мати різний вплив на білки-мішені: впливає на внутрішньоклітинну локалізацію, їх активність, сприяє або перешкоджає білок-білковим взаємодіям [28, 42]. Однак першою відкритою функцією убіквітину стала протеолітична деградація білків, позначених поліубіквітиновими ланцюгами. Убіквітин регулює і такі важливі процеси, як проліферація, розвиток і диференціювання клітин, реакція на стрес і патогени, репарація ДНК.
У 2004 році А. Чехановер, А. Гершко і І. Роуз були відзначені Нобелівською премією з хімії «За відкриття убіквітин-опосередкованої деградації білка».
Убіквітин-С-термінальна гідролаза L1 (UCHL1) — нейронспецифічний білок, необхідний для функції нейронів, інактивується реактивними ліпідами, що утворюються після церебральної ішемії. Проведене дослідження встановило, що циклопентенонові простагландини (молекули жирних кислот), що вивільняються в нервових клітинах після інсульту, зв’язуються з UCHL1 і порушують його роботу. У цьому дослідженні з’ясували, що мозковий білок UCHL1 має основне значення для відновлення нервових клітин, ушкоджених внаслідок інсульту [30].
У роботах L.F. Chalak та ін., M. Douglas-Escobar та ін., A.N. Massaro та ін. було досліджено зміну рівня UCH-L1 у новонароджених. При розвитку ГІУ ЦНС рівень UCH-L1 підвищується в перші 72 години життя порівняно з контрольною групою (2,1 ± 1,3 нг/мл), досягаючи в пацієнтів із летальним наслідком 10,8 нг/мл
у перші 6 год життя і 87–170 нг/мл у віці старше 6 год життя. Рівень UCH-L1 корелює з тяжкістю неонатального ушкодження головного мозку, а також має прогностичну цінність неврологічних наслідків (медіана 1,88 нг/мл при нормальному результаті і 2,38 нг/мл — при несприятливому). У динаміці при тяжкій і середньотяжкій ГІУ ЦНС рівень UCH-L1 знижується (медіана 2,6 нг/мл при народженні і 0,5 нг/мл на 84–96-ту год життя), на відміну від легкого ступеня ГІУ ЦНС, коли така динаміка не відзначається (1,3 нг/мл при народженні і 0,9 нг/мл на 84–96-й год життя) [19, 23, 39].
A.N. Massaro з групою дослідників завершили клінічну роботу з оцінки плазмових рівнів специфічних для головного мозку білків і цитокінів як маркерів ушкодження головного мозку в новорождених із гіпоксично-ішемічною енцефалопатією, а також ефекту, отриманого від терапії еритропоетином. Аналіз отриманих результатів продемонстрував, що в 50 новонароджених із ГІУ ЦНС підвищені вихідні рівні S100B, білка Тау, UCH-L1, ІЛ-1β, -6, -8, -10, -13, ФНП і ІФН-γ в крові в перші 24 години життя були асоційовані зі збільшенням ступеня тяжкості ушкодження головного мозку, виявленого за допомогою МРТ [40].
Основний білок мієліну (ОБМ — myelin basiс protein (MBP)) — один із білків мієлінової оболонки ЦНС. Мієлін характеризується високим вмістом протеїнів (25–30 %), що складаються з 342 різних білків. У людини виявлені 3 ізоформи цього білка з молекулярною масою 17,5; 18,5 і 21,5 кДа.
У формуванні та підтримці мієлінового шару бере участь олігодедроглія, на підставі цього ОБМ відносять до гліальних маркерів. При фокальному інфаркті мозку ОБМ може слугувати маркером субкортикального ураження ЦНС. Рівень ОБМ у крові підвищується при внутрішньочерепних крововиливах, ішемічному інсульті, травмах [21].
Застосування MBP як маркера ушкодження мієлінізованих волокон, з яких в основному складається біла речовина головного мозку, відкрило значні перспективи в клінічних та експериментальних сферах [1, 17, 50].
Дозрівання олігодендроглії починається з проліферації спонгіобластів (стовбурових клітин). Вони здатні трансформуватися як в астробласти, диференціювання яких починається дещо раніше, так і в олігодендрогліо-бласти [50].
Олігодендрогліобласти в результаті останнього мітотичного поділу утворюють «світлі олігодендрогліоцити». Ці клітини отримали свою назву за ступенем забарвлення в препаратах. Вони є незрілими, термін їх життя малий (близько двох тижнів). Надалі вони перетворюються в проміжні (за ступенем забарвлення й електронної щільності) олігодендрогліоцити. І тільки останні дають початок зрілим олігодендрогліоцитам [6, 50].
У ділянках активної мієлінізації відзначають наявність великої кількості світлих олігодендрогліоцитів, тому прийнято вважати, що саме вони відіграють основну роль у процесі мієлінізації, завершуючи його до моменту досягнення стадії проміжної зрілості. На кінцевому етапі формування темних клітин їх тонкі відростки залишаються з’єднаними з мієліновими оболонками, беручи участь у підтримці їх цілісності. Дослідження олігодендрогліобластів, проведені з використанням тимідину, міченого тритієм [50], показали, що ці клітини (інколи навіть після завершення росту) здатні мітотично ділитися й утворювати світлі клітини, які в подальшому проходять всі стадії дозрівання. І оскільки цей феномен повторюється протягом усього життя, можна припустити, що популяції олігодендрогліоцитів мають здатність до самовідновлення. Проліферація мієлінутворюючих клітин відбувається нерівномірно протягом постнатального розвитку. Близько половини з їх популяції піддається запрограмованому (фізіологічному) апоптозу [6]. Досягаючи місця свого остаточного розташування, олігодендрогліобласти втрачають здатність до проліферації і набувають своїх типових характеристик [6, 13].
Як маркер стану білої речовини в ЦНС можна відзначити низку робіт, пов’язаних із дослідженням МБР при ішемічних та геморагічних ушкоденнях головного мозку, зокрема і в новонароджених дітей [7, 11, 34, 50].
При дослідженні вмісту МБР у сироватці крові новонароджених дітей різного гестаційного віку був виявлений прямий кореляційний зв’язок між ступенем недоношеності, тяжкістю перинатального ушкодження ЦНС і рівнем МБР у сироватці крові [11]. До того ж вміст антигену в сироватці крові здорових доношених дітей становив у середньому 1,8 ± 1,6 нг/мл і не змінювався протягом усього періоду спостережень (до 6 місяців життя). У недоношених дітей із перинатальними гіпоксичними ушкодженнями ЦНС відзначено поступове підвищення сироваткових рівнів МБР із максимальними значеннями у віці 3 тижнів життя і подальшим їх зниженням [11].
У зв’язку з цим було виконано низку досліджень щодо вивчення морфологічних і гістоімунохімічних показників при перинатальному ушкодженні ЦНС. Проводили морфометричне й імуногістохімічне зіставлення зразків тканин, отриманих з ушкоджених й інтактних ділянок головного мозку новонароджених із перивентрикулярною лейкомаляцією. Дослідження олігодендрогліоцитів здійснювали з використанням моноклональних антитіл до МВР. Авторами було встановлено вірогідне зменшення порівняно з контролем кількості МВР позитивних олігодендрогліоцитів у пошкоджених ділянках головного мозку, що відповідало гіпомієлінізації [33].
Дослідженню перивентрикулярних ділянок головного мозку при гіпоксично-ішемічних ушкодженнях присвячені роботи S.A. Back та ін. Дані отримані в результаті імуногістохімічних досліджень із використанням маркерів олігодендрогліоцитів, що перебували на різних стадіях дозрівання. Об’єктом вивчення стали зразки тканин головного мозку плодів від 18 до 41 тижня гестації, які зазнали впливу хронічної внутрішньоутробної гіпоксії. Було з’ясовано, що найбільш чутливою мішенню для зазначеного вище фактора є пізні попередники олігодендрогліоцитів, перевага яких у тканині головного мозку відповідає 23–32 тижням гестації, що корелює з максимальною частотою виникнення ПВЛ у передчасно народжених дітей [14].
Отже, варто зауважити, що гіпоксично-ішемічне ушкодження головного мозку в новонародженої дитини, зокрема передчасно народженої, є одним із головних середовищних (негенетичних) чинників формування в цій групі дітей неврологічної патології.
Завдяки досягненням нейронаук у сфері вивчення механізмів гіпоксично-ішемічного ушкодження головного мозку були визначені три фази розгортання патологічних подій: первинна (хвилини, години від моменту ушкодження), вторинна (години, дні від моменту ушкодження) і віддалена третинна (дні, тижні від моменту ушкодження). Між двома першими фазами енергетичної недостатності є латентний період, коли, імовірно, можливо запобігти розвитку чи зменшити ступінь ушкодження структур головного мозку. Саме цей відрізок часу є «вікном терапевтичних можливостей».
Детальне вивчення механізмів ушкодження головного мозку в новонароджених, зокрема в передчасно народжених дітей, показало, що в його реалізації беруть участь ексайтотоксичність, окислювальний стрес й асептичне запалення, дії яких призводять до загибелі клітини. Закцентовано увагу на схильності незрілої тканини до апоптозної моделі нейрональної загибелі, а саме до формування проміжних, гібридних типів загиблих нейронів, що може бути пов’язане з мітохондріальною біоенергетичною недостатністю.
Підкреслено, що головний мозок, що розвивається, особливо на першому тижні життя, має більшу резистентність до гіпоксії. Цьому сприяють менша метаболічна активність незрілого мозку, його можливість активніше виводити з клітин продукти анаеробного гліколізу (лактат і кетонові тіла), а також здатність використовувати лактат і кетонові тіла як енергетичний субстрат.
Проаналізовано особливості функціонування глутаматних рецепторів у незрілому мозку, а саме гіпер-збудливість вищезазначених рецепторів, що обумовлена особливістю функціонування NMDA і AMPA іонних каналів, що, з одного боку, робить мозок особливо вразливим при гострому і тяжкому гіпоксично-ішемічному впливі, з іншого — швидке збудження необхідне для високої спонтанної нейрональної активності в умовах помірної енергетичної недостатності.
Процеси асептичного запалення також посилюють і пролонговують ушкодження мозку в новонародженого, які, незважаючи на незрілість імунної системи, активуються в перші години життя.
Незрілий мозок особливо чутливий до вільнорадикального ушкодження при окислювальному стресі через слаборозвинені нейтралізуючі ферментні системи нервової клітини — каталазу і глутатіонпероксидазу та високу доступність заліза, кількість якого в незрілій нейрональній тканині вище щодо зрілої.
Вищезазначені патогенетичні механізми на фоні особливостей функціонування мітохондрій у мозку, що розвивається, призводять до дебюту патологічного апоптозу.
Оцінка маркерів раннього ушкодження клітин ней-рональної і гліальної природи, ендотеліальної дисфункції з урахуванням імунологічного статусу дитини в динаміці дає змогу комплексно оцінити характер і тяжкість морфофункціональних порушень на рівні нейроваскулярних сіток головного мозку. Ці дослідження і спостереження дають можливість, з одного боку, виявити клініко-лабораторні критерії сприятливого і несприятливого прогнозу перебігу ГІУ ЦНС, а з іншого — визначити напрямки базисної патогенетичної (нейропротекторної) терапії, що запобігатиме формуванню тяжкої інвалідизуючої патології в дітей.
Список литературы
1. Блинов Д.В. Иммуноферментный анализ нейроспецифических антигенов в оценке проницаемости гематоэнцефалического барьера при гипоксически-ишемических поражениях ЦНС в перинатальном периоде (клинико-экспериментальное исследование): Дис… канд. мед. наук. Москва, 2004. 153 с.
2. Голенченко В.А. Биологические мембраны: Биохимия: Учеб. для вузов. Под ред. Е.С. Северина. Москва: ГЭОТАР-МЕД, 2003. С. 245-248.
3. Гомазков О.А. Нейротрофическая регуляция и стволовые клетки мозга. Москва: Икар, 2006. 332 с.
4. Лисяный Н.И. Иммунная система головного мозга. Киев, 1999. 216 с.
5. Молекулы адгезии. Электронный ресурс. Режим доступа: http://laboratory.rusmedserv.com/files/41_Molekuly_Adgezii.pdf.
6. Николлс Дж.Г., Мартин А.Р., Валлас Б.Дж., Фукс П.А. От нейрона к мозгу. Пер. с англ. 4-е изд. Москва: Либриком, 2017. 672 с.
7. Рябухин И.А. Нейроспецифические белки в оценке проницаемости гематоэнцефалического барьера человека и животных: Дис... д-ра мед. наук. Москва, 2004. 297 с.
8. Таболин В.А., Володин Н.Н., Дегтярева М.В. Актуальные вопросы перинатальной иммунологии. Детская иммунология. 2004. № 1. С. 1-14.
9. Таранушенко Т.Е., Окунева О.С., Демьянова И.М. и др. Уровни белков нейрональной и глиальной природы в крови новорожденных при церебральной ишемии. Педиатрия. 2010. Т. 89. № 1. С. 25-31.
10. Технологии изучения и моделирования гематоэнцефалического барьера. Неврология XXI века: диагностические, лечебные и исследовательские технологии: Руководство для врачей: в 3 т. Под ред. М.А. Пирадова, С.Н. Иллариошкина, М.М. Танашян. Т. III. Москва: АТМО, 2015. С. 376.
11. Турина О.И. Моноклональные антитела к нейроспецифическим антигенам. Получение, иммунохимический анализ, исследование проницаемости гематоэнцефалического барьера: Дис... д-ра мед. наук. Москва, 2005. 269 с.
12. Чехонин В.П., Дмитриева Т.Б., Жирков Ю.А. Иммунохимический анализ нейроспецифических антигенов. Москва: Медицина, 2000. 415 с.
13. Armati Patricia, Mathey Emily. The Biology of Oligodendrocytes. Cambridge University Press, 2010. 304. https://DOI.org/10.1017/CBO9780511782121.
14. Back S.A., Luo N.L., Borenstein N.S. et al. Late oyligoeden-drocyte coincide with the developmental window of vulnerability for human perinatal white matter injury. J. Neurosci. 2001 Feb. 21(4). 1302-1312. PMID: 11160401. PMCID: PMC6762224.
15. Bavunoglu I., Genc H., Konukoglu D. et al. Oxidative stress parameters and inflammatory and immune mediators as markers of the severity of sepsis. J. Infect. Dev. Ctries. 2016 Oct. 10(10). 1045-1052. DOI: 10.3855/jidc.7585. PMID: 27801365.
16. Blennow M., Hagberg H., Rosengren L. Glial fibrillary acidic protein in the cerebrospinal fluid: a possible indicator of prognosis in full-term asphyxiated newborn infants? Pediatr. Res. 1995. 37(3). 260-264. DOI: 10.1203/00006450-199503000-00002. PMID: 7784132.
17. Brouns R., De Vil B., Cras P., De Surgeloose D. et al. Neurobiochemical markers of brain damage in cerebrospinal fluid of acute ischemic stroke patients. Clin. Chem. 2010 Mar. 56(3). 451-458. DOI: 10.1373/clinchem.2009.134122. PMID: 19959621.
18. Casper K.B., McCarthy K.D. GFAP-positive progenitor cells produce neurons and oligodendrocytes throughout the CNS. Mol. Cell. Neurosci. 2006 Apr. 31(4). 676-684. DOI: 10.1016/j.mcn.2005.12.006. PMID: 16458536.
19. Chalak L.F., Sanchez P.J., Adams-Huet B. et al. Biomar-kers for severity of neonatal hypoxic-ischemic encephalopathy and outcomes in newborns receiving hypothermia therapy. J. Pediatr. 2014 Mar. 164(3). 468-74. DOI: 10.1016/j.jpeds.2013.10.067. PMID: 24332821. PMCID: PMC4006934.
20. Clinicaltrials.gov [Internet]. Study Record Detail. Developmental Outcomes [cited 2016 Sep 9]. Available from: https://clinicaltrials.gov/ct2/show/NCT02264808?term=Cord+Blood++HIE&rank=11.
21. Covert R., Kohn J., Yousefzadeh D., Ben-Armi N., Mittendorf R. Thalamostriate Vasculopathy in Neonates in the MAGnet Trial: Association with Placental Funisitis and Intraventricular Hemmorrhage. Pediatr. Res. 1999. 45. 192. DOI: 10.1203/00006450-199904020-01139.
22. Bonestroo H.J., Heijnen C.J., Groenendaal F., van Bel F., Nijboer C.H. Development of cerebral gray and white matter injury and cerebral inflammation over time after inflammatory perinatal asphyxia. Developmental Neuroscience. 2015. 37(1). 78-94. DOI: 10.1159/000368770. PMID: 25634435.
23. Douglas-Escobar M., Yang C., Bennett J. et al. A pilot study of novel biomarkers in neonates with hypoxic-ischemic encephalopathy. Pediatr. Res. 2010 Dec. 68(6). 531-536. DOI: 10.1203/PDR.0b013e3181f85a03. PMID: 20736881. PMCID: PMC3851011.
24. Edgar J.D., Gabriel V., Gallimore J.R., McMillan S.A., Grant J. et al. A prospective study of the sensitivity, specifity and diagnostic performance of soluble intercellular adhesion molecule 1, highly sensitive C-reactive protein, soluble E-selectin and serum amyloid Ain the diagnosis of neonatal infection. BCM Pediatr. 2010 Apr. 10. 22. DOI: 10.1186/1471-2431-10-22. PMID: 20398379. PMCID: PMC2868836.
25. Ennen C.S., Huisman T.A., Savage W.J. et al. Glial fibrillary acidic protein as a biomarker for neonatal hypoxicischemic encephalopathy treated with whole-body cooling. Am. J. Obstet. Gynecol. 2011 Sep. 205(3). 251-257. DOI: 10.1016/j.ajog.2011.06.025. PMID: 21784396. MCID: PMC4011017.
26. Florio Р., Abella R., Marinoni E. et al. Biochemical marcers of perinatal brain damage. Front. Biosci (Schol Ed). 2010 Jan 1(2). 47-72. I:10.2741/s45. PMID: 20036928.
27. Gough P.J., Raines E.W. Emerging roles of ectodomain shedding in the regulation of inflammatory responses. J. Leukoc. Biol. 2006. Mar. 79(6). 1105-1116. DOI: 10.1189/jlb.0106038. PMID: 16565325.
28. Glickman M.H., Ciechanover A. The ubiquitin-proteasome proteolytic pathway: destruction for the sake of construction. Physiol. Rev. Journal. 2002 Apr. 82(2). 373-428. DOI: 10.1152/physrev.00027.2001. PMID: 11917093.
29. Goldstein G., Scheid M., Hammerling U., Schlesinger D.H., Niall H.D., Boyse E.A. Isolation of a polypeptide that has lymphocyte-differentiating properties and is probably represented universally in living cells. Proceedings of the National Academy of Sciences of the United States of America: journal. 1975 Jan. 72(1). 11-15. DOI: 10.1073/pnas.72.1.11. PMID: 1078892.
30. Hao Liu, Nadya Povysheva, Marie E. Rose et al. Role of UCHL1 in axonal injury and functional recovery after cerebral ischemia.PNAS. 2019 March. 116(10). 4643-4650. DOI: 10.1073/pnas.1821282116.
31. Chen C.Y., Sun W.Z., Kang K.H. еt al. Hypoxic preconditioning suppresses glial activation and neuroinflammation in neonatal brain insults. Mediators of Inflammation. 2015. 2015. 632592. DOI: 10.1155/2015/632592. PMID: 26273140. PMCID: PMC4530271.
32. Huang Z., Song L., Wang C., Chen С., Liu J.-Q. Hypoxia-ischemia upregulates TRAIL and TRAIL receptors in the immature rat brain. Dev. Neurosci. 2011. 33(6). 519-30. DOI: 10.1159/000334475.
33. Iida K., Takashima S. et al. Immunohistochemical study of myelination and oligodendrocytye in infants with periventricular leucomalacia. Pediatr. Neurol. Nov 1995. 13(4). 296-304. DOI: 10.1016/0887-8994(95)00192-1. PMID: 8771165.
34. Inder Т.Е., Anderson N.J., Spencer C., Wells S., Volpe J.J. White matter injury in the premature infant: a comparison between serial cranial sonographic and MR Qidings at term. AJNR Am. J. Neuroradiol. 2003. 24(5). 805-809. PMID: 12748075.
35. Kimura Y., Tanaka K. Regulatory mechanisms involved in the control of ubiquitin homeostasis. J. Biochem. Journal. 2010 Jun. 147(6). 793-798. DOI: 10.1093/jb/mvq044. PMID: 20418328.
36. Kjaergaard A.G., Dige A., Krog J., Tønnesen E., Wogensen L. Soluble adhesion molecules correlate with surface expression in an in vitro model of endothelial activation. Basic Clin. Pharmacol. Toxicol. 2013 Oct. 113(4). 273-279. DOI: 10.1111/bcpt.12091. PMID: 23724832.
37. Laerhoven H., de Haan T.R, Offringa M., Post B. et al. Prognostic tests in term neonates with hypoxic-ischemic encephalopathy: a systematic review. Pediatrics. 2013 Jan. 132(1). 89-98. DOI: 10.1542/peds.2012-1297. PMID: 23248219.
38. Lv H., Wang Q., Wu S. et al. Neonatal hypoxic ischemic encephalopathy-related biomarkers in serum and cerebrospinal fluid. Clin. Chim. Acta. 2015 Oct. 23(450). 282-297. DOI: 10.1016/j.cca.2015.08.021. PMID: 26320853.
39. Massaro A.N., Jeromin A., Kadom N., Vezina G. et al. Serum biomarkers of MRI brain injury in neonatal hypoxic ischemic encephalopathy treated with whole-body hypothermia: a pilot study. Pediatr. Crit. Care Med. 2013 Mar. 14(3). 310-317. DOI: 10.1097/PCC.0b013e3182720642. PMID: 23392373. PMCID: PMC4420174.
40. Massaro A.N., Wu Y.W., Bammler T.K. et al. Plasma Biomarkers of Brain Injury in Neonatal Hypoxic-Ischemic Encephalopathy. J. Pediatr. 2018 Mar. 194. 67-75. DOI: 10.1016/j.jpeds.2017.10.060. PMID: 29478510.
41. Moresco L., Bellissima V., Colivicchi M. et al. Markers of brain injure in non-invasive biological fluids. Minerva Pediatr. 2010. 62(3). 141-143. PMID: 21090084.
42. Mukhopadhyay D., Riezman H. Proteasome-independent functions of ubiquitin in endocytosis and signaling Scienc.e: journal. 2007 Jan 12 (315). 5809. 201-205. DOI: 10.1126/science.1127085. PMID: 17218518.
43. Paise F., Sargison R., Makwana N. et al. Changes in the sublingual microcirculation and endothelial adhesion mo-lecules during the course of severe meningococcal disease treated in the paediatric intensive care unit. Intensive. Care Med. 2012. 38(5). 863-871. DOI: 10.1007/s00134-012-2476-5. PMID: 22398755.
44. Petruzziello-Pellegrini T.N., Moslemi-Naeni M., Marsden P.A. New insights into Shiga toxin-mediated endothelial dysfunction in hemolytic uremic syndrome. Virulence. 2013 Aug. 4(6). 556-563. DOI: 10.4161/viru.26143. PMID: 23955166. PMCID: PMC5359733.
45. Schmidt E.P., Kuiebler W.M., Lee W.L. et al. Adhesion mo-lecules: master controllers of the circulatory system. Compr. Physiol. 2016. 6(2). 945-973. DOI: 10/1002/cphy.c150020.
46. Sergeeva V.A., Aleksandrovich Y.S., Petrenkova N.S. Predictors of hypoxic ischemic encephalopathy in newborns. Messenger of anesthesiology and resuscitation. 2017. 14(4). 16-22. DOI: 10.21292/2078-5658-2017-14-4-16-22.
47. Silveira R.C., Procianoy R.S. Levels of interleukin-6 and tumor necrosis factor-alpha in the cerebrospinal fluid of full-term newborns with hypoxic-ischemic encephalopathy. J. Pediatr. 2003. 143(5). 625-629. DOI: 10.1067/S0022-3476(03)00531-6. PMID: 14615734.
48. Stewart A., Tekes A., Huisman T.A., Jennings J.M. et al. Glial fibrillary acidic protein as a biomarker for periventricular white matter injury. Am. J. Obstet. Gynecol. 2013 Jul. 209(1). 27. е. 1-7. DOI: 10.1016/j.ajog.2013.02.049. PMID: 23467054. PMC3708978.
49. Van Laerhoven H., de Haan T.R., Offringa M. et al. Prognostic tests in term neonates with hypoxic-ischemic encephalopathy: a systematic review. Pediatrics. 2013 Jan. 131(1). 88-98. PMID: 23248219. DOI: 10.1542/ peds.2012-1297. PMID: 23248219.
50. Verkhratsky A., Butt A. Glial neurobiology: a textbook. England: John Wiley & Sons, Ltd. 2007. 209 р. DOI: 10.1002/9780470517796.
51. Wilkinson K.D. The discovery of ubiquitin-dependent proteo-lysis. Proc. Natl Acad. Sci. USA. 2005 Oct. 102(43). 15280-15282. DOI: 10.1073/pnas.0504842102. PMCID: PMC1266097. PMID: 16230621.
52. Yang X., Chang Y., Wei W. Endothelial disfunction and inflammation: immunity in rhemathoid arthritis. Mediators Inflamm. 2016. 681317. DOI: 10.1155/2016/6813016. PMID: 27122657. PMCID: PMC4829719.
53. Yoon B.H., Romero R., Park J.S. et al. The relationship among inflammatory lesions of the umbilical cord (funusitis), umbilical cord plasma interleukin 6 concentration, amniotic fluid infection, and neonatal sepsis. Am. J. Obstet. Gynecol. 2000 Nov. 183(5). 1124-1129. DOI: 10.1067/mob.2000.109035. PMID: 11084553.
54. Zamir E. Molecular complexity and dynamics of cell-matrix adhesions. J. Cell. Sci. 2001 Oct. 114(Pt 20). 3583-3590. PMID: 11707510.

/10.jpg)