Введение
Инсульт является одной из основных причин смертности и инвалидности [1]. Хотя уровень смертности от инсульта снижается, число людей, живущих с последствиями инсульта, увеличивается ввиду прироста и старения населения [1]. Увеличение числа выживших после инсульта приводит к возрастанию потребности в проведении реабилитационных мероприятий. Для того чтобы специалисты-реабилитологи могли эффективно удовлетворить этот спрос, необходимо проведение рандомизированных контролируемых исследований (РКИ) по улучшению реабилитационных мероприятий в клинической практике. Из РКИ, проведенных за последние 5 лет, можно извлечь много полезной информации.
Целью данного обзора является критическая оценка исследований по реабилитации после инсульта и определение путей дальнейшего повышения качества таких исследований. Данный обзор посвящен исследованиям постинсультной реабилитации двигательных функций, поскольку двигательные расстройства у пациентов с инсультом наиболее распространены [2, 3] и являются предметом большинства исследований по реабилитации после инсульта. В исследованиях, включенных в данный обзор, для улучшения эффективности традиционных методов лечения были использованы тренировки, новые технологии, фармакологические методы и нейромодуляция.
Реабилитация двигательных функций после инсульта
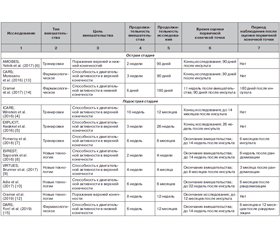
В табл. 1 представлены основные характеристики и результаты 15 исследований, обсуждаемых в данном обзоре, которые сгруппированы по типу вмешательства (панель 1). В большинстве исследований принимали участие пациенты в острой и подострой стадиях инсульта (панель 1, табл. 2), и во всех исследованиях сообщалось об улучшениях как в основной, так и в контрольной группе. Однако результаты 14 из 15 исследований были нейтральными, поскольку между группами не было статистически достоверных различий по первичной конечной точке (панель 1). В единственном исследовании, в котором были получены положительные результаты (CARS), применялось внутривенное введение Церебролизина в течение 72 часов после инсульта [13]. Церебролизин — это нейропептидный препарат, который оказывает положительное влияние на моторную функцию верхних конечностей (панель 2). Средний балл по результатам теста двигательной активности руки (Action Research Arm Test) через 90 дней после инсульта в основной группе был выше, чем в контрольной. И хотя в последующем аналогичном исследовании [28] не удалось воспроизвести вышеуказанный результат, метаанализ продемонстрировал положительные эффекты Церебролизина на показатели по модифицированной шкале Рэнкина через 90 дней после инсульта [29]. Этот результат указывает на то, что применение Церебролизина способствует улучшению исхода ишемического инсульта.
В четырех РКИ оценивались эффекты применения комплекса тренировок в острой и ранней подострой стадиях инсульта (табл. 1).
/57.jpg)
/58.jpg)
/59.jpg)
/60.jpg)
/61.jpg)
/62.jpg)
В исследовании AMOBES принимали участие пациенты в острой стадии инсульта, и было продемонстрировано, что дополнительная физиотерапия, направленная на уменьшение осложнений, связанных с иммобилизацией пациента, имела такие же преимущества при поражении верхних и нижних конечностей, как и физиотерапевтические процедуры в более низких дозах [6]. В остальных трех РКИ принимали участие пациенты в ранней подострой стадии инсульта. Было установлено, что нервно-мышечная электростимуляция [5], функциональные силовые тренировки [7] и целевые тренировки [4] имели такие же преимущества в плане функциональной активности верхних конечностей, как и стандартные методы ведения пациентов с инсультом. В исследовании EXPLICIT было продемонстрировано, что модифицированная двигательная терапия, индуцированная ограничениями, привела к нарастанию объема движений в верхних конечностях в первые 12 недель после инсульта, но это преимущество не сохранялось к 26-й неделе [5]. Поскольку первичная конечная точка не определялась и к концу исследования наблюдалось улучшение одинаковой степени как в основной, так и в контрольной группе, результаты этого исследования были расценены как нейтральные.
В пяти исследованиях изучались эффекты применения различных современных технологий у пациентов в подострой и хронической стадиях инсульта. В исследованиях EVREST [8], VIRTUES [9] и в работе Adie и соавт. [10] изучали влияние виртуальной реальности и видеоигр на двигательную способность верхних конечностей во время подострой стадии инсульта, а Cramer и соавт. [12] исследовали эффекты телереабилитации по сравнению с клинической терапией нарушений функций верхних конечностей в подострой и хронической стадиях инсульта. В исследовании RATULS изучали влияние роботизированной терапии на двигательную функцию верхних конечностей у пациентов с инсультом в хронической стадии [11]. Все эти исследования демонстрируют возможность широкого применения вышеуказанных технологий и сообщают о преимуществах, аналогичных преимуществам комплексов восстановительных мер [8] или традиционной терапии (табл. 1) [9–12].
В трех исследованиях, включая ранее упомянутое исследование CARS, изучались эффекты фармакологической терапии в острой и ранней подострой стадиях (табл. 1) [13]. Лечение моноклональными антителами не дало дальнейшего увеличения скорости ходьбы через 90 дней, которое отличалось бы от результатов, наблюдаемых у пациентов в группе плацебо [14]. Аналогично, в исследовании DARS изучались эффекты применения карбидопы/леводопы перед сеансами двигательной терапии, и было установлено, что процент участников, которые сообщали о восстановлении способности передвигаться самостоятельно, был одинаковым в группах лечения и плацебо [15].
В трех исследованиях изучались эффекты нейромодуляции в виде электрической стимуляции глотки (STEPS) [17], электрической эпидуральной стимуляции (EVEREST) [16] и повторяющейся транскраниальной магнитной стимуляции (NICHE) на ранней подострой и хронической стадии инсульта (табл. 1) [18]. В исследованиях EVEREST и NICHE стимуляция сочеталась с физиотерапией [16, 18]. Хотя результаты этих исследований были нейтральными, они иллюстрируют возможность использования нейромодуляции в многоцентровых исследованиях. В исследованиях EVEREST и NICHE провели вмешательство в течение 6 недель в хронической стадии [16, 18], и в исследовании STEPS провели три сеанса стимуляции в ранней подострой стадии [17]. Возможность увеличения продолжительности вмешательства в ранней подострой стадии следует изучить в будущих исследованиях.
Нейтральные результаты всех исследований, кроме одного, могут указывать на то, что изучаемые вмешательства имели те же преимущества, что и стандартная помощь при инсульте (в случае тренировок или применения новых технологий), или не приносили дополнительной пользы при их применении в дополнение к стандартным вмешательствам (в случае нейромодуляции или лекарственной терапии). Нейтральные результаты РКИ реабилитации после инсульта могут также быть следствием особенностей дизайна и хода этого исследования.
Улучшение исследований реабилитации после инсульта
Дизайн, ход РКИ реабилитации после инсульта и их отчетная часть являются важными компонентами, и в настоящее время формируется консенсус касательно наиболее оптимальных способов решения каких-либо проблем, связанных с ними [30]. Вовлечение пациентов в работу над дизайном исследования может повысить релевантность исследования и его результатов [31, 32]. Дальнейшие предложения по улучшению РКИ реабилитации после инсульта описаны ниже и обобщены в панели 3.
Точность и сокрытие распределения участников
Проведение реабилитационных мероприятий стандартным и слепым методом — сложный и трудоемкий процесс [33]. Тренировки и применение новых технологий требуют индивидуального подхода к каждому пациенту, и их сложно стандартизировать. В некоторых исследованиях данная проблема была устранена путем составления подробных протоколов лечебных и контрольных вмешательств, а также программ обучения терапевтов [4, 5, 7, 11, 12], но эти протоколы неприменимы для других аналогичных исследований [6, 8, 10]. При проведении реабилитационных мероприятий, эффективность которых изучается в исследовании, возникает проблема выбора времени их осуществления с учетом занятий в рамках стандартной программы реабилитации. Хотя этот аспект может не иметь значения в плане применения некоторых лекарственных средств, он может быть значимым при проведении других реабилитационных мероприятий. Например, анализ по протоколу был проведен у менее чем 10 % участников исследования DARS из-за низкой точности времени лечения и терапевтической дозы [34], что могло способствовать нейтральному результату этого исследования. Использование контрольного списка TIDieR [35] или системы спецификации реабилитационных мероприятий [36] улучшит отчетность касательно экспериментальных и контрольных вмешательств, а также повысит воспроизводимость исследований.
Сокрытие группового распределения также может быть затруднено. Для сохранения слепого метода проведения исследования можно сделать так, чтобы плацебо лекарственных средств выглядели так же, как активное вещество, и в исследованиях, в которых применяется нейромодуляция, для контрольной группы можно разработать мнимые вмешательства, симулирующие нейромодуляцию. Но использовать слепой метод исследования при применении тренировок и новых технологий возможно редко ввиду физической природы этих вмешательств. Только в исследованиях, в которых изучались лекарственные препараты [13, 15] и неинвазивная нейромодуляция [17, 18], удавалось провести слепое распределение групп. Во всех 15 рассмотренных исследованиях пытались скрыть распределение групп от экспертов, ответственных за сбор данных результатов исследования. В семи исследованиях сообщается об успешности такого сокрытия [4, 5, 7, 8, 10, 11, 18] и в четырех — о его невозможности [4, 7, 10, 11]. Улучшение и оценка точности вмешательств и сокрытие распределения групп способны улучшить качество исследований, хотя эти действия могут потребовать дополнительных человеческих ресурсов.
Контрольные вмешательства и доза
Экспериментальные исследования часто оценивают в сравнении с так называемыми традиционными, стандартными или обычными методами оказания помощи пациенту. Эти дескрипторы представляют собой разнородную группу методов лечения, которые различаются в разных странах, плохо описаны в литературе [37], и их трудно сравнивать в РКИ. Выбор подходящих контрольных вмешательств затруднен из-за недостатка знаний об их активных составляющих [37–39]. Дозы экспериментальных и контрольных вмешательств также могут быть ограничены временем и ресурсами. Доза и интенсивность физиотерапии могут различаться в группах лечения и контрольной группе и могут применяться вместе с так называемой обычной реабилитационной терапией, что еще больше усложняет интерпретацию результатов.
Во всех 15 рассмотренных исследованиях сообщались планируемые дозы экспериментальных и контрольных вмешательств, и их применяли во всех испытаниях, за исключением AMOBES [6], EXPLICIT [5] и исследования Pomeroy и соавт. [7]. Обнадеживает, что запланированная интенсивность вмешательств была согласована между экспериментальной и контрольной группами в семи исследованиях с применением новых технологий [8–12] и тренировок [4, 7]. В трех исследованиях с применением тренировок в основной группе планировалась их более высокая интенсивность, чем в контрольной [4–6]. В большинстве из четырех исследований с применением тренировок в основной и контрольной группах тренировки проводились с более низкой интенсивностью, чем рекомендовано в клинических руководствах (3,75–10,00 ч в неделю) [40, 41]. Все проводимые экспериментальные и контрольные вмешательства продемонстрировали одинаковые результаты, даже если в каких-то случаях интенсивность вмешательств была выше.
В большинстве исследований в дополнение к экспериментальному или контрольному вмешательству применяли традиционные методы лечения. Стандартные методы лечения, применяемые участниками во время исследования, не описывались и не оценивались в трех исследованиях с применением тренировок [6, 7, 39], в двух исследованиях с применением новых технологий [10, 11], в одном исследовании применения лекарственных препаратов [13] и в двух исследованиях с применением нейромодуляции [17, 18]. Таким образом, в этих исследованиях могут быть важные неучтенные межгрупповые различия. Что касается оставшихся семи исследований, то в четырех из них в контрольной группе объем лечения намеренно был таким же, как и в основной [8, 9, 12, 16], в одном исследовании в контрольной группе объем лечения намеренно был меньше, чем в основной [4], в одном — непреднамеренно больше [15] или меньше [14], чем в основной группе. Следует избегать возникновения неизвестных и непреднамеренных различий, которые могут затруднить интерпретацию результатов и ограничить возможности сравнения исследований.
Отчетность об объеме проведенных вмешательств и обычных лечебных мероприятий, выполненных участникам во время РКИ, может улучшить прозрачность будущих испытаний. Решение о том, как лучше всего сообщать об объеме физиотерапии, является сложной задачей, учитывая, что доза имеет несколько переменных (например, повторения, интенсивность терапии и ее повторения на единицу времени, общее время активной терапии и частота сеансов терапии). Переменные дозы, которые необходимо контролировать и сообщать, будут варьировать в зависимости от активных компонентов вмешательства (например, объем упражнений во время тренировок, направленных на решение конкретных задач, по сравнению с кардиореспираторными упражнениями требует других переменных) и должны быть определены заранее.
Панель 1. Глоссарий терминологии, связанной с восстановлением и реабилитацией
Восстановление и реабилитация
Восстановление
Возвращение структуры и функций тела к состоянию, которое было до инсульта [19].
Спонтанное биологическое восстановление
Восстановление после нарушения, которое происходит в течение первых 3 месяцев после инсульта в результате эндогенных биологических процессов, а не поведенческих, фармакологических или нейромодулирующих вмешательств [20, 21].
Компенсация
Использование новых моделей движения (или поведения) в результате адаптации оставшегося нейронного субстрата. Компенсации могут быть адаптивными, что характеризуется использованием альтернативных моделей движений во время выполнения задачи, также они могут быть замещающими, что характеризуется использованием различных исполнительных механизмов или вспомогательных устройств для замены утраченных двигательных компонентов [22]. Для любого отдельного пациента восстановление двигательной способности может быть комбинацией выздоровления и компенсации [23].
Реабилитация
Вмешательства, разработанные с целью помочь человеку, перенесшему инсульт или другое инвалидизирующее состояние, восстановить утраченные функции и активность, сделать максимально возможной функциональную независимость в повседневной деятельности и способствовать участию в домашней и общественной жизни.
Прогностические биомаркеры
Биологический, анатомический или физиологический показатель, связанный с различными исходами заболевания. Прогностические биомаркеры могут использоваться для отбора пациентов, у которых с наибольшей вероятностью будет определенный исход после инсульта, для исследований вмешательств, направленных на изменение этого исхода [24, 25].
Биомаркеры-предикторы
Биологический, анатомический или физиологический показатель, позволяющий прогнозировать реакцию на лечение. Биомаркеры-предикторы могут использоваться для отбора пациентов, у которых польза реабилитации после инсульта будет наиболее вероятной [24, 25].
Стадии восстановления после инсульта [19]
Острейшая
0–24 ч после инсульта.
Острая
1–7 дней после инсульта.
Ранняя подострая
От 7 дней до 3 месяцев после инсульта.
Поздняя подострая
3–6 месяцев после инсульта.
Хроническая
6 и более месяцев после инсульта.
Типы вмешательств
Тренировки
Включают физическую активность в виде растяжек или выполнения упражнений или и то и другое.
Новые технологии
Включают физическую активность в контексте игр, виртуальной реальности, робототехники и телереабилитации.
Фармакологические вмешательства
Включают комбинирование лекарственной терапии со стандартным комплексом мер по ведению пациентов с инсультом.
Неромодуляционные вмешательства
Включают комбинирование электрической и магнитной стимуляции со стандартным комплексом мер по ведению пациентов с инсультом.
Терминология исследований реабилитации [26]
Первичная конечная точка
Единственное измерение, выполненное в один момент времени, которое составляет основу расчета размера выборки и последующего статистического анализа. Общий результат исследования основан на статистическом анализе первичной конечной точки.
Положительное исследование
Первичная конечная точка достоверно лучше у участников основной группы, чем у участников контрольной группы.
Нейтральное исследование
Первичная конечная точка у участников основной и контрольной групп одинакова.
Отрицательное исследование
Первичная конечная точка достоверно хуже у участников основной группы, чем у участников контрольной группы.
Панель 2. Дефиниции, принятые ВОЗ [27]
Повреждение, поражение
Нарушение строения или функции тела, например снижение силы или потеря чувствительности.
Активность
Выполнение задачи или действия. Ограничения активности — это трудности, которые возникают у человека при выполнении таких задач, как одевание, выполнение гигиенических процедур или ходьба.
Способность
Ограничение активности, которое определяется с помощью стандартизированного показателя, такого как тест двигательной активности руки или скорость ходьбы более 10 м. Альтернативные термины включают функцию и функциональную способность.
Производительность
Ограничение активности, наблюдающееся в условиях повседневной жизни. О производительности можно сообщать самостоятельно с помощью опросника, такого как журнал двигательной активности, или напрямую измерять с помощью таких инструментов, как акселерометр или устройство для подсчета шагов.
Панель 3. Предложения по улучшению исследований по реабилитации после инсульта
Эти предложения предназначены для лиц, разрабатывающих и проводящих исследования реабилитации после инсульта. Они также определяют особенности, которые следует учитывать при оценке качества запланированных и завершенных исследований. Ресурс EQUATOR предоставляет более общие рекомендации по разработке и проведению различных типов исследований.
Планирование
Отбор пациентов:
— расширить набор участников в исследование за счет включения исследователей в клинические группы для обеспечения им доступа к пациентам;
— рассмотреть возможность включения пациентов с ишемическим и геморрагическим инсультом, а также, при необходимости, пациентов с инсультом в анамнезе;
— в подострой стадии — набор и рандомизация всех участников в течение 2 недель после инсульта, чтобы обеспечить соответствие групп по начальному повреждению;
— в хронической стадии — получение нескольких исходных оценок, или использование предварительной оценки, или и то и другое, чтобы лучше выявлять эффекты, конкретно связанные с вмешательством;
— отбор и стратификация участников с использованием прогностических биомаркеров для уменьшения вариабельности между участниками ожидаемых результатов или биомаркеров-предикторов, которые имеют четкую связь с известными или предполагаемыми биологическими механизмами действия вмешательства.
Оценка показателей:
— выбор соответствующих критериев конечных точек в зависимости от цели вмешательства, стадии восстановления после инсульта и фазы исследования;
— рассмотрение возможности оценки первичной конечной точки или проведения последующих оценок показателей по крайней мере через 6 месяцев после инсульта при оценке вмешательства в подострой стадии;
— выбор соответствующих оценок дозы с учетом известных или предполагаемых активных ингредиентов лечения и контрольных вмешательств;
— рассмотрение возможности проведения последующих оценок после первичной конечной точки.
Отчетность:
— обеспечение достаточного количества кадровых ресурсов для сокрытия группового распределения;
— сокращение препятствий для участия в исследованиях путем предоставления информации в удобной форме для потенциальных участников с афазией или испытывающих трудности с коммуникацией и предоставления услуг переводчика и транспорта при необходимости;
— разработка подробных протоколов лечения и форм отчетности, включая программы обучения терапевтов и лиц, занимающихся оценкой результатов;
— измерение и сообщение о запланированных и примененных дозах лечения и контрольных вмешательствах, а также о любых реабилитационных мероприятиях, проводимых отдельно от исследования;
— обоснование критериев включения и исключения.
Стадия восстановления
В основном восстановление двигательных функций происходит в первые 3 месяца после инсульта [21, 42, 43]. То есть этот период является критическим «окном» возможностей для экспериментальных вмешательств, направленных на восстановление и обеспечение благоприятных исходов [44, 45]. Нейробиологические механизмы восстановления во время подострой стадии сложны и все еще изучаются. Обычно ишемический инсульт вызывает каскад эффектов в отношении экспрессии генов, функции клеток и структуры выживших тканей, большинство из которых способствует восстановлению. Эти эндогенные механизмы широко распространены, их активность наиболее выражена в раннем периоде инсульта [43, 46, 47], и в значительной степени они ответственны за восстановление двигательных функций [20, 21]. Считается, что обычные методы лечения и физические тренировки способствуют улучшению двигательных функций, прежде всего за счет компенсации (панель 1) [20–22]. Будущие исследования могут быть направлены на улучшение восстановления на ранней подострой стадии за счет усиления эндогенных процессов и процессов, на которые направлено лечение. Хотя исследуемые вмешательства могут вызывать некоторые проблемы на фоне спонтанного восстановления, их можно, по крайней мере частично, решить путем отбора пациентов и критериев конечных точек.
Проведение исследований в хронической стадии инсульта облегчает выявление эффектов изучаемых вмешательств, но создает другие проблемы. Например, длительное неиспользование паретичной верхней конечности и общее физическое ухудшение могут повлиять на исходные показатели выраженности повреждения и функций. Таким образом, преимущества применения вмешательств в хронической стадии инсульта могут проявляться в виде восстановления пациентов до прежнего состояния, а не в виде конкретных неврологических эффектов, которые помогли бы пациентам добиться дальнейшего восстановления функций до уровня, превышающего прежний. Эту проблему можно решить путем вовлечения всех участников исследования в программу восстановления, а затем рандомизацию, когда исходные показатели станут стабильными.
В большинстве РКИ по реабилитации после инсульта, опубликованных за последние несколько десятилетий, для участия были отобраны пациенты в хронической стадии инсульта [48]. В 215 РКИ, включая 489 групп и 12 847 участников в Централизованной базе данных реабилитации после инсульта, которая находится в открытом доступе, средний период времени с момента развития инсульта до момента включения в исследование составил 509 дней (в среднем 141 день) [48]. Включение пациентов в исследования реабилитации в хронической стадии инсульта проблематично, потому что большинство реабилитационных мероприятий, направленных на восстановление, осуществляется на ранней подострой стадии. Обнадеживает то, что только три из 15 рассмотренных исследований были проведены в хронической стадии инсульта (табл. 2). Этот результат демонстрирует растущую возможность проведения многоцентровых исследований на тех стадиях инсульта, когда вмешательства могут оказывать наиболее выраженное положительное влияние на восстановление двигательных функций и развитие благоприятных исходов.
/64.jpg)
/65.jpg)
Отбор пациентов
В 15 исследованиях, которым посвящен данный обзор, отбор пациентов проводился преимущественно по клиническим критериям, включая верхний возрастной предел [5, 8, 13, 14], минимальный [4–8, 11, 12, 14, 16–18] и максимальный балл [4, 5, 7, 9–16, 18] по шкалам клинической оценки. В двух исследованиях лекарственных препаратов в качестве критерия отбора также использовался объем поражения мозговой ткани при инсульте [13, 14]. В будущих исследованиях можно было бы рассмотреть возможность обоснования критериев отбора, связи между ними и ожидаемыми механизмами действия исследуемого вмешательства.
В исследования, проводимые в острой стадии инсульта, набирали пациентов в течение 72 часов после инсульта, а в исследованиях, проводимых на более поздних стадиях, временные окна набора участников были более широкими (табл. 1). В исследованиях в ранней подострой стадии самый узкий временной интервал набора был в пределах 2 недель после инсульта [5], а самый широкий — до 106 дней после инсульта [4], то есть в эти исследования были включены пациенты в начале, середине и конце процесса спонтанного восстановления. Таким образом, между пациентами могут наблюдаться важные различия в степени улучшения, которые выявляются в ходе исследования из-за спонтанного биологического восстановления, которое может быть не сопоставлено между группами и не может быть выявлено ввиду воздействия исследуемого вмешательства. Эта проблема не решается сообщением об отсутствии статистически достоверной разницы между группами в средних исходных показателях. Вместо этого степень улучшения, которая может быть результатом спонтанных процессов биологического восстановления, должна быть сопоставлена между группами [49, 50], и это может быть, по крайней мере частично, решено путем набора всех участников в течение узкого промежутка времени после инсульта, например 2 недель. Проведение вмешательства, которое исследуется, может быть начато в подходящее время на основании предполагаемых или известных механизмов действия.
Отбор пациентов с использованием прогностических биомаркеров (панель 1) может улучшить соответствие основной и контрольной групп и обогатить выборку, как описано в других источниках [49, 51]. Некоторые измерения, сделанные в течение нескольких дней после инсульта, связаны с последующим двигательным восстановлением и исходом, включая показатели, полученные в результате электроэнцефалографии, транскраниальной магнитной стимуляции, применения структурных и функциональных методов МРТ и генетических анализов [49, 51]. Однако эти меры часто связаны с последующим двигательным восстановлением на групповом уровне. Прогностические биомаркеры должны давать точный прогноз касательно восстановления двигательных функций или исхода у отдельных пациентов, чтобы быть полезными для отбора пациентов или стратификации в исследованиях. Функциональный статус кортикоспинального тракта, оцениваемый с помощью транскраниальной магнитной стимуляции, является надежным предиктором восстановления функций верхних конечностей [20, 49, 50] и исходов [52] у отдельных пациентов и рекомендуется к применению в клинических исследованиях [51]. Этот прогностический биомаркер особенно важен для исследований, для участия в которых отбирают пациентов с поражением верхних конечностей от умеренной до тяжелой степени, для которых исходные клинические показатели являются плохими предикторами двигательного восстановления [49, 52].
В будущие исследования можно также включить прогностические биомаркеры (панель 1) для отбора пациентов, которые с наибольшей вероятностью отреагируют на механизм действия исследуемого вмешательства. Например, в исследовании EVEREST эпидуральная стимуляция ипсилатеральной моторной коры головного мозга в хронической стадии инсульта дала нейтральный результат (табл. 1) [16]. В рost-hoc анализах выявлено, что у пациентов с функционально интактным ипсилатеральным трактом и меньшими структурными повреждениями этого тракта вероятность улучшения функции верхних конечностей была больше, чем у пациентов, у которых кортикоспинальный тракт не был функционально интактным и у которых были более выраженные структурные повреждения этого тракта [53]. Данное открытие иллюстрирует важность выбора пациентов, у которых есть биологический субстрат, необходимый для получения положительного эффекта от проводимого вмешательства. На сегодняшний день ни в одном многоцентровом РКИ с использованием неинвазивной стимуляции для улучшения двигательной активности не было специального отбора пациентов на основе жизнеспособности кортикоспинального тракта. Хотя маловероятно, что у всех пациентов в подострой или хронической стадии будет целесообразно применять единый протокол [54, 55], протоколы стимуляции могут быть разработаны на основе ключевых прогностических биомаркеров функции кортикоспинального тракта.
Стратификация пациентов на основе функционального статуса кортикоспинального тракта может позволить более уверенно интерпретировать РКИ, которые сообщают о положительных результатах восстановления двигательных функций верхних конечностей. Например, в исследование CARS были включены пациенты с тяжелым исходным поражением верхних конечностей в течение 72 часов после инсульта (табл. 1) [13]. Характеристики пациентов и исходные клинические показатели в основной и контрольной группах были сбалансированы. Тем не менее у пациентов с ненарушенной функцией кортикоспинального тракта восстановление моторики верхних конечностей было заметно лучше, чем у лиц с поврежденным кортикоспинальным трактом, несмотря на одинаковые исходные клинические показатели [49]. Возможно, в основной группе по сравнению с контрольной было больше пациентов с ненарушенной функцией кортикоспинального тракта, у которых степень восстановления была большей независимо от получаемого лечения, и это различие могло обеспечить положительный результат исследования.
Будущие исследования, направленные на улучшение восстановления моторики верхних конечностей, могли бы устранить неоднозначность текущих данных путем набора пациентов в течение узкого временного окна после инсульта и использования анализа функциональной целостности кортикоспинального тракта при отборе и стратификации пациентов с изначально тяжелым парезом верхних конечностей. Необходимо разработать биомаркеры для исследований, направленных на улучшение восстановления моторики нижних конечностей, речевых функций и глотания.
Отбор наилучших первичных и вторичных конечных точек
Еще одна проблема РКИ реабилитации после инсульта — это выбор первичных и вторичных конечных точек с точки зрения как их определения, так и времени их оценки. При проведении исследований эффектов на двигательные функции следует выбрать конечные точки, специфичные для двигательных нарушений, оценки объема этих нарушений и их восстановления (панель 2). В исследованиях, проводимых на ранней стадии инсульта, можно с успехом применять конечные точки, отражающие все три вышеуказанных критерия, а в исследованиях на более поздних стадиях инсульта следует отдавать предпочтение оценке восстановления двигательных функций, что отражает влияние изучаемого вмешательства на повседневную деятельность пациентов. Глобальные показатели независимости от посторонней помощи или инвалидности, такие как результаты оценки по модифицированной шкале Рэнкина, недостаточно чувствительны, чтобы служить основными критериями конечной точки исследований, направленных на оценку двигательной сферы.
Первичную конечную точку следует выбирать с учетом известных или предполагаемых механизмов вмешательства и сроков его действия. Например, нервно-мышечная электрическая стимуляция паретичных мышц нижних конечностей уменьшает поражение за счет повышения силы, но не влияет на способность ходить [56], что необходимо учесть при выборе первичной конечной точки. Пациенты также могут научиться использовать стратегии компенсирующих движений для преодоления двигательных нарушений, например движение туловищем, чтобы компенсировать синергетическое сцепление плеча и локтя во время попытки что-то достать паретичной рукой [57, 58]. Такие стратегии могут способствовать улучшению активности, но их нельзя определить с помощью конечной точки, основанной на нарушениях функций. В РКИ, проводимых в ранней фазе, можно оценивать первичные конечные точки сразу после проведения вмешательства, чтобы получить данные, свидетельствующие о его пользе, тогда как в РКИ на более поздних фазах оценку первичных конечных точек можно проводить позже, чтобы выявить устойчивые положительные эффекты.
Первичные конечные точки могут быть абсолютным показателем исхода сразу после изучаемого вмешательства, например при проведении теста двигательной активности руки, или показателем восстановления с течением времени, оцениваемым, например, как разница между исходным показателем результата теста двигательной активности руки и показателем после вмешательства. Применение в качестве первичной конечной точки изменения баллов может быть проблематичным в случае исследований, проводимых в подострой стадии, поскольку ожидается, что в этот период баллы улучшатся в результате спонтанного биологического восстановления и обычного комплекса мер, применяемых у инсультных пациентов, независимо от возможных эффектов изучаемого вмешательства. Эту проблему можно хотя бы частично решить, произведя отбор всех участников исследования в короткие сроки и используя прогностические биомаркеры для сопоставления групп.
При отборе пациентов использовали широкие временные окна после инсульта (табл. 2), продолжительность вмешательства варьировала от 3 дней до 3 месяцев, а первичные конечные точки оценивали в конце вмешательства, после вмешательства или в конце исследования. Такая вариабельность затрудняет прямое сравнение исследований. В восьми из 12 рассмотренных исследований в острой и подострой стадиях оценивались первичные конечные точки до того, как участники достигли хронической стадии (через 6 месяцев после инсульта (табл. 2)). В такой ситуации улучшения могут продолжаться и после оценки первичной конечной точки. Например, вмешательство может ускорить восстановление во время подострой стадии, но в контрольной группе аналогичные результаты могут быть достигнуты через 6 месяцев после инсульта. После завершения подострой стадии полезно оценить первичную конечную точку или показатели в последующем периоде наблюдения, чтобы определить, имеет ли
изучаемое вмешательство долгосрочные эффекты. Включение вторичных конечных точек, о которых сообщают пациенты, также повысило бы значимость результатов исследований.
Практические трудности
Практические трудности, возникающие при проведении РКИ реабилитации после инсульта, различаются в зависимости от страны и системы здравоохранения с точки зрения особенностей отбора участников и удержания их в исследованиях до конца. Хотя академические медицинские центры служат ключевой клинической инфраструктурой для проведения исследований лечения острого инсульта, реабилитация часто осуществляется рассредоточенными и не связанными друг с другом организациями. Обычно участники должны физически присутствовать в месте проведения исследования, чтобы получить исследуемое вмешательство, которое обычно проводится 1–5 дней в неделю в течение 2–8 недель. Проблемы организации исследований и точности проведения вмешательств возрастают по мере того, как пациенты переходят из отделений неотложной помощи в стационарные, амбулаторные и общественные учреждения для реабилитации. Участие в исследованиях реабилитационных мероприятий на разных этапах зависит от таких факторов, как географическое положение пациента, тяжесть инсульта, сопутствующие заболевания, социальные обстоятельства, семейные предпочтения, а также наличие транспорта и лиц, обеспечивающих уход. Предоставление транспорта — это практическая мера, которая может облегчить участие в исследовании.
Скорость набора участников в исследованиях, которым посвящен этот обзор, была медленной независимо от стадии инсульта. В восьми из 15 исследований в каждом центре в месяц отбиралось 0–5 участников [5, 6, 8, 11, 12, 14–17]. В исследовании [7] с самым высоким уровнем набора отбирали по два участника в месяц. Предварительная работа по оценке возможности выполнения запланированных РКИ и приемлемости изучаемого вмешательства может помочь выявить и устранить факторы, способствующие ограничению набора. Доступ исследователей к пациентам на острой и ранней подострой стадиях может быть ограничен местонахождением и правилами медицинских учреждений, где находятся эти пациенты. Исследуемые и контрольные вмешательства могут конкурировать с обычными мероприятиями по лечению и уходу в плане временных затрат, прилагаемых усилий, особенно если участие в исследовании не является приоритетом. Разнообразие критериев включения и исключения также может ограничивать число пациентов, имеющих право на участие в исследовании. Лица, которые исключены из-за трудностей коммуникации, либо из-за афазии, либо из-за языковых барьеров, представляют собой малоизученную подгруппу пациентов, перенесших инсульт [59]. Для облегчения отбора таких пациентов необходимо предоставлять информацию в удобной для пациентов с афазией форме, а также в случае необходимости прибегать к услугам переводчика. Пребывание исследователей в клинике с целью обеспечения их ежедневного доступа к пациентам [60] и разработка вмешательств, которые могут быть выполнены независимо от рутинной медицинской помощи постинсультным пациентам, также будут способствовать привлечению и внедрению полезных вмешательств в клиническую практику.
Можно рассмотреть возможность включения в будущие исследования по реабилитации пациентов как с ишемическим, так и с геморрагическим инсультом. В отличие от исследований лечения острого инсульта или вторичной профилактики тип инсульта мало влияет на восстановление моторики [51] или исход [53]. Если цель реабилитационных мероприятий не зависит от типа инсульта, это может повысить число пациентов, соответствующих критериям отбора. В 10 из 15 исследований, рассмотренных в данном обзоре, были включены пациенты с ишемическим и геморрагическим инсультом. Из оставшихся пяти исследований были исключены пациенты с геморрагическим инсультом, и в три из этих исследований не удалось набрать необходимый размер выборки [7, 15, 18]. Включение пациентов с инсультом в анамнезе при отсутствии у них остаточных двигательных нарушений могло бы также увеличить набор участников в исследование [60].
Имплементация в клиническую практику
Нет четких доказательств того, что вмешательства, которые изучались в крупных многоцентровых исследованиях реабилитации после инсульта, превосходят по эффективности применяющийся в настоящее время комплекс мероприятий оказания помощи пациентам после инсульта. Кроме того, были продемонстрированы благоприятные эффекты как исследуемых, так и контрольных вмешательств в подострой и в хронической стадии инсульта. Этот результат свидетельствует о том, что у большинства пациентов возможно значительное улучшение двигательных нарушений и активности (табл. 1).
В руководствах по реабилитации после инсульта за последние 5 лет был увеличен рекомендуемый объем лечения [40, 41, 61], но оптимальный объем терапии в настоящее время остается неустановленным. Эксперименты на животных показывают, что большее количество тренировок двигательных функций связано с лучшим восстановлением [62–64]. Кроме того, данные, основанные на метаанализе результатов клинических исследований, показывают, что чем больше объем терапии, направленной на восстановление нарушений двигательной сферы, тем лучше ее результаты [65, 66]. Однако РКИ, в которых изучались разные дозы одних и тех же тренировок в подостром [67] и хроническом [68] периоде, не показали дополнительных преимуществ от применения доз в 2–3 раза выше тех, которые используются в стандартном комплексе ведения пациентов после инсульта [69]. Вопрос о том, может ли очень большое количество тренировок, направленных на восстановление двигательных функций, на ранней подострой стадии существенно улучшить восстановление и исходы, остается открытым [70, 71].
Проспективное обсервационное исследование с участием пациентов в хронической стадии инсульта продемонстрировало, что 90 часов физиотерапии, распределенные на 5 дней в неделю в течение 3 недель, привели к улучшению двигательных функций в верхних конечностях [72]. Однако это исследование ограничено неслепыми оценками и отсутствием контрольной группы. В другом исследовании участников с хронической стадией инсульта случайным образом распределили на три группы в зависимости от применяемого физиотерапевтического вмешательства [73]. Было установлено, что 300 часов терапии, распределенные на 5 дней в неделю в течение 12 недель, также привели к улучшению двигательных функций в верхних конечностях без эффекта группового распределения. Таким образом, дальнейшая терапия в хронической стадии инсульта может быть полезной, хотя ее возможный вклад в увеличение использования паретичной верхней конечности и уменьшение выраженности общего физического ухудшения неизвестен. Дозозависимый эффект не продемонстрирован, поскольку в обоих исследованиях сообщается об улучшении средней оценки по шкале Фугл — Мейера для верхних конечностей примерно на 9–10 баллов, несмотря на трехкратную разницу в терапевтических дозах [74, 75]. В целом в контексте РКИ [56] и клинической практики [69, 74] представляется, что лучше проводить некоторые реабилитационные мероприятия, чем не проводить их вообще.
В некоторых исследованиях были изучены новые способы увеличения объема реабилитационных мероприятий при минимизации потребности в дополнительных ресурсах. Помимо телереабилитации [12], одним из подходов является обучение технике проведения реабилитационных мероприятий членов семьи и лиц, осуществляющих уход за постинсультным пациентом. Метаанализ шести исследований с 333 участниками, в которых пациенты выполняли упражнения под контролем лиц, осуществляющих уход за ними, не дал результатов из-за общего низкого качества этих исследований [75]. Проведение реабилитации под руководством членов семьи в исследовании ATTEND, в которое случайным образом были отобраны 1250 участников в течение 1 месяца после инсульта, способствовало увеличению более чем вдвое объема реабилитационных мероприятий по сравнению с реабилитацией, применяемой в стационаре (5 против 2 часов), и обеспечило 30 дополнительных минут реабилитационных мероприятий ежедневно в течение 1 месяца после выписки из стационара [76]. Дополнительная реабилитация под руководством членов семьи не привела к улучшению показателей по модифицированной оценке Рэнкина. Проведение реабилитационных мероприятий членами семьи или опекунами пациента способствует эффективному и безопасному увеличению объема терапевтических мероприятий, однако, как показали результаты исследований, больший объем терапии не дал дополнительных преимуществ.
Таким образом, доступные в настоящее время традиционные методы лечения могут улучшить исходы инсульта, о чем свидетельствуют преимущества, полученные в контрольных группах. Эти преимущества в основном связаны с улучшенной способностью к физической активности, что, в свою очередь, может уменьшить степень инвалидности, нагрузку на лиц, осуществляющих уход за пациентами, а также улучшить качество жизни [61]. Новые виды вмешательств, которые взаимодействуют с механизмами спонтанного биологического восстановления, необходимы для уменьшения двигательных нарушений после инсульта и могут обеспечить более независимую активность. Между тем уверенность в том, что пациентам с инсультом доступны реабилитационные мероприятия, — лучший вариант для улучшения их двигательных функций и повседневной активности.
Стратегия поиска и критерии отбора
Литературный поиск для данного обзора осуществлялся в PubMed среди статей, опубликованных с 1 января 2014 г. по 5 июля 2019 г. Мы использовали комбинации терминов «инсульт», «реабилитация» и «исследование» и не применяли языковых ограничений. Мы также идентифицировали статьи с помощью поиска в наших собственных файлах. Мультицентровые РКИ со слепой оценкой, в которых случайным образом были рандомизированы по меньшей мере 100 участников, рассматривались, если в них исследовали вмешательство, которое включало реабилитационную терапию двигательных функций, или имело первичную конечную точку, оценивающую произвольную двигательную функцию, или и то и другое. Испытания с первичной конечной точкой общей инвалидности или функциональной независимости, такие как исследование AVERT, выходят за рамки настоящего обзора, потому что ни изучаемое вмешательство, ни основная конечная точка не были специфичными для реабилитации активных движений. Окончательный список литературы был выбран в результате консенсуса авторов на основе оригинальности, влияния и актуальности.
Выводы и направления будущих исследований
Увеличение числа крупных многоцентровых РКИ в ранней подострой стадии является положительным моментом в области исследований реабилитации после инсульта. Большинство исследований, доступных на сегодняшний день, были нейтральными в том смысле, что экспериментальные и контрольные вмешательства продемонстрировали одинаковые преимущества в плане восстановления двигательных функций и исходов. В данном обзоре предлагаются способы улучшения дизайна и проведения будущих исследований по реабилитации после инсульта (панель 3). Эти предложения включают расширение критериев включения, а именно включение пациентов как с ишемическим, так и с геморрагическим инсультом, пациентов с инсультом в анамнезе и пациентов с затруднениями в коммуникации, чтобы улучшить как скорость набора участников, так и обобщаемость результатов. В этот обзор также включены предложения по сужению критериев включения за счет набора пациентов в течение короткого временного окна с момента развития инсульта и использования биомаркеров для отбора пациентов, чтобы уменьшить межпредметную вариабельность и обогатить выборку. Будущие исследования также выиграют от повышения точности лечения и «ослепления» методов исследования, использования специфичных критериев первичной конечной точки, которые были бы тщательно согласованы с механизмами действия исследуемого вмешательства, и от уменьшения препятствий для участия в исследованиях. В клинической практике можно продолжать выявлять и устранять барьеры, ограничивающие доступ пациентов к соответствующим реабилитационным мероприятиям, чтобы по мере появления более эффективных методов лечения улучшались возможности их применения.
Список литературы
1. GBD 2016 Stroke Collaborators. Global, regional, and national burden of stroke, 1990–2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Neurol. 2019. 18. 439-58.
2. Langhorne P., Coupar F., Pollock A. Motor recovery after stroke: a systematic review. Lancet Neurol. 2009. 8. 741-54.
3. Roger V.L., Go A.S., Lloyd-Jones D.M. et al. Heart disease and stroke statistics — 2011 update: a report from the American Heart Association. Circulation. 2011. 123. e18-209.
4. Winstein C.J., Wolf S.L., Dromerick A.W. et al. Effect of a task-oriented rehabilitation program on upper extremity recovery following motor stroke: the ICARE randomized clinical Trial. JAMA. 2016. 315. 571-81.
5. Kwakkel G., Winters C., van Wegen E.E. et al. Effects of unilateral upper limb training in two distinct prognostic groups early after stroke: the EXPLICIT-stroke randomized clinical trial. Neurorehabil. Neural Repair. 2016. 30. 804-16.
6. Yelnik A.P., Quintaine V., Andriantsifanetra C. et al. AMOBES (active mobility very early after stroke): a randomized controlled trial. Stroke. 2017. 48. 400-05.
7. Pomeroy V.M., Hunter S.M., Johansen-Berg H. et al. Functional strength training versus movement performance therapy for upper limb motor recovery early after stroke: a RCT. Efficacy Mech. Eval. 2018. 5.
8. Saposnik G., Cohen L.G., Mamdani M. et al. Efficacy and safety of non-immersive virtual reality exercising in stroke rehabilitation (EVREST): a randomised, multicentre, single-blind, controlled trial. Lancet Neurol. 2016. 15. 1019-27.
9. Brunner I., Skouen J.S., Hofstad H. et al. Virtual reality training for upper extremity in subacute stroke (VIRTUES): a multicenter RCT. Neurology. 2017. 89. 2413-21.
10. Adie K., Schofield C., Berrow M. et al. Does the use of Nintendo Wii Sports™ improve arm function? Trial of Wii™ in stroke: a randomized controlled trial and economics analysis. Clin. Rehabil. 2017. 31. 173-85.
11. Rodgers H., Bosomworth H., Krebs H.I. et al. Robot assisted training for the upper limb after stroke (RATULS): a multicentre randomised controlled trial. Lancet. 2019. 394. 51-62.
12. Cramer S.C., Dodakian L., Le V. et al. Efficacy of home-based telerehabilitation vs in-clinic therapy for adults after stroke: a randomized clinical trial. JAMA Neurol. 2019. 76L. 1079-87.
13. Muresanu D.F., Heiss W.D., Hoemberg V. et al. Cerebrolysin and recovery after stroke (CARS): a randomized, placebo-controlled, double-blind, multicenter trial. Stroke. 2016. 47. 151-59.
14. Cramer S.C., Enney L.A., Russell C.K., Simeoni M., Thompson T.R. Proof-of-concept randomized trial of the monoclonal antibody GSK249320 versus placebo in stroke patients. Stroke. 2017. 48. 692-98.
15. Ford G.A., Bhakta B.B., Cozens A. et al. Safety and efficacy of co-careldopa as an add-on therapy to occupational and physical therapy in patients after stroke (DARS): a randomised, double-blind, placebo-controlled trial. Lancet Neurol. 2019. 18. 530-38.
16. Levy R.M., Harvey R.L., Kissela B.M. et al. Epidural electrical stimulation for stroke rehabilitation: results of the prospective, multicenter, randomized, single-blinded everest trial. Neurorehabil. Neural Repair. 2016. 30. 107-19.
17. Bath P.M., Scutt P., Love J. et al. Pharyngeal electrical stimulation for treatment of dysphagia in subacute stroke: a randomized controlled trial. Stroke. 2016. 47. 1562-70.
18. Harvey R.L., Edwards D., Dunning K. et al. Randomized sham-controlled trial of navigated repetitive transcranial magnetic stimulation for motor recovery in stroke. Stroke. 2018. 49. 2138-46.
19. Bernhardt J., Hayward K.S., Kwakkel G. et al. Agreed definitions and a shared vision for new standards in stroke recovery research: the Stroke Recovery and Rehabilitation Roundtable taskforce. Int. J. Stroke. 2017. 12. 44-50.
20. Byblow W.D., Stinear C.M., Barber P.A., Petoe M.A., Acker-ley S.J. Proportional recovery after stroke depends on corticomotor integrity. Ann. Neurol. 2015. 78. 848-59.
21. Krakauer J.W., Carmichael S.T., Corbett D., Wittenberg G.F. Getting neurorehabilitation right: what can be learned from animal models? Neurorehabil. Neural Repair. 2012. 26. 923-31.
22. Levin M.F., Kleim J.A., Wolf S.L. What do motor “recovery” and “compensation” mean in patients following stroke? Neurorehabil. Neural Repair. 2009. 23. 313-19.
23. DeJong S.L., Birkenmeier R.L., Lang C.E. Person-specific changes in motor performance accompany upper extremity functional gains after stroke. J. Appl. Biomech. 2012. 28. 304-16.
24. Califf R.M. Biomarker definitions and their applications. Exp. Biol. Med. (Maywood). 2018. 243. 213-21.
25. FDA-NIH Biomarker Working Group. BEST (Biomarkers, EndpointS, and other Tools) Silver Spring, MD, USA: Food and Drug Administration. Co-published in Bethesda MD, USA by National Institutes of Health, 2016.
26. Bresee L. The importance of negative and neutral studies for advancing clinical practice. Can. J. Hosp. Pharm. 2017. 70. 403-04.
27. WHO. Towards a common language for functioning, disability and health. Geneva: World Health Organization, 2002.
28. Guekht A., Heiss D., Gusev E., Vester J.C., Doppler E., Muresanu D. Cerebrolysin and recovery after stroke (CARS 2): a rando-mized, placebo-controlled, double-blind, multicenter clinical study. J. Neurol. Sci. 2015. 357. e103.
29. Bornstein N.M., Guekht A., Vester J. et al. Safety and efficacy of Cerebrolysin in early post-stroke recovery: a meta-analysis of nine randomized clinical trials. Neurol. Sci. 2018. 39. 629-40.
30. Walker M.F., Hoffmann T.C., Brady M.C. et al. Improving the development, monitoring and reporting of stroke rehabilitation research: consensus-based core recommendations from the stroke reco-very and rehabilitation roundtable. Int. J. Stroke. 2017. 12. 472-79.
31. Cobb E.M., Meurer W., Harney D. et al. Patient engagement in neurological clinical trials design: a conference summary. Clin. Transl. Sci. 2015. 8. 776-78.
32. Crocker J.C., Ricci-Cabello I., Parker A. et al. Impact of patient and public involvement on enrolment and retention in clinical trials: systematic review and meta-analysis. BMJ. 2018. 363. 4738.
33. Bamman M.M., Cutter G.R., Brienza D.M. et al. Medical rehabilitation: guidelines to advance the field with high-impact clinical trials. Arch. Phys. Med. Rehabil. 2018. 99. 2637-8.
34. Stinear C.M. Dopamine for motor recovery after stroke: where to from here? Lancet Neurol. 2019. 18. 514-15.
35. Hoffmann T.C., Glasziou P.P., Boutron I. et al. Better reporting of interventions: template for intervention description and replication (TIDieR) checklist and guide. BMJ. 2014. 348. g1687.
36. Van Stan J.H., Dijkers M.P., Whyte J. et al. The rehabilitation treatment specification system: implications for improvements in research design, reporting, replication, and synthesis. Arch. Phys. Med. Rehabil. 2019. 100. 146-55.
37. Lohse K.R., Pathania A., Wegman R., Boyd L.A., Lang C.E. On the reporting of experimental and control therapies in stroke rehabilitation trials: a systematic review. Arch. Phys. Med. Rehabil. 2018. 99. 1424-32.
38. Lang C.E., Lohse K.R., Birkenmeier R.L. Dose and timing in neurorehabilitation: prescribing motor therapy after stroke. Curr. Opin. Neurol. 2015. 28. 549-55.
39. Kwakkel G., Lannin N.A., Borschmann K. et al. Standardized measurement of sensorimotor recovery in stroke trials: consensus-based core recommendations from the Stroke Recovery and Rehabilitation Roundtable. Int. J. Stroke. 2017. 12. 451-61.
40. Stroke Foundation. Clinical guidelines for stroke management. 2017. https://informme.org.au/Guidelines/Clinical-Guidelines-for- Stroke-Management-2017 (accessed Nov 13, 2019).
41. National Institute for Health and Care Excellence. Stroke overview. https://pathways.nice.org.uk/pathways/stroke (accessed Nov 13, 2019).
42. Duncan P.W., Lai S.M., Keighley J. Defining post-stroke recovery: implications for design and interpretation of drug trials. Neuropharmacology. 2000. 39. 835-41.
43. Zeiler S.R., Krakauer J.W. The interaction between training and plasticity in the poststroke brain. Curr. Opin Neurol. 2013. 26. 609-16.
44. Overman J.J., Carmichael S.T. Plasticity in the injured brain: more than molecules matter. Neuroscientist. 2014. 20. 15-28.
45. Biernaskie J., Chernenko G., Corbett D. Efficacy of rehabilitative experience declines with time after focal ischemic brain injury. J. Neurosci. 2004. 24. 1245-54.
46. Zeiler S.R. Should we care about early post-stroke rehabilitation? Not yet, but soon. Curr. Neurol. Neurosci Rep. 2019. 19. 13.
47. Cassidy J.M., Cramer S.C. spontaneous and therapeutic-induced mechanisms of functional recovery after stroke. Transl. Stroke Res. 2017. 8. 33-6.
48. Lohse K.R., Schaefer S.Y., Raikes A.C., Boyd L.A., Lang C.E. Asking new questions with old data: the centralized open-access rehabilitation database for stroke. Front. Neurol. 2016. 7. 153.
49. Stinear C.M. Prediction of motor recovery after stroke: advances in biomarkers. Lancet Neurol. 2017. 16. 826-36.
50. Stinear C.M., Byblow W.D., Ackerley S.J., Smith M.C., Borges V.M., Barber P.A. Proportional motor recovery after stroke: implications for trial design. Int. J. Stroke. 2017. 48. 795-98.
51. Boyd L.A., Hayward K.S., Ward N.S. et al. Biomarkers of stroke recovery: consensus-based core recommendations from the Stroke Reco-very and Rehabilitation Roundtable. Int. J. Stroke. 2017. 12. 480-93.
52. Stinear C.M., Byblow W.D., Ackerley S.J., Smith M.C., Borges V.M., Barber P.A. PREP2: a biomarker-based algorithm for predicting upper limb function after stroke. Ann. Clin. Transl. Neurol. 2017. 4. 811-20.
53. Nouri S., Cramer S.C. Anatomy and physiology predict response to motor cortex stimulation after stroke. Neurology. 2011. 77. 1076-83.
54. Di Pino G., Pellegrino G., Assenza G. et al. Modulation of brain plasticity in stroke: a novel model for neurorehabilitation. Nat. Rev. Neurol. 2014. 10. 597-608.
55. Stinear C.M., Petoe M.A., Byblow W.D. Primary motor cortex excitability during recovery after stroke: implications for neuromodulation. Brain. Stimul. 2015. 8. 1183-90.
56. Veerbeek J.M., van Wegen E., van Peppen R. et al. What is the evidence for physical therapy poststroke? A systematic review and meta-analysis. PLoS One. 2014. 9. e87987.
57. McMorland A.J., Runnalls K.D., Byblow W.D. A neuroanatomical framework for upper limb synergies after stroke. Front. Hum. Neurosci. 2015. 9. 82.
58. McPherson L.M., Dewald J.P.A. Differences between flexion and extension synergy-driven coupling at the elbow, wrist, and fingers of individuals with chronic hemiparetic stroke. Clin. Neurophysiol. 2019. 130. 454-68.
59. Brady M.C., Fredrick A., Williams B. People with aphasia: capacity to consent, research participation and intervention inequalities. Int. J. Stroke. 2013. 8. 193-96.
60. Held J.P.O., van Duinen J., Luft A.R., Veerbeek J.M. Eligibi-lity screening for an early upper limb stroke rehabilitation study. Front. Neurol. 2019. 10. 683.
61. Winstein C.J., Stein J., Arena R. et al. Guidelines for adult stroke rehabilitation and recovery: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2016. 47. e98-169.
62. Bell J.A., Wolke M.L., Ortez R.C., Jones T.A., Kerr A.L. Training intensity affects motor rehabilitation efficacy following unilateral ischemic insult of the sensorimotor cortex in C57BL/6 mice. Neurorehabil. Neural. Repair. 2015. 29. 590-98.
63. Jeffers M.S., Karthikeyan S., Gomez-Smith M. et al. does stroke rehabilitation really matter? Рart В: Аn algorithm for prescribing an effective intensity of rehabilitation. Neurorehabil. Neural Repair. 2018. 32. 73-83.
64. Jeffers M.S., Corbett D. Synergistic effects of enriched environment and task-specific reach training on poststroke recovery of motor function. Stroke. 2018. 49. 1496-503.
65. Lohse K.R., Lang C.E., Boyd L.A. Is more better? Using metadata to explore dose-response relationships in stroke rehabilitation. Stroke. 2014. 45. 2053-58.
66. Rose D.K., Nadeau S.E., Wu S.S. et al. Locomotor training and strength and balance exercises for walking recovery after stroke: response to number of training sessions. Phys. Ther. 2017. 97. 1066-74.
67. Hunter S.M., Hammett L., Ball S. et al. Dose-response study of mobilisation and tactile stimulation therapy for the upper extremity early after stroke: a phase I trial. Neurorehabil. Neural Repair. 2011. 25. 31-22.
68. Lang C.E., Strube M.J., Bland M.D. et al. Dose response of task-specific upper limb training in people at least 6 months poststroke: a phase II, single-blind, randomized, controlled trial. Ann. Neurol. 2016. 80. 342-54.
69. Lohse K., Bland M.D., Lang C.E. Quantifying change during outpatient stroke rehabilitation: a retrospective regression analysis. Arch. Phys. Med. Rehabil. 2016. 97. 1423-1430.e1.
70. Krakauer J.W., Cortes J.C. A non-task-oriented approach based on high-dose playful movement exploration for rehabilitation of the upper limb early after stroke: a proposal. NeuroRehabilitation. 2018. 43. 31-40.
71. Hornby T.G., Holleran C.L., Hennessy P.W. et al. Variable intensive early walking poststroke (VIEWS): a randomized controlled trial. Neurorehabil. Neural Repair. 2016. 30. 440-50.
72. Ward N.S., Brander F., Kelly K. Intensive upper limb neurorehabilitation in chronic stroke: outcomes from the Queen Square programme. J. Neurol. Neurosurg. Psychiatry. 2019. 90. 498-506.
73. Daly J.J., McCabe J.P., Holcomb J., Monkiewicz M., Gansen J., Pundik S. Long-dose intensive therapy is necessary for strong, clinically significant, upper limb functional gains and retained gains in severe/moderate chronic stroke. Neurorehabil. Neural Repair. 2019. 33. 523-37.
74. Cary M.P. Jr, Prvu Bettger J., Jarvis J.M., Ottenbacher K.J., Graham J.E. Successful community discharge following postacute rehabilitation for medicare beneficiaries: analysis of a patient-centered quality measure. Health Serv. Res. 2018. 53. 2470-82.
75. Vloothuis J.D., Mulder M., Veerbeek J.M. et al. Caregiver-mediated exercises for improving outcomes after stroke. Cochrane Database Syst. Rev. 2016. 12. CD011058.
76. Lindley R.I., Anderson C.S., Billot L. et al. Family-led rehabilitation after stroke in India (ATTEND): a randomised controlled trial. Lancet. 2017. 390. 588-99.

/57.jpg)
/58.jpg)
/59.jpg)
/60.jpg)
/61.jpg)
/62.jpg)
/64.jpg)
/65.jpg)