Журнал «Здоровье ребенка» Том 15, №8, 2020
Вернуться к номеру
Антибиопленочная активность антиматриксных молекул
Авторы: Абатуров А.Е.
ГУ «Днепропетровская медицинская академия МЗ Украины», г. Днепр, Украина
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
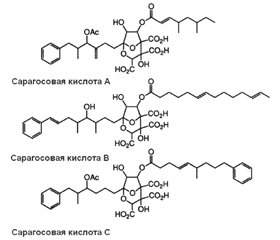
Позаклітинний матрикс біоплівок забезпечує фіксацію біоплівки на біологічній поверхні та захист її бактерій від зовнішніх несприятливих чинників. Основним структурним компонентом біоплівок є позаклітинна полісахаридна речовина. Ключовими молекулярними структурами, що підтримують тривимірну структуру біоплівки, вважають екзополісахариди й амілоїдоподібні волокна. До недавнього часу передбачалося, що більшість механізмів диспергування біоплівок асоційована з функціонуванням матриксних деградуючих ферментів, таких як глікозидгідролази, полісахаридні ліази та протеази. Однак продемонстровано, що в процесі руйнування матриксних екзополісахаридів та амілоїдоподібних волокон відіграють самостійну роль малі молекули. Серед сполук, що порушують матрикс біоплівки, розрізняють антиматриксні молекули, сполуки, що взаємодіють із мікродоменами бактеріальної мембрани, і бактеріальні поверхнево-активні речовини (біосурфагенти). Продемонстровано, що сполуки даних груп можуть пригнічувати утворення біоплівок і сприяти їх диспергуванню. Із групи антиматриксних молекул поліамін норспермідин взаємодіє з екзополісахаридами, а похідний бензохінона AA-861 і сесквітерпеновий лактон партенолід — з TasA-амілоїдоподібними волокнами. Норспермідин запобігає утворенню та диспергує біоплівки різних бактерій, включаючи Acinetobacter baumannii, Bacillus subtili, Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa, Staphylococcus aureus, Staphylococcus epidermidis. Сполука AA-861 проявляє активність проти біоплівок, що утворені бактеріями Streptococcus mutans, Bacillus cereus, Escherichia coli, а партенолід диспергує біоплівки, сформовані Escherichia coli і Bacillus cereus. Сарагосові кислоти, взаємодіючи з мікродоменами бактеріальної мембрани, порушують функціонування рафт-асоційованих протеїнів бактерій. Малі антиматриксні молекули і націлені на мікродомени мембрани бактерій сполуки, що ініціюють диспергування біоплівки, безумовно, стануть підставою для розробки ефективних антибіоплівкових терапевтичних лікарських засобів.
Внеклеточный матрикс биопленок обеспечивает фиксацию биопленки на биологической поверхности и защиту ее бактерий от внешних неблагоприятных факторов. Основным структурным компонентом биопленок является внеклеточное полисахаридное вещество. Ключевыми молекулярными структурами, поддерживающими трехмерную структуру биопленки, считают экзополисахариды и амилоидоподобные волокна. До недавнего времени предполагалось, что большинство механизмов диспергирования биопленок ассоциировано с функционированием матриксных деградирующих ферментов, таких как гликозидгидролазы, полисахаридные лиазы и протеазы. Однако продемонстрировано, что в процессе разрушения матриксных экзополисахаридов и амилоидоподобных волокон играют самостоятельную роль малые молекулы. Среди соединений, нарушающих матрикс биопленки, различают антиматриксные молекулы, соединения, взаимодействующие с микродоменами бактериальной мембраны, и бактериальные поверхностно-активные вещества (биосурфагенты). Продемонстрировано, что соединения данных групп могут ингибировать образование биопленок и способствовать их диспергированию. Из группы антиматриксных молекул полиаминное соединение норспермидин взаимодействует с экзополисахаридами, а производные бензохинона AA-861 и сесквитерпеновый лактон партенолид — с TasA-амилоидоподобными волокнами. Норспермидин предотвращает образование и диспергирует биопленки различных бактерий, включая Acinetobacter baumannii, Bacillus subtili, Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa, Staphylococcus aureus, Staphylococcus epidermidis. Соединение AA-861 проявляет активность против биопленок, которые образованы бактериями Streptococcus mutans, Bacillus cereus, Escherichia coli, а партенолид диспергирует биопленки, сформированные Escherichia coli и Bacillus cereus. Сарагосовые кислоты, взаимодействуя с микродоменами бактериальной мембраны, нарушают функционирование рафт-ассоциированных протеинов бактерий. Малые антиматриксные молекулы и нацеленные на микродомены мембраны бактерий, инициирующие диспергирование биопленки, безусловно, станут основанием для разработки эффективных антибиопленочных терапевтических лекарственных средств.
The extracellular matrix of biofilms ensures the fixation of the biofilm on the biological surface and the protection of its bacteria from external adverse factors. The main structural component of biofilms is an extracellular polysaccharide substance. Exopolysaccharides and amyloid-like fibers are considered key molecular structures that support the three-dimensional structure of biofilms. Until recently, it was assumed that most biofilm dispersion mechanisms are associated with the functioning of matrix degrading enzymes, such as glycoside hydrolases, polysaccharide lyases, and proteases. However, it has been demonstrated that small molecules play an independent role in the process of destruction of matrix exopolysaccharides and amyloid-like fibers. Among the compounds that violate the biofilm matrix, anti-matrix molecules, compounds interacting with microdomains of the bacterial membrane and bacterial surfactants (biosurfactants) are distinguished. It has been demonstrated that compounds of these groups can inhibit the formation of biofilms and contribute to the dispersion of biofilms. From the group of anti-matrix molecules, the polyamine compound norspermidine interacts with exopolysaccharides, and the derivatives of benzoquinone AA-861 and sesquiterpene lactone parthenolide interact with TasA-amyloid-like fibers. Norspermidine prevents the formation and dispersion of biofilms of various bacteria, including Acinetobacter baumannii, Bacillus subtili, Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa, Staphylococcus aureus, Staphylococcus epidermidis. Compound AA-861 is active against biofilms, which are formed by the bacteria Streptococcus mutans, Bacillus cereus, Escherichia coli. Parthenolide disperses biofilms formed by Escherichia coli and Bacillus cereus. Zaragozic acid, interacting with microdomains of the bacterial membrane, disruptі the functioning of raft-associated bacterial proteins. Small anti-matrix molecules and bacterial membranes aimed at microdomains that initiate biofilm dispersion will certainly become the basis for the development of effective antibiofilm therapeutic drugs.
бактеріальні біоплівки; диспергування; антиматриксні молекули
бактериальные биопленки; диспергирование; антиматриксные молекулы
bacterial biofilms; dispersion; anti-matrix molecules
Введение
Механизм действия антиматриксных молекул и молекул, взаимодействующих с микродоменами бактериальной мембраны
Средства, связывающиеся с экзополисахаридами
/98.jpg)
Средства, связывающиеся с TasA-амилоидоподобными волокнами
Средства, связывающиеся с микродоменами бактериальной мембраны
Заключение
- Bergstrom J.D., Kurtz M.M., Rew D.J., Amend A.M., Karkas J.D., Bostedor R.G., Bansal V.S., Dufresne C., VanMiddlesworth F.L., Hensens O.D. et al. Zaragozic acids: a family of fungal metabolites that are picomolar competitive inhibitors of squalene synthase. Proc. Natl. Acad. Sci USA. 1993 Jan. 1. 90 (1). 80-4. DOI: 10.1073/pnas.90.1.80.
- Besingi R.N., Wenderska I.B., Senadheera D.B., Cvitkovitch D.G., Long J.R., Wen Z.T., Brady L.J. Functional amyloids in Streptococcus mutans, their use as targets of biofilm inhibition and initial characterization of SMU_63 c. Microbiology. 2017 Apr. 163 (4). 488-501. doi: 10.1099/mic.0.000443.
- Blanco L.P., Evans M.L., Smith D.R., Badtke M.P., Chapman M.R. Diversity, biogenesis and function of microbial amyloids. Trends Microbiol. 2012 Feb. 20 (2). 66-73. doi: 10.1016/j.tim.2011.11.005.
- Boncher T., Bi X., Varghese S., Casero R.A. Jr, Woster P.M. Polyamine-based analogues as biochemical probes and potential therapeutics. Biochem. Soc. Trans. 2007 Apr. 35 (Pt 2). 356-63. DOI: 10.1042/BST0350356.
- Böttcher T., Kolodkin-Gal I., Kolter R., Losick R., Clardy J. Synthesis and activity of biomimetic biofilm disruptors. J. Am. Chem. Soc. 2013 Feb 27. 135 (8). 2927-30. doi: 10.1021/ja3120955
- Cardile A.P., Woodbury R.L., Sanchez C.J. Jr, Becerra S.C., Garcia R.A., Mende K., Wenke J.C., Akers K.S. Activity of Norspermidine on Bacterial Biofilms of Multidrug-Resistant Clinical Isolates Associated with Persistent Extremity Wound Infections. Adv. Exp. Med. Biol. 2016 Nov. 19. doi: 10.1007/5584_2016_93.
- Duanis-Assaf D., Duanis-Assaf T., Zeng G., Meyer R.L., Reches M., Steinberg D., Shemesh M. Cell wall associated protein TasA provides an initial binding component to extracellular polysaccharides in dual-species biofilm. Sci Rep. 2018 Jun. 19. 8 (1). 9350. doi: 10.1038/s41598-018-27548-1.
- Erskine E., MacPhee C.E., Stanley-Wall N.R. Functional Amyloid and Other Protein Fibers in the Biofilm Matrix. J. Mol. Biol. 2018 Oct. 12. 430 (20). 3642-3656. doi: 10.1016/j.jmb.2018.07.026.
- Evans M.L., Gichana E., Zhou Y., Chapman M.R. Bacterial Amyloids. Methods Mol. Biol. 2018. 1779. 267-288. doi: 10.1007/978-1-4939-7816-8_17.
- Flemming H.C., Wingender J. The biofilm matrix. Nat. Rev. Microbiol. 2010 Sep. 8 (9). 623-33. doi: 10.1038/nrmicro2415.
- Hobley L., Kim S.H., Maezato Y., Wyllie S., Fairlamb A.H., Stanley-Wall N.R., Michael A.J. Norspermidine is not a self-produced trigger for biofilm disassembly. Cell. 2014 Feb. 13. 156 (4). 844-54. doi: 10.1016/j.cell.2014.01.012.
- Jamal M., Ahmad W., Andleeb S., Jalil F., Imran M., Nawaz M.A., Hussain T., Ali M., Rafiq M., Kamil M.A. Bacterial biofilm and associated infections. Chin. Med. Assoc. 2018 Jan. 81 (1). 7-11. doi: 10.1016/j.jcma.2017.07.012.
- Kalia M., Yadav V.K., Singh P.K., Sharma D., Narvi S.S., Agarwal V. Exploring the impact of parthenolide as anti-quorum sensing and anti-biofilm agent against Pseudomonas aeruginosa. Life Sci. 2018 Apr. 15. 199. 96-103. doi: 10.1016/j.lfs.2018.03.013.
- Kolodkin-Gal I., Cao S., Chai L., Böttcher T., Kolter R., Clardy J., Losick R. A self-produced trigger for biofilm disassembly that targets exopolysaccharide. Cell. 2012 Apr. 27. 149 (3). 684-92. doi: 10.1016/j.cell.2012.02.055.
- Konai M.M., Adhikary U., Samaddar S., Ghosh C., Haldar J. Structure-Activity Relationship of Amino Acid Tunable Lipidated Norspermidine Conjugates: Disrupting Biofilms with Potent Activity against Bacterial Persisters. Bioconjug Chem. 2015 Dec. 16. 26 (12). 2442-53. doi: 10.1021/acs.bioconjchem.5b00494.
- Li H.Y., Appelbaum F.R., Willman C.L., Zager R.A., Banker D.E. Cholesterol-modulating agents kill acute myeloid leukemia cells and sensitize them to therapeutics by blocking adaptive cholesterol responses. Blood. 2003 May 1. 101 (9). 3628-34. Epub. 2002 Dec. 27. PMID: 12506040.
- Li L., Liu Y.R., Gao S., Li J.F., Li S.S., Zhang D.D., Liu S., Bai L., Zheng S.J., Duan Z.P., Qi M., Chen Y. Inhibition of 5-Lipoxygenase Pathway Attenuates Acute Liver Failure by Inhibiting Macrophage Activation. J. Immunol. Res. 2014. 697560. Published online 2014 Jun. 1. doi: 10.1155/2014/697560.
- Liu C.I., Jeng W.Y., Chang W.J., Ko T.P., Wang A.H. Binding modes of zaragozic acid A to human squalene synthase and staphylococcal dehydrosqualene synthase. J. Biol. Chem. 2012 May 25. 287 (22). 18750-7. doi: 10.1074/jbc.M112.351254.
- Lopez D., Koch G. Exploring functional membrane microdomains in bacteria: an overview. Curr. Opin. Microbiol. 2017 Feb 23. 36. 76-84. doi: 10.1016/j.mib.2017.02.001.
- López D., Kolter R. Functional microdomains in bacterial membranes. Genes Dev. 2010 Sep. 1. 24 (17). 1893-902. doi: 10.1101/gad.1945010.
- Lyons S.M., Anderson P. RNA-Seeded Functional Amyloids Balance Growth and Survival. Dev. Cell. 2016 Oct. 24. 39 (2). 131-132. doi: 10.1016/j.devcel.2016.10.005.
- Mathema V.B., Koh Y.S., Thakuri B.C., Sillanpää M. Parthenolide, a sesquiterpene lactone, expresses multiple anti-cancer and anti-inflammatory activities. Inflammation. 2012 Apr. 35 (2). 560-5. doi: 10.1007/s10753-011-9346-0.
- Maunders E., Welch M. Matrix exopolysaccharides; the sticky side of biofilm formation. FEMS Microbiol. Lett. 2017 Jul. 6. 364 (13). doi: 10.1093/femsle/fnx120.
- Michael A.J. Polyamine function in archaea and bacteria. J. Biol. Chem. 2018 Nov. 30. 293 (48). 18693-18701. doi: 10.1074/jbc.TM118.005670.
- Michael A.J. Polyamines in Eukaryotes, Bacteria, and Archaea. J. Biol. Chem. 2016 Jul. 15. 291 (29). 14896-903. doi: 10.1074/jbc.R116.734780.
- Nesse L.L., Berg K., Vestby L.K. Effects of norspermidine and spermidine on biofilm formation by potentially pathogenic Escherichia coli and Salmonella enterica wild-type strains. Appl. Environ. Microbiol. 2015 Mar. 81 (6). 2226-32. doi: 10.1128/AEM.03518-14.
- Nishio T., Yoshikawa Y., Shew C.Y., Umezawa N., Higuchi T., Yoshikawa K. Specific effects of antitumor active norspermidine on the structure and function of DNA. Sci Rep. 2019 Oct. 18. 9 (1). 14971. doi: 10.1038/s41598-019-50943-1.
- Oppenheimer-Shaanan Y., Steinberg N., Kolodkin-Gal I. Small molecules are natural triggers for the disassembly of biofilms. Trends Microbiol. 2013 Nov. 21 (11). 594-601. doi: 10.1016/j.tim.2013.08.005.
- Otto M. Phenol-soluble modulins. Int. J. Med. Microbiol. 2014 Mar. 304 (2). 164-9. doi: 10.1016/j.ijmm.2013.11.019.
- Ou M., Ling J. Norspermidine changes the basic structure of S. mutans biofilm. Mol. Med. Rep. 2017 Jan. 15 (1). 210-220. doi: 10.3892/mmr.2016.5979.
- Qu L., She P., Wang Y., Liu F., Zhang D., Chen L., Luo Z., Xu H., Qi Y., Wu Y. Effects of norspermidine on Pseudomonas aeruginosa biofilm formation and eradication. Microbiologyopen. 2016 Jun. 5 (3). 402-12. doi: 10.1002/mbo3.338.
- Ramón-Peréz M.L., Díaz-Cedillo F., Contreras-Rodríguez A., Betanzos-Cabrera G., Peralta H., Rodríguez-Martínez S., Cancino-Diaz M.E., Jan-Roblero J., Cancino Diaz J.C. Different sensitivity levels to norspermidine on biofilm formation in clinical and commensal Staphylococcus epidermidis strains. Microb. Pathog. 2015 Feb. 79. 8-16. doi: 10.1016/j.micpath.2014.12.004.
- Romero D., Sanabria-Valentín E., Vlamakis H., Kolter R. Biofilm inhibitors that target amyloid proteins. Chem. Biol. 2013 Jan. 24. 20 (1). 102-10. doi: 10.1016/j.chembiol.2012.10.021.
- Schwartz K., Syed A.K., Stephenson R.E., Rickard A.H., Boles B.R. Functional amyloids composed of phenol soluble modulins stabilize Staphylococcus aureus biofilms. PLoS Pathog. 2012. 8 (6). e1002744. doi: 10.1371/journal.ppat.1002744.
- Taleghani A., Nasseri M.A., Iranshahi M. Synthesis of dual-action parthenolide prodrugs as potent anticancer agents. Bioorg. Chem. 2017 Apr. 71. 128-134. doi: 10.1016/j.bioorg.2017.01.020.
- Van Gerven N., Klein R.D., Hultgren S.J., Remaut H. Bacterial amyloid formation: structural insights into curli biogenesis. Trends Microbiol. 2015 Nov. 23 (11). 693-706. doi: 10.1016/j.tim.2015.07.010.
- Wagner R.M., Kricks L., Lopez D. Functional Membrane Microdomains Organize Signaling Networks in Bacteria. J. Membr. Biol. 2016 Aug. 26. doi: 10.1007/s00232-016-9923-0.
- Wang M., Li Q. Parthenolide could become a promising and stable drug with anti-inflammatory effects. Nat. Prod. Res. 2015. 29 (12). 1092-101. doi: 10.1080/14786419.2014.981541.
- Wang Y., Kadiyala U., Qu Z., Elvati P., Altheim C., Kotov N.A., Violi A., Van Epps J.S. Anti-Biofilm Activity of Graphene Quantum Dots via Self-Assembly with Bacterial Amyloid Proteins. ACS Nano. 2019 Apr. 23. 13 (4). 4278-4289. doi: 10.1021/acsnano.8b09403.
- Zhou Y., Blanco L.P., Smith D.R., Chapman M.R. Bacterial amyloids. Methods Mol. Biol. 2012. 849. 303-20. doi: 10.1007/978-1-61779-551-0_21.

/97.jpg)
/99.jpg)
/100.jpg)
/101.jpg)