Вступ
Епідеміологічні дослідження продемонстрували, що поширеність ревматоїдного артриту (РА) серед населення земної кулі становить 0,5–1 % [1, 2], а серед окремих популяцій людей сягає 5–7 % [3, 4], при цьому є відомості, що дані поширеності занижені, оскільки не беруть до уваги ранні форми захворювання [5].
До чинників ризику розвитку і значних темпів прогресування РА належать високі концентрації у повітрі кварцу (діоксиду кремнію, Si) [6–8], токсичний вплив якого розглядається як один із потужних патогенетичних чинників цієї хвороби [9]. Високі концентрації кремнієвого пилу сприяють збільшенню продукції ревматоїдного фактора (RF) і антитіл до циклічного цитрулінового пептиду (аССР), але значимість Si в клініко-патогенетичних побудовах РА вивчено недостатньо [10–12].
Мета дослідження: оцінити клініко-патогенетичну значимість кремнієвого мікроелементозу в крові та синовіальній рідини хворих на РА.
Матеріали та методи
Обстежено 83 хворих на РА (21,7 % чоловіків і 78,3 % жінок віком від 22 до 75 років; у середньому 45,0 ± 1,2 року). Тривалість захворювання від перших ознак його маніфестації становила 9,0 ± 0,7 року. Системну (суглобово-вісцеральну) форму хвороби діагностовано в 19,3 % випадків, серопозитивний РА за RF встановлений у 67,5 % спостереженнь, за аССР — в 79,5 %. Параметри загальної активності захворювання (AAG) дорівнювали 2,00 ± 0,08 бала, активності артриту для 28 суглобів (DAS) — 4,70 ± 0,10 в.о., рентгенологічної стадії (ARS) — 2,40 ± 0,09 бала, індексу Лансбурі (LI) — 175,90 ± 8,91 бала, індексу прогресування хвороби (PAI) — 2,10 ± 0,28 в.о., показників у крові RF — 10,90 ± 0,99 мМО/мл, aCСР — 27,20 ± 1,29 О/мл, С-реактивного протеїну (CRP) — 13,30 ± 0,82 мг/л, фібриногену (FG) — 7,40 ± 0,34 г/л.
Остеокістоз був виявлений у 84,3 % від числа хворих на РА, субхондральний склероз — у 72,3 %, зміни рогів менісків колінних зчленувань — у 44,6 %, остеоузури — у 36,2 %, підвивихи суглобів — у 20,5 %, лігаментоз і кісти Бейкера — відповідно у 19,3 %, інтраартикулярні хондромні тіла — у 16,9 %, кальцинати Штайді — у 7,2 %, асептичний остеонекроз — у 6,0 %, ліпідні тіла Гоффа — у 3,6 %. Системний остеопороз відзначено в 63,9 % випадків, епіфізарний (навколосуглобовий) — в 81,9 %. Тендовагініти діагностовано в 45,8 % спостережень, ентезопатії — в 21,7 %, периферична полінейропатія — у 12,1 %, дигітальний артеріїт — в 2,4 %.
Здійснювали рентгенологічне дослідження периферійних суглобів, крижоздухвинних і хребцевих зчленувань (апарат Multix-Compact-Siеmens, Німеччина), ультразвукове дослідження суглобів (Envisor-Philips, Нідерланди), двохенергетичну рентгенівську остеоденситометрію проксимального відділу стегнової кістки (QDR-4500-Delphi-Hologic, США). Оцінювали метакарпальний індекс Барнетта — Нордіна (BNI) та індекс мінеральної щільності кістки (BMD), підраховували індекс інтегральної тяжкості артриту (SAI) за формулою: SAI = √LI × DAS; PAI визначали за формулою: PAI = [(ARS)2 + ∑] : d, де ∑ — сума рентгеносонографічних ознак РА, d — тривалість клінічної маніфестації захворювання.
Імуноферментним методом (рідер PR2100-Sanofi diagnostic pasteur, Франція) досліджували вміст у сироватці крові aССР, рівні RF, СRP, FG — за допомогою аналізатора Olympus-AU-640 (Японія). Вміст Si в сироватці крові (Sib) і синовіальній рідині (Sis) у 19 хворих визначали за допомогою атомно-абсорбційного спектрометра SolAAr-Mk2-MOZe з електрографітовим атомізатором (Велика Британія). З використанням комп’ютерного тензіометра PAT2-Sinterface (Німеччина) досліджували параметри поверхневого натягу (ST) сироватки крові та синовіальної рідини за часом «життя поверхні» 0,01 с, що прагне до нескінченності, підраховували їх співвідношення. Як контроль параметри кремніємії вивчено у 30 практично здорових людей віком від 18 до 62 років, серед яких було 10 чоловіків і 20 жінок.
Статистичну обробку отриманих результатів досліджень проведено за допомогою комп’ютерного варіаційного, непараметричного, кореляційного, регресійного, одно- (ANOVA) і багатофакторного (ANOVA/MANOVA) дисперсійного аналізу (за програмами Microsoft Excel та Statistica-Stat-Soft, США). Оцінювали середні значення (M), їх стандартні похибки і відхилення (SD), коефіцієнти параметричної кореляції Пірсона (r) і непараметричної Кендалла, критерії множинної регресії, однорідності дисперсії Брауна — Форсайта, багатофакторного аналізу Вілкоксона — Рао, відмінностей Макнемара — Фішера і Стьюдента (t), а також вірогідність статистичних показників (p).
Результати
У хворих на РА рівень Sib становив 164,40 ± ± 13,17 мкг/л, а Sis — 87,70 ± 7,09 мкг/л. Концентрація кремніємії мало відрізнялася від показників у здорових людей (рис. 1), а нормальні значення Sib (M ± SD здорових) встановлено в 4,8 % випадків РА, підвищені (> M + SD) — в 26,5 %, знижені (< M – SD) — в 68,7 %. Звертала на себе увагу відсутність вірогідних кореляційних зв’язків між вмістом Sib і Sis (рис. 2).
Згідно з аналізом Брауна — Форсайта, на вміст Sib впливають стать хворих і тривалість клінічної маніфестації захворювання, на показник Sis — тривалість хвороби, наявність артрокальцифікатів та інтраартикулярних тіл Штайді. У свою чергу, з параметром Sib тісно пов’язано залучення в патологічний процес міжфалангових суглобів ступнів, з Sis — ступінь вираженості субхондрального склерозу, епіфізарного остеопорозу й остеокістозу. Як демонструє регресійний аналіз, вміст цього мікроелементу в крові та синовії залежить від віку пацієнтів, ступеня лігаментозу колінних суглобів, змін рогів менісків і внутрішньосуглобових кальцинатів.
/61.jpg)
Аналіз Брауна — Форсайта свідчить, що показники Si в обох біологічних рідинах суттєво пов’язані з параметрами ARS, DAS, LI, PAI і SAI. Певний інтерес становить факт про брак впливу змін кремніємії в бік збільшення і зменшення показника на інтегральні клінічні, рентгенологічні, сонографічні ознаки патології суглобів. Разом з тим, за даними багатофакторного дисперсійного аналізу Вілкоксона — Рао, на клініко-лабораторні критерії перебігу РА (RF, aCCP, CRP, FG) має значний вплив вміст Sib, від якого також залежить характер суглобового синдрому.
Непараметричний кореляційний аналіз Кендалла продемонстрував прямий зв’язок ураження міжфалангових суглобів ступнів із рівнем Sib, колінних і плечових — із Sis. Наявність та тяжкість у хворих лігаментозу й асептичного остеонекрозу позитивно корелює з показником Sib, а інтраартикулярні тіла Штайді мають негативний зв’язок з рівнем кремніємії і позитивний — з показником синовіального Si.
Обговорення
Дисперсійний аналіз Брауна — Форсайта показав вплив вмісту Sib на параметри LI, PAI, aССР і FG, а Sis — на PAI і SAI. Кореляційний аналіз Пірсона виявив обернений зв’язок Sib із LI. З урахуванням отриманих даних статистичного аналізу зроблено висновок, що має практичну спрямованість: рівень Sib > 280 мкг/л (> M + SD хворих на РА) є прогнозонегативною ознакою щодо ураження великих зчленувань (кульшових, колінних, плечових). Cтупінь прогнозування пропонованого результату моделі становив 81,8 %.
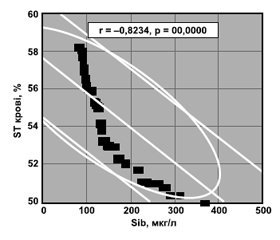
Si є поверхнево неактивною речовиною (інсурфактантом), здатним підвищувати міжфазну активність біологічних рідин. Рівень ST сироватки крові становив 54,60 ± 0,30 %, ST синовії — 88,20 ± 1,61 % (t = 31,84; p < 0,001). Кореляційні зв’язки Пірсона показника ST крові та синовії з Sib й Sis подано на рис. 3 і 4. Якщо в крові має місце високовірогідна кореляція, то в суглобовій рідині такі співвідношення відсутні.
/62.jpg)
Si бере участь у метаболізмі кісткової тканини при РА [13] і здатний формувати нормальні показники BMD [14, 15], послаблювати апоптоз остеобластів, відновлювати диференціювання остеокластів і процеси резорбції кістки [16]. У тварин із постійним дефіцитом у харчовому раціоні Si встановлено розвиток остеопорозу, що пов’язують з появою зміненої продукції в організмі остеокальцину і колагену 1-го типу [17]. У свою чергу, вживання тваринами з моделлю артриту їжі, багатої на Si, сприяє відновленню BMD [18]. За експериментального остеопорозу внутрішньоочеревинні введення наночастинок сферичного Si збільшують BMD [19]. Цей факт є добрим підґрунтям для подальших випробувань такого методу лікування в клінічній практиці у хворих на остеопороз.
Вплив на організм SiO2 є предиктором формування протиядерних, протигістонових і протитопоізомеразних антитіл 1-го типу [20, 21], а також антинейтрофільних цитоплазматичних (спрямованих до мієлопероксидази й протеїнази-3) [22, 23]. Частинки екзогенного SiO2 через активацію матриксних металопротеїназ-1 і -3 підсилюють синтез транскрипційних факторів для прозапальних цитокінів і деяких факторів зростання [24, 25]. Ключовими посередниками фіброгенезу при РА можуть бути трансформуючий фактор зростання b і тромбоцитарний фактор зростання D, а блокувати таку дію можуть IκB-кіназа та інгібітор BMS-345541 [26]. Спочатку відбувається фіксація Si на нормальних фібробластах, викликаючи профіброзну експресію генів COL1A2, COL3A1, MIVIP1, TIMP3, CTGF зі зміною кількісного й якісного їх складу, посилюючи процеси формування ревматоїдного фіброгенезу [27, 28]. Слід зазначити, що кварцовий пил здатний змінювати баланс клітин з рецепцією CD152 і CD279 [29].
Значення BNI в обстежених хворих на РА становили 0,430 ± 0,005 в.о., а BMD — 1,590 ± 0,082 SD. За даними дисперсійного аналізу, рівні Sib і Sis впливають на показник BNI, а як свідчить кореляційний аналіз, існує прямий зв’язок параметра кремніємії з BNI й обернений — із BMD. Існує чітка залежність формування остеопорозу від рівня в організмі Sib, що супроводжується вірогідним зменшенням вмісту кремніємії на 43 %, тоді як параметри Sis у цих групах хворих відрізняються несуттєво.
Висновки
1. РА супроводжується системним і локальним (внутрішньосуглобовим) кремнієвим мікроелементозом за браком дисбалансу рівня кремніємії, хоча в 13 % випадків констатується високий вміст Si в цьому об’єкті дослідження.
2. Кремнієвий дисметаболізм пов’язаний з клінічними, рентгенологічними та сонографічними ознаками перебігу РА, ступенем активності й тяжкістю суглобового синдрому.
3. Si бере участь у патогенетичних побудовах PA, причому показники Sib можуть мати прогностичну значимість.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Список литературы
1. Usenbo A., Kramer V., Young T., Musekiwa A. Prevalence of Arthritis in Africa: A systematic review and meta-analysis. PLoS One. 2015. 10(8). 0133858. doi: 10.1371/journal.pone.0133858.
2. Gabriel S.E. The epidemiology of rheumatoid arthritis. Rheum. Dis. Clin. North Am. 2019. 27(2). 269-81. doi: 10.1016/s0889-857x(05)70201-5.
3. Park J., Mendy A., Vieira E.R. Various types of arthritis in the United States: prevalence and age-related trends from 1999 to 2014. Am. J. Public. Health. 2018. 108(2). 256-8. doi: 10.2105/AJPH.2017.304179.
4. Silman A.J., Pearson J.E. Epidemiology and genetics of rheumatoid arthritis. Arthritis Res. 2018. 4(3). 265-72. doi: 10.1186/ar578.
5. Oton T., Carmona L. The epidemiology of established rheumatoid arthritis. Best Pract. Res. Clin. Rheumatol. 2019. 33(5). 101477. doi: 10.1016/j.berh.2019.101477.
6. Anic B., Mayer M. Pathogenesis of rheumatoid arthritis. Reumatizam. 2014. 61(2). 19-23.
7. Murphy D., Sinha A., Hutchinson D. A trigger for rheumatoid arthritis? Am. J. Med. 2015. 128(12). 35-45. PMID: 25427390.
8. Too C.L., Muhamad N.A., Ilar A., Padyukov L., Alfredsson L., Klareskog L. et al. Occupational exposure to textile dust increases the risk of rheumatoid arthritis: results from a Malaysian population-based case-control study. Ann. Rheum. Dis. 2016. 75(6). 997-1002. doi: 10.1136/annrheumdis-2015-208278.
9. Gomez-Puerta J.A., Gedmintas L., Costenbader K.H. The association between silica exposure and development of ANCA-associated vasculitis: systematic review and meta-analysis. Autoimmun Rev. 2018. 12(12). 1129-35. doi: 10.1016/j.autrev.2018.06.016.
10. Turk S.A., van Beers-Tas M.H., van Schaardenburg D. Prediction of future rheumatoid arthritis. Rheum. Dis. Clin. North Am. 2014. 40(4). 753-70. doi: 10.1016/j.rdc.2014.07.007.
11. Essouma M., Noubiap J.J. Is air pollution a risk factor for rheumatoid arthritis? J. Inflamm. 2015. 30(12). 48-59. doi: 10.1186/s12950-015-0092-1.
12. Conigliaro P., Chimenti M.S., Triggianese P., Sunzini F., Novelli L., Perricone C. et al. Autoantibodies in inflammatory arthritis. Autoimmun Rev. 2016. 15(7). 673-83. doi: 10.1016/j.autrev.2016.03.003.
13. Horecka A., Hordyjewska A., Blicharski T., Kocot J., Żelazowska R., Lewandowska A. et al. Simvastatin effect on calcium and silicon plasma levels in postmenopausal women with osteoarthritis. Biol. Trace Elem. Res. 2016. 171(1). 1-5. doi: 10.1007/s12011-016-0635-1.
14. Shadjou N., Hasanzadeh M. Silica-based mesoporous nanobiomaterials as promoter of bone regeneration process. J. Biomed. Mater. Res. A. 2015. 103(11). 3703-16. doi: 10.1002/jbm.a.35504.
15. Tatara M.R., Krupski W., Szpetnar M., Dąbrowski A., Bury P., Szabelska A. et al. Effects of total gastrectomy on plasma silicon and amino acid concentrations in men. Exp. Biol. Med. 2015. 240(12). 1557-63. doi: 10.1177/1535370215588925.
16. Casarrubios L., Matesanz M.C., Sánchez-Salcedo S., Arcos D., Vallet-Regí M., Portolés M.T. Nanocrystallinity effects on osteoblast and osteoclast response to silicon substituted hydroxyapatite. J. Colloid Interface Sci. 2016. 15(482). 112-20. doi: 10.1016/j.jcis.2016.07.075.
17. Dong M., Jiao G., Liu H., Wu W., Li S., Wang Q. et al. Biological silicon stimulates collagen type 1 and osteocalcin synthesis in human osteoblast-like cells through the BMP-2/Smad/RUNX2 signaling pathway. Biol. Trace Elem. Res. 2016. 173(2). 306-15. doi: 10.1007/s12011-016-0686-3.
18. Rodella L.F., Bonazza V., Labanca M., Lonati C., Rezzani R. A review of the effects of dietary silicon intake on bone homeostasis and regeneration. J. Nutr. Health Aging. 2014. 18(9). 820-6. doi: 10.1007/s12603-014-0555-8.
19. Weitzmann M.N., Ha S.W., Vikulina T., Roser-Page S., Lee J.K., Beck G.R. Bioactive silica nanoparticles reverse age-associated bone loss in mice. Nanomedicine. 2015. 11(4). 959-67. doi: 10.1016/j.nano.2015.01.013.
20. Bello S., Rinaldi A., Trabucco S., Serafino L., Bonali C., Lapadula G. Erasmus syndrome in a marble worker. Reumatismo. 2015. 67(3). 116-22. doi: 10.4081/reumatismo.2015.826.
21. Chaouch N., Mjid M., Zarrouk M., Rouhou S.C., Ammous I., Hantous S., Racil H., Chabbou A. Erasmus' syndrome with pseudo-tumour masses. Rev. Mal. Respir. 2011. 28(7). 924-7. doi: 10.1016/j.rmr.2011.06.003.
22. Farhat S.C., Silva C.A., Orione M.A., Campos L.M., Sallum A.M., Braga A.L. Air pollution in autoimmune rheumatic diseases: a review. Autoimmun Rev. 2011. 11(1). 14-21. doi: 10.1016/j.autrev.2011.06.008.
23. Makol A., Reilly M.J., Rosenman K.D. Prevalence of connective tissue disease in silicosis (1985–2006) — a report from the state of Michigan surveillance system for silicosis. Am. J. Ind. Med. 2011. 54(4). 255-62. doi: 10.1002/ajim.20917.
24. Lafyatis R., York M. Innate immunity and inflammation in systemic sclerosis. Curr. Opin. Rheumatol. 2016. 21(6). 617-22. doi: 10.1097/BOR.0b013e32832fd69e.
25. Wei P., Yang Y., Guo X., Hei N., Lai S., Assassi S. et al. Identification of an association of TNFAIP3 polymorphisms with matrix metalloproteinase expression in fibroblasts in an integrative study of systemic sclerosis-associated genetic and environmental factors. Arthritis Rheumatol. 2016. 68(3). 749-60. doi: 10.1002/art.39476.
26. Charni Chaabane S., Coomans de Brachène A., Essaghir A., Velghe A., Lo Re S., Stockis J. et al. PDGF-D expression is down-regulated by TGFβ in fibroblasts. PLoS One. 2014. 9(10). 108656. doi: 10.1371/journal.pone.0108656.
27. Murdaca G., Contatore M., Gulli R., Mandich P., Puppo F. Genetic factors and systemic sclerosis. Autoimmun Rev. 2016. 15(5). 427-32. doi: 10.1016/j.autrev.2016.01.016.
28. Yang Y., Wei P., Guo X.J., Zhou D., Zhang W.Z., Assassi S. et al. Impact of age and autoantibody status on the gene expression of scleroderma fibroblasts in response to silica stimulation. Eur. J. Inflamm. 2018. 11(3). 631-9.
29. Rocha M.C., Santos L.M., Bagatin E., Cohen Tervaert J.W., Damoiseaux J.G., Lido A.V. et al. Genetic polymorphisms and surface expression of CTLA-4 and PD-1 on T cells of silica-exposed workers. Int. J. Hyg. Environ Health. 2012. 215(6). 562-9. doi: 10.1016/j.ijheh.2011.10.010.

/61.jpg)
/62.jpg)