Журнал «Медицина неотложных состояний» Том 17, №1, 2021
Вернуться к номеру
Тривалий електрокардіографічний моніторинг у кардіохірургічному стаціонарі: сучасні погляди та досвід застосування телемоніторингової системи після стентування коронарних артерій
Авторы: Дзюба Д.О.(1), Сиворакша О.О.(1), Чайковський І.А.(2), Хаврюченко О.В.(1), Соловйов В.В.(3), Лоскутов О.А.(1)
(1) – Національна медична академія післядипломної освіти імені П.Л. Шупика, м. Київ, Україна
(2) – Інститут кібернетики ім. В.М. Глушкова НАН України, м. Київ, Україна
(3) – ТОВ «Сольвейг», м. Київ, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
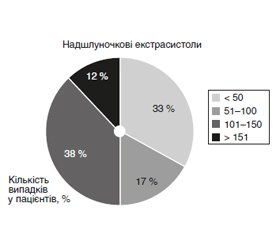
Актуальність. Захворювання серцево-судинної системи в Україні посідають лідерські позиції. На сьогодні постійний моніторинг електрокардіограми (ЕКГ) є рутинним дослідженням у пацієнтів, які госпіталізуються до лікарні із серцево-судинною патологією. Мета: провести аналіз досвіду застосування тривалого електрокардіографічного моніторингу в пацієнтів у ранньому післяопераційному періоді стентування коронарних артерій. Матеріали та методи. У дослідження включено 24 пацієнти з ішемічною хворобою серця, яким було проведено стентування коронарних артерій у плановому порядку. Усім пацієнтам після закінчення оперативного втручання проводився тривалий ЕКГ-моніторинг. Результати. Серед пацієнтів, які брали участь у нашому дослідженні, у 17 % хворих у ранньому післяопераційному періоді фіксувались поодинокі надшлуночкові екстрасистоли та у всіх пацієнтів було зафіксовано епізоди поодиноких шлуночкових екстрасистол. Значимої дислокації сегмента ST не було зафіксовано в жодного пацієнта. Висновки. На основі спостереження за пацієнтами із серцево-судинними подіями в післяопераційному періоді показано, що використання цілодобового автоматичного запису ЕГК за допомогою мобільних пристроїв покращує можливості вчасної діагностики (включно з ургентною) повторних подій. Сформульовано рекомендації щодо доцільності його використання в різних режимах для пацієнтів із різним перебігом хвороби.
Актуальность. Заболевания сердечно-сосудистой системы в Украине занимают лидерские позиции. На сегодняшний день постоянный мониторинг электрокардиограммы (ЭКГ) является рутинным исследованием у пациентов, которые госпитализируются в больницу с сердечно-сосудистой патологией. Цель: провести анализ опыта применения длительного электрокардиографического мониторинга у пациентов в раннем послеоперационном периоде стентирования коронарных артерий. Материалы и методы. В исследование были включены 24 пациента с ишемической болезнью сердца, которым было проведено стентирование коронарных артерий в плановом порядке. Всем пациентам после окончания оперативного вмешательства проводился длительный ЭКГ-мониторинг. Результаты. Среди пациентов, принимавших участие в нашем исследовании, у 17 % больных в раннем послеоперационном периоде отмечались единичные наджелудочковые экстрасистолы и у всех пациентов были зафиксированы эпизоды единичных желудочковых экстрасистол. Значимой дислокации сегмента ST не было зафиксировано ни у одного пациента. Выводы. На основе наблюдения за пациентами с сердечно-сосудистыми событиями в послеоперационном периоде показано, что использование круглосуточной автоматической записи ЭГК с помощью мобильных устройств улучшает возможности своевременной диагностики (включая ургентную) повторных событий. Сформулированы рекомендации о целесообразности ее использования в различных режимах для пациентов с разным течением болезни.
Background. Diseases of the cardiovascular system in recent decades have taken the lead. In Ukraine alone, mortality rates reach half a million annually. Today, continuous ECG monitoring is a routine study in patients hospitalized with cardiovascular disease. The purpose was to analyze the experience of long-term electrocardiographic monitoring in patients in the early postoperative period of coronary artery stenting. Materials and methods. The study included 24 patients with coronary heart disease who underwent routine coronary artery stenting. All patients underwent long-term ECG monitoring after the operation. Results. Among the patients in our study, single supraventricular extrasystoles were recorded in 17 % of patients in the early postoperative period, and episodes of single ventricular extrasystoles were recorded in all patients. There was no significant ST segment dislocation observed in any patient. Based on the observation of patients with cardiovascular events in the postoperative period, it was shown that the usage of round-the-clock automatic recording of ECG by using mobile devices improves the ability to timely diagnose (including urgent) recurrences. Conclusions. Recommendations on the feasibility of its usage in different regimens for patients with different disease were formulated.
тривалий кардіомоніторинг; електрокардіографія; стентування коронарних артерій; екстрасистоли
длительный кардиомониторинг; электрокардиография; стентирование коронарных артерий; экстрасистолы
long-term cardiomonitoring; electrocardiography; coronary artery stenting; extrasystole
Вступ
Матеріали та методи
/53.jpg)
/53_2.jpg)
/54.jpg)
Результати та обговорення
Висновки
- Actual health problemsand their minimization in the context of armed conflict in Ukraine. Eds by V.M. Kovalenko, V.M. Kornatskiy. K.: SPD FO «Kolomitsyn VYu», 2018. 214 p.
- Abrams D.J., MacRae C.A. Long QT syndrome. Circulation. 2014. 129(14). 1524-1529.
- Adam S., Osborne S., Welch J. (Eds) Critical Care Nursing: Science and Practice. Thirdedition. Oxford University Press, Oxford. 2017.
- Aehlert B. ECGs made easy, fourth edition. Maryland Heights: Mosby Elsevier. 2011.
- Allen C., Glasziou P., Del Mar C. Bed rest: a potentially harmful treatment needing more careful evaluation. Lancet. 1999. 354(9186). 1229-1233.
- Arizona Centre for Education and Research on Therapeutics (2017) Combined list of drugs that prolong QT and/or cause Torsades de Pointes (TDP), available at https://crediblemeds.org/pdftemp/pdf/CombinedList.pdf (accessed 22/01/2017)
- Bennett D.H. Bennett’s Cardiac Arrhythmias: Practical notes on interpretation and treatment. 8th ed. London: Hodder Arnold, 2013.
- Bovino L.R., Funk M., Pelter M.M., Desai M.M., Jefferson V., Andrews L.K., Forte K. The value of continuous ST-segment monitoring in the emergency department. Advanced Emergency Nursing Journal. 2015. 37(4). 290-300.
- Carmo P., Ferreira J., Aguiar C., Ferreira A., Raposo L., Gonçalves P., Brito J., Silva A. Does Continuous ST-Segment Monitoring Add Prognostic Information to the TIMI, PURSUIT, and GRACE Risk Scores? Annals of Noninvasive Electrocardiology, 2011. 16(3). 239-249.
- Drew B.J., Ackerman M.J., Funk M., Gibler W.B. et al. On behalf of the American Heart Association Acute Cardiac Care Committee of the Council on Clinical Cardiology; Council on Cardiovascular Nursing; American College of Cardiology Foundation. Prevention of torsade de pointes in hospital settings: a scientific statement from the American Heart Association and the American College of Cardiology Foundation. Circulation. 2010. 121. 1047-1060.
- Funk M., Winkler C.G., May J.L., Stephens K., Fennie K.P., Rose L.L., Turkman Y.E., Drew B.J. Unnecessary arrhythmia monitoring and underutilization of ischemia and QT interval monitoring in current clinical practice: baseline results of the Practical Use of the Latest Standards for Electrocardiography trial. Journal of Electrocardiology. 2010. 43(6). 542-547.
- Garcia T.B. 12-lead ECG: The Art of Interpretation. 2nd еd. Burlington, Ma: Jones and Bartlett, 2015.
- Hatchett R. Cardiac monitoring and the use of a systematic approach in interpreting electrocardiogram rhythms. Nursing Standard. 2017. 32. 11. 51-62.
- Houghton A.R., Gray D. Making sense of the ECG: A hands-on guide. 4th ed. Boca Raton: CRC Press, 2014.
- Hreybe H., Saba S. Location of Acute Myocardial Infarction and Associated Arrhythmias and Outcome. Clinical Cardiology. 2009. 32(5). 274-277.
- Kirchhof P., Benussi S., Kotecha D. et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur. Heart J. 2016. 37. 2893-2962.
- Klabunde R.E. Cardiovascular physiology concepts, 2nd ed. Baltimore, MD; Lippincott Williams & Wilkins, 2012.
- Morris F., Brady W.J. Acute myocardial infarction — part I, in Morris F., Brady W.J., Camm J. (eds) ABC of Clinical Electrocardiography. 2nd ed. Oxford: Blackwell publishing, 2009. 29-32.
- Patton J.A., Funk M. Survey of use of ST-segment monitoring in patients with acute coronary syndrome. Am. J. Crit. Care. 2001. 10(1). 23-34.
- Pelter M.M., Drew B.J. Harm from alarm fatigue, Agency for Healthcare Research and Quality, 2015. available at https://psnet.ahrq.gov/webmm/case/362/harm-from-alarm-fatigue (accessed 06/12/2017)
- Pickham D., Drew B.J. QT/QTc interval monitoring in the emergency department. Journal of Emergency Nursing. 2008. 34(5). 428-434.
- Pickham D., Helfenbein E., Shinn J.A., Chan G., Funk M., Drew B.J. How many patients need QT interval monitoring in critical care units? Preliminary report of the QT in Practice study. Journal of Electrocardiology. 2010. 43(6). 572-576.
- Pitcher D., Nolan J. Peri-arrest arrhythmias. Resuscitation Council UK, London, 2015. http://tinyurl. com/ogeh2jt (accessed 30/11/2017)
- Rautaharju P.M., Surawicz B., Gettes L.S. AHA/ACCF/HRS Recommendations for the Standardization and Interpretation of the Electrocardiogram. Part IV: The ST Segment, T and U Waves, and the QT Interval. A Scientific Statement from the American Heart Association Electrocardiography and Arrhythmias Committee, Council on Clinical Cardiology; the American College of Cardiology Foundation; and the Heart Rhythm Society. Circulation. 2009. 119. 241-250.
- Resuscitation Council (UK). Advanced Life Support. Seventh edition. RCUK, London, 2016.
- Roden D. Long-QT syndrome. N. Engl. J. Med. 2008. 358. 169.
- Sangkachand P., Sarosario B., Funk M. Continuous ST-segment monitoring: nurses’ attitudes, practices, and quality of patient care. American Journal of Critical Care. 2011. 20(3). 226-238.
- Sandau K.E., Funk M., Auerbach A. et al. Update to Practice Standards for Electrocardiographic Monitoring in Hospital Settings: A Scientific Statement From the American Heart Association. Circulation. 2017. 136. 273-344. DOI: 10.1161/CIR.0000000000000527.
- Sandau K.E., Smith M. Continuous ST-segment monitoring: 3 case studies in progressive care. Crit. Care Nurse. 2009. 29(5). 18-30.
- Spratt G. Three steps to reduce alarm fatigue and improve patient safety. AARC Times. August 2016. 13-16.
- Thygesen K., Alpert J.S., Jaffe A.S., Simoons M.L., Chaitman B.R., White H.D. The Writing Group on behalf of the Joint ESC/ACCF/AHA/WHF Task Force for the Universal Definition of Myocardial Infarction. Third universal definition of myocardial infarction. European Heart Journal. 2012.

/54_2.jpg)