Проблема алергії та алергічних захворювань є найбільш актуальною та найбільш складною у практиці педіатра та сімейного лікаря. На сьогодні, за даними ВООЗ, понад 40–50 % населення планети страждають від різних алергічних захворювань: бронхіальної астми, атопічного дерматиту, риніту, кон’юнктивіту, полінозу, різних проявів харчової й лікарської алергії тощо. За науковим прогнозом, очікується подальше зростання числа алергічних захворювань, тобто можна буде говорити про наявність неінфекційної пандемії.
На жаль, зараз відсутні точні дані про поширеність харчової алергічної реакції у світі: скоріше за все, це пов’язано, з одного боку, з численними проявами захворювання, що зачіпають багато органів і систем, а з іншого — із труднощами верифікації діагнозу в клінічній практиці. Згідно зі статистичними даними, у світі налічується приблизно 520 млн осіб, які страждають саме від харчової алергії. Що стосується дітей, то в малюків із кожним десятиліттям харчова алергія стає предметом серйозного занепокоєння як батьків, так і лікарів. Частота патології різко зросла за останнє десятиліття і досягає 10 % серед дитячої популяції в усьому світі. Так, у США поширеність харчової алергії в дітей віком до 18 років збільшилася на 18 %, а частота амбулаторних відвідувань, пов’язаних із даною проблемою, зросла в три рази за останні 7 років. У Канаді поширеність патології становить приблизно 7 % [1–3].
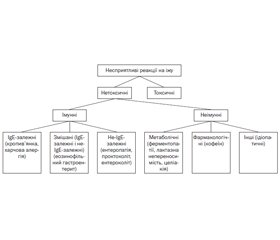
При цьому далеко не всі несприятливі реакції на їжу належать до харчової алергії. За загальноприйнятим визначенням, до харчової алергії відносять тільки імунологічно зумовлені реакції. До несприятливих реакцій на їжу належить і низка метаболічних захворювань, токсичних реакцій, непереносимість харчових продуктів тощо. Сьогодні найбільш повною, структурованою й клінічно адаптованою є класифікація проявів харчової алергії за патогенетичним принципом, наведена в керівництві з ведення хворих із харчовою алергією й анафілаксією Європейської академії алергології та клінічної імунології (European Academy of Allergy and Clinical Immunology, EAACI) [1] (рис. 1).
За цією класифікацією, алергія — це класична імунна реакція. Дослівний переклад слова «алергія» — «змінена реакція», тобто це набута болісна (підвищена, гіперреакція) реакція з боку нашої імунної системи, що виникає у відповідь на дію алергену, виявляється симптомами будь-якого алергічного захворювання. Таким чином, алергічна реакція — це патологічна форма імунної реакції, тобто це група патологічних станів, що характеризуються незвичайною й надмірною імунною відповіддю на специфічні білки їжі, можуть мати як IgE-, так і не-IgE-опосередковані механізми (рис. 2).
Серед усіх несприятливих реакцій на їжу харчова алергія є однією з найбільш обговорюваних проблем.
Безперечно, практично будь-який білковий продукт, що використовується в харчуванні дитини, особливо раннього віку, може викликати розвиток алергічних реакцій або захворювань. Однак найбільш важливим, найбільш значущим алергеном у харчуванні дітей, у тому числі і дітей раннього віку, є білок коров’ячого молока (БКМ).
Білок коров’ячого молока — найчастіша причина не тільки розвитку харчової алергії, а й інших несприятливих харчових реакцій у дітей першого року життя, насамперед гастроінтестинальної алергії. Зазвичай у практикуючого лікаря виникає чимало труднощів і помилок, пов’язаних із діагностикою гастроiнтестинальної харчової алергії. Ці помилки пояснюються як суб’єктивними, так і об’єктивними причинами, у першу чергу тим, що гастроінтестинальні реакції на їжу перебігають за не-IgE-опосередкованим механізмом.
Відповідно до цієї адаптованої класифікації, виділяють IgE-опосередковану гастроінтестинальну харчову алергію, змішані IgE-опосередковані й клітинні реакції на їжу й гастроінтестинальні прояви харчової алергії, опосередковані клітинними реакціями на їжу. А до гастроінтестинальних проявів харчової алергії, опосередкованих клітинними реакціями на їжу, відносять індукований їжею проктит, проктоколіт та індукований їжею ентероколіт.
Ентероколіт, індукований харчовими білками, або Food protein-induced enterocolitis syndrome (FPIES), зустрічається переважно в дітей першого року життя, при цьому більшість хворих на ентероколіт, індукований харчовими білками, це діти перших днів або місяців життя (від 1 до 3 міс.). FPIES класифікується як не-IgE-опосередкована алергічна реакція, що характеризується наполегливими відрижками, блюванням, вираженими рідкими випорожненнями з великою кількістю слизу, із домішками крові. Клінічні ознаки індукованого харчовими білками ентероколіту подані в керівництві з ведення дітей з алергією до БКМ Всесвітньої алергологічної організації (World Allergy Organization, WАО) [3], є цілком характерними для цього стану. За відсутності адекватної терапії FPIES поступово відмічається затримка фізичного розвитку.
Відповідно до сучасних уявлень, діагностичними критеріями FPIES є [4]: 1) вік дитини до 2 років при першому прояві (часто, але не обов’язково); 2) повторюване блювання, блідість, млявість протягом 2–4 год, що виникають у результаті впливу їжі; 3) симптоми тривають кілька годин і минають, як правило, протягом 6 год. Діарея виникає набагато рідше й пізніше (через 5–10 год); 4) відсутність симптомів, характерних для IgE-опосередкованих реакцій; 5) усунення симптомів після елімінації причинно-значущих білків із харчування дитини; 6) виникнення типових симптомів протягом 2–4 год при повторному прийомі продукту або проведенні провокаційної проби. Двох аналогічних епізодів достатньо для остаточного встановлення діагнозу без провокаційної проби.
Треба пам’ятати, що дослідження загального і специфічних IgE при FPIES не інформативні, шкірні проби теж завжди негативні. При морфологічному дослідженні характерним є активне імунне еозинофільне запалення слизової оболонки й підслизового шару тонкої кишки.
Клінічна картина білок-індукованого ентероколіту часто нагадує маніфестацію некротизуючого ентероколіту (НЕК), тим більше що часові інтервали розвитку цих двох патологічних станів збігаються. Відрізнити FPIES від НЕК можна, спираючись на морфологічні відмінності, а також застосовуючи три диференціальні правила:
1) алергія до БКМ, що виявляється ентероколітом, може розвинутися лише при впливі на кишечник продуктів, що містять БКМ (суміші на основі коров’ячого молока);
2) важливим є час виникнення симптомів від початку ентерального харчування — це в середньому 23-тя доба (що пов’язане з незрілістю імунної системи);
3) необхідно враховувати час зникнення симптомів, які при алергії до БКМ починають згасати одразу ж після виключення з раціону алергену, чого не відбувається при відміні ентерального харчування в дітей із НЕК.
Розвиток симптомів FPIES на тлі виключно грудного вигодовування відбувається вкрай рідко й обмежується окремими клінічними випадками, які пояснюються потраплянням невеликої кількості БКМ із харчування матері через грудне молоко [5].
Ентеропатія, індукована харчовими білками, або FPIE, зазвичай маніфестує у віці понад 4–6 міс. Відмінними ознаками ентеропатії є ураження ворсинок і пов’язаний із цим синдром мальабсорбції: хронічна секреторна «кривава» діарея, істотний дефіцит маси тіла, м’язова дистрофія. Ентеропатії притаманний характерний габітус дитини: великий живіт, через часте поєднання з гіпопротеїнемією можуть відзначатися набряки, швидко прогресує вторинна затримка фізичного й нервово-психічного розвитку. У випадках розвитку ентеропатії є необхідною диференціальна діагностика з целіакією, при цьому морфологічна картина білок-індукованої ентеропатії також схожа з целіакією: відзначається атрофічний ентерит із пошкодженням та атрофією ворсинок, гіперплазією крипт, запалення, але в слизовому й підслизовому шарах підвищене число еозинофілів.
Відповідно до сучасних уявлень, діагностичними критеріями ентеропатії, індукованої харчовими білками, є [4]: 1) вік дитини до 9 міс. при перших проявах; 2) схожі шлунково-кишкові симптоми (в основному блювання й відсутність збільшення маси тіла) при повторному прийомі провокуючої їжі за відсутності інших причин; 3) підтвердження діагнозу в дитини за допомогою біопсії слизової оболонки кишечника; 4) купірування симптомів протягом декількох тижнів при призначенні елімінаційної дієти з виключенням причинно-значущих продуктів (однак повне відновлення ворсинок може зайняти кілька місяців).
У дітей раннього віку й алергічна ентеропатія, і білок-індукований ентероколіт вірогідно частіше бувають обумовлені гіперчутливістю саме до БКМ, проте зрідка можливе їх поєднання з алергією на сою, яйце, пшеницю та інші продукти.
Проктоколіт, індукований харчовими білками, — це найбільш часта причина ректальної кровотечі в грудних дітей. Проктоколіт є не-IgE-опосередкованим захворюванням, викликаним імунною відповіддю проти харчових білків. Проктоколіт характеризується наявністю слизу і/або крові в калі в зовні здорового немовляти. Цей патологічний стан виникає внаслідок клітинно-опосередкованих імунних реакцій із переважною Th1-відповіддю й продукцією IL-2 і INF-γ, що викликають ураження сегментів товстої кишки.
Зазвичай захворювання дебютує протягом перших 6 місяців життя (у середньому у 2 місяці), хоча може маніфестувати з перших днів життя. Крім гемоколіту, симптомами проктоколіту можуть бути слиз у калі (у вигляді прожилок або тяжів, це навіть може бути єдиним проявом, тобто кров макроскопічно може не визначатися). При мікроскопії в слизі зазвичай виявляють підвищену кількість лейкоцитів, значна частина яких представлена еозинофілами. Іноді основні симптоми проктоколіту асоціюються з кишковою колікою і збільшенням частоти випорожнень. Незважаючи на наявність таких серйозних симптомів, як слиз і кров у випорожненнях, діти практично завжди виглядають здоровими й у них добра прибавка в масі. Це слід враховувати в диференціальній діагностиці проктоколіту, індукованого харчовими білками, з іншими захворюваннями (наприклад, кишковими інфекціями, запальними захворюваннями кишечника), при яких, як правило, поряд із симптомами гемоколіту мають місце тяжкий стан дитини, зневоднення, погана прибавка маси тіла або схуднення, а також виражені гематологічні зміни.
Поява крові в калі пов’язана з підвищеною уразливістю запаленої слизової оболонки товстої кишки, а в низці випадків із наявністю ерозій. Кров може бути змішана зі слизом або бути у вигляді вкраплень і прожилок (що часто помилково розцінюють як прояв періанальних тріщин). У будь-якому разі крововтрата, як правило, є мінімальною й не веде до розвитку змін [3, 7]. Необхідно мати на увазі, що в дітей із проктоколітом маркери атопії (атопічний дерматит, обтяжений алергічний сімейний анамнез, підвищення рівня еозинофілів у крові) зустрічаються не набагато частіше, ніж у звичайній популяції. Рідко можна виявити підвищення титру загального і специфічних IgE, а також позитивні шкірні prick-тести. Це пояснюється не-IgE-залежним механізмом розвитку даного захворювання. Для діагностичних цілей ендоскопія не потрібна, але в тих випадках, коли її проводять, виявляють еритему, контактну уразливість, ослаблення судинного рисунка й лімфонодулярну гіперплазію. У тяжких випадках виявляють ерозії в прямій кишці, іноді зміни охоплюють всю товсту кишку. При гістологічному дослідженні виявляють збільшене число еозинофілів у власній пластинці слизової оболонки (> 6 еозинофілів × 400) [8]. У тяжких випадках спостерігають проникнення еозинофілів в епітелій крипт (еозинофільний криптит), скупчення еозинофілів (еозинофільні мікроабсцеси) й наявність нейтрофілів (активне запалення).
Діагностичними критеріями проктоколіту, індукованого харчовими білками, є [4]: 1) наявність невеликої кількості крові в калі в дитини за відсутності інших клінічних симптомів; 2) зникнення симптомів після виключення всіх причинно-значущих білків; 3) виключення інших можливих причин ректальної кровотечі.
Таким чином, на сьогодні загальновизнаний діагностичний тест для проктоколіту відсутній, діагноз проктоколіту в педіатричній практиці — це клінічний діагноз, що цілком відповідає сучасним настановам. Так, Європейська академія алергології та клінічної імунології [9] у 2015 році оприлюднила гайдлайн, згідно з яким діагноз проктоколіту повинен бути заснованим на анамнезі, симптомах, клінічній історії, елімінаційній дієті, тільки іноді — на спеціально розробленій харчовій провокаційній пробі. Отже, у більшості випадків будь-яка інструментальна та лабораторна діагностика буде зайвою, оскільки правильно обрана тактика лікування вже дасть позитивний результат і буде маркером правильно встановленого діагнозу.
Частим причинним фактором проктоколіту, індукованого харчовими білками, є введення в харчування дитини сумішей на основі коров’ячого молока й сої. Синдром може розвинутися й у дітей, які перебувають виключно на грудному вигодовуванні (згідно зі статистикою, у 60 % випадків проктоколіт розвивається саме в дітей на природному вигодовуванні) [8], у цьому випадку імунна відповідь спрямована на продукти, що входять у раціон матері, але при елімінації з харчування дитини і/або матері-годувальниці продуктів, що містять БКМ (і сої), купірування ознак явної кровотечі відбувається протягом 72 год [6].
Якщо дитина отримує материнське молоко, то грудне вигодовування зберігається в максимальному обсязі, а лікування проктоколіту полягає в елімінації алергену з раціону матері-годувальниці (якщо дитина перебувала на природному вигодовуванні) або переведенні на суміші з глибоким гідролізом білків (якщо дитина перебувала на штучному вигодовуванні та отримувала суміш на основі коров’ячого молока або сої). Згідно з настановами та гайдлайнами, не рекомендується застосування будь-яких сумішей на основі часткових гідролізатів: існує доказова база, яка підтверджує, що часткові гідролізати (сироватка або казеїн) можуть знижувати ризик розвитку харчової алергії в дітей із групи ризику порівняно з використанням сумішей на основі незбираного білка (за умови виключення БКМ із раціону дитини), тобто такі замінники грудного молока будуть ефективними тільки для профілактики харчової алергії, а не для її лікування. Отже, у більшості випадків проктоколіту, що з’явився в дитини, яка перебуває на штучному вигодовуванні, першим вибором є суміш — глибокий гідролізат (eHF) [2, 10, 11].
Прикладом таких сучасних замінників грудного молока можуть бути суміші-гідролізати, що випускаються в Нідерландах компанією FrieslandCampina, — Friso PEP та Friso PEP АС.
Friso PEP — глибокий гідролізат сироваткового білка, який зазвичай використовується для лікування при легких і середньотяжких формах харчової алергії. Склад Friso PEP відповідає особливим нутритивним потребам дітей із симптомами алергії до білків коров’ячого молока, забезпечуючи дитину всіма необхідними поживними речовинами для підтримки здорового зростання й розвитку. Суміш можна використовувати як частину спеціальної дієти — як єдине джерело харчування, можна використовувати для приготування страв прикорму, також вона підходить і для тривалого вигодовування завдяки збалансованому складу — комплексу антиоксидантів, нуклеотидів, максимально фізіологічному вуглеводному профілю (лактоза — 46 % від загальної кількості вуглеводів, підтримка активності лактази, пребіотичний ефект, забезпечення кращого засвоєння Ca); максимально фізіологічному жировому профілю (немає СЦТ + немає слідів білка); майже ідеальному з алергологічної точки зору білковому складу (8 % пептидів із молекулярною масою < 3,5 kDa, тобто не мають алергопотенціалу; менше 1 % пептидів > 6 kDa; 16 % пептидів — 2–10 kDa, тобто сприяють виробленню оральної толерантності). Крім того, загальна низька кількість амінокислот забезпечує суміші гарну органолептику, що є важливим для високої комплаєнтності маленьких пацієнтів.
Жировий компонент гідролізатів представлений рослинними тригліцеридами, у молекулу яких входять довголанцюгові жирні кислоти. Суміш рослинних олій містить велику кількість ненасичених жирних кислот, у тому числі збалансоване співвідношення незамінних жирних кислот — лінолевої й альфа-ліноленової, що є попередниками довголанцюгових ненасичених жирних кислот омега-6 і омега-3 відповідно. Останні виконують важливі біологічні функції, входячи до складу мембран клітин головного мозку й сітківки.
Традиційно вважається, що сироваткові гідролізати є більш фізіологічними, оскільки сироватковий білок є основним білком жіночого молока. Крім того, сироваткові гідролізати мають більш приємні смак і запах порівняно із сумішами на основі гідролізу казеїну. Однак при високому ступені сенсибілізації до білків коров’ячого молока, тяжкому перебігу захворювання, несприятливій реакції на сироваткові гідролізати більш ефективним є використання казеїнових гідролізатів. Це обумовлене тим, що казеїнові гідролізати містять більшу кількість пептидів із низькомолекулярною масою, ніж сироваткові, тому алергічні реакції при їх вживанні практично не зустрічаються.
Friso PEP АС — це глибокий гідролізат казеїну, якій містить велику кількість пептидів із мінімальною молекулярною масою — 3500 Da. Тому вважається, що алергічні анафілактичні реакції при його вживанні зустрічаються вкрай рідко. Лікарі зазвичай роблять вибір на користь казеїнових гідролізатів тоді, коли стикаються з тяжкими формами алергії в дитини (FPIES або FPIE), або ж тоді, коли вживання сироваткових гідролізатів неможливе або небажане.
Friso PEP АС (АС — Allergy Care) має доведену клінічну ефективність для дітей із тяжкими проявами харчової алергії, а також при поєднанні шкірних проявів алергії з гастроінтестинальними (відрижки, запори, коліки) та може використовуватися для тривалого вигодовування. Суміш містить лінолеву й α-ліноленову кислоти (незамінні омега-3 й омега-6 жирні кислоти для розвитку мозку й органів зору), нуклеотиди, що підтримують розвиток імунної системи, холін, рослинні довголанцюгові жири, склад яких максимально наближений до грудного молока й не відрізняється від стандарту адаптованих молочних сумішей. Не містить лактозу, яка при наявності синдрому мальабсорбції, характерного як для ентеропатії, так і для ентероколіту, буде погіршувати клінічний перебіг захворювання. Також важливим є те, що завдяки низькій кількості вільних амінокислот забезпечується оптимальне використання всмоктувальної здатності тонкої кишки, що сприятиме зменшенню діарейного синдрому й нормалізації моторної функції кишечника.
Для дітей із гастроінтестинальними проявами харчової алергії й синдромом мальабсорбції, зумовленими алергією до білка коров’ячого молока, перевагу слід віддавати спеціалізованим сумішам, які легко всмоктуються в систему ворітної вени, минаючи лімфатичні судини, не потребуючи емульгування й участі панкреатичної ліпази. З огляду на особливості ліпідного складу подібних сумішей вони призначаються й у випадках вираженого порушення нутритивного статусу у хворих з алергічною патологією.
Таким чином, використовуючи лінійку сумішей-гідролізатів, що випускаються компанією FrieslandCampina, як приклад, можна сказати, що за наявності більш тяжких клінічних форм захворювання, таких як білок-індукований ентероколіт або білок-індукована ентеропатія, слід віддавати перевагу казеїновому гідролізату (Friso PEP AC). У разі більш легкої форми розвитку хвороби, за наявності білок-індукованого проктоколіту, перевагу треба віддавати сироватковому гідролізату (Friso PEP).
Однак у 10 % випадків розвиток проктоколіту можливий у дітей, які отримували суміші на основі високогідролізованих білків коров’ячого молока [2, 9, 10]. У цій ситуації дитину переводять на амінокислотні суміші, що веде до повного зникнення симптомів. Так, суміш на основі амінокислот (AAF) рекомендується як перший вибір при анафілаксії й еозинофільному езофагіті; як другий вибір — при непереносимості eHF [11].
Соєві суміші в даний час обмежено використовуються в дітей з алергією до БКМ і не рекомендуються при гастроінтестинальних проявах алергії. Висока частота перехресних реакцій до білків коров’ячого та козячого молока робить недоцільним застосування з лікувальною метою сумішей на основі козячого молока через наявність гомологічних амінокислотних послідовностей. До речі, усіма міжнародними товариствами, гастроентерологами, алергологами й нутриціологами [9] не рекомендується використання в харчуванні дітей з алергією до БКМ продуктів і сумішей на основі молока інших тварин у зв’язку з високою частотою перехресних алергічних реакцій — до 95 % (для козячого молока).
Тривалість діагностичної дієти, згідно з клінічними рекомендаціями, залежить від форми харчової алергії. Вона повинна бути максимально короткою, але достатньою для того, щоб оцінити зникнення або стабілізацію клінічних симптомів. Пацієнтам з мальабсорбцією, а також із затримкою показників фізичного розвитку (FPIES або ентеропатія, що індукована харчовими білками) для оцінки відповіді на елімінаційну дієту може знадобитися не менше 2–4 тижнів [10]. Якщо діагноз буде підтвердженим, то рекомендується суворе дотримання дієтотерапії протягом 12–18 місяців, а дані про розвиток толерантності варіюють: у середньому від 2–3 до 5 років. Якщо за ці терміни симптоматика не знімається, наявність алергії до передбачуваного продукту малоймовірна; проте слід пам’ятати, що в таких випадках необхідно виключити множинний характер харчової алергії [10]. У разі наявності проктоколіту, що індукований харчовими білками, розвиток толерантності відбувається до віку від 1 до 3 років, більшість досягає клінічної толерантності до 1 року життя.
Прогноз розвитку толерантності залежить від віку пацієнта й титру sIgE на момент встановлення діагнозу. У разі виникнення IgE-негативних гастроінтестинальних алергічних захворювань, що супроводжуються гемоколітом, термін розвитку толерантності може досягати 100 % пацієнтів до 5 років [12].
Підсумовуючи вищевикладене, можна процитувати основні тези, викладені в рекомендаціях EAACI, 2015 [9], а саме:
1. Формули на основі глибокого гідролізу білка коров’ячого молока — перший вибір у дітей грудного та раннього віку.
2. Дані суміші повинні забезпечувати адекватне зростання й розвиток (важливо в дітей перших 6 місяців життя до введення продуктів прикорму).
3. Формули на основі окремих амінокислот також можуть бути рекомендовані для пацієнтів із тяжкими симптомами.
4. Соєві суміші не слід рекомендувати до 6 місяців і в будь-якому віці при наявності шлунково-кишкових симптомів.
5. У дітей від 6 до 12 місяців життя призначення соєвих сумішей повинно розглядатися на індивідуальній основі.
6. Формули на основі частково гідролізованого білка не є показаними для лікування алергії до БКМ.
Таким чином, зараз для створення повноцінного раціону дітям, які страждають на алергію до БКМ, широко використовуються спеціалізовані продукти, а саме суміші на основі високогідролізованого молочного білка або амінокислот [2, 9, 11, 12]. І тільки своєчасно призначена адекватна дієта й подальше суворе дотримання елімінаційних раціонів є єдино ефективною тактикою ведення дітей, які страждають на гастроінтестинальні форми алергії.
Конфлікт інтересів. Не заявлений.

/68.jpg)