Вступ
Вітамін D має широкий спектр ендокринної, автокринної та паракринної активності й чинить багатогранний вплив на організм людини: він бере участь у регуляції метаболізму кальцію й фосфатів, у підтримці функціонування імунної та ендокринної систем, у процесах згортання крові, у запобіганні розвитку автоімунних та алергічних захворювань, гальмує утворення і зростання пухлин [1, 2]. Масштабність впливу вітаміну D на організм людини підкреслює поширеність розподілу рецепторів вітаміну D (VDR) і ферментів метаболізму вітаміну D — CYP24A1 і CYP27B [2]. Загальновідомим проявом дефіциту вітаміну D у дітей є рахіт з ураженням опорно-рухового апарату. Важлива роль цього вітаміну в роботі імунної системи до пандемії COVID-19 згадувалася рідше, проте з появою цього захворювання набула широкого розголосу. Отже, у цій публікації розглянута передусім роль вітаміну D у впливі на імунну систему, що є особливо важливим для дитини, яка розвивається та набуває імунного захисту при взаємодії з оточуючим середовищем.
Роль вітаміну D в імунній системі
Вітамін D є одним з основних медіаторів вроджених імунних реакцій [2, 3]. VDR і метаболічні ферменти вітаміну D присутні практично в усіх клітинах вродженої й адаптивної імунної системи [2]. Клітини імунної системи продукують 1,25-дигідроксивітамін D (1,25(OH)2D) локально, а експресія CYP27B1 регулюється в цих клітинах за допомогою імунорегуляторних каналів, а не змінами в гомеостазі кальцію [3].
Стимуляція утворення 1,25(OH)2D здійснюється декількома медіаторами, а саме інтерфероном γ (IFNγ), Toll-подібними рецепторами після їх взаємодії з ліпополісахаридами, ліпопротеїнами й іншими молекулярними компонентами мікроорганізмів. 1,25(OH)2D, у свою чергу, стимулює синтез низькомолекулярних катіонних антимікробних пептидів (кателіцидин і β-дефензини), які справляють виражений гальмівний вплив на бактерії, гриби й деякі віруси (наприклад, вірус грипу, парагрипу, респіраторно-синцитіальний вірус, риновіруси) [4, 5]. Ці білки секретуються моноцитами, нейтрофілами, макрофагами, природними клітинами-кілерами (NK-клітини), епітеліальними клітинами дихальних шляхів, шлунково-кишкового тракту, шкірних покривів [6]. Антимікробні пептиди можуть знищити патогенні мікроорганізми протягом декількох хвилин, виступаючи захистом першої лінії, що запобігає розвитку захворювання [7]. In vitro кателіцидин продемонстрував ефективність проти стійких до антибіотиків штамів Pseudomonas aeruginosa [4] і мікобактерій туберкульозу [8]. Активна форма вітаміну D здатна регулювати вроджений імунітет та індукувати вироблення hCAP (промотор кателіцидину). У моноцитах/макрофагах активація Toll-подібних рецепторів викликає експресію VDR та локалізований синтез 1,25(OH)2D, що, у свою чергу, посилює синтез hCAP. Додаткові дослідження показали, що hCAP виступає посередником автофагії, спричиненої вітаміном D [60].
Дефензини мають антибактеріальну, протигрибкову і противірусну активність. За рахунок хемотаксису вони залучають до вогнища запалення моноцити, Т-лімфоцити, дендритні й опасисті клітини, впливають на процеси проліферації та загоєння ран [8].
Епідеміологічні дані пов’язують дефіцит вітаміну D із підвищеною сприйнятливістю до гострих респіраторних вірусних інфекцій (гострих респіраторних захворювань, ГРЗ) [11]. У кількох дослідженнях in vitro було виявлено, що вітамін D захищає дихальні шляхи від респіраторних патогенів не тільки шляхом стимулювання експресії антимікробних пептидів, а й через безпосередній вплив на реплікацію респіраторних вірусів [10, 11].
В експериментальних умовах обробка клітин дихального епітелію розчином 25-гідроксивітаміну D (25(OH)D) викликала тимчасову резистентність до риновірусів, послаблювала індуковану вірусами експресію генів, що кодують молекулу міжклітинної адгезії (глікопротеїн клітинної поверхні, який є клітинним рецептором для риновірусів) і рецептор фактора активації тромбоцитів (рецептор, який бере участь в адгезії Streptococcus pneumoniae до клітин респіраторного епітелію). Ці ефекти були пов’язані з підвищеною експресією генів, що кодують інгібітор NF-κB IκBα і кателіцидин [10].
Вітамін D сприяє дозріванню й диференціюванню моноцитів і макрофагів, підвищує їх хемотаксичну та фагоцитарну активність [3], підвищує здатність макрофагів продукувати макрофаг-специфічні поверхневі антигени, лізосомальний фермент кислу фосфатазу й секретувати H2O2, що необхідно для забезпечення їх антимікробної функції [15]. Оксидантна реакція має й антивірусний ефект [15], хоча аномальна індукція може призвести до пошкодження тканин, що спостерігається, наприклад, при інфекції грипу [32]. У даному випадку важливо відмітити, що прийом вітаміну D зменшує експресію прозапальних та збільшує експресію протизапальних цитокінів макрофагами за допомогою регуляції фосфатази MAPK-1 та пригнічення активації р38 [59], що збалансовує рівновагу в імунній системі.
З одного боку, вітамін D в активованих макрофагах і дендритних клітинах знижує транскрипцію інтерлейкіну (IL) 12, продукцію запальних цитокінів і хемокінів (наприклад, IFNγ, IL-17 і IL-21), направляючи диференціювання Th0 клітин в Th2-клітини, підвищуючи продукцію IL-4, IL-5 і IL-10, цитокінів [13]. Індукований IL-10 також пригнічує клітини Th1 і Th17 і, відповідно, продукцію IFNγ, IL-17 і IL-2, що призводить до імунної толерантності [13]. Таким чином, вітамін D справляє імуномодулюючий вплив на інтерлейкіновий та цитокіновий баланс, запобігаючи надмірній активації імунної системи, що є вкрай важливим для гальмування запальної реакції при деяких захворюваннях.
З іншого боку, вітамін D — імуносупресивний гормон, кальцитріол інгібує проліферацію та диференціювання Т- і В-лімфоцитів, але вироблення кальцитріолу дендритними клітинами «програмує» хоумінг Т-клітин до епідермісу, що має важливе значення для тривалого імунного нагляду та підтримки цілісності бар’єра. Вітамін D пригнічує ефекторні функції Т-хелперів і цитотоксичних Т-клітин, але сприяє розвитку регуляторних Т-лімфоцитів, що пригнічують опосередковане імунітетом запалення. Вітамін D інгібує вироблення IL-2 та IFNγ. Кальцитріол пригнічує вироблення антитіл В-клітинами, стимульованими IL-2. Вітамін D сприяє переробці антигенів, відіграє роль у знижувальному регулюванні головного комплексу гістосумісності 2-го типу (MHC-II) [59].
Варто відмітити, що NK-клітини, стимульовані через VDR, у комплексі забезпечують захист організму не лише від внутрішньоклітинних патогенів, а й від автоімунних захворювань [12]. Вітамін D чинить інгібуючий вплив на клітини Th17 і продукцію IL-17, які сприяють ураженню власних тканин при автоімунних захворюваннях (розсіяний склероз, псоріаз, автоімунний увеїт, інсулін-залежний діабет, ревматоїдний артрит, хвороба Крона, атопічний дерматит) [12, 14].
Більше того, нещодавнє дослідження на мишах показало, що активовані форми вітаміну D знижують пошкодження легень, викликане забрудненням повітря, і сприяють відновленню легеневої тканини шляхом блокування сигнального шляху трансформуючого фактора росту β1 і модуляції локальної експресії MMP9, полегшуючи ремоделювання тканин [16].
Алергени, як і інфекційні патогени, через експресію CYP27B1 і утворення 1,25(OH)2D можуть запускати транскрипцію понад 1000 генів [17], включаючи гени, що регулюють активність гладеньких м’язів бронхів. У деяких дослідженнях виявлена зворотна залежність між рівнем 1,25(OH)2D у сироватці крові хворих із бронхіальною астмою й реактивністю дихальних шляхів [17].
Дослідження показали статистично значущий зв’язок між низьким рівнем вмісту вітаміну D в організмі внаслідок недостатньої профілактики гіповітамінозу та запаленням глоткового і піднебінних мигдаликів у дітей шкільного віку [57]. Достатній рівень вітаміну D може впливати (збільшувати) на рівень гормону тимуса тимозину β4 — виявлена позитивна кореляція [61].
Роль вітаміну D при захворюваннях дихальної системи
Крім профілактики рахіту було встановлено, що дефіцит вітаміну D може призвести до більш тривалого ГРЗ: середня тривалість ГРЗ в осіб групи з дефіцитом вітаміну D становила 4–13 днів, без дефіциту — 2–8 днів [19]. П’ять метааналізів продемонстрували, що додаткове призначення препаратів вітаміну D дорослим і дітям дозволяє знизити ризик розвитку гострих респіраторних інфекцій верхніх дихальних шляхів і загострень бронхіальної астми [22–24]. Кращі результати спостерігалися в пацієнтів із низьким початковим рівнем вітаміну D [22–24].
При аналізі 25 рандомізованих контрольованих досліджень із включенням 10 933 учасників віком від 0 до 95 років було виявлено, що добавки вітаміну D на 12 % знижували ризик виникнення гострої інфекції дихальних шляхів серед всіх учасників (р < 0,001). Захисний вплив спостерігався в підгрупі дітей, які отримували вітамін D щодня або щотижня без додаткових болюсних доз, на відміну від тих, хто отримував одну або кілька болюсних доз без регулярного вживання профілактичних доз. Серед дітей, які отримували вітамін D щодня або щотижня, захисний вплив був більш виражений при вихідному рівні 25(OH)D < 25 нмоль/л [23].
У систематичному аналізі 24 досліджень виявили зворотний нелінійний зв’язок між концентрацією 25(OH)D та ризиком розвитку гострої інфекції дихальних шляхів: найбільший ризик виникав при концентрації 25(OH)D < 37,5 нмоль/л [24]. При цьому встановлено, що при кожному зниженні концентрації 25(OH)D на 10 нмоль/л імовірність розвитку гострої інфекції дихальних шляхів збільшувалася на 1,02 (довірчий інтервал 0,97–1,07).
У метааналізі 12 досліджень із включенням 2279 учасників було виявлено, що в дітей із захворюваннями нижніх дихальних шляхів середні рівні вітаміну D були значно меншими порівняно з контрольною групою практично здорових дітей. Також була виявлена кореляція між рівнями вітаміну D, частотою й тяжкістю захворювань [25].
В одному з останніх метааналізів недостатність 25(OH)D реєструвалась у 64,0 % дітей із сепсисом (18 досліджень із включенням 889 дітей, р < 0,0001) та у 48,7 % дітей з інфекціями дихальних шляхів (25 досліджень із включенням 2699 хворих, р < 0,0001). При цьому діти з недостатністю 25(OH)D мали підвищений ризик смертності [43].
У дослідженнях, проведених в Монголії, виявили, що в дітей із середньою вихідною концентрацією 25(OH)D 7,5 нг/мл в крові щоденні добавки вітаміну D в дозі 300 МО привели до зниження частоти ГРЗ на 50 % [26].
У рандомізованому клінічному дослідженні при вивченні впливу вітаміну D на частоту захворювання на сезонний грип А та В серед дітей віком від 6 до 15 років було виявлено, що добавка вітаміну D знижувала частоту грипу A [27]. Сприятливий вплив вітаміну D у хворих на грип пов’язують із пригніченням «цитокінової бурі» — надмірної хаотичної активації імунної системи, що при тяжкому перебігу захворювання супроводжується ураженням альвеол [28]. Як відомо, саме «цитокінова буря» призводить до тяжкого перебігу COVID-19 [50], що також відноситься до ГРЗ. Однак у деяких метааналізах ефекту вітаміну D на запобігання ГРЗ та пневмонії не виявили [28, 29], що, можливо, було пов’язане з достатньо високим вихідним рівнем 25(OH)D в досліджуваних осіб.
Учені з медичної школи Бостонського університету проаналізували, як впливає рівень вітаміну D в крові на тяжкість захворювання і показник смертності при COVID-19 (обстежені майже 200 тисяч осіб). Виявилося, що у хворих на COVID-19 із достатнім рівнем вітаміну D (понад 30 нг/мл у плазмі крові) ризик позитивного результату тестування на COVID-19, несприятливих клінічних наслідків (розвиток тяжких ускладнень або смерті) значно нижчий. Графік за результатами дослідження демонструє, що чим нижча концентрація в крові 25(ОН)D, тим вищий ризик позитивного результату на COVID-19 [29]. На сьогодні в усьому світі проводиться понад 50 клінічних досліджень, присвячених ролі вітаміну D у профілактиці/лікуванні/зменшенні смертності від COVID-19 [62].
У систематичному огляді рандомізованих контрольованих досліджень, у яких вивчали вплив добавок вітаміну D, було показано, що в дітей і дорослих вітамін D знижує частоту виникнення кортикостероїд-залежних загострень бронхіальної астми на 36 % і на 61 % зменшує частоту госпіталізацій [30]. Результати Кокранівського систематичного огляду дев’яти досліджень пацієнтів із бронхіальною астмою в дорослих та дітей також продемонстрували значний захисний вплив додавання вітаміну D на зменшення кількості випадків загострень захворювання [30].
У деяких дослідженнях виявили, що при проведенні вакцинації додавання вітаміну D може підвищити рівень захисного імунітету. В експериментальних умовах при вакцинації зрілих дорослих мишей вакциною проти поліомієліту, Haemophilus influenzae типу b, дифтерії та вірусного гепатиту В додавання 1,25(OH)2D посилювало системну імунну відповідь та вироблення антиген-специфічного імунітету в слизових оболонках, а саме рівні IgA і IgG [31]. Також вітамін D, що вводився разом із тривалентною вакциною проти грипу, посилював гуморальну імунну відповідь проти гемаглютиніну вірусів і місцевий імунітет слизових оболонок [32]. Одночасне застосування 1,25(OH)2D із тривалентною вакциною проти грипу на мишах посилює як місцеву відповідь, так і системну специфічну реакцію з утворенням специфічних антитіл, результатом чого була нейтралізація живого вірусу грипу, нанесеного на слизову оболонку носової порожнини тварин [60]. Дослідження на моделях тварин показують, що кальцитріол індукує міграцію дендритних клітин із місця вакцинації до місцевих лімфатичних вузлів та стимулює антиген-специфічні клітини Т та В, збільшуючи вироблення антитіл, спричинених дією вакцин [20].
Роль вітаміну D при захворюваннях шлунково-кишкового тракту
У метааналізі 13 досліджень виявлено взаємозв’язок між запальними захворюваннями кишечника й низьким рівнем 25(OH)D, причому на тлі загострення хвороби Крона реєструвалися більш низькі концентрації вітаміну D в крові [33]. Додавання вітаміну D дітям із запальними захворюваннями кишечника супроводжувалося підвищенням рівня 25(OH)D в крові (р < 0,05) і зниженням активності захворювання [34].
У метааналіз з вивчення зв’язку між рівнем
25(OH)D й наявністю інфекції, викликаної Clostridium difficile, увійшли вісім публікацій із включенням 4479 пацієнтів. Було виявлено, що середня концентрація 25(OH)D в пацієнтів із даною інфекцією була на 3,54 нг/мл нижчою, ніж у пацієнтів без неї. Пацієнти з меншим рівнем 25(OH)D в крові (< 20 нг/мл) мали вищі шанси на розвиток тяжкого перебігу інфекційного захворювання, спричиненого Clostridium difficile, порівняно з пацієнтами з більшим рівнем 25(OH)D [35]. Вплив дефіциту вітаміну D на імунні функції: порушений склад мікробіоти кишечника, зменшена кількість лімфоцитів, зменшена маса органів лімфатичної системи, порушені імунні можливості (здатності) макрофагів (включаючи антимікробні функції). У свою чергу, кальцитріол допомагає відновити функції макрофагів [59].
Кальцитріол також стимулює експресію білка щільного міжклітинного з’єднання, Е-кадгерину та конексину-43 у шлунково-кишковому тракті, які функціонують як структурні попередники щільних контактів та забезпечують зв’язок між цитозолем та позаклітинним середовищем кишкового бар’єра. Вони також підтримують бар’єрну функцію епітелію нирок та посилюють бар’єрну функцію епітелію рогівки [59].
Шлунково-кишковий тракт є важливою захисною лінією, у якій епітеліальні клітини забезпечують фізичний та біохімічний бар’єр і співпрацюють з імунними клітинами та мікрофлорою кишечника для посилення кишкового бар’єра, боротьби з патогенами та обмежують їх прямий контакт з епітелієм [59].
Таким чином, недостатній рівень вітаміну D в організмі може сприяти не лише порушенню мінералізації кісток, а і зниженню імунітету, розвитку автоімунних і алергічних порушень, запальних захворювань кишечника.
Причини дефіциту вітаміну D
Гіповітаміноз D може бути як екзогенного, так і ендогенного походження. Вплив сонячного світла, а саме ультрафіолетових променів із довжиною хвилі 280–310 нм, що викликає вироблення вітаміну D3 в шкірі, є основним джерелом ендогенного вітаміну D в організмі. Іншими джерелами синтезу вітаміну D можуть бути ергокальциферол і ергостерол — стероїди, що надходять із їжею, із яких утворюється й активується вітамін D2 [36]. Ергокальциферол міститься в печінці риб, морепродуктах, кисломолочних продуктах, твердому сирі, рослинній олії й вершковому маслі, у жовтках. У молоці його рівень невеликий, до того ж його засвоєння в кишечнику утруднюється через фосфор, присутній у молоці. Ергостерол міститься в дріжджах, злаках, картоплі, петрушці.
В Україні сонце активне тільки 3 місяці, а гостра нестача ультрафіолету триває з жовтня по квітень. Таким чином, для профілактики розвитку нестачі вітаміну D жителям України необхідно додатково застосовувати препарати вітаміну D, особливо малюкам на грудному вигодовуванні.
Забрудненість повітря, переважання туманних днів, географічна широта понад 40 градусів, темна шкіра та одяг знижують вироблення вітаміну D у шкірі. У густонаселених регіонах помірного клімату, особливо в Північній Європі, період, коли синтез вітаміну D у шкірі не може відбуватися, триває понад 6 місяців протягом року [1]. Сонцезахисні засоби з SPF15 і більше можуть знизити синтез вітаміну в шкірі на 98 % [37].
Крім дефіциту сонячного світла, причинами гіповітамінозу D можуть бути неповноцінне харчування з недостатнім споживанням їжі, що містить провітамін D2, й ендогенні фактори.
До ендогенних причин гіповітамінозу D відносять [37, 38]:
1) порушення процесів всмоктування вітаміну D в кишечнику, що спостерігається при синдромі мальабсорбції, целіакії, обструкції жовчовивідних шляхів, муковісцидозі, ожирінні;
2) порушення процесів гідроксилювання неактивних форм вітаміну D в його активні форми (вітамін D3) в печінці та нирках. Це може бути пов’язане з хронічними захворюваннями цих органів, а також із генетичними порушеннями процесів синтезу вітаміну D3;
3) вживання деяких ліків (ізоніазид, рифампіцин, антиконвульсанти);
4) відсутність або порушення функціональної активності рецепторів до вітаміну D.
Деякі люди мають генетичну схильність до розвитку гіповітамінозу. Обстеження близько 30 000 американців європейського походження виявило зв’язок відносного гіповітамінозу D з поліморфізмом одиночних нуклеотидів у чотирьох генах: у гені DHCR7, що бере участь у біосинтезі холестерину, у генах CYP2R1 і CYP24A1, що кодують білки, відповідальні за гідроксилювання, і в GC-кодованому гені, який відповідає за VD-зв’язуючий білок, необхідний для транспортування вітаміну D [38]. Аналогічні дані були отримані і при обстеженні інших етнічних груп [37, 38].
Запобігання дефіциту та оптимальні дози вітаміну D
Дефіцит вітаміну D (рівень 25(ОН)D у крові < 50 нмоль/л) прискорює обмін кісткової тканини, втрату кісткової маси й спричинює остеопорозні переломи [2]. Систематичне щоденне введення 400 МО вітаміну D запобігає розвитку рахіту. Наприклад, у Туреччині така тактика сприяла зниженню захворюваності на рахіт з 6 до 0,1 % [21]. Відповідно до Рекомендацій глобального консенсусу щодо запобігання харчовому рахіту (2016 рік), вживання 400 МО/добу (10 мкг/добу) вітаміну D є достатньою дозою для профілактики рахіту, це рекомендується для всіх немовлят від народження до 12-місячного віку, незалежно від способу годування [18].
У немовлят 400 МО/добу вітаміну D, що вводиться як добавка до харчування, достатньо для запобігання рентгенологічним ознакам рахіту, навіть серед немовлят, народжених із дефіцитом вітаміну D [18].
Доза 400 МО/добу підтримувала рівень
25(OH)D > 50 нмоль/л у 97 % немовлят після 12 місяців; дози 800 та 1200 МО/добу не дали додаткової користі щодо параметрів мінеральної щільності кісток, а доза 1600 МО/добу викликала занепокоєння щодо потенційної токсичності [18].
Після 12-місячного віку всі діти та дорослі повинні задовольняти свої харчові потреби у вітаміні D сукупно за рахунок харчування та/або добавок у загальній кількості щонайменше 600 МО/добу (15 мкг).
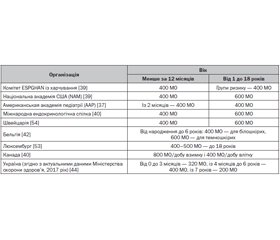
Розрізняють тяжкий дефіцит вітаміну D (можливий розвиток рахіту й розм’якшення кісток у дітей), недостатній рівень (може призводити до дефіциту вітаміну D), достатній рівень вітаміну D (адекватний рівень для функціонування організму й підтримання загального здоров’я) і токсичний рівень (може мати несприятливі наслідки для здоров’я). У різних рекомендаціях ці рівні можуть варіювати (табл. 1).
Група у складі 33 експертів із дитячої ендокринології, педіатрії, харчування, епідеміології, охорони здоров’я та економіки охорони здоров’я, які представляли 11 організацій, ухвалила й опублікувала рекомендації з профілактики та лікування рахіту [18]. Відповідно до них достатнім рівнем вітаміну D вважається рівень 25(OH)D у крові понад 50 нмоль/л (20 нг/мл), недостатнім — між 30–50 нмоль/л, дефіцит — нижче від 30 нмоль/л (12 нг/мл), токсичним — понад 250 нмоль/л. Світовий консенсус із профілактики рахіту рекомендує додаткове до їжі споживання 400 МО/добу (10 мкг) вітаміну D від народження до мінімум 12-місячного віку, незалежно від режиму годування. Ця рекомендація підтверджується результатами численних досліджень, демонструючи, що зазначена універсальна доза добавки вітаміну D пов’язана з хорошою прихильністю [52]. Вищезазначена група експертів рекомендувала щоденний прийом вітаміну D для дітей віком до 1 року в дозі 400 МО і 600 МО для дітей віком понад 1 рік і дорослих, що збігається з рекомендаціями Національної академії США (NAM) та ендокринологічного товариства. Однак спільнота ендокринологів не виключає, що в окремих випадках для досягнення й підтримки рівня 25(OH)D в сироватці 75 нмоль/л (30 нг/мл) може знадобитися до 2000 МО вітаміну D/день [41]. Тим не менше в усьому світі не надходило повідомлень про рентгенографічно підтверджений рахіт у немовлят або дітей, які регулярно щодня отримують 400 МО вітаміну D [18].
На сьогодні метою профілактичного прийому вітаміну D є не тільки запобігання розвитку рахіту, а й підтримка оптимального сироваткового рівня 25(OH)D для повноцінного функціонування організму. Кількість вітаміну D в материнському й коров’ячому молоці невелика, а немовлята зазвичай мало перебувають під прямими сонячними променями, тому діти на грудному вигодовуванні в першу чергу потребують додаткових джерел вітаміну D [2].
Пренатальна добавка вітаміну D для вагітних 400 МО/добу з подальшим вживанням матір’ю 6400 МО/добу протягом періоду лактації дає дитині кількість вітаміну D, порівнянну з такою, яку б дитина отримувала з добавками, — 400 МО/добу. Проте вживання матір’ю такої високої дози вітаміну D можливе тільки в тому випадку, якщо виконуються спостереження за сироватковими рівнями кальцію та фосфору матері і контролюється функціональний стан нирок [42]. Однак такий підхід не став поширеним, зважаючи на потенційний ризик регулярного прийому високих доз для матері дитини.
Загалом у різних країнах несуттєво різняться профілактичні дози щоденного прийому вітаміну D серед дітей.
У Канаді профілактична доза вітаміну D становить 800 МО/добу взимку і 400 МО/добу влітку, у Болгарії — 800 МО/добу протягом усього року, у Румунії — 400 МО/добу [40]. Міністерство охорони здоров’я Туреччини рекомендує прийом як мінімум 400 МО/добу вітаміну D від народження до 1 року, незалежно від типу вигодовування [20]. Для запобігання рахіту та/або досягнення вмісту 25(ОН)D вище від 20 нг/мл зазвичай досить дози 400 МО вітаміну D [42].
Відповідно до національних рекомендацій Польщі, доношені новонароджені та немовлята віком 0–6 місяців мають отримувати 400 МО вітаміну D на добу з перших днів життя, незалежно від характеру вигодовування; діти 6–12 місяців — 400–600 МО/добу залежно від того, яку кількість вітаміну D вживають із продуктами харчування; діти 1–10 років потребують сумарної кількості вітаміну D з продуктами харчування та у вигляді добавок до харчування від 600 до 1000 МО/добу [56].
Організація «Громадське здоров’я» в Англії радить дітям віком понад 1 рік вживати вітамін D у дозі 400 МО/добу. Були досліджені наявні в продажу дитячі полівітаміни та вітаміни D. Установлено, що мало полівітамінних препаратів містять рекомендовану кількість вітаміну D — 400 МО/добу. Лікарі повинні знати про це, рекомендуючи добавки вітаміну D, і радити батькам обирати продукт, що містить вітаміну D ≥ 400 МО/добу [51].
У деяких рекомендаціях також вказується верхня межа дозування вітаміну D. NAM, наприклад, рекомендує, щоб споживання вітаміну D не перевищувало 2000 МО/день у дітей віком 1–10 років і
4000 МО/день — у дітей віком понад 10 років і дорослих [40]. Застосування високих болюсних доз рекомендується тільки для лікування рахіту. Високі концентрації 25(OH)D можуть викликати гіперкальціємію, гіперкальціурію, а при тривалому прийомі — нефрокальциноз і ниркову недостатність. У здорових дітей гіперкальціємія й гіперкальціурія за відсутності підвищених концентрацій 25(OH)D можуть бути пов’язані з генетичними змінами метаболізму вітаміну D [18].
В одному дослідженні при введенні двох болюсних доз 100 000 МО вітаміну D3 з інтервалом в 3,5 місяця без щоденних добавок виявили швидке збільшення рівня 25(OH)D в сироватці крові через 10 днів після болюсної дози. Однак рівень 25(OH)D в сироватці крові повернувся до вихідних рівнів через 3,5 місяця і відповідав показникам у групі плацебо [45]. Ці дані узгоджуються з результатами інших досліджень, що вказує на необхідність щоденного вживання додаткового джерела вітаміну D, а не болюсних доз.
Неефективність болюсних доз для профілактики дефіциту вітаміну D може бути пов’язана з тим, що високі циркулюючі концентрації після болюсного введення можуть хронічно порушувати регуляцію активності ферментів, відповідальних за синтез і деградацію 1,25(OH)2D, що призводить до зниження концентрації цього метаболіту у тканинах поза нирками [46]. Це може послабити здатність 1,25(OH)2D підтримувати захисні імунні реакції організму.
У подвійному сліпому рандомізованому дослідженні при вивченні впливу 400, 800, 1200 і 1600 МО вітаміну D3 на день на дітей без дефіциту вітаміну D (25(OH)D > 50 нмоль/л) було виявлено, що доза 400 МО/добу підтримувала рівні 25(OH)D > 50 нмоль/л у 97 % дітей після 12 місяців; дози 800 і 1200 МО/добу не чинили додаткового впливу на параметри мінеральної щільності кісток, а доза 1600 МО/добу викликала стурбованість із приводу потенційної токсичності [47]. Проведені в подальшому дослідження лише підтвердили попередні результати: у фінському багаторічному дослідженні було показано, що профілактичний прийом вітаміну D в дозі 1200 МО з харчовими добавками порівняно з 400 МО не показав кращого впливу на щільність кісткової тканини [55].
Останніми роками пропонується план щодо адекватного збагачення вітаміном D їжі для досягнення рівня 25(OH)D в сироватці не менше ніж 20 нг/мл [48]. Наприклад, Фінляндія запровадила збагачення харчових продуктів (молочних продуктів) вітаміном D, що дозволило практично усунути його дефіцит [48].
При спостереженні за 1898 дітьми віком від 1 до 5 років було виявлено, що додавання вітаміну D в коров’яче молоко підвищувало рівень 1,25(OH)2D на 3,4 нг/мл (1,6 нг/мл) на 250 мл на день. Вплив добавок вітаміну D і споживання молока на рівень 1,25(OH)2D виявився однаковим і не залежав від пігментації шкіри або пори року [47].
Хоча традиційно вітаміни D2 і D3 вважалися еквівалентними, у деяких дослідженнях виявили, що вітамін D3 може бути як мінімум у 3 рази сильнішим, ніж вітамін D2 [40]. Це може бути пов’язаним із більшою афінністю рецепторів до 25(OH)D3 порівняно з 25(OH)D2 [40, 49]. Дослідження із застосуванням комп’ютерного моделювання біологічної активності похідних вітаміну D3 з різною ліпофільністю продемонстрували, що жиророзчинна форма вітаміну D має не лише вищу схожість з однойменними рецепторами порівняно з водорозчинними формами, а й важливіші відмінності за характером взаємодії з білками [49]. Також, враховуючи те, що вітамін D є жиророзчинним вітаміном, при призначенні водних розчинів вітаміну D слід стежити за достатнім і своєчасним надходженням жирів в організм дитини [49].
В олійних розчинах, на відміну від водних, вітамін D зберігає свою стабільність без консервантів та стабілізаторів, що робить їх більш безпечними [49]. Деякі водні розчини вітаміну D містять пропіленгліколь, який при тривалому використанні є небезпечним для дитини, зокрема для нервової системи, може спричинити аритмії, лактатацидоз [48]. Окремі водні розчини вітаміну D також містять бензиловий спирт, який взагалі токсичний для немовлят — його пов’язують із синдромом задишки; викликає алергічні шкірні висипання. Використання бензилового спирту заборонене навіть у дитячих іграшках [63].
З огляду на вищезазначене сучасні олійні розчини вітаміну D є безпечними і створюють фізіологічні умови для найкращого всмоктування вітаміну D в кишечнику здорової дитини [49].
Серед препаратів вітаміну D3 привертає увагу сучасний олійний розчин у вигляді крапель Супер Д плюс («Глобал Фарма», Польща). В одній краплі препарату міститься 400 МО вітаміну D3, що відповідає вітчизняним та міжнародним рекомендаціям із профілактики рахіту та гіповітамінозу D. Супер Д плюс може бути рекомендований до широкого використання в педіатричній практиці, адже в його складі відсутні барвники та консерванти, що мінімізує ризик розвитку алергічних реакцій. Препарат містить лише вітамін D — холекальциферол (D3), DL-aльфа-токоферол (вітамін Е) та олію із середньоланцюговими тригліцеридами, що є фізіологічним підходом до профілактики гіповітамінозу D. Для дітей від 4 років існують жувальні таблетки Супер Д, що містять 800 МО вітаміну D. Завдяки унікальній формі випуску у вигляді жувальних таблеток діти отримують необхідну кількість вітаміну D за комфортних умов споживання.
Висновки
Таким чином, вітамін D є вкрай важливим елементом для імунної системи людини, у першу чергу дитини, у якої вона тільки зазнає становлення в процесі адаптації до навколишнього середовища. Сучасні наукові дані вказують на точки прикладання вітаміну на імунну систему. Хоча досі лишається дискутабельною необхідна добова доза вітаміну D, однак у більшості наукових джерел оптимальною для профілактики недостатності вітаміну в дітей до 12-місячного віку є добова доза 400 МО.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Reichrath J., Saternus R., Vogt T. Challenge and perspective: the relevance of ultraviolet (UV) radiation and the vitamin D endocrine system (VDES) for psoriasis and other inflammatory skin diseases. Photochem. Photobiol. Sci. 2017. 16. 433-444.
2. Bouillon R., Marcocci C., Carmeliet G. et al. Skeletal and Extraskeletal Actions of Vitamin D: Current Evidence and Outstanding Questions. Endocr. Rev. 2019 Aug 1. 40(4). 1109-1151.
3. Fabbri A., Infante M., Ricordi C. Editorial — Vitamin D status: a key modulator of innate immunity and natural defense from acute viral respiratory infections. Eur. Rev. Med. Pharmacol. Sci. 2020 Apr. 24(7). 4048-4052. doi: 10.26355/eurrev_202004_20876.
4. Wang T.Т., Nestel F.Р., Bourdeau V. et al. Cutting edge: 1,25-dihydroxyvitamin D3 is a direct inducer of antimicrobial peptide gene expression. J. Immunol. 2004 Sep 1. 173(5). 2909-12.
5. Barlow P.G., Svoboda P., Mackellar A. et al. Antiviral Activity and Increased Host Defense against Influenza Infection Elicited by the Human Cathelicidin LL-37. PLoS ONE. 2011. 6. e25333.
6. Reddy K.V., Yedery R.D., Aranha C. Antimicrobial peptides: premises and promises. International Journal of Antimicrobial Agents. 2004. 24. 536-54.
7. Vargas Buonfiglio L.G., Cano M., Pezzulo A.A. et al. Effect of vitamin D3 on the antimicrobial activity of human airway surface liquid: Preliminary results of a randomised placebo-controlled double-blind trial. BMJ Open Respir. Res. 2017. 44. e00021.
8. Liu P.T., Stenger S., Tang D.H., Modlin R.L. Cutting edge: vitamin D-mediated human antimicrobial activity against Mycobacterium tuberculosis is dependent on the induction of cathelicidin. J. Immunol. 2007. 179(4). 2060-2063.
9. Wang T.-T., Dabbas B., Laperriere D. et al. Direct and Indirect Induction by 1, 25-Dihydroxyvitamin D3 of the NOD2/CARD15-Defensin β2 Innate Immune Pathway Defective in Crohn Disease. J. Biol. Chem. 2010. 285. 2227-2231.
10. Zdrenghea M.T., Makrinioti H., Bagacean C. et al. Vitamin D modulation of innate immune responses to respiratory viral infections. Rev. Med. Virol. 2017. 27. doi: 10.1002/rmv.1909.
11. Greiller C.L., Suri R., Jolliffe D.А. et al. Vitamin D attenuates rhinovirus-induced expression of intercellular adhesion molecule-1 –(ICAM-1) and platelet-activating factor receptor (PAFR) in respiratory epithelial cells. J. Steroid Biochem. Mol. Biol. 2019 Mar. 187. 152-159.
12. Tao S., Zhang H., Xue L. et al. Vitamin D Protects against Particles-Caused Lung Injury through Induction of Autophagy in an Nrf2-Dependent Manner. Environ. Toxicol. 2019. 34. 594-609.
13. Hewison M., Zehnder D., Chakraverty R., Adams J.S. Vitamin D and barrier function: a novel role for extra-renal 1 alpha-hydroxylase. Mol. Cell Endocrinol. 2004 Feb 27. 215(1–2). 31-8.
14. Park S.Y., Gupta D., Kim C.H., Dziarski R. Differential effects of peptidoglycan recognition proteins on experimental atopic and contact dermatitis mediated by Treg and Th17 cells. PLoS One. 2011. 6(9). e24961.
15. Mailhot G., Whitе J.H. Vitamin D and Immunity in Infants and Children. Nutrients. 2020. 12. 1233.
16. Cohen M.S. et al. 1,25-Dihydroxyvitamin D3 activates secretion of hydrogen peroxide by human monocytes. Journal of Immunology. 1986. 136. 1049-1053; Farhangi M.А., Mesgari-Abbasi M., Hajiluian G., Nameni G., Shahabi P. Adipose Tissue Inflammation and Oxidative Stress: the Ameliorative Effects of Vitamin D. Inflammation. 2017 Oct. 40(5). 1688-1697.
17. Jensen M.Е., Ducharme F.M., Alos Na. et al. Vitamin D in the prevention of exacerbations of asthma in preschoolers (DIVA): protocol for a multicentre randomised placebo-controlled triple-blind trial. BMJ Open. 2019. 9(12). e033075.
18. Munns C., Shaw N., Kiely M. et al. Global consensus recommendations on prevention and management of nutritional rickets. J. Clin. Endocrinol. Metab. 2016. 101(2). 394-415.
19. Wang et al. Association between micronutrient deficiency and acute respiratory infections in healthy adults: a systematic review of observational studies. Nutrition Journal. 2019. 18. 80. https://doi.org/10.1186/s12937-019-0507-6
20. Dąbrowska-Leonik N., Bernatowska E., Pac M. et al. Vitamin D deficiency in children with recurrent respiratory infections, with or without immunoglobulin deficiency. Adv. Med. Sci. 2018. 63(1). 173-178. doi: 10.1016/j.advms.2017.08.001.
21. Hatun Ş., Ozkan B., Bereket A. Vitamin D deficiency and prevention: Turkish experience. Acta Paediatr. 2011. 100(9). 1195-1199.
22. Autier P., Mullie P., Macacu A., Dragomir M., Boniol M., Coppens K., Pizot C., Boniol M. Effect of vitamin D supplementation on non-skeletal disorders: A systematic review of meta-analyses and randomised trials. Lancet Diabetes Endocrinol. 2017. 5. 986-1004.
23. Martineau A.R., Jolliffe D.A., Hooper R.L. et al. Vitamin D supplementation to prevent acute respiratory tract infections: systematic review and meta-analysis of individual participant data. BMJ. 2017 Feb 15. 356. i6583. Epub 2017 Feb 15.
24. Pham H., Rahman А., Majidi A., Waterhouse M., Neale R.E. Acute Respiratory Tract Infection and 25-Hydroxyvitamin D Concentration: A Systematic Review and Meta-Analysis. Int. J. Environ. Res. Public Health. 2019 Sep. 16(17). 3020.
25. Kana Ram Jat. Vitamin D deficiency and lower respiratory tract infections in children: A systematic review and meta-analysis of observational studies. Trop. Dr. 2017. 47. 77-84. doi: 10.1177/0049475516644141.
26. Camargo C.A. Jr., Ganmaa D., Frazier A.L., Kirchberg F.F., Stuart J.J., Kleinman K., Sumberzul N., Rich-Edwards J.W. Randomized Trial of Vitamin D Supplementation and Risk of Acute Respiratory Infection in Mongolia. Pediatrics. 2012. 130. e561-e567.
27. Urashima M., Segawa T., Okazaki M., Kurihara M., Wada Y., Ida H. Randomized trial of vitamin D supplementation to prevent seasonal influenza A in schoolchildren. Am. J. Clin. Nutr. 2010. 91(5). 1255-1260.
28. Martineau A.R., Jolliffe D.А., Greenberg L. et al. Vitamin D supplementation to prevent acute respiratory infections: individual participant data meta-analysis. Health Technol. Assess. 2019 Jan. 23(2). 1-44.
29. Kaufman H.W., Niles J.K., Kroll M.H., Bi C., Holick M.F. SARS-CoV-2 positivity rates associated with circulating 25-hydroxyvitamin D levels. PLoS ONE. September 17 2020. https://doi.org/10.1371/journal.pone.0239252
30. Martineau A.R., Cates C.J., Urashima M. et al. Vitamin D for the management of asthma. Cochrane Database Syst. Rev. 2016 Sep 5. 9. CD011511.
31. Sadarangani S.Р., Whitaker J.А., Poland G.A. Let there be light: the role of vitamin D in the immune response to vaccines. Expert Rev. Vaccines. 2015. 14(11). 1427-40.
32. Lang P.О., Samaras D. Aging adults and seasonal influenza: does the vitamin d status (h)arm the body? J. Aging Res. 2012. 2012. 806198.
33. Lu C., Yang J., Yu W., Li D., Xiang Z., Lin Y., Yu C. Association between 25(OH)D Level, Ultraviolet Exposure, Geographical Location, and Inflammatory Bowel Disease Activity: A Systematic Review and Meta-Analysis. PLoS One. 2015. 10(7). e0132036.
34. Martin N.G., Rigterink T., Adamji M., Wall C.L., Day A.S. Single high-dose oral vitamin D3 treatment in New Zealand children with inflammatory bowel disease. Transl. Pediatr. 2019 Jan. 8(1). 35-41.
35. Furuya-Kanamori L., Wangdi K., Yakob L. et al. 25-Hydroxyvitamin D Concentrations and Clostridium difficile Infection: A Meta-Analysis. JPEN J. Parenter. Enteral. Nutr. 2017 Jul. 41(5). 890-895. Epub 2015 Dec 23.
36. Bikle D.D. Agents that affect bone mineral homeostasis: vitamin D. In: Basic and Clinical Pharmacology. Ed. B.G. Katzung McGraw-Hill, NY, USA, 2007. 755-758.
37. Misra M., Pacaud D., Petryk A., et al. Drug and Therapeutics Committee of the Lawson Wilkins Pediatric Endocrine Society. Vitamin D deficiency in children and its management: review of current knowledge and recommendations. Pediatrics. 2008 Aug. 122(2). 398-417.
38. McGrath J.J., Saha S., Burne T.H., Eyles D.W. A systematic review of the association between common single nucleotide polymorphisms and 25-hydroxyvitamin D concentrations. J. Steroid Biochem. Mol. Biol. 2010. 121(1–2). 471-477.
39. Braegger C., Campoy C., Colomb V. et al. ESPGHAN Committee on Nutrition. Vitamin D in the healthy European paediatric population. J Pediatr. Gastroenterol. Nutr. 2013. 56. 692-701. doi: 10.1097/MPG.0b013e31828f3c05.
40. Ross A.С., Manson J.Е., Abrams S.А. et al. The 2011 report on dietary reference intakes for calcium and vitamin D from the Institute of Medicine: what clinicians need to know. IOM (Institute of Medicine) Dietary reference intakes for calcium and vitamin D. Committee to Review Dietary Reference Intakes for Calcium and Vitamin D Washington DC: The National Academies Press Institute of Medicine 2011. J. Clin. Endocrinol. Metab. 2011. 96(1). 53-58.
41. Holick M.F., Binkley N.C., Bischoff-Ferrari H.A. et al. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J. Clin. Endocrinol. Metab. 2011. 96(7). 1911-30.
42. De Ronne N., De Schepper J.; Société flamande de Pédiatrie. Recommendations for vitamin D supplementation in infants and young children. J. Pharm. Belg. 2013 Sep. (3). 12-21.
43. Cariolou M., Cupp M.А., Evangelou E., Tzoulaki I., Berlanga-Taylor A.J. Importance of vitamin D in acute and critically ill children with subgroup analyses of sepsis and respiratory tract infections: a systematic review and meta-analysis. BMJ Open. 2019 May 22. 9(5). e027666. doi: 10.1136/bmjopen-2018-027666.
44. Наказ Міністерства охорони здоров’я України № 1073 від 03.09.2017. https://zakon.rada.gov.ua/laws/show/z1206-17
45. Ducharme F.M., Jensen M., Mailhot G., et al. Impact of two oral doses of 100,000 IU of vitamin D3 in preschoolers with viral-induced asthma: a pilot randomised controlled trial. Trials. 2019. 20. 138. 10.1186/s13063-019-3184.
46. Vieth R. How to optimize vitamin D supplementation to prevent cancer, based on cellular adaptation and hydroxylase enzymology. Anticancer Res. 2009. 29. 3675-84.
47. Gallo S., Comeau K., Vanstone C. et al. Effect of different dosages of oral vitamin D supplementation on vitamin D status in healthy, breastfed infants: a randomized trial. JAMA. 2013. 309(17). 1785-1792.
48. Jaaskelainen T., Itkonen S.T., Lundqvist A. et al. The Positive Impact of General Vitamin D Food Fortification Policy on Vitamin D Status in a Representative Adult Finnish Population: Evidence from an 11-Y Follow-up Based on Standardized 25-Hydroxyvitamin D Data. Am. J. Clin. Nutr. 2017. 105. 1512-1520. doi: 10.3945/ajcn.116.151415.
49. Чекман І.С., Горчакова Н.О., Бережний В.В., Давидюк А.В., Романько М.Р. Фармакологія вітаміну D. Современная педиатрия. 2017. 2(82). 28-36.
50. Busko М. Low Vitamin D in COVID-19 Predicts ICU Admission, Poor Survival. https://www.medscape.com/viewarticle/937567
51. Moon R.J., Curtis E.Е., Cooper C., Davies J.Н., Harvey N.C. Vitamin D supplementation: are multivitamins sufficient? Arch. Dis. Child. 2019 Feb 25. doi: 10.1136/archdischild-2018-316339.
52. Uday S., Kongjonaj А., Aguiar М., Tulchinsky T., Högler W. Variations in infant and childhood vitamin D supplementation programmes across Europe and factors influencing adherence. Endocrine Connections. 2017. 6. 667-675.
53. Debacker M. et al.; Conseil Scientifique, Domain de la Sante. La vitamine D de 0–100 ans: Recommandations concernant la supplementation et le dosage. https://conseil-scientifique.public.lu/fr/publications/examens-laboratoire/vitamineD.html
54. Amstutz V., Cornuz J., Krieg M.-A., Favrat B. Vitamine D: actualité et recommandations. Rev. Med. Suisse. 2011. 7.
55. Rosendahl J. et al. Effect of Higher vs Standard Dosage of Vitamin D3 Supplementation on Bone Strength and Infection in Healthy Infants: A Randomized Clinical Trial. JAMA Pediatr. 2018. 172(7). 646-654. doi: 10.1001/jamapediatrics.2018.0602.
56. Rusińska A. et al. Vitamin D Supplementation Guidelines for General Population and Groups at Risk of Vitamin D Deficiency in Poland — Recommendations of the Polish Society of Pediatric Endocrinology and Diabetes and the Expert Panel With Participation of National Specialist Consultants and Representatives of Scientific Societies — 2018 Update. Front. Endocrinol. (Lausanne). 2018. 9. 246. doi: 10.3389/fendo.2018.00246.
57. Vintilescu B.Ș., Niculescu C.Е. Involvement of Vitamin D in Chronic Infections of the Waldeyer’s Ring in the School Aged Child. Curr. Health Sci. J. 2019 Jul-Sep. 45(3). 291-295. Published online 2019 Sep 30. doi: 10.12865/CHSJ.45.03.07. PMCID: PMC6993768. PMID: 32042457.
58. Lim T.Y., Poole R.L., Pageler N.M. Propylene glycol toxicity in children. J. Pediatr. Pharmacol. Ther. 2014 Oct-Dec. 19(4). 277-82. doi: 10.5863/1551-6776-19.4.277. PMID: 25762872. PMCID: PMC4341412.
59. Gombart A.F., Adeline P. and Maggini S. A Review of Micronutrients and the Immune System Working in Harmony to Reduce the Risk of Infection. Nutrients. 2020. 12. 236. doi: 10.3390/nu12010236.
60. Lang P.О., Aspinall R. Can We Translate Vitamin D Immunomodulating Effect on Innate and Adaptive Immunity to Vaccine Response? Nutrients. 2015. 7. 2044-2060. doi: 10.3390/nu7032044.
61. Hiba Sibaii, Salwa Refat El-Zayat, Azza Abd El-Shaheed, Nermine N. Mahfouz, Sara F. Sallam, Marwa H. El Azma. The Hidden Function of Vitamin D. Journal of Medical Sciences. 2016 Dec 15. 4(4). 591-595.
62. ClinicalTrials.gov: Federally-funded clinical studies related to COVID-19. https://clinicaltrials.gov/ct2/results?cond=COVID&term=vitamin+d&cntry=&state=&city=&dist=
63. Постанова Кабінету Міністрів України від 28 лютого 2018 р. № 151 «Про затвердження Технічного регламенту безпечності іграшок». Додаток 2 до Технічного регламенту «Особливі вимоги щодо безпечності». Розділ 23. Пункт № 43. https://zakon.rada.gov.ua/laws/show/151-2018-%D0%BF#n8

/93.jpg)