Международный неврологический журнал Том 17, №1, 2021
Вернуться к номеру
Довідник клініциста, який проводить реабілітацію після інсульту Розділ 4. Реабілітація верхньої кінцівки при геміплегічній формі ураження (http://www.ebrsr.com)
Авторы: Robert Teasell, MD, Norhayati Hussein, MD, Magdalena Mirkowski, MSc, MScOT, Danielle Vanderlaan, RRT, Marcus Saikaley, HBSc, Mitchell Longval, BSc, Jerome Iruthayarajah, MSc
Рубрики: Неврология
Разделы: Справочник специалиста
Версия для печати
4.1. Відновлення функції верхньої кінцівки
4.1.1. Етапи відновлення моторної функції за Бруннстромом
Сім етапів відновлення моторної функції за Бруннстромом (докладніше див. таблицю нижче):
1. Млявий параліч. Відсутність рефлексів.
2. Певна вираженість спастичного тонусу. Відсутність довільних рухів. Синергія, викликана фасилітацією.
3. Відмічається явна спастичність. Синергетичні рухи можна викликати добровільно.
4. Спастичність зменшується. Переважають синергетичні рухи.
5. Спастичність поступово зменшується. Синергія втрачає перевагу, хоча все ще присутня.
6. Координація і патерни руху майже нормальні. Проблема з більш швидкими складними рухами.
7. Нормальне функціонування відновлене.
4.1.2. Типове відновлення й прогностичні фактори
За даними дослідження Nakayama et al. (1994), для пацієнтів, які пережили інсульт і мають тяжку форму парезу руки з незначним або відсутнім активним рухом, під час госпіталізації:
— 14 % — повне відновлення моторної функції;
— 30 % — часткове відновлення.
За даними дослідження Kwakkel et al. (2003), за 6 місяців 11,6 % пацієнтів досягли повного функціонального відновлення, тоді як у 38 % спостерігались майже точні координовані рухи.
Потенційні прогностичні фактори відновлення верхньої кінцівки включають активне розгинання пальців та абдукцію плеча:
1. Встановлено, що активне розгинання пальців є надійним прогностичним фактором коротко-, середньо- і довгострокового відновлення після інсульту (Smania et al., 2007).
2. Пацієнти з мінімальною абдукцією плеча й конт-ролем рухів верхньої кінцівки при геміпаретичній формі ураження при надходженні на реабілітацію мали досить високі шанси відновити деяку здатність кисті, тоді як пацієнти, які не контролювали проксимальний рух руки, мали поганий прогноз на відновлення працездатності рук (Houwink et al., 2013).
3. Дослідження EPOS продемонструвало, що пацієнти, які можуть незначним чином розгинати пальці й відводити плече на 2-й день після інсульту, мали 98% імовірність досягнення певного ступеня точності й координованості рухів через 6 місяців, на відміну від 25% імовірності в тих, хто не демонстрував подібного добровільного моторного конт-ролю.
4. Крім того, у 60 % пацієнтів, які почали розгинати пальці протягом 72 годин, через 6 місяців повністю відновилося функціонування верхніх кінцівок за шкалою ARAT (Nijland et al., 2010).
4.1.3. Відновлення верхньої кінцівки: фіксована пропорція
Протягом 6 місяців після інсульту порушення функціонування верхньої кінцівки відновлюється за фіксованою пропорцією. Фіксована пропорція передбачає, що 70 % максимально можливого покращання моторної функції кожного пацієнта відбувається незалежно від початкових порушень (оцінювання за шкалою Фугля-Меєра), але лише у випадку тих пацієнтів, які не втратили інтактну (моторну) функцію кортикоспінального тракту (Prabhakaran et al., 2008). Необоротні структурні пошкодження кортикоспінального тракту серйозно обмежують відновлення верхньої кінцівки (Stinear et al., 2007; 2012). Як свідчать дані досліджень, на цю фіксовану пропорцію відновлення моторної функції після порушення не впливають реабілітаційні методи лікування. Дослідження за допомогою 3D-принтера з кінематикою в пацієнтів, які пережили підгострий період інсульту й ішемічний інсульт, демонструє, що відновлення моторних функцій, пов’язане з реабілітацією, зумовлене більшою мірою адаптивними або компенсаторними стратегіями навчання. Більшість клінічних тестів, призначених для оцінки відновлення моторних функцій верхніх кінцівок (наприклад, тест моторної активності руки (див. нижче)), оцінюють лише функцію або здатність пацієнта виконати завдання.
4.2. Оцінка верхньої кінцівки
Для оцінки реабілітації верхніх кінцівок застосовується широкий спектр критеріїв ефективності. Їх можна поділити на загальні категорії, перелічені нижче.
4.2.2. Моторна функція
Тест моторної активності руки (ARAT)
ARAT — це тест, спеціально розроблений для визначення обмеження активності руки, який оцінює здатність пацієнта поводитися з предметами, що відрізняються за розміром, вагою і формою. У тесті оцінюються моторні функції руки за 19 пунктами, як дистальні, так і проксимальні рухи. За кожний пункт пацієнт отримує бал у порядку 0, 1, 2 або 3, при цьому вищі значення вказують на кращий стан моторної активності руки. Загальний бал ARAT — це сума результатів за 19 пунктами, а отже, максимальний бал — 57. Показано, що цей показник є досить надійним під час повторного тестування й має внутрішню валідність, коли використовується для оцінки моторної функції у хворих на ішемічний інсульт (Ward et al., 2019; Nomikos et al., 2018).
Оцінювання Фугля-Меєра (FMA)
FMA — це показник порушення, що використовується для оцінки моторної функції та контролю, включно з рівновагою, відчуттям і болем у суглобах у пацієнтів після інсульту. Він складається з 155 пунктів, кожен з яких оцінюється за трибальною порядковою шкалою. Максимальна оцінка моторної ефективності — 66 балів за верхню кінцівку, 34 бали за нижню кінцівку, 14 балів за рівновагу, 24 бали за відчуття й 44 бали за пасивні рухи суглобів і біль у суглобах, максимальна кількість балів, яку можна отримати, — 266. Доведено, що показник є досить надійним та обґрунтованим (Nilsson et al., 2001; Sanford et al., 1993).
Оцінювання Фугля-Меєра для верхньої кінцівки (FMA-UE)
FMA-UE — це показник, що використовується для оцінки моторної функції верхньої кінцівки в пацієнтів після інсульту. Він складається з чотирьох категорій (плече/лікоть/передпліччя, зап’ястя, кисть/палець і координація) і включає 23 різні рухи, які оцінюють 33 елементи. Елементи оцінюються за 3-бальною шкалою: 0 = неспроможний до виконання, 1 = часткова спроможність до виконання та 2 = майже нормальна здатність до виконання. Під час оцінювання можна отримати максимально 66 балів, а надійність та обґрунтованість оцінювання доведено (Okuyama et al., 2018; Villán-Villán et al., 2018).
Тест на моторну функцію Вулфа (WMFT)
WMFT — це показник, що кількісно визначає моторну здатність верхніх кінцівок у тих, хто пережив інсульт. Тест складається із 17 завдань (наприклад, підняти руки вгору, за допомогою лише абдукції плеча, взяти олівець, взяти скріпку). Потім ці завдання поділяються на 3 сфери: функціональні завдання, показники сили і якість рухів. Пацієнти оцінюються за 6-бальною шкалою (1 = не може виконати завдання,
6 = виконує завдання з тією ж успішністю, як і неураженою стороною). Доведено, що цей показник є досить надійним та обґрунтованим (Nilsson et al., 2005; Wolf et al., 2001).
4.2.3. Точність і координованість рухів
Тест «коробка та кубики» (BBT)
BBT — це показник односторонньої точності й координованості рухів рук пацієнтів, які пережили інсульт, під час виконання дій, що характеризують велику моторику. Цей показник складається з 1 функціонального завдання. Таке завдання передбачає пересування пацієнтом якомога більшої кількості дерев’яних кубиків з одного кінця перегородженої коробки на інший протягом 60 секунд. Результати пацієнтів оцінюються на основі кількості кубиків, які вони пересунули (чим більше пересунутих кубиків, тим кращий результат). Доведено, що цей показник є досить надійним та обґрунтованим (Higgins et al., 2005; Platz et al., 2005).
Тест з дев’ятьма отворами й стрижнями (9HPT)
9HPT — це показник загальної точності і координованості рухів рук пацієнтів, які пережили інсульт, під час виконання дій, що характеризують велику моторику. Цей показник складається з 1 функціонального завдання. Пацієнтам пропонується вийняти з контейнера 9 стрижнів і вставити їх в отвори. Після того, як всі 9 стрижнів вставлені, їх виймають з отворів якомога швидше і поміщають назад у контейнер. Оцінюють, як швидко пацієнти можуть вставити й вийняти стрижні, тому чим швидший час вони продемонструють, тим кращий це результат. Доведено, що цей показник є досить надійним і діагностично обґрунтованим (Nilsson et al., 2017).
Перцептивно-моторний тест Пердью при роботі на комутаційній панелі (РPT)
PPT — це показник точності сили стискання й швидкості в тих, хто пережив інсульт. Цей показник складається з 1 функціонального завдання. Пацієнтам пропонується розмістити якомога більше шпильок на комутаційній панелі за 30 секунд, а потім повторити цю вправу для іншої руки. Результати пацієнтів оцінюють за кількістю шпильок, які вони можуть розмістити на комутаційній панелі за певний проміжок часу. Доведено, що цей показник є досить надійним та обґрунтованим (Gonzalez et al., 2017; Wittich & Nadon, 2017).
4.2.4. ADL
Індекс Бартел (BI)
Індекс Бартел — це показник того, наскільки добре пацієнт, який пережив інсульт, може функціонувати самостійно та наскільки якісно він може мати активність у повсякденному житті (ADL). Показник складається зі шкали з 10 елементів (наприклад, годування, догляд, одягання, контроль кишечника). Потім кожне завдання вимірюється за 3-бальною шкалою функціональних здібностей/шкалою незалежності. Доведено, що цей показник є досить надійним та обґрунтованим у повному вигляді (Gonzalez et al., 2018; Park et al., 2018).
Здатність користуватися обома руками (ABILHAND)
ABILHAND — це показник того, наскільки добре людина, яка пережила інсульт, використовує обидві руки для виконання різноманітних мануальних завдань. Показник передбачає виконання 23 загальних дій із застосуванням обох рук (наприклад, забивання цвяха, загортання подарунків, різання м’яса, застібання сорочки, відкриття пошти). Потім кожне завдання оцінюється за 3-бальною шкалою (0 = виконання дії неможливе, 1 = складно, 2 = легко) з огляду на загальну здатність. Доведено, що цей показник є досить надійним та обґрунтованим у повному вигляді (Ashford et al., 2008; Penta et al., 2001).
Канадська шкала продуктивності праці (COPM)
COPM — це показник того, наскільки добре людина, яка пережила інсульт, обслуговує себе, наскільки є ефективною і як проводить дозвілля. Оцінка складається з 25 функціональних елементів/завдань (наприклад, купання, здатність працювати принаймні неповний робочий день, діяльність, яку доводиться при цьому виконувати). Потім кожне завдання оцінюється за єдиною 10-бальною рейтинговою шкалою, при цьому в першу чергу вимірюється рівень майстерності в кожній з 3 підкатегорій (самообслуговування, ефективність і дозвілля). Доведено, що цей показник є досить надійним та обґрунтованим у повному вигляді (Yang et al., 2017).
Інструмент активності рук і кистей Chedoke (CAHAI)
CAHAI — це показник функціонування верхньої кінцівки, для визначення якого застосовується 13-бальна кількісна шкала для оцінки відновлення руки й кисті при виконанні активності в повсякденному житті після інсульту. Це тест на ефективність із застосуванням 13 пунктів, що виконуються в реальному житті, призначених для заохочення використання пацієнтом обох верхніх кінцівок. Нараховані бали відображають відносну здатність пацієнта самостійно виконувати стабілізацію або маніпуляцію в ADL з ураженою верхньою кінцівкою. Доведено, що цей показник є досить надійним під час повторного тестування й надає узгоджені висновки, а також належну структуру й діагностичну обґрунтованість (Ward et al., 2019; Schuster-Amft et al., 2018; Barreca et al., 2004).
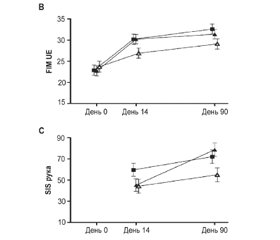
Шкала функціональної незалежності (FIM)
FIM є показником завантаженості і як така є зворотним маркером функціональної незалежності, що визначається як здатність виконувати повсякденні завдання безпечно й без сторонньої допомоги. Захід складається з 6 сфер функцій (контроль сфінктера, самообслуговування, мобільність, рух, спілкування й соціальне пізнання). Елементи цих сфер: управління сечовим міхуром, догляд за собою, переміщення у ванну й вихід з неї, швидкість ходьби, розуміння й соціальна взаємодія. Потім кожне завдання оцінюється за 7-бальною шкалою Лінкерта (1 = допомога в усіх сферах). Доведено, що цей показник є максимально надійним і діагностично обґрунтованим у повному вигляді (Granger et al., 1998; Linacre et al., 1994; Granger et al., 1993).
Модифікований індекс Бартел (MBI)
MBI — це показник того, наскільки добре пацієнт, який пережив інсульт, може функціонувати самостійно і наскільки якісно він може мати активність у повсякденному житті (ADL). Показник складається зі шкали з 10 елементів (наприклад, годування, догляд, одягання, контроль кишечника). Потім кожне завдання вимірюється за 5-бальною шкалою функціональних здібностей/шкалою незалежності. Доведено, що цей показник є досить надійним та обґрунтованим у повному вигляді. Примітка. Єдина відмінність між модифікованим індексом Бартел та оригінальним індексом Бартел полягає в тому, що модифікований індекс Бартел представлений 5-бальною шкалою оцінок, тоді як оригінальний індекс Бартел — 3-бальною (MacIsaac et al., 2017; Ohura et al., 2017).
Журнал моторної активності (MAL)
MAL — це показник використання і якості руху ураженої руки, який повідомляється пацієнтом. Оцінка складається з 30 функціональних завдань (наприклад, розкладання кухонного приладдя, застібання сорочки, розчісування волосся). Потім кожне завдання вимірюється за 6-бальною шкалою (0 = повна нездатність використовувати уражену руку). Доведено, що цей показник є досить надійним та обґрунтованим (Chuang et al., 2017).
Шкала оцінки моторних функцій (MAS)
MAS — це показник, заснований на ефективності, який оцінює повсякденну моторну функцію. Оцінка складається з 8 завдань, в основі яких лежать моторні функції (наприклад, лежання на спині, утримання балансу під час сидіння, ходьба). Потім кожне завдання вимірюється за 7-бальною шкалою (0 = неоптимальна ефективність рухів, 6 = оптимальна ефективність рухів). Доведено, що цей показник є досить надійним і діагностично обґрунтованим (Simondson et al., 2003).
Анкета щодо впливу інсульту (SIS)
SIS — це показник наслідків інсульту в різних сферах життєдіяльності, який повідомляється пацієнтом. Анкета складається з 59 функціональних завдань (наприклад, динамометр, завдання схопити й утримати, ходьба, читання вголос, оцінка емоційного регулювання, згадування слів, кількість виконаних завдань і зав’язування взуття). Потім ці завдання поділяються на 8 різних підкласів, які включають: силу, функцію руки, рухливість, спілкування, емоції, пам’ять, участь та активність у повсякденному житті (ADL). Кожне завдання вимірюється за 5-бальною шкалою (1 = нездатність виконати завдання, 5 = зовсім не складно). Доведено, що цей показник є досить надійним та обґрунтованим (Mulder et al., 2016; Richardson et al., 2016).
4.2.5. Спастичність
Шкала Ешворта (AS)
Шкала Ешворта — показник опору пасивним рухам у тих, хто пережив інсульт. Оцінка передбачає виконання 15 функціональних рухів, що контролюються кваліфікованим клініцистом. Ці рухи рівномірно розподілені на 2 секції: для верхньої і нижньої кінцівок. Потім кожен рух оцінюється за 5-бальною шкалою (0 = відсутність підвищення м’язового тонусу, 1 = ледь помітне підвищення м’язового тонусу,
2 = помірне підвищення м’язового тонусу, 3 = значне підвищення м’язового тонусу (рух ураженої кінцівки ускладнений), 4 = повне згинання/ригідність кінцівки (майже неможливо рухати ураженою кінцівкою)). Доведено, що цей показник є досить надійним та обґрунтованим (Merholz et al., 2005; Watkins et al., 2002).
Модифікована шкала Ешворта (mAS)
MAS є мірою м’язової спастичності для тих, хто пережив інсульт. Оцінка передбачає виконання 20 функціональних рухів, які контролюються кваліфікованим клініцистом. Ці рухи рівномірно розділені на 2 секції: для верхньої і нижньої кінцівок. Потім кожен рух оцінюється за 6-бальною шкалою (0 = відсутність підвищення м’язового тонусу, 1 = ледь помітне підвищення м’язового тонусу, 1+ = незначне підвищення м’язового тонусу, 2 = помірне підвищення м’язового тонусу, 3 = значне підвищення м’язового тонусу (рух ураженої кінцівки ускладнений), 4 = повне згинання/ригідність кінцівки (майже неможливо рухати ураженою кінцівкою)). Доведено, що цей показник є досить надійним та обґрунтованим (Mehrholz et al., 2005; Blackburn et al., 2002).
4.2.6. Тяжкість інсульту
Етапи відновлення за Бруннстромом (BRS)
BRS є показником м’язової спастичності для тих, хто пережив інсульт. Оцінка містить 35 функціональних рухів, які виконуються під керівництвом клініциста (наприклад, абдукція плеча, аддукція плеча, згинання/розгинання ніг). Ці рухи рівномірно розподілені на 2 секції: для верхньої і нижньої кінцівок. Потім кожен рух оцінюється за 6-бальною шкалою (1 = наявна млявість, і ніякі рухи кінцівками не можуть бути ініційовані, 2 = рух відбувається стримано, і починає розвиватися спастичність, 3 = рух майже неможливий, а спастичність серйозна, 4 = рух починає відновлюватися, а спастичність починає знижуватися, 5 = можливі більш складні комбінації рухів, оскільки спастичність знижується далі; 6 = спастичність зникає, і стають можливими окремі рухи суглобів). Доведено, що цей показник є досить надійним і діагностично обґрунтованим (Naghdi et al., 2010; Safaz et al., 2009).
Модифікована шкала Ренкіна (mRS)
Модифікована шкала Ренкіна є показником функціональної незалежності тих, хто пережив інсульт. Оцінка містить 1 пункт. Цей пункт — це співбесіда, що триває приблизно 30–45 хвилин і проводиться кваліфікованим клініцистом. Клініцист ставить пацієнтові запитання щодо загального стану здоров’я, легкості здійсненні ADL (приготування їжі, прийом їжі, одягання) та інших факторів, що стосуються його життя. Наприкінці співбесіди пацієнта оцінюють за 6-бальною шкалою (0 = прикутий до ліжка, потребує допомоги з базовими ADL, 5 = функціонує на тому ж рівні, що й до інсульту). Доведено, що цей показник є досить надійним та обґрунтованим (Quinn et al., 2009; Wilson et al., 2002).
Шкала тяжкості інсульту національних інститутів здоров’я США (NIHSS)
NIHSS — це показник соматосенсорної функції в осіб, які пережили інсульт, під час гострої фази інсульту. Ця оцінка містить 11 пунктів, а 2 з 11 пунктів — це оцінки пасивного діапазону рухів (PROM), які клініцист проводить на верхній і нижній кінцівках пацієнта. Решта 9 пунктів — це візуальні огляди, які проводить клініцист (наприклад, уважність погляду, прозопарез, дизартрія, рівень свідомості). Потім кожен пункт оцінюється за 3-бальною шкалою (0 = нормальний, 2 = мінімальна функція/обізнаність). Доведено, що цей показник є досить надійним та обґрунтованим (Heldner et al., 2013; Weimar et al., 2004).
4.2.7. Сила м’язів
Сила стискання рук (HGS)
Сила стискання рукою — це показник загальної сили стискання у тих, хто пережив інсульт. Цей показник складається з 1 функціонального завдання. Це завдання передбачає, що пацієнт стискає динамометр, а потім отримує результати вимірювання сили стискання. Потім цю дію повторюють ще 1 раз, і найкращий з двох результатів фіксується в якості оцінки. Доведено, що цей показник є досить надійним під час тестування/повторного тестування та обґрунтованим (Heldner et al., 2015).
4.3. Управління реабілітацією верхньої кінцівки
Прискорення відновлення після інсульту
Існує кілька способів прискорити відновлення моторних функцій за сприяння реабілітації.
Стимуляція іпсилатеральної кори головного мозку
Діяльність
— Повторювана практика;
— діяльність, спрямована на виконання певного завдання;
— індукована обмеженнями рухова терапія;
— віртуальна реальність;
— телереабілітація.
Психічна стимуляція
— Терапія «дія — спостереження»;
— дзеркальна терапія;
— психічна терапія.
Стимуляція мозку
— Пряма стимуляція кори;
— повторювана транскраніальна магнітна стимуляція (rTMS) (10 Гц — висока частота);
— транскраніальна стимуляція постійним струмом (tDCS) (анод).
Медикаментозна стимуляція
— Фармакотерапія.
Інгібування контралатеральної кори головного мозку
— Повторювана транскраніальна магнітна стимуляція (rTMS) (1 Гц — низька частота);
— транскраніальна стимуляція постійним струмом (tDCS) (катод).
Прискорення або полегшення відновлення при геміплегічній формі ураження кінцівки
— Повторювана практика;
— силове тренування;
— рухова терапія, індукована обмеженнями;
— функціональна електрична стимуляція (FES);
— роботизовано;
— сенсорна стимуляція (EMG/сенсорний біологічний зворотний зв’язок, TENS, акупунктура).
Заохочувальне перенесення з неушкодженої кінцівки
— Рухова терапія, індукована обмеженнями;
— білатеральна активна терапія;
— дзеркальна терапія.
Основні принципи реабілітації верхньої кінцівки
4.3.1. Прискорена або більш інтенсивна терапія у верхній кінцівці
Роль інтенсивності терапії
Реабілітація після інсульту збільшує моторну реорганізацію, тоді як відсутність реабілітації зменшує її; більш інтенсивне моторне тренування тварин у подальшому збільшує реорганізацію. Більша інтенсивність терапії в клінічних умовах покращує результати; такі дані повідомлялися стосовно PT, OT, терапії для лікування афазії, тренування на біговій доріжці й функціонування верхньої кінцівки в обраних пацієнтів (наприклад, CIMT). Винятком є дослідження VECTORS (Dromerick et al., 2009), результати якого продемонстрували високу інтенсивність CIMT для верхньої кінцівки (6 годин/день), а в разі початку проведення терапії починаючи з 10-го дня було продемонстроване менше покращання через 3 місяці, ніж у разі застосування менш інтенсивної терапії; при цьому обґрунтування невизначене, і це випробування включало небагато учасників (n = 52).
Кількість повторень для верхньої кінцівки
Жодне дослідження систематично не визначало критичного порогу інтенсивності реабілітації, необхідного для отримання позитивного результату (MacLellan et al., 2011). Дослідження на тваринах демонструють необхідність сотні повторень (250–300 за сеанс). Випробування EXCITE передбачало 196 годин терапії для одного пацієнта. Якщо поріг не досягнуто, спостерігався менший ступінь відновлення ураженої руки; у пацієнта розвиваються компенсаторні рухи (Schweighofer et al., 2009). Lang et al. (2007) виявили, що в разі застосування завдань, спрямованих на виконання певного завдання, функціональні рухи верхніх кінцівок відбувалась лише в 51 % сеансів реабілітації, спрямованих на реабілітацію верхніх кінцівок. Середня кількість повторень за сеанс становила лише 32. Для досягнення максимальної кількості повторень можуть знадобитися технології (відеоігри, робототехніка) (Saposnik et al., 2010).
Відсутність різниці між різними методами терапії, про яку повідомляється в дослідженні English et al. (2015), не відповідала результатам недавнього метааналізу, проведеного Verbeek et al. (2014), які визначили, що більший час терапії призводить до кращого відновлення функцій після прояву симптомів інсульту. English et al. (2015) у своєму дослідженні припускають, що ця розбіжність може бути зумовлена широкими критеріями включення й виключення. Однак під час РКД не було виявлено суттєвої різниці між додатковою терапією і традиційною терапією моторної функції верхньої кінцівки (Dickstein et al., 1997; Donaldson et al., 2009; English et al., 2015; Lincoln et al., 1999; Rodgers et al., 2003; Ross et al., 2009). Вивчались додаткові методи терапії, окрім інших широко відомих методів лікування, і вони включали тренування з метою відновлення моторної активності для виконання конкретних завдань, прискорену реабілітацію і функціональне силове тренування. На противагу цим дослідженням Kwakkel et al. у своєму дослідженні (1999) встановили, що тренування рук забезпечує додаткове покращання моторної функції верхніх кінцівок порівняно з традиційною терапією; такі ж дані отримали Platz et al. (2001), Han et al. (2013) і Repsaite et al. (2015). У РКД, проведеному Harris et al. (2009), було продемонстровано, що ступінчаста повторювана додаткова програма для верхньої кінцівки (GRASP) показує кращі результати, ніж Інструмент активності рук і кистей Chedoke, а також кращі показники міцності стискання й застосування верхньої кінцівки при паретичній формі ураження. Однак цей результат слід інтерпретувати з обережністю, оскільки контрольна група не отримувала звичайної активної терапії.
Висновки
Вочевидь, для покращання моторної функції або функціональної незалежності верхньої кінцівки продемонстровані результати додаткової терапії для верхньої кінцівки не кращі, ніж результати традиційної терапії.
4.3.2. Тренування для виконання певного завдання
Практика виконання певного завдання потрібна для засвоєння моторної навички. Найкращий спосіб вивчитися повторно виконувати дане завдання — це знову закріпити його виконання. Тренування для виконання певного завдання порівняно з традиційною реабілітацією при інсульті дає тривалу реорганізацію кори певної ділянки. Повторення без засвоєння моторної навички часто буває недостатньо для того, щоб відбулося повторне навчання й закріпилося у корі головного мозку. Page et al. (2003) відзначають, що сама лише інтенсивність не враховує відмінності між традиційним інсультом і реабілітацією, що стосується виконання конкретного завдання. Сеанси, на яких проводиться тренування для виконання певного завдання, тривають лише 15 хвилин, і вони ефективні також для стимулювання тривалих змін у корі головного мозку. У разі застосування спеціальних режимів, спрямованих на завчання виконання певного завдання низької інтенсивності, призначеного для покращання користування й функціонування ураженої кінцівки, відмічалися значні покращання (Smith et al., 1999; Whitall et al., 2000; Winstein та Rose, 2001).
Висновки
Тренування для виконання певного завдання, які проводилися самостійно або в поєднанні з іншими терапевтичними підходами, можуть виявитися корисними для покращання моторної функції, зменшення спастичності, збільшення діапазону рухів і сили м’язів, але не тяжкості інсульту або ADL.
4.3.3. Силове тренування
Силові тренування передбачають поступові активні вправи на подолання опору. Harris and Eng (2010) провели систематичний огляд і метааналіз силових тренувань з метою дослідження сили, функції і показників ADL верхньої кінцівки після інсульту; під час огляду вони спостерігали значний ефект, пов’язаний з тренуванням (SMD = 0,95; 95% ДI 0,05–1,85; р = 0,04).
Висновки
Силові тренування можуть покращити моторну функцію і збільшити діапазон рухів, але не точність і координованість рухів, і не можуть зменшити спастичність. Література дає неоднозначні дані щодо силових тренувань і функціональної сили для покращання ADL і м’язової сили.
4.3.4. Рухова терапія, індукована обмеженням (CIMT)
/72.jpg) Дві ключові особливості CIMT — обмеження задіювання неураженої кисті/руки й спрямування зусиль на розробляння/застосування ураженої кисті/руки (Fritz et al., 2005). Оскільки ті, хто пережив інсульт, можуть стикатися з «засвоєним незастосуванням» ураженої верхньої кінцівки протягом короткого періоду часу (Taub, 1980), CIMT призначена для подолання засвоєного незастосування шляхом сприяння нейропластичності й залежної від застосування реорганізації кори (Taub et al., 1999). CIMT призначена для зменшення функціональної недостатності в найбільш ураженій верхній кінцівці. Ключові особливості CIMT — обмеження задіювання неураженої кисті/руки й спрямування зусиль на розробляння/застосування ураженої кисті/руки. CIMT призначені для подолання засвоєного незастосування шляхом сприяння реорганізації кори (Taub et al., 1999). Для застосування CIMT кандидати мають відповідати таким вимогам: це пацієнти, які можуть активно розгинати зап’ястя щонайменше на 20 градусів та активно розгинати пальці на 10 градусів, з мінімальними сенсорною або когнітивною недостатністю.
Дві ключові особливості CIMT — обмеження задіювання неураженої кисті/руки й спрямування зусиль на розробляння/застосування ураженої кисті/руки (Fritz et al., 2005). Оскільки ті, хто пережив інсульт, можуть стикатися з «засвоєним незастосуванням» ураженої верхньої кінцівки протягом короткого періоду часу (Taub, 1980), CIMT призначена для подолання засвоєного незастосування шляхом сприяння нейропластичності й залежної від застосування реорганізації кори (Taub et al., 1999). CIMT призначена для зменшення функціональної недостатності в найбільш ураженій верхній кінцівці. Ключові особливості CIMT — обмеження задіювання неураженої кисті/руки й спрямування зусиль на розробляння/застосування ураженої кисті/руки. CIMT призначені для подолання засвоєного незастосування шляхом сприяння реорганізації кори (Taub et al., 1999). Для застосування CIMT кандидати мають відповідати таким вимогам: це пацієнти, які можуть активно розгинати зап’ястя щонайменше на 20 градусів та активно розгинати пальці на 10 градусів, з мінімальними сенсорною або когнітивною недостатністю.
CIMT можна описати як:
А. Традиційна CIMT: двотижнева програма тренувань із 6-годинним інтенсивним тренуванням верхніх кінцівок із обмеженням застосування ураженої руки протягом принаймні 90 % годин неспання.
В. Модифікована CMT: часто є менш інтенсивною, ніж традиційна CIMT, із змінною інтенсивністю, часом обмеження й тривалістю програми.
Оптимальні терміни лікування залишаються невизначеними. Хоча є дані про те, що пацієнти, які проходять лікування в гострій фазі інсульту, можуть продемонструвати кращі результати (Taub & Morris, 2001), є також дані про те, що ця терапія насправді може виявитися шкідливою (випробування VECTORS, Dromerick et al., 2009).
CIMT у гострій/підгострій фазі
В огляді Etoom et al. (2016) було встановлено, що, як продемонстрували результати аналізу 36 випробувань, CIMT дала значний ефект порівняно з конт-рольним втручанням, хоча існував високий рівень неоднорідності. Автори припустили, що значущий ефект міг бути викривленим через упередженість публікацій. Однак дослідження з цього огляду, які розглядали ефективність CIMT протягом перших 6 місяців після інсульту, у цілому виявили незначний ефект (Etoom et al., 2016).
Висновки
Рухова терапія, індукована обмеженнями, у гострій/підгострій фазі може бути корисною для покращання спастичності та м’язової сили, але не моторної функції. Література дає неоднозначні дані щодо покращання рівня ADL і точності й координованості рухів.
Модифікована рухова терапія, індукована обмеженнями, у гострій/підгострій фазі корисна для покращання моторної функції, а не допоможе в покращанні ADL, точності й координованості рухів, спастичності, пропріорецепції або м’язової сили.
CIMT у хронічній фазі
Загалом більшість вивчених досліджень свідчать про позитивний вплив CIMT, застосованої в хронічній фазі інсульту, на моторну функцію верхньої кінцівки.
Результати наймасштабнішого й найбільш ретельно проведеного дослідження Оцінка рухової терапії, індукованої обмеженнями (EXCITE) можуть надати найбільш вагомі на сьогодні докази переваг лікування CIMT. У дослідження, яке тривало 3 роки, були залучені 222 особи із 7 закладів США з середнім ступенем інвалідності, у яких після інсульту минуло від 3 до 9 місяців. Лікування проводилось до 6 годин на день, 5 днів на тиждень протягом 2 тижнів. Пацієнти проходили повторне переоцінювання до 24 місяців після лікування. Через 12 місяців порівняно з контрольною групою, яка отримувала звичайний догляд, учасники експериментальної групи мали значно вищі бали в розділах WMFT і журналі моторної активності. Через 24 місяці ці набутки збереглися. Хоча ці результати обнадійливі, кількість пацієнтів, яким це лікування може підійти, залишається невизначеною (Cramer, 2007). У дослідженні EXCITE лише 6,3 % обстежених пацієнтів мали право брати в ньому участь. Незважаючи на те, що пропонуються більш високі оцінки відсоткового відношення, що становить 20–25 %, залишається невизначеним, чи отримають користь від лікування пацієнти з більшою інвалідністю.
Verbeek et al. (2014) повідомляють про високоінтенсивну CIMT (рукавиця, яку носять 90 % дня, і 3–6 годин терапії/день) і низькоінтенсивну CIMT (рукавиця, яку носять < 90 % дня, і 0–3 години терапії/день), які сприяли отриманню значної зведеної величини ефекту для руки при паретичній формі ураження (синергія) і діяльності, що залучає кисть і руку.
Висновки
Рухова терапія, індукована обмеженнями, може бути корисною для покращання моторної функції, ADL і сили м’язів у хронічній фазі після інсульту.
Модифікована рухова терапія, індукована обмеженнями, може бути корисною для покращання моторної функції та ADL у хронічній фазі після інсульту.
Запуск моторної системи
4.3.5. Терапія «дія — спостереження»
Терапія «дія — спостереження» — це форма терапії, за допомогою якої моторна задача виконується індивідом, який спостерігає за дзеркальним відображенням іншої людини, яка виконує те саме завдання. Дана терапія призначена для підвищення збудливості в первинній моторній корі шляхом активації обновних образів про дії через дзеркальну нейронну систему (Kim & Kim, 2015a). Попри те, що результати терапії «дія — спостереження» оцінювали переважно в здорових добровольців, дослідження оцінювали його переваги в перенавчанні рухів після інсульту.
Висновки
Терапія «дія — спостереження» може бути корисною для покращання точності й координованості рухів і спастичності, але не сили м’язів.
Доказовість неоднозначна, коли йдеться про покращання моторної функції та ADL.
4.3.6. Дзеркальна терапія
Дзеркальна терапія — це форма візуальних образів, коли дзеркало використовується для передачі візуальних стимулів у мозок шляхом спостереження за незміненою частиною тіла, коли та здійснює серію рухів. Дзеркало розміщується в середній сагітальній площині відносно пацієнта, відображаючи рухи сторони, неураженої парезом, так, ніби це була уражена сторона. Премоторна кора важлива для нейропластичності й реагує на візуальний зворотний зв’язок.
Висновки
Дзеркальна терапія може покращити моторну функцію, пропріорецепцію точності й координованості рухів і зменшити наслідки інсульту, але в літературі даються неоднозначні дані щодо покращання рівня ADL, спастичності й сили м’язів.
4.3.7. Розумова практика
/77_2.jpg) Психічні образи були запозичені зі спортивної психології, де, як було показано, методика покращує спортивні показники, коли використовується як доповнення до стандартних методів тренувань. Розумова практика передбачає розумову репетицію певного завдання чи серії завдань. Найбільш правдоподібним поясненням переваги цього методу є те, що збережені моторні плани для виконання рухів можуть бути доступні й посилені під час розумової практики. У дослідженні Page et al. (2001a, b, c, 2005, 2007) пацієнти групи, у якій застосовується розумова практика, продемонстрували покращання функції верхніх кінцівок. Огляд Cochrane (Barclay-Goddard et al., 2011) засвідчив, що за результатами 6 РКД (119 учасників) розумова практика в поєднанні з іншими методами лікування виявилася більш ефективною для покращання функції верхніх кінцівок, ніж інше лікування (SMD = 1,37; 95% ДI 0,60–2,15; р < 0,0001). Її рекомендовано застосовувати як допоміжний засіб при застосуванні інших втручань для лікування верхніх кінцівок, і вона застосовується як засіб забезпечення успішності рухової терапії, індукованої обмеженнями.
Психічні образи були запозичені зі спортивної психології, де, як було показано, методика покращує спортивні показники, коли використовується як доповнення до стандартних методів тренувань. Розумова практика передбачає розумову репетицію певного завдання чи серії завдань. Найбільш правдоподібним поясненням переваги цього методу є те, що збережені моторні плани для виконання рухів можуть бути доступні й посилені під час розумової практики. У дослідженні Page et al. (2001a, b, c, 2005, 2007) пацієнти групи, у якій застосовується розумова практика, продемонстрували покращання функції верхніх кінцівок. Огляд Cochrane (Barclay-Goddard et al., 2011) засвідчив, що за результатами 6 РКД (119 учасників) розумова практика в поєднанні з іншими методами лікування виявилася більш ефективною для покращання функції верхніх кінцівок, ніж інше лікування (SMD = 1,37; 95% ДI 0,60–2,15; р < 0,0001). Її рекомендовано застосовувати як допоміжний засіб при застосуванні інших втручань для лікування верхніх кінцівок, і вона застосовується як засіб забезпечення успішності рухової терапії, індукованої обмеженнями.
Nilsen et al. (2010) провели систематичний огляд використання розумової практики для відновлювального лікування моторних функцій, включаючи результати 15 досліджень, 4 з яких були класифіковані як рівень 1 (тобто РКД). Хоча автори дійшли висновку, що існують докази ефективності розумової практики, особливо в поєднанні з терапією верхніх кінцівок, вони також обговорювали проблеми підбиття підсумків гетерогенних досліджень. Дослідження різнились щодо протоколів лікування, характеристик пацієнта, критеріїв прийнятності, дозування, методів, що використовуються для забезпечення розумової практики (аудіозаписи, письмові інструкції, фотографії), хронічності інсульту й оцінки наслідків. Автори застерегли, що для того, щоб скласти конкретні рекомендації щодо лікування, необхідно провести додаткові дослідження.
У метааналіз (Cha et al., 2012) було включено результати 5 РКД та оцінено додаткову користь розумової практики в поєднанні з тренуванням виконання функціональних завдань. Оцінені в окремих дослідженнях наслідки включали індекси FMA, ARAT і Бартел. Орієнтовний розмір ефекту лікування при об’єднанні досліджень становив 0,51 (95% ДІ 0,27–0,750, що вказує на помірний ефект. Однак у метааналізі Machado et al. (2015) за результатами 7 РКД встановлено, що порівняно з контрольною групою розумова практика не була більш ефективною для покращання моторної функції верхніх кінцівок, коли застосовувалася як допоміжна терапія.
Verbeek et al. (2014) виявили суттєву зведену величину ефекту для діяльності, що залучає кисть і руку, але не для моторної функції руки при паретичній формі ураження (синергія) або сили м’язів.
Висновки
Розумова практика може сприяти покращанню моторної функції і збільшенню сили м’язів, але докази щодо покращання рівня ADL неоднозначні.
4.3.8. Тренування обох рук
При тренуванні обох рук пацієнти виконують однакові дії одночасно обома верхніми кінцівками. Практикуючи рухи обома руками, можна активувати інтактну півкулю, щоб полегшити активацію пошкодженої півкулі через нейронні мережі, зв’язані мозолистим тілом (Morris et al., 2008; Summers et al., 2007).
Огляд членів організації Cochrane дослідження Coupar et al. (2010), яке включало результати 18 РКД і нараховувало 549 учасників, свідчить про те, що значного покращання функції ADL не відбулося (стандартизована різниця середніх 0,25; 95% ДІ від –0,14 до 0,63), як і функціонального руху руки (SMD = –0,07; 95% ДІ від –0,42 до 0,28) або кисті (SMD = –0,04; 95% ДІ від –0,50 до 0,42) при тренуванні обох рук порівняно зі звичайним доглядом після інсульту.
Cauraugh et al. (2010) зробили метааналіз, який включає результати 25 досліджень, більшість з яких були РКД. Стандартизована середня різниця загального ефекту лікування становила 0,734, що є великим ефектом. На величину ефекту впливав тип лікування (виключно тренування обох рук, тренування обох рук із застосуванням зовнішніх ритмічних слухових стимулів (ритмотерапія) (BATRAC), поєднання тренування обох рук та електроміографічної (EMG) нервово-м’язової стимуляції та активних/пасивних рухів за допомогою робототехніки). Дослідження стимуляції BATRAC та EMG були пов’язані з найбільшою SMD.
Van Delden et al. (2012) оцінювали ефективність терапії із застосуванням обох рук або однієї, а також те, чи впливала вона на тяжкість парезу. Огляд включав результати 9 РКД. Були проведені сукупні аналізи 452 пацієнтів для проведення оцінки Фугля-Меєра (FMA), тесту моторної активності руки (ARAT), шкали оцінки моторної активності (MAS) і журналу моторної активності (MAL). В усіх категоріях тяжкості тренування однієї руки було кращим, коли результати оцінювались за допомогою ARAT, але не було відмінностей у балах пацієнтів, які мали тяжкий або середній парез. Не було суттєвих відмінностей у покращанні між групами пацієнтів із тяжкою або середньою формами за оцінками MAS або FMA, що свідчить про те, що обидва підходи до тренування були ефективними. Більш високі бали MAL свідчать про кращі результати, отримані пацієнтами групи, представники якої тренували одну руку, хоча ця група представлена лише пацієнтами з легкими формами.
Verbeek et al. (2014) виявили суттєву зведену величину ефекту для моторних функцій і моторної сили паретичної руки.
Висновки
Тренування обох рук можуть покращити моторну функцію, але не м’язову силу. Література дає неодно-значні дані щодо тренування обох рук для покращання точності й координованості рухів та ADL.
4.3.9. Музична терапія
Музична терапія є перспективною технікою реабілітації для покращання функції руки при геміпаретичній формі ураження після інсульту. Вона включає багато складових традиційних втручань для реабілітації верхніх кінцівок, включаючи повторювану практику завдань, індивідуалізацію пальців, а також тактильний і слуховий зворотний зв’язок (van Wijck et al., 2012). Програму реабілітації можна також коректувати, збільшивши темп пісень або включивши складніші музичні твори залежно від результатів, які демонструє кожний пацієнт. Крім того, музична терапія може викликати більше емоцій, ніж традиційні втручання для верхніх кінцівок, що може призвести до більшого залучення пацієнта (Van Vugt et al., 2014).
Висновки
Загалом література дає неоднозначні дані щодо музичної терапії для реабілітації верхніх кінцівок після інсульту. Слід зазначити, що багато досліджень цього розділу суттєво різняться щодо впровадження музичної терапії.
Сенсорна стимуляція верхньої кінцівки.
Сенсомоторне тренування при геміпаретичній формі ураження верхньої кінцівки
Сенсомоторне стимуляційне лікування включало термічну стимуляцію, періодичну пневматичну компресію, шинування, кортикальну стимуляцію і програми сенсорних тренувань.
4.3.10. Транскутанна електрична стимуляція нервової системи (TENS)
Laufer & Gabyzon (2011) провели систематичний огляд ефективності TENS для відновлення рухів, який включав результати 15 досліджень. У семи із цих досліджень вивчались методи лікування, спрямовані на верхні кінцівки, у той час як два включали методи як для верхніх, так і для нижніх кінцівок. Для участі в більшості досліджень набирали учасників із хронічною стадією інсульту. Результати, оцінені в цих дослідженнях, включали кінематику руху під час дотягування до чогось, силу щипання, тест функції руки Джебсена — Тейлора, ARAT, індекс Барел і модифіковану шкалу оцінки руху. Автори стверджували, що, хоча протоколи стимуляції та варіації часу й підбору результатів вимірювань дозволяють зробити остаточні висновки, існує велика варіативність, і все ж існують докази того, що лікування TENS у поєднанні з реабілітаційною терапією може допомогти покращити відновлення моторних функцій.
Висновки
TENS може бути корисною для покращання моторної функції, але докази щодо покращання точності й координованості рухів, ADL і м’язової сили неоднозначні.
4.3.11. Електроакупунктура
Було доведено, що електроакупунктура не ефективніша для покращання моторної функції верхніх кінцівок, ніж традиційна терапія. Про це свідчать результати трьох досліджень високої методологічної якості й значні розміри зразків (Li et al., 2012; Quian et al., 2014; Zhang et al., 2017).
Висновки
Електроакупунктура покращує спастичність і може покращити моторну функцію, тяжкість інсульту та м’язову силу, але не ADL.
4.3.12. Акупунктура
У Китаї акупунктура є прийнятною, швидкою, простою, безпечною та економічно вигідною формою лікування, що використовується для покращання моторних, сенсорних, вербальних комунікацій та інших неврологічних функцій у пацієнтів після інсульту (Wu et al., 2002). Як пишуть у своєму дослідженні Rabinstein та Shulman (2003), «акупунктура — це терапія, яка передбачає стимуляцію певних анатомічних ділянок на шкірі за допомогою різноманітних методів, і найпоширенішою є стимуляція металевими голками, якими маніпулюють вручну або як електродами, що проводять електричний струм». Акупунктура може стимулювати вивільнення нейромедіаторів (Han & Terenius, 1982) і впливати на глибоку структуру мозку (Wu et al., 2002). Lo et al. (2005) встановили, що акупунктура при застосуванні впродовж принаймні 10 хвилин приводила до тривалих змін у збудливості й пластичності кори навіть після того, як голковий подразник прибрали. Дослідження з використанням позитронно-емісійної томографії (PET) для спостереження мозкової функції після електроакупунктурних процедур продемонструвало, що метаболізм глюкози суттєво змінився відразу після лікування й через три тижні щоденних електроакупунктурних процедур у багатьох церебральних моторних ділянках (Fang et al., 2012). На основі цих результатів Fang et al. (2012) дійшли висновку, що електроакупунктура брала участь у модулюванні моторної пластики.
Більшість досліджень, що вивчають ефективність акупунктури для покращання моторної функції верхніх кінцівок, встановили, що для акупунктури порівняно з контрольною групою не було значної переваги.
Висновки
Акупунктура, імовірно, не покращує моторну функцію верхніх кінцівок або рівень незалежності. Здається, вона послаблює спастичність.
4.3.13. EMG/біологічний зворотний зв’язок у верхній кінцівці при геміпаретичній формі ураження
EMG/біологічний зворотний зв’язок задіює зовнішні електроди, прикріплені до цільових м’язів, щоб вловити електричний потенціал моторної одиниці. Це забезпечує звуковий або візуальний зворотний зв’язок щодо того, наскільки пацієнт активує цільовий м’яз. Загалом дані свідчать про те, що біологічний зворотний зв’язок, наданий за допомогою технології EMG окремо або в поєднанні з іншими методами лікування, може не покращити моторну функцію верхніх кінцівок, точність і координованість рухів або спастичність. Щоб визначити, чи корисний цей метод реабілітації для покращання інших аспектів функції верхніх кінцівок, потрібні більш вагомі РКД.
Є вагомі докази того, що терапія EMG/біологічного зворотного зв’язку не краща за інші форми лікування й може не покращити моторну функцію верхніх кінцівок або спастичність.
Висновки
Література неоднозначно описує EMG/біологічний зворотний зв’язок щодо покращання ADL, ROM, тяжкості інсульту та м’язової сили, але, схоже, ця терапія не є корисною для покращання моторної функції, точності й координованості рухів і спастичності.
Закінчення в наступному номері

/61.jpg)
/62.jpg)
/63.jpg)
/64.jpg)
/65.jpg)
/67.jpg)
/68.jpg)
/69.jpg)
/70.jpg)
/71.jpg)
/71_2.jpg)
/72_2.jpg)
/73.jpg)
/73_2.jpg)
/74.jpg)
/75.jpg)
/75_2.jpg)
/76.jpg)
/76_2.jpg)
/77.jpg)
/77_3.jpg)
/78.jpg)
/78_2.jpg)
/79.jpg)
/79_2.jpg)
/79_3.jpg)
/80.jpg)
/80_2.jpg)
/81.jpg)
/82.jpg)
/82_2.jpg)