Резюме
Актуальність. Застосування метилтіонінію у випадках інфекцій нижніх сечових шляхів відкриває великі можливості впливу на патогенну мікрофлору без використання традиційних антибактеріальних препаратів. У даний час в Україні єдиним засобом, що містить метилтіоніній, є Пембіна-Блю. Механізм фармакологічної дії останньої полягає в здатності при контакті з мікробною клітиною викликати енергозалежне мембранне збурення її структур з посиленим утворенням активних форм кисню й пошкодженням її ДНК. Утворення зазначених малорозчинних комплексних сполук з мукополісахаридами й білками бактеріальної клітини в сечових просторах спричиняє загибель або різке зниження життєвих функцій різних патогенних мікроорганізмів, а рослинні компоненти (шавлія) здатні потенціювати уросептичні ефекти. Метою дослідження стало встановлення клінічної ефективності препарату Пембіна-Блю в осіб із хронічним бактеріальним простатитом як компонента комплексної терапії, а також оцінка впливу Пембіна-Блю на можливість зменшення рецидивів цього захворювання в термін 3 місяці. В Інституті сексології та андрології та у відділі андрології і сексології ДУ «Інститут урології НАМН України» було проведено дослідження впливу комбінованої терапії з включенням препарату Пембіна-Блю на перебіг хронічного бактеріального простатиту. Матеріали та методи. У 30 пацієнтів (І група) з верифікованим хронічним бактеріальним простатитом у фазі загострення (середній вік 29,2 ± 1,4 року) проводилося комплексне медикаментозне лікування в поєднанні із застосуванням препарату Пембіна-Блю по 1 капсулі 2 рази на добу протягом 20 днів. Анамнез захворювання становив від 2,2 до 6,7 року (в середньому 3,2 ± 0,5 року). Групу II (n = 30) становили пацієнти з верифікованим хронічним бактеріальним простатитом у фазі загострення (середній вік 33,2 ± 1,0 року), які одержували традиційну комбіновану терапію з включенням препарату Пембіна-Блю в дозі по 1 капсулі 2 рази на день протягом перших 20 днів із наступною перервою у 20 днів і курсами 20-денного прийому. Отже, пацієнти ІІ групи отримали три 20-денних курси препарату Пембіна-Блю з рівними перервами протягом 100 днів. Контрольну групу (група ІІІ) становили 15 пацієнтів з аналогічними даними, які одержували медикаментозну терапію без використання рослинних препаратів. Результати. За період понад 3 місяці рівень рецидивів у пацієнтів ІІ групи виявився вірогідно нижчим (симптоми нижніх сечових шляхів з бактеріурією були відсутніми), ніж в осіб контрольної групи. Рівень рецидивів у пацієнтів з І групи був нижчим у 2 рази, ніж у контролі (р < 0,05). Комплаєнтність щодо подальшого призначення монотерапії препаратом Пембіна-Блю в осіб IІ групи була високою, жодних небажаних клінічних ефектів виявлено не було. В осіб I, II і III груп їх рівень був практично однаковим і становив у середньому 6,6 % (n = 2), що не потребувало відміни препарату (випадки диспепсії). Низький їх рівень у групах із застосуванням препарату Пембіна-Блю, аналогічний такому в контролі, вказував на його безпечність і добру комплаєнтність. Динаміка лікування в групах з різними видами комбінованої терапії вказувала на покращання всіх взаємопов’язаних показників. Отримання ефекту до 30 діб ми спостерігали в І групі в 93,3 %, у ІІ групі — у 90 %, у ІІІ групі — у 96,6 %. Відмінності за клінічними й лабораторними показниками в групах, які отримували препарат Пембіна-Блю, і контрольній групі не мали статистичної вірогідності. Протягом наступних 70 днів, що загалом становило 100 днів моніторингу урологічного статусу пацієнтів, пацієнти ІІ групи отримували перманентно препарат Пембіна-Блю, а інші групи терапію не отримували. Висновки. Комбінована терапія випадків хронічного бактеріального простатиту з включенням препарату Пембіна-Блю є ефективною методикою, що дозволяє покращити якість життя пацієнта за рахунок швидкої ліквідації симптомів нижніх сечових шляхів, ефективного зниження лейкоцитарної реакції в сечі і титрів бактеріурії. Застосування препарату Пембіна-Блю в осіб із хронічним бактеріальним простатитом дозволяє вірогідно зменшити частоту розвитку рецидивів захворювання протягом понад 3 місяців (підвищення ефективності елімінації мікробного збудника, зменшення вираженості симптомів нижніх сечових шляхів) і покращити показники лікування за рахунок підвищення якості життя пацієнта.
Актуальность. Применение метилтиониния в случаях инфекций нижних мочевых путей открывает большие возможности влияния на патогенную микрофлору без использования традиционных антибактериальных препаратов. В настоящее время в Украине единственным средством, содержащим метилтиониний, является Пембина-Блю. Механизм фармакологического действия последней заключается в способности при контакте с микробной клеткой вызвать энергозависимое мембранное возмущение ее структур с усиленным образованием активных форм кислорода и повреждением ее ДНК. Образование указанных малорастворимых комплексных соединений с мукополисахаридами и белками бактериальной клетки в мочевых пространствах вызывает гибель или резкое снижение жизненных функций различных патогенных микроорганизмов, а растительные компоненты (шалфей) способны усиливать уросептические эффекты. Целью исследования стало установление клинической эффективности препарата Пембина-Блю у лиц с хроническим бактериальным простатитом в качестве компонента комплексной терапии, а также оценка влияния Пембина-Блю на возможность уменьшения рецидивов этого заболевания в срок 3 месяца. В Институте сексологии и андрологии и в отделе андрологии и сексологии ГУ «Институт урологии НАМН Украины» было проведено исследование влияния комбинированной терапии с включением препарата Пембина-Блю на течение хронического бактериального простатита. Материалы и методы. У 30 пациентов (I группа) с верифицированным хроническим бактериальным простатитом в фазе обострения (средний возраст 29,2 ± 1,4 года) проводилось комплексное медикаментозное лечение в сочетании с применением препарата Пембина-Блю по 1 капсуле 2 раза в сутки в течение 20 дней. Анамнез заболевания составлял от 2,2 до 6,7 года (в среднем 3,2 ± 0,5 года). Группу II (n = 30) составили пациенты с верифицированным хроническим бактериальным простатитом в фазе обострения (средний возраст 33,2 ± 1,0 года), получавшие традиционную комбинированную терапию с включением препарата Пембина-Блю в дозе по 1 капсуле 2 раза в день в течение первых 20 дней с последующим перерывом в 20 дней и курсами 20-дневного приема. Таким образом, пациенты II группы получили три 20-дневных курса препарата Пембина-Блю с равными перерывами в течение 100 дней. Контрольную группу (группа III) составляли 15 пациентов с аналогичными данными, которые получали медикаментозную терапию без использования растительных препаратов. Результаты. За период более 3 месяцев уровень рецидивов у пациентов II группы оказался достоверно ниже (симптомы нижних мочевых путей с бактериурией отсутствовали), чем у лиц контрольной группы. Уровень рецидивов у пациентов I группы был ниже в 2 раза, чем в контроле (р < 0,05). Комплаентность при дальнейшем назначении монотерапии препаратом Пембина-Блю у лиц II группы была высокой, каких-либо нежелательных клинических эффектов выявлено не было. У лиц I, II и III групп их уровень был практически одинаковым и составил в среднем 6,6 % (n = 2), что не требовало отмены препарата (случаи диспепсии). Низкий их уровень в группах с применением препарата Пембина-Блю, аналогичный таковому в контроле, указывал на его безопасность и хорошую комплаентность. Динамика лечения в группах с различными видами комбинированной терапии указывала на улучшение всех взаимосвязанных показателей. Получение эффекта до 30 суток мы наблюдали в первой группе у 93,3 %, во II группе — у 90 %, в III группе — у 96,6 %. Различия по клиническим и лабораторным показателям в группах, получавших препарат Пембина-Блю, и контрольной группе не были статистически достоверными. В течение следующих 70 дней, что в целом составило 100 дней мониторинга урологического статуса пациентов, пациенты II группы получали перманентно препарат Пембина-Блю, а другие группы терапию не получали. Выводы. Комбинированная терапия случаев хронического бактериального простатита с включением препарата Пембина-Блю является эффективной методикой, позволяющей улучшить качество жизни пациента за счет быстрой ликвидации симптомов нижних мочевых путей, эффективного снижения лейкоцитарной реакции в моче и титров бактериурии. Применение препарата Пембина-Блю у лиц с хроническим бактериальным простатитом позволяет достоверно уменьшить частоту развития рецидивов заболевания в течение более 3 месяцев (повышение эффективности элиминации микробного возбудителя, уменьшение выраженности симптомов нижних мочевых путей) и улучшить показатели лечения за счет повышения качества жизни пациента.
Background. The use of methylthioninium in cases of lower urinary tract infections opens up great opportunities for influencing pathogenic microflora without using traditional antibacterial drugs. At present, in Ukraine, the only drug containing methylthioninium is Pembina Blue. The mechanism of pharmacological action of the latter lies in the ability, upon contact with a microbial cell, to cause energy-dependent membrane disturbance in its structures, with increased formation of reactive oxygen species and damage to DNA. The formation of these poorly soluble complex compounds with mucopolysaccharides and proteins of the bacterial cell in the urinary spaces leads to the death or a sharp decrease in the vital functions of various pathogenic microorganisms, and plant components (salvia) can potentiate uroseptic effects. The purpose of the study was to establish the clinical efficacy of Pembina Blue in patients with chronic bacterial prostatitis, as a component of comrehensive therapy, and to evaluate the effect of Pembina Blue on the possibility of reducing the recurrence of this disease within 3 months. At the Ukrainian Institute of Sexology and Andrology, a study was conducted of the effect of combination therapy with the inclusion of Pembina Blue on the course of chronic bacterial prostatitis. Materials and methods. In 30 patients (group I) with verified chronic bacterial prostatitis in the acute phase (average age — 29.2 ± 1.4 years), comprehensive drug treatment was carried out in combination with the use of Pembina Blue, 1 capsule 2 times a day for 20 days. The medical history ranged from 2.2 to 6.7 years (average of 3.2 ± 0.5 years). Group II (n = 30) consisted of patients with verified chronic bacterial prostatitis, in the exacerbation phase (average age 33.2 ± 1.0 years), who received traditional combination therapy with the inclusion of Pembina Blue in a dose of 1 capsule 2 times a day for the first 20 days, followed by a 20-day break and 20-day courses of administration. Thus, patients of group II received three 20-day courses of Pembina Blue at equal intervals for 100 days. The control group (group III) consisted of 15 patients with similar data who received drug therapy without herbal preparations. Results. Over a period of more than 3 months, the relapse rate in patients of group II was significantly lower (no lower urinary tract symptoms or bacteriuria) than in the control group. The relapse rate in patients from group I was 2 times lower than in controls (p < 0.05). Compliance with Pembina Blue monotherapy in patients of group II was high, no adverse clinical effects were found. Their level in individuals of groups I, II and III was almost the same and averaged 6.6 % (n = 2), which did not require discontinuation of the drug (cases of dyspepsia). A low level of adverse effects in the groups of Pembina Blue, similar to that of controls, indicated its safety and good compliance. The dynamics of treatment in groups with various types of combination therapy indicated an improvement in all interrelated indicators. We observed the effect within 30 days in group I — 93.3 %, in group II — 90 %, in group III — 96.6 %. Differences in clinical and laboratory parameters in the groups receiving Pembina Blue and in the control group did not have statistical significance. Over the next 70 days, which in total amounted to 100 days of monitoring the urological status of patients, those in group II received Pembina Blue routinely, and other groups did not receive therapy. Conclusions. Combination therapy in cases of chronic bacterial prostatitis, with the inclusion of Pembina Blue, is an effective technique that improves the patient’s quality of life due to the rapid elimination of symptoms of the lower urinary tract, effective reduction of leukocyte reaction in the urine and bacteriuria. The use of Pembina Blue in people with chronic bacterial prostatitis can reliably reduce the incidence of disease relapses for more than 3 months (increasing the efficiency of elimination of the microbial pathogen, reducing the severity of symptoms of the lower urinary tract) and increase treatment rates by improving the patient’s quality of life.
Вступ
Умовою ефективної терапії інфекцій нижніх сечових і статевих шляхів у чоловіків є попередня чітка верифікація нозології за критеріями Європейської асоціації урологів. Згідно із сучасними уявленнями про етіопатогенез хронічних інфекційно-запальних захворювань простатовезикулярного комплексу (ПВК), інфікування його структур може перебігати приховано, з відсутністю будь-яких симптомів, або мати незначну симптоматику [1, 2]. Порушення акту сечовипускання може як відігравати ініціальну роль у формуванні захворювання (нейрогенні розлади конгенітальні, первинна детрузорно-сфінктерна диссинергія), так і бути нейрогенним ускладненням з розладом акту сечовипускання інфекційного генезу (хронічний простатит). Детрузорно-сфінктерна диссинергія різного ступеня вираженості часто є процесом, що перебігає хвилеподібно, з поступовою втратою повноцінного забезпечення регуляції функції автономної нервової системи сечового міхура. Найбільш частою причиною останнього є вогнищевий запальний процес в структурах ПВК і шийки сечового міхура [6].
Значно поширені у світі інфекції сечовивідних шляхів (ІСШ) характеризуються високим ризиком ускладнень (формування хронічних запальних процесів) і значними фінансовими витратами в системі охорони здоров’я. Реалізація ІСШ у людському організмі відбувається на тлі певних імунозалежних/незалежних захисних реакцій, проте їх вираженість не завжди дозволяє впоратися з розвитком інфекційно-запального процесу. Еволюція уропатогенних штамів групи Enterobactericeae сприяла формуванню низки факторів вірулентності: утворенню мікробних біоплівок на уротелії, інгібуванню міграції нейтрофілів у вогнище запалення, можливості зниження імунної відповіді при реінфекції, здатності виживати всередині макрофагів і стійкості до антибіотиків [5].
Колонізація уропатогенами проток передміхурової залози (ПЗ) відбувається уретрогенно й залежить від анатомо-фізіологічних умов у сечових шляхах. Аномальне розташування, дистрофічні (кристалічні або білкові структури в протоках) зміни, запалення, ятрогенні або травматичні ушкодження, а також низка інших факторів сприяють розвитку нейрогенних порушень у сфінктерному апараті детрузора й передміхурової залози. Це виражається в дисфункції сфінктерної системи з несинхронним скороченням, підвищенням внутрішньоміхурового й внутрішньопростатичного тиску. Такі умови створюють прецедент внутрішньопростатичного рефлюксу — швидкого інфікування внутрішньопростатичних проток і розмноження там уропатогенів з формуванням запальної реакції. Маса інфікованого детриту за рахунок високого інтраацинарного тиску потрапляє в структури інтерстиціальної тканини, запускаючи там каскад запальних реакцій. Таке запалення не є специфічним і характеризується міграцією лейкоцитів в інтраплазматичний простір [3]. Включення імунних реакцій захисту може послабити або нівелювати бактеріальне запалення, приводячи до швидкого регресу його вогнищ, з переходом у вогнищевий склероз, що ми часто бачимо в осіб із так званим первинно хронічним простатитом. Іншим варіантом результату є повноцінна гостра запальна реакція з розвитком клінічних симптомів. Саме така форма вимагає активного лікування й часто ускладнюється хронізацією процесу з рецидивами захворювання. Запальна реакція в паренхімі також різко порушує надходження лікарських речовин з кровотоку, що позначається на результатах лікування. Останнє стосується нераціональної антибіотикотерапії, коли курсові дози є недостатніми або неадекватними.
Формування стійкої антибіотикорезистентності флори сечових шляхів до традиційних антибактеріальних препаратів вимагає нових засобів для лікування й профілактики ІСШ. Актуальними залишаються препарати, альтернативні антибіотикам (вакцини, бактеріофаги, уросептики рослинного походження). Часто використовуваними засобами при лікуванні ІСШ другої лінії є рослинні уросептики, неспецифічні протизапальні засоби, про- і пребіотики, препарати D-манози, імунотропні препарати [6, 7]. Фітопрепарати, що застосовуються при ІСШ, дуже різнорідні за механізмом дії, довгостроковістю ефектів і комплаєнтністю, мають уросептичні ефекти, вимагають тривалого застосування, а за складом здебільшого є комбінованими. Фітотерапія супроводжує антибіотикотерапію в більшості випадків, тому що доведено, що її вплив на уропатогени сприяє підвищенню ефективності останньої.
Сучасними реаліями застосування антибіотикотерапії при ІСШ і статевих захворюваннях у чоловіків є: 1) широке використання емпіричної терапії з формуванням високих рівнів стійких грамнегативних штамів і підвищенням економічних витрат; 2) застосування традиційних схем, низький рівень упровадження нових діагностичних технологій (тест ампліфікації нуклеїнових кислот, мас-спектрометрія, біосенсори, методи крапельної мікрофлюїдики) [8, 9]; 3) побудова антибіотикотерапії без урахування регіональних особливостей чутливості антибіотиків до уропатогенов тощо.
Широко використовуваний у медичній практиці ХХ століття, метиленовий синій (МС) у даний час застосовується рідко, хоча, за даними іноземних джерел, його використання має широкі перспективи у випадках резистентності мікробної флори до антибактеріальних препаратів або необхідності покращання їх ефективності. Згідно з даними сучасних наукових досліджень, МС залишається ефективним антисептиком, що застосовується в промисловості й медицині [10–13].
У даний час вісь інтересів до ефектів МС змістилася в бік перспектив його застосування в осіб із симптомами нижніх сечових шляхів (СНСШ) інфекційного й неінфекційного генезу, а також при виявленому етіологічному факторі [14–21].
Суттю застосування комерційних фенотіазинових барвників — метилтіонінію і толуїдинового синього є використання їх фотосенсибілізуючого ефекту для інактивації патогенних організмів, включно з вірусами, бактеріями й грибами [22]. Бактерицидні властивості МС використовуються в різних галузях медицини завдяки ефектам фотопошкодження й виникненню віруліцидних [23], антифунгіцидних і антибактеріальних ефектів [24–27]. МС здатний викликати ефект фотопошкодження різних видів аденовірусів [28], герпетичних вірусів, одонтогенних бактерій (грампозитивні й грамнегативні), грибків Kluyveromyces fragilis і Candida аlbicans [29], вірусу Influenza, Helicobacter [30]. За наявності великого потенціалу у фенотіазинових барвників щодо антивірусних і антимікробних засобів у літературі недостатньо досліджень, присвячених даній темі, і вони розрізнені [31–36].
Механізм впливу МС полягає в розвитку метахроматичної реакції між МС і бактеріями, з додатковою димеризацією структур барвником [33].
Повнота фотобактерицидної ефективності барвника пояснюється повнотою його метахроматичної реакції з ліпополісахаридами біомембран і білками зовнішніх мембран бактеріальних клітин [34].
Фотоінактивація вірусної клітини за допомогою МС, коли загальною мішенню виступає нуклеїнова кислота, здатна викликати енергозалежне мембранне збурення з посиленим утворенням активних форм кисню й пошкодженням чужорідної ДНК і мітохондрій. Ефект протигрибкового впливу МС полягає в розвитку мітохондріальної дисфункції, порушення окисно-відновного і мембранного потенціалу в клітинах міцелію гриба, з інгібіцією переходу дріжджів C.albicans у гіф [37].
Окремо, в контексті доцільності застосування МС, слід розглянути доброякісну гіперплазію передміхурової залози (ДГПЗ) — досить поширене захворювання чоловічої статевої сфери, з переважним ураженням осіб після 50 років. Морфологічний дебют ДГПЗ може виникати в чоловіків віком 30 і більше років (у середньому — у 20 % чоловіків у 40 років і 90 % чоловіків у 90 років), однак клінічні прояви у вигляді симптомів нижніх сечових шляхів з’являються після 45–50 років [38]. Збільшення кількості випадків ДГПЗ, що виникли вперше, протягом останнього десятиліття є актуальною проблемою сучасної урології [1, 2]. До СНСШ традиційно відносять млявий струмінь сечі, імперативні позиви до сечовипускання вдень і вночі, відчуття неповного випорожнення сечового міхура, виділення сечі у вигляді крапель в кінці акту, нетримання при переповненні сечового міхура, а також гостру затримку сечі. Гостра затримка сечі (частота 3,0/1000 пацієнтів на рік у віці 40–49 років і 34,7/1000 пацієнтів на рік у віці 40–49 років) є станом, що вимагає негайного втручання [39].
Інфекційно-запальний процес в структурах ПВК спричиняє розвиток гіпоксії і вираженого оксидативного стресу в ацинусах і сполучнотканинному каркасі, що різко ускладнює фізіологічний механізм елімінації бактерій, формуючи умови персистенції бактеріального запалення. Виникнення міхурово-сечовідного рефлюксу погіршує адгезію уропатогенів з подальшим утворенням біоплівок [40].
Метилтіоніній має всі властивості, необхідні в даній клінічній ситуації, а саме: а) він здатний проникати в товщу біоплівок і структури уротелію завдяки малій молекулярній масі; б) він дає уросептичний (бактерицидний) ефект щодо грамнегативних мікроорганізмів (група Enterobacteriaceae з провідним штамом Escherichia coli); в) полегшує екстерналізацію, а також елімінацію мікробного агента (усунення збудника, що знаходиться в глибоких шарах уротелію на межі з підслизовим шаром), що особливо важливо для запобігання рецидивам інфекцій сечових шляхів [32, 35].
Застосування МС у випадках інфекцій сечових шляхів відкриває великі можливості впливу на патогенну мікрофлору без використання традиційних антибактеріальних препаратів. У даний час в Україні єдиним засобом, що містить метилтіоніній, залишається Пембіна-Блю, Silvestrini. Механізм фармакологічної дії останньої полягає в здатності при контакті з мікробною клітиною викликати енергозалежне мембранне збурення її структур з посиленим утворенням активних форм кисню й пошкодженням її ДНК. Утворення малорозчинних комплексних сполук з мукополісахаридами й білками бактеріальної клітини в сечових просторах як верхніх, так і нижніх шляхів сприяє загибелі або різкому зниженню життєвих функцій різних патогенних мікроорганізмів, а рослинні компоненти (шавлія) здатні потенціювати уросептичні ефекти [4].
Мета дослідження: встановити клінічну ефективність препарату Пембіна-Блю в осіб із хронічним бактеріальним простатитом як компонента комплексної терапії. Оцінити вплив Пембіна-Блю на можливість зменшення рецидивів протягом 3 місяців.
Матеріали та методи
В Українському інституті сексології та андрології було проведено дослідження впливу комбінованої терапії з включенням препарату Пембіна-Блю в осіб із хронічним бактеріальним простатитом. У 30 пацієнтів (І група) з верифікованим хронічним бактеріальним простатитом у фазі загострення (середній вік — 29,2 ± 1,4 року) проводилося комплексне медикаментозне лікування в поєднанні із застосуванням Пембіна-Блю по 1 капсулі 2 рази на добу протягом 20 днів. Анамнез захворювання становив від 2,2 до 6,7 року (в середньому 3,2 ± 0,5 року). Групу II (n = 30) становили пацієнти з верифікованим хронічним бактеріальним простатитом у фазі загострення (середній вік 33,2 ± 1,0 року), які одержували традиційну комбіновану терапію з включенням препарату Пембіна-Блю в дозі по 1 капсулі 2 рази на день протягом перших 20 днів з наступною перервою в 20 днів і курсами 20-денного прийому. Отже, пацієнти ІІ групи отримали три 20-денних курси Пембіна-Блю з рівними перервами протягом 100 днів. Контрольну групу (група ІІІ) становили 15 пацієнтів із хронічним бактеріальним простатитом в фазі загострення, аналогічного віку й схожого анамнезу, які одержували медикаментозну терапію без використання рослинних препаратів.
Завдання дослідження: вивчити вплив Пембіна-Блю: 1) на стан цитологічної картини секрету передміхурової залози й осаду сечі; 2) вираженість СНСШ (дані International Prostate Symptom Score (IPSS) і Quality of Life (QoL)); 3) стан мікробного пейзажу в секреті передміхурової залози й уринарній культурі.
Критерії включення пацієнтів у дослідження: а) чоловіки віком 25–45 років, які мають відкриті статеві контакти; б) наявність хронічного запального процесу в передміхуровій залозі і сім’яних міхурцях, верифікованого лабораторними й ультразвуковим методами; в) відсутність ефекту від проведеної консервативної терапії протягом 6 місяців; г) наявність скарг, що відповідають раніше верифікованому хронічному інфекційно-запальному захворюванню простатовезикулярного комплексу; д) інформованість про клінічне дослідження й здатність до адекватного співробітництва.
Критерії виключення з дослідження: використання інших методів лікування хронічного інфекційно-запального захворювання простатовезикулярного комплексу; наявність цукрового діабету; плазмовий рівень PSA понад 3,9 нг/мл; необхідність подальшої діагностики стану; прийом понад 5 лікарських препаратів; прийом будь-яких інших препаратів аналогічної дії і складу, прийом антибактеріальних препаратів.
Критерії оцінки клінічної ефективності: динаміка показників опитувальників за шкалою IPSS/QoL («відмінний ефект» — покращання до норми; «добрий ефект» — покращання всіх показників на 30–50 %; «задовільний ефект» — на 10–30 %; «без ефекту» — зрушення основних показників на ± 10 %; «погіршення» — зниження показників на 10 % і більше); оцінка ефективності терапії пацієнтом і лікарем; аналіз динаміки соку простати. Оцінка ефективності одужання полягала в зменшенні або зникненні скарг, нормалізації цитологічних параметрів зазначених середовищ та елімінації бактеріального фактора (частковій або повній).
Спостереження за пацієнтами проводилося протягом 100 днів з попередньою діагностикою до початку терапії, потім на 30-ту й 100-ту добу від початку лікування, з оцінкою безпеки препарату (рівень побічних ефектів).
Діагностика проводилася шляхом оцінки соматичного й генітального статусу, проведення трансректального ультразвукового дослідження, цитологічного й бактеріологічного аналізу секрету простати, проведення анкетування за шкалами IPSS і QoL, опитування з метою виявлення небажаних побічних явищ фармакотерапії.
Застосування статистичних методів полягало в обчисленні показників суттєвої різниці за коефіцієнтами вірогідності Стьюдента — Фішера (при р < 0,05) і виконанні кореляційного статистичного аналізу за допомогою стандартних комп’ютерних програм.
Результати та обговорення
У результаті досліджень, проведених до початку лікування, було встановлено наявність типової клініко-лабораторної картини хронічного бактеріального запалення в простатовезикулярному комплексі: а) наявність типових скарг із превалюванням СНСШ за даними анкет IPSS і QoL; б) наявність запальної реакції в секреті передміхурової залози й сечі; в) наявність бактеріальної інфекції при мікробіологічному дослідженні (табл. 1).
Середній термін проведення терапії вищевказаного стану становив 27 ± 4 діб і мало відрізнявся в групах. Було встановлено, що лейкоцитарна реакція в секреті передміхурової залози мала місце в різні періоди запального процесу. На початку лікування в більшості пацієнтів вона не мала тієї вираженості, якої набувала до 10–14 діб, характеризуючи дренаж запального вмісту ацинарних проток ПЗ, прояви якого зберігалися до кінця 1-го місяця. Висока лейкоцитарна реакція закономірно мала прямий корелятивний зв’язок з вираженістю мікробного титру в секреті ПЗ. Аналогічні мікробно-цитологічні характеристики можна було спостерігати і в уринарній культурі, отриманій після масажу ПЗ. Поділ останньої в момент мікції на 1-шу і 2-гу порції з метою топічної верифікації процесу давав можливість підтвердження наявності ізольованого запального процесу в нижніх сечових (статевих) шляхах у чоловіка. При порівнянні цитологічних результатів аналізу секрету ПЗ із 1-ю порцією сечі було встановлено, що в понад 95 % пацієнтів були ознаки лейкоцитарної реакції в обох середовищах, а також ознаки дренажу ацинусів ПЗ в уринарне середовище (лецитинові зерна). Результат нітритного тесту в сечі, скринінгового методу діагностики бактеріурії, чітко корелював із запальною реакцією (лейкоцитарна реакція) і зниженням трофічної функції (дефіцит лецитинових зерен, відсутність феномена кристалізації) в секреті ПЗ. Дані прояви поєднувалися з наявністю виражених СНСШ (високі показники IPSS) і зниженням якості життя (високі показники QoL). Підтвердження бактеріального генезу вищевказаних проявів за допомогою мікробіологічного й ультразвукового дослідження сприяло остаточній верифікації діагнозу (табл. 1).
/57_2.jpg)
Динаміка лікування в групах з різними видами комбінованої терапії вказувала на покращання всіх взаємопов’язаних показників. Вірогідний клінічний ефект до 30 діб ми спостерігали в І групі у 93,3 %, у ІІ групі — у 90 %, в ІІІ групі — у 96,6 %. Відмінності за клінічними й лабораторними показниками в групах, які отримували Пембіна-Блю, і контрольній групі не мали статистичної вірогідності. Протягом наступних 70 днів, що в сумі становило 100 днів моніторингу урологічного статусу пацієнтів, пацієнти ІІ групи отримували лікування за схемою, а інші групи терапію не отримували. До закінчення строків спостереження була проведена оцінка ризику розвитку раннього рецидиву хронічного простатиту, а також оцінка стану сечовипускання і якості життя (IPSS, QoL).
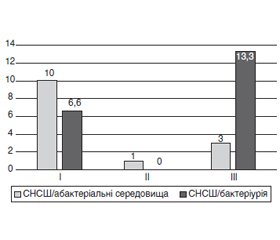
Рис. 1 містить дані про кількість рецидивів, що виникли в осіб із хронічним бактеріальним простатитом за період 3 місяці. Стан розглядався як рецидив за наявності в пацієнта СНСШ, що супроводжуються запальною реакцією в секреті передміхурової залози (з бактеріальною інфекцією/без неї). Рецидивом вважалося й повторне виникнення СНСШ із середніми або вираженими проявами за шкалами IPSS (12–13 балів) і QoL (2 бали). Усі симптоми рецидивів були зібрані в групи: СНСШ зі стерильними середовищами і СНСШ з бактеріурією/інфекцією в секреті передміхурової залози.
Встановлено, що за період терапії понад 3 місяці рівень рецидивів у пацієнтів ІІ групи був вірогідно нижче (СНСШ із бактеріурією були відсутні), ніж в осіб контрольної групи. Рівень рецидивів у пацієнтів І групи також був нижче в 2 рази, ніж у контролі (р < 0,05).
Комплаєнтність щодо монотерапії препаратом Пембіна-Блю в осіб IІ групи була високою, жодних небажаних клінічних ефектів виявлено не було. В осіб I, II і III груп їх рівень був практично однаковим і становив у середньому 6,6 % (n = 2), що не вимагало відміни препарату (випадки диспепсії). Низький рівень небажаних явищ у групах із застосуванням препарату Пембіна-Блю аналогічний такому в контролі, що вказувало на його безпеку й добру комплаєнтність.
Аналіз ефективності комбінованої терапії встановив, що Пембіна-Блю сприяла покращанню стану нижніх сечових шляхів, зменшенню вираженості запальної реакції в сечі (зменшення лейкоцитурії і бактеріурії), зниженню запальної реакції в секреті простати (зменшення лейкоцитів, підвищення рівня лецитинових зерен з динамікою відновлення феномена кристалізації).
Застосування препарату Пембіна-Блю з метою активації рецепції слизової сечової системи, пригнічення формування бактеріальних біоплівок уропатогенними штамами Enterobacteriaceae, є науково обґрунтованим і ефективним клінічним підходом у терапії хронічних простатитів. Механізми формування запальної реакції в простатичній тканині, що ініційовані бактеріальним агентом або являють собою постбактеріальну проліферативну реакцію в асептичних умовах, є універсальною моделлю хронічного простатиту й везикуліту. Можливість санації сечових просторів за допомогою антисептика метилтіонінію є унікальною можливістю елімінації мікробного фактора з високою часткою нормалізації мікробного пейзажу. Пембіна-Блю за рахунок складу антикристалуричних фітокомпонентів здатна позитивно впливати на колоїдно-кристалоїдні відношення в сечі, що також сприяє зниженню запальної реакції в нижніх сечових шляхах.
Отже, застосування препарату Пембіна-Блю в осіб із хронічним бактеріальним простатитом як компонента комплексної терапії створює всі умови для реалізації антимікробного, протизапального й репараційного ефектів.
Важливим позитивним моментом такого виду лікування була відсутність будь-якого негативного ефекту при призначенні препарату Пембіна-Блю при спостереженні за пацієнтами протягом 100 діб. Отримана висока ефективність класичних схем комбінованої терапії з включенням Пембіна-Блю дає підстави рекомендувати препарат з метою зменшення ризику розвитку рецидивів хронічного простатиту.
Висновки
1. Комбінована терапія випадків хронічного бактеріального простатиту з включенням препарату Пембіна-Блю є ефективною методикою, що дозволяє покращити якість життя пацієнта за рахунок швидкої ліквідації симптомів нижніх сечових шляхів, зниження лейкоцитарної реакції в сечі й титрів бактеріурії.
2. Застосування препарату Пембіна-Блю в осіб із хронічним бактеріальним простатитом дозволяє вірогідно зменшити частоту розвитку рецидивів захворювання протягом понад 3 місяців (підвищення ефективності елімінації мікробного збудника, зменшення вираженості симптомів нижніх сечових шляхів) і покращити показники лікування за рахунок підвищення якості життя пацієнта.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів і власної фінансової зацікавленості при підготовці даної статті.
Список литературы
1. Горпинченко І.І., Гурженко Ю.М., Спиридоненко В.В. Можливості впливу фітокорекції на пригнічення процесів доброякісної гіперплазії передміхурової залози в осіб із супутніми хронічними запальними захворюваннями передміхурової залози. Здоровье мужчины. 2016. № 1(56). С. 121-126.
2. Горпинченко І.І., Гурженко Ю.М., Спиридоненко В.В. Сучасні дані про вплив хронічного запалення в патогенезі доброякісної гіперплазії передміхурової залози і раку передміхурової залози. Здоровье мужчины. 2014. № 4. С. 91–94.
3. Спиридоненко В.В. Хронічний калькульозний простатит: етіологія, патогенез, діагностика та сучасні методи лікування. Здоровье мужчины. 2016. № 4(59). С. 6-9.
4. Спиридоненко В.В. Применение метиленового синего в терапии инфекций мочевых путей: современный взгляд. Здоровье Украины. 2020. № 2. С. 2-3.
5. Schwab S., Jobin K., Kurts C. Urinary tract infection: recent insight into the evolutionary arms race between uropathogenic Esche–richia coli and our immune system. Nephrol. Dial. Transplant. 2017. 32(12). 1977-1983.
6. Toh S.L., Boswell-Ruys C.L., Lee B.S.B., Simpson J.M., Clezy K.R. Probiotics for preventing urinary tract infection in people with neuropathic bladder. Cochrane Database Syst. Rev. 2017 Sep 8. 9. CD010723.
7. Sihra N., Goodman A., Zakri R., Sahai A., Malde S. Nonantibiotic prevention and management of recurrent urinary tract infection. Nat. Rev. Urol. 2018. 15(12). 750-776.
8. Осипов Г.А., Родионов Г.Г. Применение метода масс-спектрометрии микробных маркеров в клинической практике. Лабор. диагностика. Спецвыпуск Лаборатория. 2013. № 2. С. 68-73.
9. Кухтевич И.В., Жуков М.В., Чубинский-Надеждин В.И., Букатин А.С., Евстрапов А.А. Фиксация бактерий E.сoli на подложке для измерений в жидкости методом атомно-силовой микроскопии. Научное приборостроение. 2012. Т. 22. № 4.
10. Sipos A.J., Urakawa H. Differential responses of nitrifying archaea and bacteria to methylene blue toxicity. Lett. Appl. Microbiol. 2016. 62(2). 199-206. Erratum in: Lett. Appl. Microbiol. 2016. 62(4). 359-360.
11. Stawicki S.P., Sims C., Sarani B., Grossman M.D., Gracias V.H. Methylene blue and vasoplegia: who, when, and how? Mini Rev. Med. Chem. 2008. 8(5). 472-90.
12. Delport A., Harvey B.H., Petzer A., Petzer J.P. The monoamine oxidase inhibition properties of selected structural analogues of methylene blue. Toxicol. Appl. Pharmacol. 2017. 325. 1-8.
13. Tian R.B., Asmar S., Napez C., Lépidi H., Drancourt M. Effectiveness of purified methylene blue in an experimental model of Mycobacterium ulcerans infection. Int. J. Antimicrob. Agents. 2017. 49(3). 290-295.
14. Gerber G.S., Brendler C.B. Evaluation of the urologic patient: history, physical examination, and urinalysis. Wein A.J. et al.; eds. Campbell-Walsh Urology. 10th ed. Philadelphia, Pa.: Elsevier Saunders, 2012. 75-76.
15. Hanno P., Nordling J., Fall M. Bladder pain syndrome. Med. Clin. North Am. 2011. 95(1). 55-73.
16. Sivalingam S., Monga М. Management of Ureteral Stent Discomfort in Contemporary Urology Practice. Urology Practice. 2014. 1. 141-145.
17. Kyungtae Ko, Won Ki Lee, Cheol Young Oh et al. A Combination of Antibiotics and Non-Steroidal Anti-Inflammatory Drugs More Beneficial Than Antibiotic Monotherapy For The Treatment of Female Acute Uncomplicated Cystitis? A Randomized Controlled Pilot Study. Female Urology. 2018. 15(06). 365-369.
18. Kulchavenya E. Acute uncomplicated cystitis: is antibiotic unavoidable? Ther. Adv. Urol. 2018. 10(9). 257-262.
19. Bjerrum L., Lindbæk M. Which treatment strategy for women with symptoms of urinary tract infection? BMJ. 2015. 351.
20. Hotchandani R., Aggarwal K.K. Urinary Tract Infections in Women. Indian Journal of Clinical Practice. 2012. 23(4). 187-192.
21. Fischer K.M., Louie M. Ureteral Stent Discomfort and Its Management. P. Curr. Urol. Rep. 2018. 19. 64.
22. Wainwright M. Non-porphyrin photosensitizers in biomedicine. Chem. Soc. Rev. 1997. 25. 351-359.
23. Wagner S.J., Skripchenko A., Robinette D., Mallory D.A., Hirayama J., Cincotta L., Foley J. The use of dimethylmethylene blue for virus photoinactivation of red cell suspensions. Dev. Biol. (Basel). 2000. 102. 125-9.
24. Ito T. Toluidine blue: The mode of photodynamic action in yeast cells. Photochem. Photobiol. 1977. 25. 47-53.
25. Wakayama Y., Takagi M., Yano K. Photosensitized inactivation of E. coli cells in toluidine blue-light system. Photochem. Photobiol. 1980. 32. 601-605.
26. Wilson M. Bactericidal effect of laser light and its potential use in the treatment of plaque-related diseases. Int. Dent. J. 1994. 44. 181-189.
27. Bhatti M., MacRobert A., Meghji S., Henderson B., Wilson M. Astudy of the uptake of toluidine blue O by Porphyromonas gingivalis and the mechanism of lethal photosensitization. Photochem. Photobiol. 1998. 68. 370-376.
28. Hiatt C., Kaufman E., Helplin J., Baron S. Inactivation of viruses by the photodynamic action of toluidine blue. J. Immunol. 1960. 84. 480-484.
29. Wilson M., Dobson J., Sarkar S. Sensitization of periodontopathogenic bacteria to killing by light from a low-powerlaser. Oral Microbiol. Immunol. 1993. 8. 182-187.
30. Wainwright M., Phoenix D.A., Marland J., Wareing D.R.A., Bolton F.J. A study of photobacterial activity in the phenothiazinium series. FEMS Immunol. Med. Microbiol. 1997. 19. 75-80.
31. Mohr H., Bachmann B., Klein-Struckmeier A., Lambrecht B. Virus inactivation of blood products by phenothiazine dyes and light. Photochem. Photobiol. 1997. 65. 441-445.
32. Usacheva M.N., Teichert M.C., Biel M.A. Comparison of the methylene blue and toluidine blue photobactericidal efficacy against gram-positive and gram-negative microorganisms. Lasers Surg. Med. 2001. 29(2). 165-73.
33. Usacheva M.N., Teichert M.C., Biel M.A. The role of the methylene blue and toluidine blue monomers and dimers in the photoinactivation of bacteria. J. Photochem. Photobiol. B. 2003 Oct 15. 71(1–3). 87-98.
34. Usacheva M.N., Teichert M.C., Sievert C.E., Biel M.A. Effect of Ca+ on the photobactericidal efficacy of methylene blue and toluidine blue against gram-negative bacteria and the dye affinity for lipopolysaccharides. Lasers Surg. Med. 2006 Dec. 38(10). 946-54.
35. Pal R., Ansari M.A., Saibabu V., Das S., Fatima Z., Hameed S. Nonphotodynamic Roles of Methylene Blue: Display of Distinct Antimycobacterial and Anticandidal Mode of Actions. J. Pathog. 2018 Jan 31. 2018. 3759704.
36. de Carvalho Leonel L., Carvalho M.L., da Silva B.M., Zamuner S., Alberto-Silva C., Silva Costa M. Photodynamic Antimicrobial Chemotherapy (PACT) using methylene blue inhibits the viability of the biofilm produced by Candida albicans. Photodiagnosis Photodyn. Ther. 2019 Jun. 26. 316-323.
37. Ansari M.A., Fatima Z., Hameed S. Antifungal Action of Methylene Blue Involves Mitochondrial Dysfunction and Disruption of Redox and Membrane Homeostasis in C.albicans. Open Microbiol. J. 2016 Feb 25. 10. 12-22.
38. Diagnosis and Management of Benign Prostatic Hyperplasia. Am. Fam. Physician. 2008. 77(10). 1403-1410, 1413.
39. Guidelines on the Management of Non-Neurogenic Male Lower Urinary Tract Symptoms (LUTS), incl. Benign Prostatic Obstruction (BPO). European Association of Urology. 2014.
40. Natural history of prostatism: risk factors for acute urinary retention. J. Urol. Aug. 1997. 158(2). 481-7.
/57.jpg)

/57_2.jpg)