У наш час доведено, що захворювання пародонта — основна причина втрати зубів [1]. Як відомо, пародонт об’єднує комплекс тканин, які оточують зуб, мають генетичну та функціональну спільність (ясна, зубо-ясенне з’єднання, кортикальна пластинка, губчаста альвео-лярна кістка, періодонтальна зв’язка, цемент кореня, кровоносні і лімфатичні судини, нервові волокна) і забезпечують надійну фіксацію зуба в щелепних кістках [2]. Крім опорної і амортизаційної (щільно утримує зуб в альвеолі, розподіляє навантаження і тиск при жуванні), пародонт також виконує бар’єрну (перешкоджає проникненню мікроорганізмів і шкідливих речовин в ділянку кореня), трофічну, рефлекторну, пластичну (дія фібро- і остеобластів) функції тощо. Завдяки пародонту відбувається постійна регенерація тканин, втрачених у результаті фізіологічних і/або патологічних процесів [3].
Пародонтит (в англомовній літературі — periodontitis) є запальним захворюванням, яке викликається специфічною мікрофлорою і призводить до прогресуючого руйнування зв’язкового апарату зуба і альвеолярної кістки. Це супроводжується утворенням рецесії ясен, формуванням пародонтальних кишень як відокремлено, так і обопільно. Необхідно мати на увазі, що непомітний і безсимптомний перебіг пародонтиту на початку захворювання часто призводить до того, що пацієнти звертаються по допомогу на пізніх його стадіях [4].
Доведено, що активація запалення в пародонті нерозривно пов’язана з системними процесами в організмі, які супроводжуються запальною відповіддю [5]. Дослідження останніх років показали, що пародонтит є супутнім фактором при ішемічній хворобі серця та цереброваскулярних захворюваннях/ішемічному інсульті [6], негативно впливає на травну, серцево-судинну, ендокринну та інші системи організму [7]. Встановлено, що підвищений рівень С-реактивного білка знижується після лікування пародонтиту [8]. Тому тяжкість перебігу і негативний вплив пародонтиту на здоров’я людини вказують на важливість проблеми його профілактики і лікування [9].
Епідеміологія
У наш час у всьому світі відмічається зростання поширеності захворювань пародонта. У молодому віці частіше діагностують гінгівіт, у старших вікових групах — генералізований пародонтит (95 %) [10]. Гінгівіт виявляється у 23–77 % дітей Латинської Америки [11]. У США гінгівіт відмічається у 9–17 % дітей віком 3–11 років, в Австралії, Швеції, Англії та Швейцарії — у 48–85 % дітей віком 3–6 років, серед підлітків гінгівіт діагностується у 70–90 % [12]. Обстеження на півночі Італії показало, що серед італійців віком 20–75 років тяжкий пародонтит зустрічається у 34,9 %, помірно тяжкий — у 40,8 % [13]. В Норвегії популяційне обстеження 1911 людей віком 20–79 років показало, що у 49,5 % обстежених був пародонтит, у 9,1 % — тяжкий пародонтит [14].
Етіологія та патогенез
Вважається, що пародонтит є відображенням складних динамічних взаємодій між вірусами, специфічними бактеріальними збудниками та руйнівними імунними реакціями [15].
У порожнині рота і глотці людини виявлено більше ніж 300 видів мікробів — не лише бактерії, але і віруси, гриби. Останнім часом виділяють так звані пародонтопатогенні форми мікроорганізмів, серед них грамнегативні анаеробні бактерії групи бактероїдів (Porphyromonas gingivalis, Prevotella melanogenica, спірохети, спірили), а також грампозитивні бактерії групи актиноміцетів (Actinomyces naeslundii, Actinomyces viscosus тощо) [16].
Доведено, що запалення провокується біоплівками бактерій [1]. Тобто основним етіологічним фактором, що індукує запалення в тканинах пародонта, є мікроорганізми біоплівки, яка щільно прилягає до поверхні зуба. Уміст мікробної біоплівки складний: білки, вуглеводи, неорганічні компоненти (кальцій, фосфор тощо). При цьому більше ніж 70 % органічного складу представлено мікроорганізмами, які відрізняються високою патогенністю, адгезією до тканин зуба за рахунок гелеподібних продуктів (білки слини, декстрани тощо), деяких компонентів ясенної рідини [16].
Мікроорганізми біоплівки виділяють ендотоксини, здатні проникати через епітелій ясенної борозни і сполучнотканинний епітелій, таким чином порушуючи бар’єрну функцію епітелію ясенної борозни і створюючи умови для порушення цілісності зубо-ясенного з’єднання і ураження підлеглих тканин пародонта [16]. Біоплівка також допомагає патогенним бактеріям заховатись від відповіді організму-господаря.
Але потрібно мати на увазі, що мікробний фактор може бути реалізований повною мірою лише за відсутності і/або неадекватної захисної реакції імунної системи (порушення активності поліморфноядерних лейкоцитів, моноцитів, утворення цитокінів тощо) [16].
Мікроорганізми швидше регулюють, ніж безпосередньо викликають запальні зміни в тканинах пародонта. Наприклад, P.gingivalis, T.forsythia, Tr.denticola, Pl.intermedia взаємодіють з комплементом різними шляхами, пригнічуючи або стимулюючи його. Ключова роль в ініціації переходу від симбіотичної структури мікробіому до дисбіотичної належить P.gingivalis, хоча сама по собі, без бактерій-коменсалів, вона не може викликати пародонтит. P.gingivalis продукує фактори вірулентності (гінгіпаїни, серинові фосфатази тощо), що впливають на відповідь макроорганізму, створюючи сприятливі умови для росту мікроорганізмів. Формується мікробна колонія, яка не лише здатна вижити в умовах запалення, але і потребує його підтримки, оскільки запалення надає поживні речовини у вигляді продуктів тканинного руйнування (пептиди, які утворюються при деградації колагену, залізовмісних сполук).
У тканинах пародонта первинне місце виникнення запалення — ясенна борозна. Тут відбувається постійна мікробна атака і запальна відповідь на неї. Результатом цієї взаємодії є ясенна рідина, кількість якої в нормі дуже мала, але при розвитку запалення різко зростає за рахунок надходження з кровоносних судин білків плазми і формених елементів крові. У під’ясенній ділянці і в пародонтальних кишенях в умовах обмеженого доступу кисню і збільшеної кількості ясенної рідини та джерел поживних речовин активуються анаероби. Інші ж мікроорганізми, для яких запальне середовище несприятливе, витісняються з мікробіоценозу. Утворення біоплівки супроводжується збільшенням у слині числа нейтрофільних лейкоцитів, які, маючи високу кініноутворюючу активність, сприяють продукції вазоактивних речовин і зміні тонусу судин, що призводить до їх короткочасної дилатації, це підвищує об’ємний кровотік у пародонті, в основному внаслідок збільшення числа функціонуючих капілярів і активації місцевого кровообігу. У подальшому зміни метаболізму тканин активують тканинні рецептори і виникають регіонарні констрикторні рефлекси, що супроводжується підвищенням судинного тонусу, спазмом судин. Зменшується об’єм мікроциркуляторного русла, що призводить до обмеження транспорту кисню і поживних речовин у тканини пародонта, сповільнюється видалення СО2 і продуктів метаболізму, це сприяє подальшому збільшенню гіпоксії [5].
Таким чином, запалення безпосередньо впливає на кількісний і якісний склад біоплівки при пародонтиті. Бактерії індукують запалення, стимулюють утворення ясенної рідини, щоб отримати необхідні поживні речовини. Високотоксичні метаболіти, які накопичуються в ясенній рідині, викликають пошкодження ендотеліальних клітин, посилюють агрегацію тромбоцитів, що збільшує розлади мікроциркуляції, сприяє розвитку набряку і замикає порочне коло. Селективне розмноження патогенних «інфламофільних» бактерій сприяє тривалому збереженню порочного кола безперервної тканинної деструкції і бактеріального росту. Тобто пародонтитасоційована флора продовжує підтримувати розвиток запалення.
Ретельне видалення мікробної біоплівки дозволяє зупинити розвиток пародонтиту, але не забезпечує повного відновлення тканинного гомеостазу. У ситуації, коли постійно підтримується запальна відповідь, різні типи клітин (мастоцити, тромбоцити, лейкоцити) надлишково генерують медіатори запалення, цитокіни і хемокіни. Гормони, біогенні аміни, цитокіни, а також ліпополісахариди мікробних клітин викликають патологічні зміни у клітинних мембранах, активацію каскаду реакцій, що призводять до утворення ейкозаноїдів (простагландинів і лейкотрієнів), які відіграють ключову роль у розвитку запалення і деструкції тканин пародонта. У найбільшій кількості у вогнище запалення залучаються нейтрофіли, що є джерелом похідних арахідонової кислоти, оксиду азоту і активних форм кисню (АФК). Ці речовини є високоактивними регуляторами клітинних функцій. Присутні в тканинах у вкрай низьких концентраціях, вони викликають ефекти як «гормони місцевої дії», впливають на метаболізм клітин, які їх продукують за автокринним механізмом, і на оточуючі клітини — за паракринним механізмом.
Причому інтенсивність утворення вільних радикалів пов’язана скоріше не з тяжкістю захворювання, а з його активністю. Активність ліпопероксидації, вільнорадикальне окиснення не лише м’яких тканин, а й кісткової призводить до деструкції колагенових волокон і резорбції альвеолярного відростка [5].
У розвитку запалення основна роль належить простагландинам, які утворюються з арахідонової кислоти за участю циклооксигенази (ЦОГ). Існує два типи ЦОГ, які відповідають за утворення різних типів простагландинів. При цьому простагландини, що утворюються під впливом ЦОГ-1 (що синтезується в більшості клітин, вважається конституціональною), відповідають за фізіологічні функції, стимулюють репаративний потенціал і підвищують стійкість клітин до ендогенних і екзогенних ушкоджуючих факторів, зокрема беруть участь у формуванні захисного слизового шару шлунка. А простагландини, що утворюються під впливом індуцибельної ЦОГ-2 (індукується медіаторами запалення, гормонами і факторами росту), відповідають за розвиток болю, запалення і лихоманки. Однак вона відіграє важливу роль у підтримці гомеостазу основних органів і тканин.
Системна протизапальна терапія пародонтиту
Основною фармакологічною стратегією лікування пародонтиту є пригнічення запального процесу з метою запобігання руйнуванню тканин і розсмоктуванню кісток. Важливими мішенями протизапальної терапії є ейкозаноїди і АФК. Мета терапії, що модулює запальну відповідь організму, полягає у відновленні балансу між прозапальними медіаторами (цитокінами, ейкозаноїдами) і деструктивними ферментами (матриксні металопротеїнази), з одного боку, і протизапальними медіаторами й інгібіторами ферментів — з іншого.
Для лікування будь-яких запальних процесів найбільш активними є стероїдні і нестероїдні протизапальні препарати. За результатами досліджень встановлено згубний вплив стероїдних протизапальних препаратів на структури пародонта [17]. Доведено, що системна стероїдна терапія є фактором пригнічення виживання зубів після терапії зубних каналів [18]. За результатами експериментальних досліджень встановлено, що дексаметазон пригнічує резорбцію кістки на початковому етапі ортодонтичного процесу, однак затримує процес дозрівання колагену в матриксі кістки [19].
Тому оптимальним класом препаратів для системної протизапальної терапії пародонтиту є нестероїдні протизапальні лікарські засоби (НПЛЗ) [1]. Сьогодні у клінічній практиці відомо більше ніж 25 різних представників цієї групи, що мають відмінності за хімічною структурою, особливостями механізму дії, швидкістю настання ефекту, показаннями до застосування і переносимістю. За механізмом дії вони поділяються: на неселективні НПЛЗ (інгібітори як ЦОГ-2, так і ЦОГ-1 диклофенак, кеторолак, кетопрофен, ібупрофен, індометацин, напроксен); помірно селективні НПЛЗ (німесулід, мелоксикам, етодолак); високоселективні НПЛЗ (коксиби).
Побічні ефекти при прийомі НПЛЗ багато в чому пов’язані з переважним гальмуванням тієї чи іншої ізоформи ЦОГ. Для традиційних неселективних НПЛЗ, які блокують ЦОГ-1 і ЦОГ-2, існує небезпека розвитку тяжкої патології шлунково-кишкового тракту, що характеризується наявністю ерозій, виразок і гастроінтестинальних катастроф — кровотеч і перфорацій (НПЛЗ-гастропатія і НПЛЗ-ентеропатія). Ризик появи даних ускладнень в осіб, які регулярно приймають неселективні НПЛЗ, зростає більше ніж у 4 рази і становить приблизно 0,5–1 епізод на 100 пацієнтів на рік. Пацієнти, які регулярно приймають нестероїдні протизапальні засоби, гинуть від подібних ускладнень в 2–3 рази частіше, ніж люди, які не одержують жодних НПЛЗ. Помірно селективні і специфічні інгібітори ЦОГ-2 справляють незначний вплив на утворення простагландину в слизовій оболонці шлунково-кишкового тракту, тому при їх застосуванні ризик гастроінтестинальних ускладнень значно менший порівняно з використанням традиційних НПЛЗ.
У той же час і між більш новими представниками класу НПЛЗ є відмінності за профілем безпеки. Специфічні інгібітори ЦОГ-2, селективно блокуючи ЦОГ-2, призводять до негативного впливу на серцево-судинну систему: тромбоз, підвищення ризику інфарктів, ішемічніх інсультів. Це пояснюється, по-перше, блокуванням вазопротекторного простагландину I2. По-друге, пригнічення ЦОГ-2 викликає зниження продукції простагландину D2, що теж призводить до зростання ризику серцево-судинних захворювань, оскільки у периферичних тканинах простагландин D2 стимулює вазодилатацію і пригнічує агрегацію тромбоцитів, а також виявляє нейропротекторну дію щодо клітин головного мозку. Простагландин D2 існує протягом дуже короткого періоду часу і перетворюється на простагландин J2, що виявляє протизапальну дію: він вимикає синтез прозапального простагландину E2, тобто є регулятором запальної реакції за зворотним зв’язком. По-третє, при фізіологічному перебігу запальної реакції каскад утворення прозапальних медіаторів на певному етапі перемикається на синтез із арахідонової кислоти протизапальних молекул, ліпоксинів. Цей процес вимагає спільної участі ЦОГ-2 і двох ізоформ ліпоксигенази [20]. Крім негативного впливу на серцево-судинну систему, селективні інгібітори ЦОГ-2 порушують формування кісток, зокрема інгібують цей процес навколо ортопедичних імплантатів [21]. Доведений більш високий ризик порушень консолідації перелому у пацієнтів, які приймають селективні інгібітори ЦОГ-2 [22]. Це пояснюють різними впливами на диференціювання фібробластів, остеобластів та інших клітин-попередників у культурі мезенхімальних клітин людини [20].
Помірно селективні інгібітори ЦОГ-2 збалансовано впливають як на ЦОГ-1, так і на ЦОГ-2, тим самим забезпечують оптимальний профіль гастроінтестинальної і кардіоваскулярної безпеки, при цьому показують достатню протизапальну і анальгетичну ефективність, підтверджену клінічними дослідженнями.
Серед помірно селективних НПЛЗ особливе місце посідає німесулід. У терапевтичних концентраціях він пригнічує 88 % активності ЦОГ-2 і 45 % активності ЦОГ-1. Такий баланс забезпечує швидке настання протизапального та анальгетичного ефекту, при низькому ризику гастроінтестинальних небажаних явищ. Передбачається, що німесулід пригнічує ЦОГ-1 саме у вогнищі запалення і болю при мінімальному впливі на ЦОГ-1 у шлунку і нирках. Крім того, німесулід є єдиним із НПЛЗ, що пригнічує 5-ЛОГ, зменшуючи синтез прозапальних лейкотрієнів, що також покращує клінічну ефективність і гастроінтестинальну безпеку препарату.
Німесулід має низку фармакологічних ефектів, незалежних від клас-специфічного впливу на ЦОГ-2, що підсилюють протизапальну і знеболюючу активність препарату і зменшують його гастротоксичність. Встановлено, що він викликає блокаду фермента фосфо-діестерази IV, знижуючи активність клітин запальної агресії — макрофагів і нейтрофілів, пригнічує продукцію вільних радикалів, утворення токсичних форм кисню, активність індуцибельної NO-синтетази (NOS), запобігаючи їх шкідливій дії на тканини у вогнищі запалення. Німесулід пригнічує вивільнення прозапальних цитокінів, фактора некрозу пухлини, утворення і вивільнення субстанції Р, тим самим роблячи істотний внесок у протизапальну та знеболювальну дію препарату. Німесуліду властива здатність пригнічувати вивільнення гістаміну тучними клітинами, що, з одного боку, гальмує секрецію соляної кислоти в шлунку, а з іншого — дозволяє використовувати його у пацієнтів з алергічною схильністю і схильністю до аспіринової астми.
Також німесулід пригнічує синтез металопротеїназ, більшою мірою еластази і колагенази, тим самим запобігає руйнуванню протеогліканів і колагену хрящової тканини. Він активує синтез інгібітора тканинного активатора плазміногену і блокує продукцію тромбоцит-активуючого фактора, що є надзвичайно важливим у запобіганні тромбоемболічним ускладненням, особливо у пацієнтів із супутніми кардіоваскулярними захворюваннями. Така здатність німесуліду робить цей НПЛЗ дійсно унікальним з точки зору багатофакторності впливу.
Німесулід — похідне сульфонанілідів, має оригінальну структуру, що складається з 2 ароматичних кілець і метилсульфонілової групи, які визначають відносно високу рКа (6,5) і помірну ліпофільність препарату. Ці якості обумовлюють низьку локальну подразнюючу дію препарату на шлунково-кишковий тракт.
Короткий період напіввиведення (1,8–4,7 год) німесуліду, швидке досягнення максимальної концентрації в плазмі крові зумовлюють високу швидкість настання анальгетичного і протизапального ефекту, а також зменшення частоти побічних ефектів. При пероральному прийомі препарат швидко і практично повністю абсорбується незалежно від прийому їжі. Завдяки своїм біохімічним властивостям німесулід легко потрапляє у вогнище запалення. Концентрація вільного німесуліду безпосередньо у вогнищі запалення, де рН середовища нижчий, може бути набагато вищою від його плазмової концентрації [19, 20].
Німесулід має сприятливий гастроінтестинальний профіль безпеки, що обумовлено багатьма факторами: слабкою кислотністю (практично нейтральністю) і ліпофільністю препарату, інгібіцією супероксидних аніонів і відсутністю роз’єднання оксидативного фосфорилювання при його прийомі, помірною селективністю, коротким періодом напіввиведення і блокуванням вивільнення гістаміну. Невисокий ризик ускладнень з боку органів шлунково-кишкового тракту на фоні прийому німесуліду продемонстрований в роботі A. Conforti і співавт., які проаналізували повідомлення про 10 608 випадків значущих побічних ефектів, що так чи інакше асоціюються з використанням різних НПЛЗ (1988–2000). Згідно з цим аналізом, німесулід був причиною виникнення ускладнень з боку шлунково-кишкового тракту в середньому більше ніж у 2 рази рідше за інші нестероїдні протизапальні засоби. Кількість повідомлень, пов’язаних з німесулідом, становила 10,4 %. Частка ж повідомлень про ускладнення при застосуванні кетопрофену — 21,7 %, диклофенаку — 21,2 %, піроксикаму — 18,6 %.
У 2013 році були опубліковані результати європейського популяційного дослідження, що довело відносно високу безпеку німесуліду щодо виникнення виразок і/або кровотеч з верхніх відділів шлунково-кишкового тракту (J. Castellsague). Дослідники оцінювали ризик розвитку серйозних ускладнень з боку шлунково-кишкового тракту в період з 2001 по 2008 р. Сумарно зареєстровані 588 827 осіб, які приймали НПЛЗ, при цьому виявлений 3031 епізод значущих ускладнень із боку шлунково-кишкового тракту (виразки і/або кровотечі). Німесулід демонстрував найбільш низький ризик, разом із селективними інгібіторами ЦОГ-2 целекоксибом і рофекоксибом він увійшов до групи препаратів із ризиком менше ніж 2; у групу середнього ризику (відносний ризик від 2 до 5) увійшли напроксен, ібупрофен, диклофенак, мелоксикам, еторикоксиб; групу високого ризику (відносний ризик > 5) становили кетопрофен, кеторолак, піроксикам.
Порівняльний аналіз побічних реакцій з боку печінки, індукованих німесулідом і неселективними НПЛЗ, що включає рандомізовані і постмаркетингові клінічні дослідження, показав, що німесулід викликає підвищення печінкових ферментів не частіше, ніж «традиційні» НПЛЗ. У 2014 році у Відні в Міжнародному консенсусі стало також відомо положення про те, що ризик пов’язаних із використанням німесуліду тяжких печінкових реакцій є низьким і знаходиться в тих самих межах, що і токсичність інших нестероїдних протизапальних засобів, а користь від його застосування перевищує ризики.
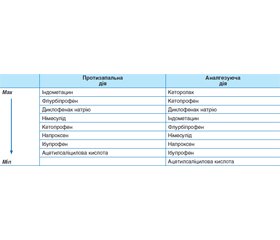
Таким чином, висока протизапальна та аналгетична активність німесуліду, сприятливий гастроінтестинальний та кардіоваскулярний профіль безпеки, відсутність гепатотоксичності обумовлюють його широке застосування для лікування пародонтиту. З цією метою також може застосовуватися кеторолак і кетопрофен [25]. Порівняльна протизапальна та аналгезуюча дія НПЛЗ наведена в табл. 1, однак потрібно брати до уваги ризик побічних ефектів, особливо у шлунково-кишковому тракті [1], при застосуванні неселективних НПЛЗ. Для гастропротекторного ефекту разом з НПЛЗ призначають лікарські засоби, що захищають слизову оболонку шлунково-кишкового тракту. Є тенденції призначати з цією метою омепразол — інгібітор протонного насоса, однак треба зважати на те, що омепразол виявляє інгібуючий вплив і на ізоферменти цитохрому Р-450 і цим самим може порушувати метаболізм НПЛЗ. Найбільш доцільно для гастропротекції застосовувати мізопростол — синтетичний аналог простагландину E2.
/22.jpg)
Для підвищення ефективності лікування одонтогенних запальних захворювань, що супроводжуються почуттям болю середньої та високої інтенсивності, використовують курс послідовного застосування НПЛЗ. У перші дві доби призначають кеторолаку трометамін 10 мг кожні 4–6 годин для досягнення вираженого знеболюючого ефекту, а з 3-ї доби — німесулід 100 мг всередину 2 рази на добу протягом 3–6 діб [20].
Для лікування швидко прогресуючого пародонтиту може призначатися щоденний прийом усередину омега-3 поліненасичених жирних кислот і 81 мг ацетилсаліцилової кислоти. Це призводить до значного зменшення глибини пародонтальної кишені і висоти зубо-ясенного прикріплення. Однак необхідно пам’ятати, що прийом ацетилсаліцилової кислоти відміняють за 1 тиждень до оперативного втручання, щоб уникнути кровотечі [26].
Напроксен і кетопрофен доцільно використовувати в комплексній терапії швидко прогресуючого пародонтиту, оскільки ці лікарські засоби здатні значною мірою гальмувати кісткову резорбцію, пригнічуючи синтез обох деструктивних типів простагландинів (E2 і F2α). Протизапальна активність кетопрофену вища за активність ібупрофену і фенілбутазону відповідно в 20 і 80 разів [27].
Важливо для мінімізації ризиків застосування НПЛЗ зважати на взаємодію лікарських засобів, зокрема їх використання у пацієнтів, які отримують антигіпертензивну терапію, варфарин та похідні сульфонілсечовини.
Доведено, що НПЛЗ порушують утворення судинорозширюючих простагландинів і зменшують ефекти антигіпертензивних лікарських засобів у такій послідовності: інгібітори ангіотензинперетворюючого ферменту/блокатори рецепторів ангіотензину ІІ > діуретикі > бета-адреноблокатори > антагоністи кальцію або альфа-адреноблокатори. За даними французьких дослідників, які проаналізували 11 442 повідомлення про побічні реакції на лікарські засоби у пацієнтів, які отримували пероральні антигіпертензивні засоби в період між 2008 і 2010 роками, 517 (4,5 %) з них (переважно жінки) отримували НПЛЗ. У 24,2 % (125 пацієнтів) взаємодія антигіпертензивних та НПЛЗ була причиною побічної реакції на лікарські засоби. Частіше повідомлялося про гостру ниркову недостатність (20,7 %), що була викликана взаємодією між НПЛЗ та інгібіторами ангіотензинперетворюючого ферменту, блокаторами рецепторів ангіотензину ІІ або діуретиками [28]. Результати останніх досліджень підтверджують цю закономірність: виявлено підвищення в амбулаторних умовах артеріального тиску у пацієнтів, які на фоні антигіпертензивної терапії почали вживати НПЛЗ [29]. НПЛЗ навіть при однократному прийомі викликали гіпертонічний криз у пацієнтів із артеріальною гіпертензією [30].
НПЛЗ можуть підвищувати концентрацію вільної фракції в крові варфарину та похідних сульфонілсечовини, збільшуючи ризик виникнення відповідно кровотечі [31] або гіпоглікемії [32].
Оскільки НПЛЗ не справляють пригнічуючого впливу на пародонтопатогенну мікрофлору, їх слід застосовувати в комплексі з ефективними антимікробними засобами [20]. Доведено, що при лікуванні агресивного пародонтиту корисні системні антибіотики (метронідазол, амоксицилін), які збільшують ефективність місцевої терапії [33].
Системні антибактеріальні препарати впливають на пародонтопатогенні мікроорганізми, стафілококи і стрептококи та інші патогенні мікроорганізми, вірогідно знижують мікробну забрудненість пародонтальних кишень, що сприяє зниженню інтенсивності запальних явищ у тканинах пародонта [10].
Один із перспективних напрямів лікування пародонтиту — пригнічення матриксних металопротеїназ при застосуванні субантимікробних доз доксицикліну [24]. У пацієнтів, яким застосували доксициклін у β-циклодекстрині, була меншою глибина періодонтального зондування та більше зростання рівня клінічного прикріплення [34].
З іншого боку, використання антибіотика у монотерапії часто недостатньо ефективне, тому додатково застосовують НПЛЗ, інгібітори матриксних металопротеїназ і агенти із кістковоінтегруючою дією. Поєднання даних засобів у комбінації дозволяє знизити їх дозу та частоту побічних ефектів і покращує прихильність до лікування і його ефективність (4D-підхід) [35].
Серед сучасних нових напрямів протизапальної системної терапії пародонтиту — використання статинів, бісфосфонатів, пробіотиків, антицитокінових засобів тощо.
Так, доведено, що аторвастатин у дозі 80 мг/добу виявляє протизапальні ефекти, зменшуючи пародонтальне запалення, і цей вплив корелює із інтенсивністю змін каротидного запалення [36]. Пробіотики, антихемокіни, ліпідні медіатори, біоактивні жирні кислоти модулюють імунну відповідь і викликають антиоксидантну дію [37]. Бісфосфонати пригнічують активність остеокластів, зв’язуються з кристалами гідроксіапатиту і запобігають їх розчиненню, збільшують щільність кістки. При місцевому застосуванні бісфосфонати суттєво знижують післяопераційну втрату кісткової тканини, а також стимулюють остеогенез при внутрішньокісткових дефектах. Але застосування бісфофонатів обмежується тим, що описано випадки пов’язаного із вживанням бісфосфонатів остеонекрозу щелеп [38]. Антицитокінова терапія активно застосовується при лікуванні ревматоїдного артриту, патогенез якого має багато спільного із патогенезом пародонтиту [24], і тому вважається одним із перспективних напрямів протизапальної терапії при пародонтиті.
Отже, неконтрольована запальна відповідь організму в умовах мікробної біоплівки, яка щільно прилягає до поверхні зуба, призводить до руйнування тканин пародонта, втрати кісткової тканини. Якщо гостре запалення своєчасно стихає, запобігаючи деструкції, але не відбувається повного відновлення гомеостазу тканин, це призводить до пошкоджень, викликаних нейтрофілами, і хронічного запалення.
Тому системна протизапальна терапія із використанням нестероїдних протизапальних лікарських засобів є важливим напрямом терапії пародонтиту, що забезпечує зниження інтенсивності запалення, мінімізує руйнування тканин пародонта, обмежує ресурс поживних речовин для патогенних мікроорганізмів, запобігає резорбції альвеолярної кістки.
Для профілактики гастропатії доцільно в комплексі терапії використовувати синтетичний аналог простагландину E2 мізопростол. Менеджмент взаємодії лікарських засобів доцільно застосовувати у випадку призначення НПЛЗ пацієнту, який приймає похідні сульфонілсечовини, варфарин, антигіпертензивні лікарські засоби тощо.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 09.12.2020
Рецензовано/Revised 21.12.2020
Прийнято до друку/Accepted 29.12.2020
Список литературы
1. Gugliandolo E., Fusco R., D’Amico R., Militi A., Oteri G., Wallace J.L., Di Paola R., Cuzzocrea S. Anti-inflammatory effect of ATB-352, a H2S-releasing ketoprofen derivative, on lipopolysaccharide-induced periodontitis in rats. Pharmacol. Res. 2018. Vol. 132. P. 220-231.
2. Чижевский И.В., Моисейцева Л.А., Ермакова И.Д., Забышный А.А. Воспалительные заболевания пародонта у детей. Часть І. Клиника, дифференциальная диагностика воспалительных заболеваний пародонта. Здоров’я дитини. 2008. 12(3). http://www.mif-ua.com/archive/article/5866.
3. Гончарик П.В., Кравченко А.В., Панасюк Г.Д. Заболевания пародонта. Гомель: ГУ «РНПЦ РМиЭЧ», 2018. 37 c.
4. Карданова Л.В., Тхазаплижева М.Т., Балкаров А.О. Некоторые аспекты местного лечения хронических воспалительных заболеваний пародонта. Современные проблемы науки и образования. 2014. № 6. https://www.science-education.ru/ru/article/view?id=15777.
5. Романенко И.Г., Крючков Д.Ю. Генерализованный пародонтит и метаболический синдром. Единство патогенетических механизмов развития. Кримський терапевтичний журнал. 2011. Т. 1. С. 60-67.
6. Fifer K., Subramanian S., Fontanez S., Figueroa A., Brady T.J., Tawakol A. High periodontal disease activity is associated with subsequent carotid artery stenosis progression. J. Am. Coll. Cardiol. 2011. Vol. 57. E1571.
7. Супрун Э.В., Пиминов А.Ф., Ролик С.Н. Заболевания пародонта: современные подходы к рационализации местной терапии в рамках комплексного лечения воспалительных заболеваний полости рта. Аптека. 2013. № 44(915). https://www.apteka.ua/article/259575.
8. Rastogi P., Singhal R., Sethi A., Agarwal A., Singh V.K., Sethi R. Assessment of the effect of periodontal treatment in patients with coronary artery disease: A pilot survey. J. Cardiovasc. Dis. Research. 2012. Vol. 3. P. 124-127.
9. Малютіна А.Ю., Тріфонов Б.В., Жилякова Е.Т. та ін. Новий погляд на проблему профілактики і лікування захворювань пародонта. Науковий результат. Медицина і фармація. 2016. Т. 2. № 3. С. 64-69.
10. Мазур І.П., Хайтович М.В., Голопихо Л.І. Клінічна фармакологія та фармакотерапія в стоматології: навчальний посібник. 2-ге вид. К.: Медицина, 2019. 376 с.
11. Botero J.E., Rösing C.K., Duque A., Jaramillo A., Contreras A. Periodontal disease in children and adolescents of Latin Ame-rica. Periodontol. 2000. 2015. Vol. 67. № 1. P. 34-57.
12. Holm-Pederson P., Muller F., Lang N. Pathology and Treatment of Gingivitis in the Aging Individual. Textbook of Geriatric Dentistry. Textbook of Geriatric Dentistry. 3. John Wiley & Sons; Jun 19, 2015. Р. 211-223.
13. Aimetti M., Perotto S., Castiglione A., Mariani G.M., Ferrarotti F., Romano F. Prevalence of periodontitis in an adult population from an urban area in North Italy: findings from a cross-sectional population-based epidemiological survey. J. Clin. Periodontol. 2015. Vol. 42. № 7. P. 622-631.
14. Holde G.E., Oscarson N., Trovik T.A., Tillberg A., Jönsson B. Periodontitis Prevalence and Severity in Adults: A Cross-Sectional Study in Norwegian Circumpolar Communities. J. Periodontol. 2017. Vol. 88. № 10. P. 1012-1022.
15. Slots J. Periodontitis: facts, fallacies and the future. Periodontol. 2000. 2017. Vol. 75. № 1. P. 7-23.
16. Денисова Е.Г. Заболевания пародонта у детей. Учебное пособие для врачей-интернов стоматологического профиля. Харьков, 2008. C. 113.
17. Cavagni J., Muniz F.M.G., Rösing C.K. The effect of inflammatory response modulator agents on gingivitis and periodontitis. RGO-Revista Gaúcha de Odontologia. 2016. Vol. 64. № 3. P. 312-319.
18. Ng Y.-L., Mann V., Gulabivala K. A prospective study of the factors affecting outcomes of non-surgical root canal treatment: part 2: tooth survival. Int. Endod. J. 2011. Vol. 44. № 7. P. 610-25.
19. Knop L.A.H., Shintcovsk R.L., Retamoso L.B., Ribeiro J.S., Tanaka O.M. Non-steroidal and steroidal anti-inflammatory use in the context of orthodontic movement. Eur. J. Orthod. 2012. Vol. 34. № 5. P. 531-535.
20. Ушаков Р.В., Герасимова Т.П., Ушакова Т.В., Коркин В.В. Противовоспалительная терапия в пародонтологии. М.: ГБОУ ДПО РМАПО, 2016. 88 c.
21. Etikala A., Tattan M., Askar H., Wang H.-L. Effects of NSAIDs on Periodontal and Dental Implant Therapy. Compend. Contin. Educ. Dent. 2019. Vol. 40. № 2. e1-e9.
22. Wang Z., Bhattacharyya T. Trends of non-union and prescriptions for non-steroidal anti-inflammatory drugs in the United States, 1993–2012. Acta Orthopaedica. 2015. Vol. 86. № 5. P. 632-637.
23. Stephen J.M. Gingivitis. 2018. https://emedicine.medscape.com/article/763801-overview
24. Preshaw P.M. Host modulation therapy with anti-inflammatory agents. Periodontol. 2000. 2018. Vol. 76. № 1. P. 131-149.
25. Самигуллина Л.И. Фармакоэпидемиологический анализ амбулаторных назначений НПВС в хирургической стоматологии. Фундаментальные исследования. 2012. № 4 (часть 1). С. 112-115.
26. El-Sharkawy H., Aboelsaad N., Eliwa M. et al. Adjunctive treatment of chronic periodontitis with daily dietary supplementation with omega-3 Fatty acids and low-dose aspirin. Periodontol. 2010. Vol. 81. № 11. P. 1635-1643.
27. Маланьин И.В., Бондаренко И.С., Павлович О.А., Голуб Ю.Н. Опыт применения нового препарата «Кетопрофен» при лечении воспалительных заболеваний периодонта. Фундаментальные исследования. 2006. № 9. С. 104-105.
28. Fournier J.P., Sommet A., Durrieu G. et al. Drug interactions between antihypertensive drugs and non-steroidal anti-inflammatory agents: a descriptive study using the French Pharmacovigilance database. French Network of Regional Pharmacovigilance Centres. Fundam. Clin. Pharmacol. 2014. Vol. 28. № 2. P. 230-235.
29. Floor-Schreudering A., De Smet P.A., Buurma H. et al. NSAID-antihypertensive drug interactions: which outpatients are at risk for a rise in systolic blood pressure. Eur. J. Prev. Cardiol. 2015. Vol. 22. № 1. P. 91-99.
30. Wallbach M., Lach N., Stock J. et al. Direct assessment of adherence and drug interactions in patients with hypertensive crisis. A cross-sectional study in the Emergency Department. J. Clin. Hypertens. (Greenwich). 2019. Vol. 21. № 1. P. 55-63.
31. Crader M.F., Johns T., Arnold J.K. Warfarin Drug Interactions. StatPearls [Internet]. 2020. https://www.ncbi.nlm.nih.gov/books/NBK441964/
32. May M., Schindler C. Clinically and pharmacologically relevant interactions of antidiabetic drugs. Ther. Adv. Endocrinol. Metab. 2016. Vol. 7. № 2. P. 69-83.
33. Rabelo C.C., Feres M., Gonçalves C., Figueiredo L.C., Faveri M., Tu Y.-K., Chambrone L. Systemic antibiotics in the treatment of aggressive periodontitis. A systematic review and a Bayesian Network meta-analysis. J. Clin. Periodontol. 2015. Vol. 42. № 7. P. 647-57.
34. Trajano da C.V.C., Brasileiro C.B., Henriques J. et al. Doxycycline encapsulated in β-cyclodextrin for periodontitis: a clinical trial. Braz. Oral Res. 2020. Vol. 33. e112.
35. Jain P., Mirza M.A., Iqbal Z.A. 4-D approach for amelioration of periodontitis. Med. Hypotheses. 2019. Vol. 133. 109392.
36. Subramanian S., Emami H., Vucic E. et al. High Dose Atorvastatin Reduces Periodontal Inflammation: A Novel Pleiotropic Effect of Statins. J. Am. Coll. Cardiol. 2013. Vol. 62. № 25. P. 2382-2391.
37. Sulijaya B., Takahashi N., Yamazaki K. Host modulation therapy using anti-inflammatory and antioxidant agents in periodontitis: A review to a clinical translation. Arch. Oral Biol. 2019. Vol. 105. P. 72-80.
38. Aghaloo T.L., Kang B., Sung E.C. et al. Periodontal dise-ase and bisphosphonates induce osteonecrosis of the jaws in the rat. J. Bone Miner. Res. 2011. Vol. 26. № 8. P. 1871-82.

/22.jpg)