Архив офтальмологии Украины Том 9, №1, 2021
Вернуться к номеру
Поширеність і характеристика первинної відкритокутової глаукоми у пацієнтів з діабетичною ретинопатією при цукровому діабеті 2-го типу
Авторы: Могілевський С.Ю.(1), Гудзенко К.А.(2)
(1) — Національний університет охорони здоров’я України імені П.Л. Шупика*, м. Київ, Україна
(2) — Національний медичний університет імені О.О.Богомольця, м. Київ, Україна
Рубрики: Офтальмология
Разделы: Клинические исследования
Версия для печати
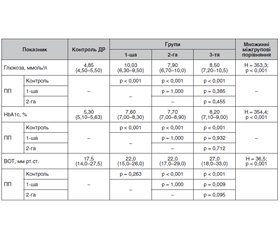
Актуальність. Чисельні літературні дані дозволяють встановити залежність виникнення первинної відкритокутової глаукоми (ПВКГ) у пацієнтів з діабетичною ретинопатією (ДР) при цукровому діабеті 2-го типу (ЦД2). Мета: визначити поширеність і характеристику первинної відкритокутової глаукоми у пацієнтів з діабетичною ретинопатією при цукровому діабеті 2-го типу. Матеріали та методи. Було обстежено 1450 пацієнтів з ЦД2, у яких за класифікацією Американської академії офтальмології (2002) встановлювали стадію ДР. Стадію ПВКГ встановлювали за класифікацією А.П. Нестерова й А.Я. Буніна (1976 р.) і класифікацією периметричних змін за стадіями глаукоми. Пацієнти були віком від 45 до 75 років, серед них 970 (66,9 %) чоловіків і 480 (33,1 %) жінок. Тривалість ЦД2 становила від 2 до 15 років. Для статистичних досліджень використано програми MedStat і MedCalc v.15.1 (MedCalc Software bvba). Результати. У пацієнтів з ЦД2 та ДР різних стадій поширеність ПВКГ становила 20,8 %, що у 4–6 разів вище, ніж у загальній популяції. Серед пацієнтів з І стадією ДР (no retinopathy) 71,6 % мали І та ІІ стадії ПВКГ, серед пацієнтів із непроліферативною ДР 87,6 % — ІІ і ІІІ стадії, а серед пацієнтів з проліферативною ДР 78,4 % — ІІІ і IV стадії. Серед усіх пацієнтів з ДР та ПВКГ частка нормотензивної глаукоми становила 18,6 %, що не відрізнялося від такого показника при ПВКГ без ЦД2. У 42,9 % в анамнезі спочатку відзначали розвиток ЦД2, до якого через 1–7 років долучалася ПВКГ, а 57,1 % мали спочатку ПВКГ, до якої через 1–8 років долучався ЦД2. Залежно від тривалості захворювання достеменно зростала тяжкість як ДР, так і ПВКГ, що вказувало на залежність тяжкості ДР і ПВКГ від тривалості захворювання та пришвидшення їх розвитку за умов взаємного сполучення. Висновки. Результати дослідження підтвердили більш високу поширеність та взаємне обтяження перебігу ДР при ЦД2 та ПВКГ, що обґрунтовує необхідність вивчення спільних механізмів їх патогенезу.
Background. Numerous literature data made it possible to establish the dependence of primary open-angle glaucoma (POAG) in patients with diabetic retinopathy (DR) on type 2 diabetes mellitus (DM2). The purpose was to determine the prevalence and characteristics of primary open-angle glaucoma in patients with diabetic retinopathy in type 2 diabetes mellitus. Material and methods. One thousand four hundred and fifty patients with DM2 were examined, in whom the stage of DR was determined according to the classification of American Academy of Ophthalmology (2002). POAG stage was established according to the classification of A.P. Nesterov and A.Ya. Bunin (1976) and classification of perimetric changes by glaucoma stages. The age of patients, 970 (66.9 %) men and 480 (33.1 %) women, was from 45 to 75 years. The duration of DM2 was from 2 to 15 years. For statistical studies, MedStat and MedCalc v.15.1 (Medcalc Software bvba) were used. Results. In patients with DM2 and DR of different stages, the prevalence of POAG amounted to 20.8 %, which is 4–6 times higher than in the general population. Among individuals with DR stage I (no retinopathy), 71.6 % had POAG stage I and II, among patients with non-proliferative DR, 87.6 % had stages II and III, and among those with proliferative DR, 78.4 % had stages III and IV. Among all patients with DR and POAG, the proportion of normal tension glaucoma was 18.6 %, which did not differ from that in POAG without DM2. 42.9 % of patients initially had the development of DM2 in past medical history, joined by POAG in 1–7 years, and 57.1 % first had POAG, joined by DM2 in 1–8 years. Depending on the duration of the disease, the severity of both DR and POAG increased, which indicated the dependence of DR and POAG severity on disease duration and acceleration of their development if they combined. Conclusions. The results of the study confirmed the wider prevalence and mutual burden of DR course in DM2 and POAG, which justifies the need to study the general mechanisms of their pathogenesis.
діабетична ретинопатія; первинна відкритокутова глаукома; цукровий діабет 2-го типу; поширеність
diabetic retinopathy; primary open-angle glaucoma; type 2 diabetes mellitus; prevalence
Вступ
Матеріал та методи
Результати та обговорення
Висновки
- International Diabetes Federation. IDF Diabetes Atlas, 8th Edition [Internet]. Brussels, Belgium: International Diabetes Federation, 2017 [cited 2019 March 21]. Available from: www.diabetesatlas.org/resources/2017-atlas.html.
- DeFronzo R.A., Ferrannini E., Zimmet P., Alberti G. International Textbook of Diabetes Mellitus, 2 Volume Set. 4th Edition. New York: Wiley-Blackwell, 2015. 1203 р.
- Thomas R.L., Halim S., Gurudas S., Sivaprasad S., Owens D.R. IDF Diabetes Atlas: A review of studies utilising retinal photography on the global prevalence of diabetes related retinopathy between 2015 and 2018. Diabetes Res. Clin. Pract. 2019 Nov. 157. 107840. doi: 10.1016/j.diabres.2019.107840.
- Cheloni R., Gandolfi S.A., Signorelli C., Odone A. Global prevalence of diabetic retinopathy: protocol for a systematic review and meta-analysis. BMJ Open. 2019 Mar 3. 9(3). e022188. doi: 10.1136/bmjopen-2018-022188.
- Holman N., Young B., Gadsby R. Current prevalence of Type 1 and Type 2 diabetes in adults and children in the UK. Diabet. Med. J. Br. Diabet. Assoc. 2015. 32. 1119-20. DOI: http://dx.doi.org/10.1111/ dme.12791.
- Eshaq R.S., Aldalati A.M.Z., Alexander J.S., Harris N.R. Diabetic retinopathy: Breaking the barrier. Pathophysiology. 2017 Dec. 24(4). 229-241. doi: 10.1016/j.pathophys.2017.07.001.
- Tham Y.C., Li X., Wong T.Y., Quigley H.A., Aung T., Cheng C.Y. Global prevalence of glaucoma and projections of glaucoma burden through 2040: a systematic review and meta-analysis. Ophthalmology. 2014 Nov. 121(11). 2081-90. doi: 10.1016/j.ophtha.2014.05.013. Epub 2014 Jun 26. PMID: 24974815.
- Grzybowski A., Och M., Kanclerz P., Leffler C., Moraes C.G. Primary Open Angle Glaucoma and Vascular Risk Factors: A Review of Population Based Studies from 1990 to 2019. J. Clin. Med. 2020 Mar 11. 9(3). 761. doi: 10.3390/jcm9030761.
- Dharmadhikari S., Lohiya K., Chelkar V., Kalyani V.K.S., Dole K., Deshpande M., Khandekar R., Kulkarni S. Magnitude and determinants of glaucoma in type II diabetics: A hospital based cross-sectional study in Maharashtra, India. Oman. J. Ophthalmol. 2015 Jan-Apr. 8(1). 19-23. doi: 10.4103/0974-620X.149858.
- Zhao Y.X., Chen X.W. Diabetes and risk of glaucoma: systematic review and a Meta-analysis of prospective cohort studies. Int. J. Ophthalmol. 2017. 10(9). 1430-5. doi: 10.18240/ijo.2017.09.16.
- Thakuria J., Deka D.C., Sarma S. Prevalence of glaucoma amongst diabetic patients attending a tertiary health care in North Eastern India. IJHRMLP. 2017 Jan. 3(1). 96-101. doi: 01.2017-17271752.
- Early Treatment Diabetic Retinopathy Study Research Group. Grading diabetic retinopathy from stereoscopic color fundus photographs — an extension of the modified airlie house classification: ETDRS report № 10. Ophthalmology. 2020 Apr. 127(4S). 99-119. doi: 10.1016/j.ophtha.2020.01.030.
- Balashevich L.I., Izmailov A.S. Diabetic ophthalmopathy. SPb.: Man, 2012. 396 [in Russian].
- Nesterov A.P. Glaucoma. Moscow: LTD “Medical Information Agency”, 2014. 360 [in Russian].
- Rykov S.O., Medvedovskaya N.V., Troyanov D.P. Current state and dynamics of glaucoma prevalence among the adult population of Ukraine. Ukraine. The health of the nation. 2012. 2(22). 119-21 [in Russian].
- Unified clinical protocol of medical care. Primary open-angle glaucoma. Primary and secondary medical care. Order of the Ministry of Health of Ukraine dated “23” November 2011 № 816. Available on: https://www.dec.gov.ua/wp-content/uploads/2019/11/816dod2_1.pdf [in Ukranian].
- Terminology and Guidelines for Glaucoma. 4th Edition. European Glaucoma Society. Available on: www.eugs.org.
- Voigt M., Schmidt S., Lehmann T., Köhler B., Kloos C., Voigt U.A., Meller D., Wolf G., Müller U.A., Müller N. Prevalence and Progression Rate of Diabetic Retinopathy in Type 2 Diabetes Patients in Correlation with the Duration of Diabetes. Exp. Clin. Endocrinol. Diabetes. 2018 Sep. 126(9). 570-576. doi: 10.1055/s-0043-120570.
- Bhutia L., Dhakal S., Bhutia S.C. To find the prevalence of glaucoma in patients with diabetes mellitus attending tertiary care hospital, east Sikkim. Indian Journal of Clinical and Experimental Ophthalmology. 2018. 4(4). 447-9. doi: 10.18231/2395-1451.2018.0100.
- Horwitz A., Petrovski B.É., Torp-Pedersen C., Kolko M. Danish Nationwide Data Reveal a Link between Diabetes Mellitus, Diabetic Retinopathy, and Glaucoma. J. Diabetes Res. 2016. 2016. 2684674. doi: 10.1155/2016/2684674.

/16.jpg)
/17.jpg)
/18.jpg)