Журнал «Практическая онкология» Том 4, №1, 2021
Вернуться к номеру
Нейроендокринні пухлини: огляд клінічних випадків
Авторы: Тетяна Чистик
Рубрики: Онкология
Разделы: Справочник специалиста
Версия для печати
Нейроендокринні пухлини (НЕП) — гетерогенна група новоутворень, що походять із клітин нервового гребеня ембріональної кишки, мають біологічно активні властивості синтезувати вазоактивні пептиди й зустрічаються практично в усіх органах.
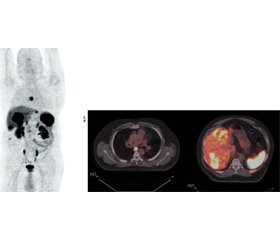
Найбільш часта їх локалізація (60 %) — шлунково-кишковий тракт, переважне місце розташування — тонка кишка (35–50 %), пряма кишка (5–23 %) і товста кишка (19 %); рідше виявляються НЕП шлунка (8 %), підшлункової залози (8 %) і апендикса (8 %). Близько 30 % НЕП зустрічаються в бронхах і легенях (рис. 1).
/58.jpg)
За останні 30 років захворюваність на НЕП зросла на 500 %. У 50 % випадків НЕП діагностується на поширеній стадії. Для цих пухлин не розроблені програми ранньої діагностики й скринінгу.
22 грудня 2020 року за підтримки фармацевтичної компанії IPSEN Pharma відбувся круглий стіл «Нейроендокринні пухлини», у рамках якого були висвітлені 4 клінічних випадки НЕП різних локалізацій, розвиток і перебіг захворювання, методи діагностики й лікування.
Перше спостереження було наведене доктором медичних наук, професором, завідувачем кафедри онкології Запорізької медичної академії післядипломної освіти Олексієм Олексійовичем Ковальовим.
Пацієнт, чоловік 60 років, без супутньої патології у вересні 2013 року звернувся зі скаргами на диспное протягом останніх 5 місяців. Методом комп’ютерної томографії (КТ) виявлена пухлина лівої легені розміром 2,5 см, при бронхоскопії з біопсією встановлено, що вона є атиповою нейроендокринною пухлиною.
Яка подальша тактика обстеження й лікування? Чи достатньо буде таких обстежень, як бронхоскопія і комп’ютерна томографія, для прийняття клінічного рішення?
Згідно з рекомендаціями NCCN (версія 2, 2020 рік), при НЕП з локалізацією в ділянці бронхів або легенів необхідними діагностичними опціями є виконання КТ органів малого таза (ОМТ), КТ органів черевної порожнини (ОЧП), магнітно-резонансної томографії (МРТ) головного мозку й позитронно-емісійної томографії з КТ (ПЕТ-КТ). На жаль, не завжди можливе застосування всіх перерахованих методів, однак на сьогодні приймати клінічне рішення без даних ПЕТ-КТ буде неправильно.
Було проведено ПЕТ-КТ-сканування, на якому виявлена пухлина легені без ураження медіастинальних лімфатичних вузлів. На МРТ головного мозку ознак метастазів у центральну нервову систему немає. Пухлина стадії Т2N0M0 визнана резектабельною, у зв’язку з чим у вересні 2013 року була проведена лівобічна нижня лобектомія. Висновок морфологічного дослідження — погано диференційована нейроендокринна карцинома з ділянками некрозу, мітотичний індекс 5/10, рТ2b N0M0, Ki-67 > 20 %.
Чи потрібна в даному випадку ад’ювантна терапія?
Традиційно при I і II стадії пухлини можна обійтися без ад’ювантної терапії, хоча в низці статей все ж наголошується на необхідності її проведення. У рекомендаціях NCCN (2020) роль системної терапії в ад’ювантному режимі не визначена. При резектабельних пухлинах можливе проведення таких терапевтичних опцій:
— резекція + ад’ювантна хіміотерапія + променева терапія;
— неоад’ювантна хіміотерапія + променева терапія з наступною резекцією;
— тільки хіміотерапія;
— тільки променева терапія;
— хіміотерапія і променева терапія.
Хіміотерапевтичне лікування може включати комбінацію цисплатин + етопозид або карбоплатин + етопозид.
Власний досвід говорить про те, що рецидивування НЕП, як правило, не залежить від проведення/відсутності ад’ювантної терапії. Ад’ювантна терапія в нашому спостереженні не призначалась. Прогресування НЕП відбулося через 12 місяців — у вересні 2014 року, коли з’явилися нові клінічні симптоми — припливи й діарея, що свідчать про розвиток карциноїдного синдрому. На КТ виявлені білобарні метастази в печінці й множинні ураження лімфатичних вузлів. Проведена біопсія печінки, що підтвердила наявність метастазів нейроендокринної атипової пухлини легені в печінку з високим рівнем проліферації Ki-67 — 30 %. Біохімічні дослідження показали підвищення рівня метаболітів серотоніну 5-HIAA (5-hydroxyindoleacetic acid, 5-гідроксиіндолоцтова кислота) — 1438 ммоль/24 год (референтні значення 10,4–46,8 момоль/24 год) і хромограніну — 165 мкг/л (референтні значення 0–100 мкг/л).
Згідно з рекомендаціями NCCN (2020 р.), за наявності пульмонарних НЕП як терапію 1-ї лінії слід розглянути:
— спостереження за пацієнтами зі стабільним захворюванням і легким пухлинним навантаженням;
— регіональну терапію для хворих з переважаючими метастазами в печінці;
— циторедуктивну операцію;
— системну терапію.
Уточнюється, що системна терапія може не підходити для всіх пацієнтів з місцево-регіонарним поширеним або метастатичним захворюванням.
На нашу думку, для пацієнта з наведеного клінічного спостереження найбільш оптимальним вибором було призначення системної терапії із застосуванням інгібітору рецепторів соматостатину ланреотиду (Соматулін® Аутожель® 120 мг/1 раз/28 днів) протягом 1 року — з вересня 2014-го по травень 2015-го.
Обговорювалися також інші терапевтичні опції, такі як застосування еверолімусу; радіоактивного лютецію; комбінації цисплатин + етопозид або карбоплатин + етопозид; темозоломід з капецитабіном + етопозид.
Ефективність лікування НЕП інгібіторами рецепторів соматостатину була доведена в низці великих досліджень. У міжнародному рандомізованому подвійному сліпому плацебо-контрольованому дослідженні III фази CLARINET вивчалася ефективність застосування препарату Соматулін® Аутожель® порівняно з плацебо щодо виживаності без прогресування у 204 пацієнтів з нефункціонуючими ентеропанкретичними пухлинами. Під час дослідження CLARINET були отримані нові докази антипроліферативного ефекту Соматуліну® Аутожель® при багатьох видах НЕП з різною локалізацією, у тому числі при значному метастатичному поширенні. Було переконливо доведено, що ефекти аналогів соматостатину не обмежуються тільки регресом клінічної симптоматики й зниженням рівня біохімічних маркерів пухлини, а включають безпосередній вплив на пухлину.
Соматулін® Аутожель® забезпечує ефективний контроль над симптомами НЕП (припливи, діарея), стабілізує прогресування пухлини, покращує якість життя пацієнтів (може застосовуватися ними самостійно), ефективний у пацієнтів з непереносимістю октреотиду. Більшість побічних ефектів, як правило, передбачувані й повністю купіруються.
Наш пацієнт протягом 8 місяців отримував Соматулін® Аутожель®. У травні 2015 року було виявлено прогресування пухлини за RECIST, що вимагало прийняття рішення про призначення 2-ї лінії терапії. У рекомендаціях NCCN (2020 р.) як терапія 2-ї лінії розглядається застосування еверолімусу, однак підкреслюється, що безпека й ефективність такого лікування при карциноїдному синдромі не встановлена. Також пропонуються інші варіанти — 5-флюороурацил, капецитабін, дакарбазин, оксаліплатин, стрептозоцин, темозоломід.
Ми зробили вибір на користь комбінації темозоломід + капецитабін, 4 цикли, які пацієнт отримував із травня по серпень 2015 року. Поряд з хіміотерапією була продовжена терапія препаратом Соматулін® Аутожель® 120 мг/1 раз/28 днів. Правильність такого вибору лікування підтверджується рекомендаціями NCCN (2020 р.), у яких наголошується, що при прогресуванні захворювання в пацієнтів з функціональними пухлинами слід продовжувати терапію ланреотидом або використовувати його в поєднанні з будь-яким варіантом системної терапії.
У вересні 2015 року у зв’язку з погіршенням стану пацієнта виникла необхідність у застосуванні 3-ї лінії терапії. Був призначений інтерферон альфа 1 раз на 3 тижні й продовжене лікування препаратом Соматулін® Аутожель® 120 мг/1 раз/28 днів. Цю терапію пацієнт отримував до січня 2016 року.
Із січня 2016 року лікування Соматуліном® Аутожель® було припинено, призначена 4-та лінія терапії. З лютого по червень 2016 року пацієнт отримував комбінацію цисплатин + етопозид, 6 циклів. З червня по жовтень 2016 року (5-та лінія терапії) — комбінацію стрептозотоцин + капецитабін.
У жовтні 2016 року у зв’язку з прогресуванням пухлинного процесу стан пацієнта різко погіршився. Була проведена Ga68 DOTATATE PET-КТ, що показала позитивні рецептори соматостатину, білобарні метастази в печінку, множинні лімфовузли з обох боків діафрагми.
Тоді ж була виявлена карциноїдна хвороба серця — очікуване ускладнення, що проявляється фіброеластозом або потовщенням ендокарда, переважно правого шлуночка й клапанів, унаслідок надлишкового продукування серотоніну. У нашому випадку таке ускладнення не прогнозувалося (що було помилкою), воно спричинило розвиток серцевої недостатності.
NCCN (2020) рекомендує чіткий алгоритм спостереження за хворими з карциноїдним синдромом, що передбачає:
— біохімічний моніторинг і контроль рівня серотоніну в сечі;
— обов’язкове проведення ехокардіоскопії під час прогресування пухлини;
— при доброму контролі карциноїдного синдрому — проведення ехокардіографії, абдомінальної або тазової КТ;
— при поганому контролі карциноїдного синдрому — застосування додаткових методів контролю й лікування, спрямованих на пухлинну циторедукцію, з використанням циторедуктивної хірургії, емболізації і різних видів системної терапії.
У жовтні 2016 року в пацієнта з’явилися неконтрольовані симптоми — гемодинамічна нестабільність, тахікардія, аритмія, діарея, метаболічний ацидоз, розлад психічного статусу, припливи, різке підвищення рівня сироваткового 5-HIAA і CgA, що було викликано розвитком карциноїдного кризу. Карциноїдний криз — тяжке ускладнення з одночасним проявом усіх симптомів карциноїдного синдрому, пов’язане з масивним викидом біологічно активних речовин унаслідок маніпуляцій з пухлиною під час операції, біопсії пухлини, введенням анестезуючих засобів або хіміотерапії. Карциноїдний криз ускладнює перебіг карциноїдної хвороби серця й нерідко закінчується смертю хворого.
Факторами ризику карциноїдного кризу є наявність карциноїдного синдрому, підвищений рівень 5-гідроксиіндолоцтової кислоти і/або хромограніну А, високе пухлинне навантаження, карциноїдне захворювання серця, похилий вік пацієнтів, використання препаратів, що викликають вивільнення гістаміну (симпатоміметики, бронходилататори).
Лікування карциноїдного кризу здійснюється у відділенні інтенсивної терапії. При появі неконтрольованих симптомів застосовуються аналоги соматостатину короткої дії як «терапія порятунку» у вигляді безперервної 24-годинної інфузії. Призначається симптоматична терапія, спрямована на стабілізацію гемодинаміки. Для зменшення епізодів, викликаних неспецифічним вивільненням гістаміну, використовуються стероїди, хоча їх застосування не запобігає розвитку анафілактичного шоку. При тяжкій діареї призначається дієта, лоперамід з максимальною дозою 16 мг/добу, кодеїн 10 мг з максимальною дозою 30 мг/6 год. Крім того, використовується ципрогептадин, блокатор серотонінових рецепторів, у дозах 4 мг/8 год, телотристат етил, що знижує вироблення серотоніну за рахунок пригнічення ферменту триптофангідроксилази.
З метою профілактики карциноїдного кризу при функціональних НЕП і за наявності карциноїдного синдрому вже починаючи з 1-ї лінії терапії рекомендується проводити безперервне лікування інгібіторами рецепторів соматостатину пролонгованої дії (ланреотид 120 мг кожні 28 днів). Зменшення пухлинного навантаження повинне здійснюватися будь-яким способом (циторедукція). Також необхідні регулярне оцінювання стану харчування і корекція недоїдання (нікотинамід, вітамін В12, ферменти підшлункової залози, жиророзчинні вітаміни); корекція зневоднення, електролітних порушень і гіпопротеїнемії; відмова від алкоголю, гострої їжі і продуктів, багатих триптофаном; обмеження фізичних навантажень.
Після аналізу даного спостереження ми зробили такі висновки:
— 1-ша лінія терапії функціонуючих метастатичних нейроендокринних пухлин повинна включати застосування інгібіторів рецепторів соматостатину пролонгованої дії (ланреотид 120 мг/28 днів);
— усі наступні лінії терапії, у тому числі радіотерапія лютецієм-177, повинні комбінуватися з інгібіторами рецепторів соматостатину пролонгованої дії;
— на тлі відмови від терапії інгібіторами соматостатину можуть прогресувати карциноїдні симптоми, найбільш тяжкими з яких є карциноїдна хвороба серця й карциноїдний криз;
— карциноїдний криз — життєзагрозливий стан, що вимагає проведення терапії в умовах відділення інтенсивної терапії.
Завершуючи свій виступ, професор О.О. Ковальов підкреслив, що крім проведення протипухлинного лікування у хворих з НЕП важливим завданням є обов’язковий контроль карциноїдних симптомів і профілактика карциноїдного кризу.
Анна Василівна Хмель, лікар-хіміотерапевт Київського обласного онкологічного диспансеру, запропонувала до уваги аудиторії два клінічних випадки НЕП із власної практики.
Пацієнтка, 1981 року народження, в березні 2016 року звернулася до гастроентеролога з приводу скарг на періодичну діарею, блювання, рясне потовиділення, втому, висипання на шкірі, більше на шкірі обличчя. Була направлена на фіброгастродуоденоскопію та ультразвукове дослідження (УЗД) органів черевної порожнини. За даними інструментальних досліджень встановлений діагноз: хронічний панкреатит у стадії загострення. Гастроезофагеальна рефлюксна хвороба. Призначено курс лікування, що на деякий час приніс полегшення. З 2016 року по 2018 рік пацієнтка не зверталася по медичну допомогу. При появі вищезгаданої симптоматики займалася самолікуванням. У вересні 2018 роки її стан різко погіршився: з’явилися задишка, виражена слабкість, відбулася значна втрата ваги, виник біль у грудному відділі хребта. Самостійно пройшла УЗД черевної порожнини, малого таза, у результаті було виявлено новоутворення тіла підшлункової залози, множинні утворення печінки. У зв’язку з цим пацієнтка була направлена на консультацію до онколога. 07.10.2018 була проведена КТ ОГК, ОЧП, ОМТ з контрастом. На КТ: ознаки неопластичного ураження тіла підшлункової залози (2,3 × 1,2 см). Вторинне ураження печінки, правої легені, лімфаденопатія заочеревинних метастатичних вузлів. Біопсія новоутворення не виконувалася! За даними КТ-діагостики був встановлений діагноз: рак тіла підшлункової залози Т2NxMх. Метастази в печінку, праву легеню. Стадія 4. Клінічна група 2.
З листопада 2018 року по лютий 2019 року проводилися 3 курси ПХТ за схемою: гемцитабін 1000 мг/м2 в/в у 1-й і 8-й дні 21-денного курсу + цисплатин 75 мг/м2 в/в у 1-й день. Дані курси хіміотерапії, зі слів хворої, вона переносила з вираженою інтоксикацією. 15.02.2019 на КТ ОГК, ОЧП, ОМТ з контрастом: КТ-ознаки неопластического ураження тіла підшлункової залози (2,3 × 1,4 см), незначне збільшення розмірів вторинних уражень печінки, метастази правої легені. Лімфаденопатія заочеревинних лімфатичних вузлів. Поява підозрілого вогнища в тілі S2.
У лютому 2019 року стан пацієнтки погіршився — посилилася задишка, з’явилися шкірний висип, слабкість, почастішала діарея. Було рекомендовано симптоматичне лікування за місцем проживання. 26.02.2020 вона одержала іншу думку фахівця, у зв’язку з чим проведена біопсія новоутворення підшлункової залози. 06.03.2020 при патогістологічному дослідженні отримано висновок: високодиференційована (G1) нейроендокринна пухлина підшлункової залози. Типовий карциноїд. Ki-67 — 1 %. Від діагностики ПЕТ-КТ з Ga-68 DOTATATE пацієнтка відмовилася. Без додаткового обстеження було прийнято рішення про термінове призначення препарату Соматулін® Аутожель® 120 мг на 21 день, перше введення якого здійснено 09.03.2020. Через 8 днів загальний стан пацієнтки покращився. При біохімічному дослідженні маркерів НЕП (23.03.2020) рівень хромограніну А становив 5427 нг/мг. 24.03.2020 проведена остеосцинтиграфія, що не виявила вторинного ураження кісткової системи. Встановлено діагноз: нейроендокринна карцинома (типовий карциноїд) тіла підшлункової залози з вторинним ураженням печінки, правої легені Т2сNхМ1, G1. Стадія 4, клінічна група 2.
Рівень хромограніну А (на 20.06.2020) — 1221 нг/мг.
Пацієнтка продовжує отримувати Соматулін® Аутожель® у дозі 120 мг на 21 день. Останнє введення препарату — в листопаді 2020 року. Контроль хромограніну А (від 21.09.2020) — 530 нг/мг. 16.11.2020 проведена КТ ОГК, ОЧП, ОМТ з контрастом, на якій виявлено КТ-ознаки неопластичного ураження тіла підшлункової залози (1,7 × 0,9 см), вторинне ураження печінки, правої легені. Відзначена незначна позитивна динаміка у вигляді зменшення новоутворення підшлункової залози й розмірів вторинного ураження легені. Розміри новоутворення правої легені стабільні. На даний момент шкірний висип не спостерігається, вага пацієнтки стабілізувалася, діарея виникає рідко.
У наступному випадку з практики пацієнтка, 1967 року народження, з 2014 року пред’являла скарги на кашель, але, зі слів її дочки, лікарі при зверненні й обстеженні пацієнтки не надавали цьому значення. У 2016 році на оглядовій рентгенограмі органів грудної клітки виявлено фіброзні зміни в легенях. У 2018 році на флюорографії зміни відсутні. Тоді ж на УЗД виявлено утворення в печінці, значення якому не надали. Також у 2018 році була проведена холецистектомія, після якої пацієнтка почала відзначати сильний кашель, почервоніння обличчя і шиї, набряклість обличчя, надмірне потовиділення й різке зниження ваги.
У 2019 році на оглядовій рентгенограмі органів грудної клітки виявлено фіброз і пневмонію. Призначено курс антибіотикотерапії. Однак, незважаючи на проведене лікування, на контрольній рентгенограмі ОГК зміни зберігалися, у зв’язку з чим пацієнтка була направлена до пульмонолога, а потім до онколога. На КТ від 13.03.2019 картина відповідає центральному cancer pulmonum dextrae, що ускладнений ателектазом верхньої частки легені з інвазією верхньочасткового бронха і верхньочасткової гілки правої легеневої артерії, пролабує в ділянку середостіння. Метастатичне ураження паренхіми печінки до 35 %, дрібновогнищеве утворення лівої надниркової залози (метастази), кістковий канцероматоз склеротичного характеру. Також була проведена МРТ, на якій виявлені ознаки множинного вторинного (метастатичного) ураження кісток склепіння черепа, церебральної васкулопатії, за візуальною шкалою Fazekas gr. I; DVA лівої півкулі мозочка. На КТ від 13.09.2019 виявлено ознаки об’ємного утворення верхньої частки правої легені з поширенням на корінь правої легені й середостіння, вторинної зміни лімфовузлів зазначеної локалізації, вторинних змін плеври, печінки, кісткової системи. Стабілізація процесу.
При імуногістохімічному дослідженні фрагмента пухлини бронха визначено, що гістологічна будова пухлини й імунофенотип пухлинних клітин відповідають типовому карциноїду (високодиференційованій нейроендокринній пухлині). Рівень хромограніну А (09.04.2019) — 3896 мкг/л, серотоніну — 563 нг/мл. Встановлений діагноз: типовий карциноїд (Ki-67 — 2 %).
Улітку 2019 року в Ізраїлі була проведена ПЕТ-КТ з галіумом. У конгломераті медіастинальних лімфовузлів відзначені лімфовузли з підвищеним накопиченням Ga Tate. Білатерально в плевральному потовщенні спостерігається патологічно збільшене накопичення Ga Tate. У правій і лівій частках печінки в метастатичних утвореннях відзначається підвищене накопичення Ga Tate різної інтенсивності. Суміжно з лівою і правою частками печінки в капсульно перитонеально розташованих утвореннях відзначено патологічне збільшення накопичень Ga Tate. Зліва в параорбітальній ділянці в лімфовузлі, оціненому як метастатичний, спостерігається патологічно збільшене накопичення Ga Tate. У кістках спостерігаються великі ділянки патологічно збільшеного накопичення Ga Tate.
У квітні 2019 року пацієнтці призначений Соматулін® Аутожель® у дозі 120 мг. Уже на початку прийому зникла діарея і втома, зменшилися кашель і почервоніння шкіри обличчя й шиї.
У лютому 2020 року на ПЕТ-КТ з Ga-68 DOTATATE спостерігається незначне прогресування захворювання — збільшення розмірів утворення в плеврі справа й печінці. 03.03.2020 — хромогранін А — 506,9 мг/мл. Отримала 22 курси препарату Соматулін® Аутожель® 120 мг, 13 курсів зомети 4 мг. Своєчасно проходила консультації ендокринолога й кардіолога.
Близько 2 місяців тому стан пацієнтки погіршився, що вимагало зміни лікування на Lu-177 DOTATATE. В Україні отримати таке лікування неможливо через відсутність реєстрації препарату. Тому пацієнтка пройшла 2 курси терапії з Lu-177 DOTATATE в Польщі. Протягом усього цього часу прийом препарату Соматулін® Аутожель® 120 мг не припинявся.
У листопаді 2020 року стан пацієнтки погіршився: підвищилася температура тіла до 38,0 °С, з’явилися виражені болі в кістках і м’язах, слабкість. Виконана КТ ОГК, на якій відзначається поява випоту в правій плевральній порожнині, збільшення частини вузлових утворень уздовж плеври правого геміторакса, наростання склеротичних змін у кістках. В іншому картина КТ без суттєвої динаміки. На даний момент пацієнтка отримує стаціонарне лікування. Стан покращився.
Клінічний випадок НЕП шлунка навів доктор медичних наук, професор кафедри онкології Національного університету охорони здоров’я України ім. П.Л. Шупика Богдан Вікторович Сорокін.
Пацієнтка, 1950 року народження, звернулася зі скаргами на тахікардію, запаморочення, пітливість на тлі припливів жару без підвищення температури. Обстежилась у провідній клініці з приводу вузлового зоба. Тоді ж на УЗД була візуалізована кіста правого яєчника. В одній з онкологічних клінік у лютому 2018 р. була виконана операція — екстирпація матки з придатками. При патогістологічному дослідженні зроблено висновок про цистоаденому правого яєчника. Під час обстеження також були виявлені два поліпи шлунка 4 мм у діаметрі. Рекомендоване спостереження, біопсія не проводилася.
На першому контрольному огляді в липні 2018 року виконано езогастродуоденоскопію (ЕГДС) — збільшення вузлів не зафіксовано. На наступному огляді в квітні 2019 року відзначалося збільшення вузла. Була виконана біопсія, що дозволила виявити нейроендокринну пухлину. Імуногістохімічне дослідження (ІГХ): G2, Ki-67 — 4 %. Рівень гастрину — 2700 пг/мл (норма — 13–115 пг/мл), хромограніну А — 681 нг/мг (норма — 27–94 нг/мг). При проведенні ЕД-відеоскопії — в середній третині шлунка по малій кривизні, ближче до передньої стінки, спостерігалися 2 підслизових утворення — 7,1 × 4,9 мм і 5,8 × 3,7 мм округлої форми, у межах слизової оболонки й підслизового шару, без ознак інвазії в м’язовий шар шлунка. На межі тіла дна шлунка, по передній стінці, виявлено внутрішньослизове утворення 5,3 × 3,4 мм у межах слизової оболонки, переважно з гіперехогенними компонентами. На спіральній КТ трьох зон: дивертикульоз сигмоподібної і низхідної кишки. По малій кривизні в ділянці верхньої і середньої третини є поліпоподібне гіперваскулярне утворення шлунка розмірами 9 × 7 мм і 7 × 5 мм. Регіонарні лімфатичні вузли не збільшені. Контури шлунка чіткі. За даними ІГХ: хромогранін А — позитивний, синаптофізин — позитивний, Ki-67 — 4 %. На підставі всього вищеперерахованого встановлений діагноз: нейроендокринна пухлина шлунка G2 T1N0M0.
Пацієнтка має супутню патологію — проліферативну лейоміому тіла матки, цистаденому правого яєчника, після пангістеректомії І типу, а також ішемічну хворобу серця. Дифузний кардіосклероз. Гіпертонічна хвороба II стадії. Варикоз підшкірних вен обох гомілок. Хронічна венозна недостатність ІІ. Цукровий діабет 2-го типу. Жовчнокам’яна хвороба, конкремент 20 × 15 мм.
Для визначення інвазивності росту пухлини була проведена ультразвукова діагностика. У травні 2019 року виконана операція — ендоскопічна туморектомія (3 НЕП шлунка). Після операції призначена терапія синтетичними аналогами соматостатину пролонгованої дії — Соматулін® Аутожель® 120 мг і спостереження. Маркери НЕП (15.06.2019): хромогранін А — 517 нг/мг (зменшення на 164 нг/мг) і гастрин — 1551 пг/мл (зменшення на 1149 пг/мл). Надалі динаміка маркерів НЕП визначалася після кожної ін’єкції препарату Соматулін® Аутожель® 120 мг.
Після 1-ї ін’єкції: гастрин — 521 пг/мл (зменшення на 1030 пг/мл) і хромогранін А — 195 нг/мг (зменшення на 322 нг/мг).
Після 2-ї ін’єкції: гастрин — 289 пг/мл (зменшення на 232 пг/мл) і хромогранін А — 176 нг/мг (зменшення на 19 нг/мг).
Після 3-ї ін’єкції: гастрин — 299 пг/мл (збільшення на 10 пг/мл) і хромогранін А — 212 нг/мг (збільшення на 36 нг/мг).
Після 4-ї ін’єкції: гастрин — 698 пг/мл (збільшення на 399 пг/мл) і хромогранін А — 199 нг/мг (зменшення на 13 нг/мг).
Після 5-ї ін’єкції: гастрин — 564 пг/мл (зменшення на 134 пг/мл) і хромогранін А — 238 нг/мг (збільшення на 39 нг/мг).
У період з липня по жовтень 2019 року ендоскопічний контроль з біопсії не виявив НЕП. КТ — без змін порівняно з попереднім. На ЕГД-відеоскопії виявлено одиничне утворення, підозріле на НЕП. На УЗД шлунка виявлена нова пухлина шлунка, проведена ендоскопічна туморектомія за типом SMD. Патогістологічне дослідження (ПГД) і ІГХ: хромогранін А — позитивний, синаптофізин — позитивний, загальний цитокератин — позитивний. Ki-67 — менше за 1 %.
Після проведеної операції тривало спостереження за пацієнткою, визначалися маркери НЕП у динаміці. 29.02.2020: гастрин — 147 пг/мл, хромогранін А — 87 нг/мл; 21.04.2020: гастрин — 273 пг/мл, хромогранін А — 276 нг/мл; 05.06.2020: гастрин — 292 пг/мл, хромогранін А — 288 нг/мл. 17.06.2020 було проведено ендоскопічний контроль, за допомогою якого виявлене одне утворення діаметром 3 мм, підозріле на НЕП. ПГД не підтвердило НЕП, було зроблено висновок про грануляційний поліп. 01.08.2020 — гастрин — 682 пг/мл,
хромогранін А — 486 нг/мл. З’явився клінічний симптом — підвищена пітливість.
Було продовжено лікування Соматуліном® Аутожель® 120 мг. Після 6-ї ін’єкції гастрин — 207 пг/мл, хромогранін А — 161 нг мл; після 7-ї ін’єкції гастрин — 200 пг/мл, хромогранін А — 299 нг/мл. На контрольній ЕГДС (05.11.2020): у середній третині шлунка виявлено утворення, підозріле на НЕП, діаметром 4 мм. Було видалене, ПГД виявило грануляційний поліп.
У даний час пацієнтка перебуває під наглядом, її стан оцінюється як задовільний.
Після виступів спікерів відбулося обговорення наведених клінічних випадків. Професор О.О. Ковальов підкреслив, що в сучасних умовах неприпустиме проведення хіміотерапії без верифікації діагнозу. Це свідчить про поверхове ставлення до діагностики, а також до призначення лікування. Також професор рекомендував пацієнтці з олігометастазами в печінку розглянути можливість трансплантації печінки, а пацієнтці з типовим карциноїдом — додавання імунотерапії, зазначивши, що показанням до її призначення є мікросателітна нестабільність, незалежно від фенотипу й анатомії пухлини. Професор Б.В. Сорокін акцентував увагу на розвитку нових можливостей переведення слабоімуногенної пухлини в імуногенну, що дозволить підвищити ефективність імунотерапії в майбутньому.

/59.jpg)
/60.jpg)
/61.jpg)