Вступ
Аналіз наявних літературних даних показав, що коронавірусна інфекція є системною патологією, що викликає ураження нервової системи [1–3]. Найбільш часто розвиваються: головний біль, втрата смаку й нюху, атаксія, менінгіт, когнітивна дисфункція, втрата пам’яті, судоми й порушення свідомості [4–11]. Тривалі дослідження продемонстрували, що вплив SARS-CoV-2 на головний, спинний мозок і периферичні нерви може бути особливо руйнівним і сприяти порушенням життєдіяльності організму навіть після елімінації вірусу. У проведених експериментальних дослідженнях виявлено тривале персистування вірусу в центральній нервовій системі (ЦНС) [12].
Отже, необхідність розуміння неврологічних проблем, пов’язаних з високою частотою пошкодження нервової системи, тяжкістю неврологічний проявів, тривалістю персистування вірусу в клітинах нервової системи, підкреслює високу актуальність систематизації і аналізу наявної інформації, що стосується механізмів пошкодження нервової системи, особливостей симптомокомплексу й можливостей терапевтичного втручання для корекції неврологічних проявів з урахуванням патогенезу.
Патогенез
Механізми взаємодії SARS-CoV-2 з нервовою системою складні й різноманітні. Згідно з наявними даними [6], неврологічні прояви обумовлені кількома механізмами (рис. 1).
1. Пряме пошкодження вірусом
А. Нейрогенний шлях
Найбільш складним і недостатньо вивченим є пряме пошкодження вірусом клітин нервової системи. Віремія, що виникає при інфікуванні COVID-19, призводить до поширення вірусу по організму з потоком крові. Нейротропізм може розвиватися двома основними шляхами: гематогенним і/або нейрогенним.
Нейрогенна передача вірусу через периферичні нерви (у першу чергу ретроградний рух через нюховий нерв у нюхову цибулину, минаючи ґратчасту пластину) — це один зі шляхів, якими вірус може отримати доступ до ЦНС.
Встановлено, що інтраназальне інфікування мишей бляшкоутворюючими одиницями SARS-CoV-2 призвело до 100% смертності до 6-го дня після зараження. При цьому найвищі титри вірусу в легенях спостерігались на 3-й день, і вони знизилися на 5-й і 6-й дні після зараження. Тоді як у головному мозку високі рівні вірусу виявлялись у всіх тварин на 5-й і 6-й дні. Початок тяжкого захворювання в інфікованих мишей корелював з піковими рівнями вірусу в головному мозку, при цьому вони були приблизно в 1000 разів вище, ніж пікові титри в легенях, що свідчить про високий реплікативний потенціал SARS-CoV-2 у мозку. Відносна регуляція мРНК цитокінів і хемокінів була приблизно в 10–50 разів вище в мозку порівняно з легенями, що переконливо свідчить про те, що велике нейрозапалення, яке супроводжується інфільтрацією лейкоцитів, кровотечею і загибеллю нейрональних клітин, сприяло клінічному захворюванню в цих мишей [12].
/9.jpg)
При ретельному регіональному картуванні нюхових нервових трактів і різних ділянок ЦНС у матеріалі автопсії осіб з COVID-19 за допомогою RT-qPCR вірусна РНК була виявлена в нюховій цибулині, нюховому тракті, нюховому горбку, у гангліях трійчастого нерва, у довгастому мозку й мозочку [9, 13, 14]. Виявлення реплікації вірусу в цих тканинах підтверджує, що SARS-CoV-2 може проникати в мозок, інфікувавши нервові закінчення очей, носової порожнини, ротоглотки і згодом взаємодіючи з рецепторами на поверхні нервових закінчень. Потім, після процесу ферментативного ендоцитозу, він проходить через кальмодулін-залежний ретроградний шлях транспорту кальцію по інтернейронах до ядер мозку. Ця гіпотеза узгоджується з раніше опублікованими повідомленнями про те, що нейротропні коронавіруси інфікують нюхові нейрони й передаються в мозок за допомогою аксонального транспортування [9, 15–17].
Ще один цікавий частий клінічний симптом COVID-19 — це гіпогевзія [3, 18]. Відчуття смаку реалізується через лицевий нерв (від передніх двох третин язика), язиково-глотковий нерв і верхню горлову гілку блукаючого нерва (від задніх двох третин язика), інформація передається до ядра солітарного тракту в стовбурі мозку, а потім у таламус. Отже, ці черепні нерви також потенційно забезпечують транснейрональний шлях потрапляння вірусу в головний мозок [18–21].
Нейрогенний шлях поширення вірусу може пояснити втрату нюху, смаку, а також цим шляхом може відбуватися ураження стовбура мозку й кардіореспіраторного центру в довгастому мозку, що може потенційно сприяти порушенню дихання й настанню смерті. Крім присутності РНК вірусу, при COVID-19 у ЦНС виявлена значна втрата нейронів у грушоподібній та інфралімбічній корі, базальних гангліях і дорсальних ядрах шва в середньому мозку [14]. Дані зміни виявлені у хворих з тяжкою коронавірусною інфекцією, тому повною мірою не можуть бути перенесені на осіб з легким і помірно-тяжким перебігом захворювання. Однак вони становлять інтерес щодо розуміння патогенетичних особливостей захворювання й розвитку віддалених наслідків.
При проникненні SARS-CoV-2 всередину ЦНС через нюхову цибулину клітини нейроепітелію, пошкоджені вірусом, активують запальні клітини. ORF3a, ORF8b, білки E і шлях NF-κB запускають шлях запалення, що призводить до виникнення цитокінового шторму, викликаючи подальше пошкодження нейронів, порушення процесів нейропластичності й нейрогенезу. Механізм взаємодії SARS-CoV-2 із ЦНС, що призводить до дисфункції нюхової системи, дозволяє припустити наявність взаємозв’язку між COVID-19 і нейродегенеративними захворюваннями, при яких порушення нюху також відіграє важливу роль.
Встановлено, що нюхова дисфункція є чутливим індикатором різних нейродегенеративних захворювань, таких як хвороба Паркінсона й хвороба Альцгеймера. Основним фактором дисфункції нюху є холінергічна система базального переднього мозку, що регулює різні нейротрансмітери в головному мозку. Холінергічні ней-рони проєктуються в нюхову цибулину й модулюють різні неврологічні дії, що стимулюють імунну відповідь, коли чужорідний агент вторгається в ЦНС. За наявності вираженого ушкодження або дефекту холінергічних нейронів виникає активація фенотипу M1 і медіаторів запалення, включно з інтерлейкіном (IL) 6, IL-12p40, IL-15 і фактором некрозу пухлини α (TNF-α), високий рівень яких призводить до нейрозапалення й загибелі клітин [22–24].
Б. Гематогенний шлях, або ураження гематоенцефалічного бар’єра
Інший шлях, яким вірус може проникнути в мозок, — це порушення гематоенцефалічного бар’єра (ГЕБ) [25].
Ендотеліальні клітини мікросудин, які утворюють гематоенцефалічний бар’єр, захищають ЦНС від широкого спектра токсинів і мікроорганізмів, виявлених у крові. Ці клітини експресують білки щільних контактів, що обмежують переміщення між сусідніми клітинами, і діють через специфічні транспортери й рецепторні білки, які контролюють вхід і вихід молекул, що надходять з крові в паренхіму мозку [26]. У недавньому дослідженні виявлено, що спайковий білок S1, часто зображуваний як червоні гілки вірусу, може долати гематоенцефалічний бар’єр у мишей [27]. Порушення цілісності гематоенцефалічного бар’єра під впливом SARS-CoV-2 може відбуватися за допомогою різних механізмів:
а) активація мікроендотеліальних клітин головного мозку вірусом SARS-CoV-2 викликає високу експресію судинних і міжклітинних молекул адгезії (VCAM і ICAM), індукує експресію і активацію матричних металопротеїназ (MMP), які руйнують білки щільних контактів;
b) розпізнавання VCAM і ICAM через інтегрини β1 і β2 викликає зв’язування циркулюючих лейкоцитів з ендотеліальними клітинами, що призводить до трансцелюлярної екстравазації. Цей процес сприяє проникненню вірусу в паренхіму головного мозку за допомогою механізму «троянського коня»;
c) реплікація вірусу SARS-CoV-2 викликає прямий клітинний стрес, пов’язаний з більшістю цитотоксичних ефектів, які призводять до дегенерації інфікованих клітин, викликаючи зморщування і лізис ендотеліальних клітин [25, 27];
d) активація запальної імунної відповіді SARS-CoV-2 також підвищує проникність ГЕБ, вдруге сприяючи екстравазації білків плазми й клітин крові, приводячи до активації лейкоцитів і тромбоцитів, що ще більшою мірою сприяє пошкодженню гематоенцефалічного бар’єра. Загибель ендотеліальних клітин порушує мікросередовище паренхіми головного мозку, забезпечуючи вільне проходження вірусу SARS-CoV-2 та інфікування інших клітин центральної нервової системи;
е) експресія рецепторів ангіотензинперетворюючого ферменту 2 (ACE2) і протеїн-конвертази фурину (PCF) у мембрані ендотеліальних клітин мікросудин головного мозку сприяє інфікуванню SARS-CoV-2, який зв’язується з клітинами через субодиницю S1 свого білка.
Встановлено, що, подібно до SARS-CoV, SARS-CoV-2 для проникнення всередину клітин використовує рецептори ангіотензинперетворюючого ферменту 2 [29]. Вірус закріплюється на ACE2 через білок-шип [30]. Відома експресія рецепторів ACE2 у легенях, серці, нирках, кишечнику, мозку і яєчках, що є потенційними мішенями COVID-19 [29]. У ЦНС ACE2 рецептори експресуються гліальними клітинами й нейронами [31], розташованими в різних ділянках мозку людини, включно з мигдалеподібним тілом, корою головного мозку й стовбуром мозку, причому найвищі рівні експресії виявляються в стовбурі мозку, де розташовується дихальний центр [9, 32]. Потрапивши в середовище нейронних тканин, вірус взаємодіє з рецепторами ACE2 та ініціює цикл розмноження, що супроводжується пошкодженням нейронів без істотного запалення [16]. Результатом інтерналізації ACE2, індукованого SARS-CoV-2, є втрата експресії ACE2 на рівні клітинної поверхні, що може поставити під загрозу здатність клітини метаболізувати ангіотензин II (Ang II), що являє собою ключовий посередник синтезу Ang-(1-7), який є одним з найбільш важливих серцево-судинних медіаторів периферичної дії ренін-ангіотензин-альдостеронової системи (РААС) [30, 33]. У результаті відбувається зміна динамічного балансу між двома гілками РAAС: (1) ACE/Ang II/AT1R із прозапальною активністю і (2) ACE2/Ang-(1-7)/MasR із протизапальними властивостями [33]. Ang II діє як паракринний медіатор у ЦНС: в основному в астроцитах, де через активацію TGF-β і локальну продукцію альдостерону він дає прозапальний ефект, що приводить до пошкодження. Більше того, за рахунок виробництва супероксиду Ang II прискорює старіння й дисфункцію самих астроцитів. Передбачається, що обидва ці процеси є кофактором, який призводить до розвитку когнітивної дисфункції, що визначає більш високий ризик розвитку деменції, тому що відомо, що при таких станах, як хвороба Альцгеймера, судинні когнітивні порушення й когнітивні порушення після інсульту, переважає вісь ACE/Ang II/AT1R, посилюючи й прискорюючи розвиток когнітивних порушень. Отже, збільшення співвідношення Ang II/Ang-(1-7), що відбувається після ендоцитозу ACE2, може викликати хронічну втрату функції ураженої тканини й порушення функціонування мозку [34]. Крім того, пряме й опосередковане ACE2 вірусне пошкодження ендотелію викликає ендотеліїт і нейросудинну ендотеліальну дисфункцію. Це проявляється різними порушеннями, у тому числі довгостроковими. Щільність рецепторів ACE2 у ЦНС впливає на взаємодію організму з вірусом, обумовлюючи індивідуальні особливості патогенезу й розвиток ускладнень [35, 36].
Отже, SARS-CoV-2 може досягати ЦНС різними шляхами й викликати гострі захворювання, а також зберігатися в клітинах ЦНС і брати участь у формуванні відстрочених неврологічних наслідків.
Крім описаних механізмів прямого пошкодження вірусом нервової системи, досить часто відзначається опосередковане ураження, пов’язане з активацією запальних і протромботичних шляхів, що можуть мати стосунок до патогенезу системних симптомів і симптомів ЦНС.
2. Запально-опосередковане ушкодження
Накопичені дані свідчать про те, що пацієнти з COVID-19 можуть мати синдром цитокінового шторму, який характеризується підвищеним рівнем IL-1, IL-2, IL-6, фактора, що стимулює колонії гранулоцитів, який індукується інтерфероном γ білка 10, запального білка макрофагів 1α і фактора некрозу пухлини α [37–39]. У пацієнтів з тяжким COVID-19 виявляються високі рівні інтерферону γ і IL-18 і гемофагоцитоз, що є важливими патологічними ознаками цитокінового шторму. Встановлено, що первинні культури гліальних клітин, які зазнали впливу коронавірусу, секретують прозапальні цитокіни IL-6, IL-12, IL-15 і TNF-α.
При некротичній енцефалопатії, гострій некротичній мієлопатії, енцефаліті й гострому дисемінованому енцефаломієліті з негативною полімеразною ланцюговою реакцією в спинномозковій рідині цитокіновий шторм є найбільш імовірним механізмом ураження ЦНС. Отже, імунна відповідь і розвиток запалення відіграють важливу роль у патогенезі COVID-19 [40]. При цьому індивідуальні особливості імунної відповіді (надмірна імунна відповідь із системним гіперзапаленням, спровокована зв’язуванням спайкового білка SARS-CoV-2 (S1) з клітинами, що експресують ACE2) являють собою предиктор смертності й тяжкості інфекції SARS-CoV-2, опосередкованої виробленням цитокінів і пов’язаних з ними медіаторів запалення.
У пацієнтів із SARS-CoV-2 було виявлено, що автоантитіла до спайк-білка коронавірусу реагують з епітеліальними й ендотеліальними клітинами людини й викликають цитотоксичність [21, 22]. Отже, пацієнти з COVID-19 можуть виробляти антитіла проти SARS-CoV-2, які також атакують антигени ендотеліальних клітин людини в судинах головного мозку або в нейронах (через порушений гематоенцефалічний бар’єр), що може призводити до набряку мозку й автоімунного енцефаліту.
Гіперзапальна реакція у відповідь на вплив вірусу призводить до розвитку синдрому системної запальної відповіді, що виявляється високим рівнем С-реактивного білка, коагулопатією (підвищенням рівня D-димеру, зниженням рівня тромбоцитів і фібриногену), пошкодженням тканин (підвищення рівня лактатдегідрогенази, аланінамінотрансферази й аспартатамінотрансферази), активацією гепатоцитів і макрофагів (підвищений рівень феритину) і цитопенії (тромбоцитопенія і лімфопенія) [39, 41].
3. Тромботичне пошкодження
У пацієнтів з СOVID-19 відзначається підвищення рівня циркулюючих протромботичних факторів, що відображає стан гіперкоагуляції. Прозапальні цитокіни викликають активацію ендотеліальних і мононуклеарних клітин з експресією тканинного фактора, що призводить до активації каскаду коагуляції і генерації тромбіну. Циркуляція вільного тромбіну активує тромбоцити й призводить до тромбозу. Також передбачається, що зв’язування SARS-CoV-2 з рецептором ACE2 викликає дисбаланс ренін-ангіотензинової системи, сприяючи осі ACE1 — ангіотензин і розвитку ендотеліальної дисфункції, що призводить до тромбозів різного ступеня вираженості й локалізації, у тому числі ішемічних інсультів [37, 42, 43].
4. Ураження в результаті гіпоксії і порушення гомеостазу
Встановлено, що дифузний альвеолярний та інтерстиціальний запальний набряк при COVID-19 призводить до порушення альвеолярного газообміну й гіпоксії ЦНС. Анаеробний метаболізм у мітохондріях клітин головного мозку призводить до ацидозу, вазодилатації, посилення інтерстиціального набряку, обструкції церебрального кровотоку, внутрішньочерепної гіпертензії і коми [44]. У більшості пацієнтів у відділенні інтенсивної терапії розвиваються симптоми гострої церебральної дисфункції, що виявляється делірієм, сплутаністю свідомості, психозом, які об’єднуються терміном «енцефалопатія критичних станів» або «мозковий синдром критичних станів». Ця енцефалопатія є незалежним предиктором смерті й пов’язана з довготривалою когнітивною дисфункцією. Механізми, що лежать в її основі, неоднорідні і багатофакторні, вони включають пряме пошкодження головного мозку, респіраторну, серцеву, ниркову або печінкову недостатність, сепсис, ендокринний або електролітний дисбаланс, вплив фармакологічних препаратів. Описана серія 18 пацієнтів з COVID-19, які померли у відділенні інтенсивної терапії і яким було виконано розтин. При автопсії в усіх було виявлено гостре гіпоксично-ішемічне пошкодження [44, 45].
Незважаючи на існування різних механізмів, у більшості випадків неврологічні прояви COVID-19 виникають у результаті їх комплексного впливу.
Клінічні прояви ураження ЦНС при COVID-19
Інфекція SARS-CoV-2 проявляється загальними симптомами у вигляді гарячки, кашлю, втоми, головного болю й задишки. З’являється все більше клінічних повідомлень про симптоми ураження ЦНС, такі як головний біль, нудота, блювання, порушення свідомості й гострі цереброваскулярні захворювання, включно з інсультом, тромбозом венозного синуса і внутрішньомозковою кровотечею [3, 11, 38, 46].
Більш специфічні неврологічні прояви у вигляді менінгоенцефаліту й гострої некротичної енцефалопатії описані в різних вікових групах. У цих пацієнтів найчастіше захворювання маніфестувало розвитком фебрильної гарячки, блювання, судом, пригнічення свідомості [47–50].
Крім того, проведений огляд літератури показав, що гострі цереброваскулярні захворювання (ЦВЗ) є одними з найбільш поширених серйозних неврологічних ускладнень, які спостерігаються в популяціях COVID-19 [42, 43]. В італійській, голландській і китайській когортах пацієнтів з COVID-19, які надійшли з підтвердженою інфекцією, частота ішемічного інсульту становила 2,5; 3,7 і 5 % відповідно, незважаючи на венозну тромбопрофілактику [51–53]. Характерно, що ЦВЗ розвиваються при COVID-19 не тільки в літніх осіб із супутніми серцево-судинними захворюваннями, але й у молодих, початково здорових пацієнтів. При цьому більш високі рівні D-димерів можуть вказувати на більш високий ризик цереброваскулярних захворювань (D-димер є продуктом деградації фібринового згустку і вказує на нещодавнє або поточне утворення згустку).
Багато авторів повідомляють про ураження спинного мозку й периферичної нервової системи в пацієнтів з COVID-19 (синдром Гієна — Барре, гострий мієліт) [54–56]. Також описано виникнення вогнищевої неврологічної симптоматики в результаті демієлінізуючих процесів, викликаних інфекцією SARS-CoV-2 [39]. Крім того, у пацієнтів з COVID-19 також реєструються неспецифічні психологічні проблеми, такі як тривога, депресія, безсоння і дистрес [57]: у 35 % пацієнтів, які перенесли COVID-19, легкі, а в 13 % — помірні або тяжкі психологічні симптоми [58].
Отже, згідно з даними поточних досліджень, у результаті дії багатофакторних механізмів (вірусні, імунні, гіпоксичні, гіперкоагуляційні) інфекція SARS-CoV-2 може викликати цілий спектр неврологічних захворювань (табл. 1), що залучають центральну нервову систему, периферичну нервову систему (ПНС) і ефекторні органи (м’язи). Серед проявів ЦНС, що мали місце у 24,8 % пацієнтів, найбільш частими були запаморочення (16,8 %), головний біль (13,1 %), зміна рівня свідомості (7,5 %) і гострі цереброваскулярні захворювання (2,8 %), що визначаються як ішемічний або геморагічний інсульт. Серед проявів ПНС, що мали місце у 8,9 % пацієнтів, найбільш поширеними були гіпогевзія (5,6 %), гіпосмія (5,1 %) і невралгія (2,3 %). Залучення м’язів у вигляді міалгій і підвищення рівня креатинкінази в крові (> 200 Од/л) були виявлені в 10,7 % хворих [3]. На додаток до цього в пацієнтів у критичному стані спостерігалися ураження багатьох органів, у тому числі печінки, нирок і м’язів. Інші дослідження, проведені в усьому світі, підтвердили ці висновки [59].
/12.jpg)
Лонг-ковід і постковід
Останнім часом стало з’являтися все більше даних про симптоми, які зберігаються тривалий час, а також про структурні й функціональні зміни в різних органах і системах після COVID-19 [60]. Стає ясно, що симптоми COVID-19 (їх понад 30) навіть серед осіб з «легкою» формою захворювання зберігаються довгий час після гострої фази у великої кількості пацієнтів. Постковідний синдром (Post-COVID-19 syndrome), також відомий як Long Covid, являє собою наслідки коронавірусної інфекції, при якій до 20 % осіб, які перенесли коронавірусну інфекцію, страждають від довгострокових симптомів, які тривають до 12 тижнів, а у 2,3 % випадків — довше [61]. Постковідний синдром внесений до Міжнародного класифікатора хвороб (МКХ-10) у формулюванні Post COVID-19 condition.
У грудні 2020 року Національним інститутом здоров’я Великої Британії (NICE) була запропонована така класифікація постковідних станів [62]:
— гострий COVID-19 (симптоми, що тривають до чотирьох тижнів);
— тривалий симптоматичний COVID-19 (симптоми, що тривають від 4 до 12 тижнів);
— постковідний синдром (симптоми, що тривають понад 12 тижнів, не пояснюються альтернативним діагнозом, здатні змінюватися з часом, зникати і знову виникати, зачіпаючи багато систем організму).
На додаток до вищевказаних клінічних визначень було також запропоновано ввести термін «довгий COVID» (Long COVID), що включає період симптоматики в цілому від 4 тижнів і більше.
Проведене дослідження показало, що через два місяці після лікування не більше ніж 13 % пацієнтів були повністю безсимптомними, близько 30 % пацієнтів мали 1 або 2 залишкових симптоми, понад 50 % мали 3 або більше симптоми. Усього залишкові симптоми мали близько 2/3 пацієнтів. Найбільш часто реєстрованими симптомами під час і після COVID-19 були задишка й стомлюваність [63–66]. До типових симптомів також належать болі в м’язах і суглобах, втрата смаку й нюху [67, 68]. Отже, спостерігається тільки часткове відновлення симптомів і стану здоров’я хворих, і далеко не всі пацієнти повністю одужують навіть через декілька місяців після гострої фази хвороби. Залишкова симптоматика значною мірою залежить від віку, перебування в лікарні, тяжкості перебігу й наявності задишки на початку захворювання [69].
Слід зазначити, що розвиток симптомів постгострого і пролонгованого COVID-19 безпосередньо не залежить від тяжкості перебігу гострого COVID-19 або місця лікування — у стаціонарі або поза ним. Симптоми можуть із часом змінюватися, зникати і з’являтися знову, а також можуть змінюватися за інтенсивністю.
Симптоматика після COVID-19 у першу чергу пов’язана з дихальною системою, серцем і нервовою системою, рідше вражаються нирки, печінка, підшлункова залоза, селезінка, навіть шкіра й слизові оболонки, що, можливо, є наслідком прямого вторгнення вірусу в тканини, вираженого запалення, імунологічного дисбалансу, цитокінового шторму й порушення згортання крові з подальшими тромбоемболіями, як обговорювалося вище [70]. Слід враховувати, що залишкові соматичні й функціональні проблеми також виявляються при легких формах COVID-19 і можуть зберігатися протягом тривалого періоду часу, порушуючи якість життя хворих.
Найбільш частими неврологічними резидуальними змінами, що реєструються в пацієнтів з COVID-19, є головний біль, запаморочення, шум у вухах, біль у м’язах, гемосенсорна дисфункція (аносмія і агевзія), периферичні невропатії, порушення сну, делірій (у літніх пацієнтів). Інсульт — рідкісний прояв у гострій фазі інфекції, однак він може виникати також у постгострий період, до 2–3 місяців після хвороби. Також описані відстрочені перепади настрою, порушення пам’яті й когнітивних функцій, фізичний дискомфорт [71]. У дослідженні британських колег, які використовували когнітивний опитувальник приблизно у 84 000 учасників, виявлена висока частота когнітивних порушень навіть у пацієнтів, які перенесли інфекцію в легкій формі, без задишки і будь-якої залишкової симптоматики [72, 73].
Також відзначена висока частота занепокоєння, виснаження, які можна узагальнити терміном «синдром хронічної втоми», що перебігає з хронічною емоційною нестабільністю й фізичною слабкістю і не дозволяє повноцінно виконувати роботу. Люди, які страждають від COVID-19, мають підвищений ризик розвитку депресії, посттравматичного стресу й зловживання токсичними речовинами [74]. Встановлено, що молоді пацієнти більш схильні до емоційних наслідків, ніж пацієнти, старші за 60 років [75, 76].
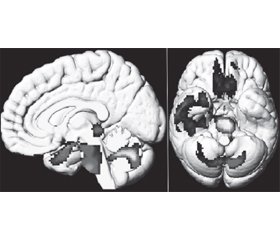
Проведення позитронно-емісійної томографії в пацієнтів, які перенесли коронавірус, у яких функціональні скарги зберігалися більше ніж через 3 тижні після появи перших симптомів інфекції, продемонструвало гіпометаболізм головного мозку в ділянці нюхової звивини, пов’язаних лімбічної і паралімбічної ділянок, а також його поширення на стовбур мозку й мозочок (рис. 2) [74]. Цей гіпометаболізм пов’язаний із симптомами і має значення біомаркера, що дозволяє ідентифікувати таких пацієнтів і потенційно стежити за ними.
З огляду на появу нових даних, пов’язаних з формуванням лонг-ковіду, починається пошук механізмів розвитку постковідного синдрому, а також проведення клінічних досліджень щодо потенційної можливості терапевтичних впливів, спрямованих на профілактику й лікування віддалених наслідків перенесеного коронавірусу або лонг-ковіду.
/13.jpg)
Відповідно до сучасних уявлень, найбільш значущими нейробіологічними процесами, що формують ендогенну захисну активність ЦНС, є нейротрофіка, нейропротекція, нейропластичність і нейрогенез. При цьому технології досягнення формування безлічі молекулярних шляхів, зв’язків, регулювання рівноваги засновані на фармакологічних і нефармакологічних підходах. Взаємно збагачувані шляхи регуляції нейрогенезу в процесі реабілітації хворих — синаптичний (гімнастика, масаж, заняття з логопедом, плавання тощо) і гуморальний (дотація нейротрофічних факторів і модуляція нейротрансмітерних процесів). Для збереження активності медіаторів, що відповідають за регенерацію і відновлення функції нервової тканини, у клінічній неврології використовують нейропротектори, серед яких ключове місце посідають цитиколіни (Нейроксон®). Нейроксон® — препарат, що має мультимодальну дію, забезпечує нейропротекцію і нейрорепарацію. Він активно впливає на нейромедіаторний баланс, посилюючи синтез ацетилхоліну в ЦНС, що обумовлює його призначення при когнітивних порушеннях різного генезу.
Крім того, Нейроксон® сприяє підвищенню вмісту попередників ендотеліальних клітин, збільшуючи активність ангіо- і неоваскулогенезу, а також відновлює цілісність нейрональних мембран, знижуючи активність фосфоліпази, і таким чином перешкоджає розвитку апоптозу.
Отже, з огляду на багатофакторний патогенез COVID-19, що приводить до тривалого персистування клінічних симптомів у результаті порушення нейропластичності й нейрогенезу з формуванням холінергічної недостатності, рекомендоване застосування препарату Нейроксон® у дозуванні 1000 мг на добу, розділених на 2 прийоми, протягом 30 днів.
Також доцільним видається рекомендувати більш тривалий медичний нагляд і контроль за людьми, які перехворіли на COVID-19, для профілактики, своєчасного виявлення й корекції віддалених ускладнень [69].
Висновки
Залучення ЦНС при COVID-19 різнорідне як за клінічними проявами, так і за основними механізмами. У деяких випадках вдається верифікувати пряму вірусну інвазію ЦНС. У більшості пацієнтів з легкими формами захворювання (залежно від респіраторного статусу) запальні або цереброваскулярні порушення є переважаючими ускладненнями з боку центральної нервової системи. У цьому контексті задіяні механізми реалізуються через запальний (цитокіновий шторм), протромботичний і ендотеліальний (через ACE2) шляхи. У тяжкохворих пацієнтів з COVID-19 включаються додаткові механізми, пов’язані з енцефалопатією критичних станів, такі як гіпоксія, системні порушення та вплив лікарських препаратів.
Незважаючи на численні клінічні звіти про неврологічні й психіатричні симптоми COVID-19, як і раніше, складно встановити, чи пов’язані вони з прямим або непрямим впливом вірусної інфекції, чи є вторинними щодо гіпоксії, сепсису, цитокінової реакції і поліорганної недостатності.
Гостра необхідність у більш глибокому розумінні неврологічних проблем, пов’язаних з COVID-19, привела до створення нейробанку даних COVID-19 (NeuroCOVID), бази даних, яка буде збирати клінічну інформацію про неврологічні симптоми, ускладнення і наслідки, пов’язані із зараженням SARS-CoV-2, а також про вплив COVID-19 на неврологічні стани, що існували раніше [5].
Проникнувши в головний мозок, COVID-19 може впливати на роботу інших органів і систем, а також організму в цілому. З огляду на механізми ушкодження особи, які вижили після COVID-19, у яких інфекція досягла головного мозку, можуть стати сприйнятливими до інших серйозних захворювань, таких як хвороба Паркінсона, зниження когнітивних функцій, розсіяний склероз та інші автоімунні захворювання.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів і власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 02.02.2021
Рецензовано/Revised 17.02.2021
Прийнято до друку/Accepted 22.02.2021
Список литературы
1. Rothan H.A., Byrareddy S.N. The epidemiology and pathogenesis of coronavirus disease (COVID-19) outbreak. J. Autoimmun. 2020. 109. 102433.
2. Rothan H.A., Acharya A., Reid S.P., Kumar M., Byrared-dy S.N. Molecular Aspects of COVID-19 Differential Pathogenesis. Pathogens. 2020. 9. 538.
3. Mao L., Jin H., Wang M. et al. Neurologic Manifestations of Hospitalized Patients With Coronavirus Disease 2019 in Wuhan, China. JAMA Neurol. 2020. 77(6). 683-690. doi: 10.1001/jamaneurol.2020.1127.
4. Espinosa P.S., Rizvi Z., Sharma P., Hindi F., Filatov A. Neurological Complications of Coronavirus Disease (COVID-19): Encephalopathy, MRI Brain and Cerebrospinal Fluid Findings: Case 2. Cureus. 2020. 12. e7930.
5. Filatov A., Sharma P., Hindi F., Espinosa P.S. Neurological Complications of Coronavirus Disease (COVID-19): Encephalopathy. Cureus. 2020. 12. e7352.
6. Heneka M.T., Golenbock D., Latz E., Morgan D., Brown R. Immediate and long-term consequences of COVID-19 infections for the development of neurological disease. Alzheimer’s Res. Ther. 2020. 12. 69.
7. Mahammedi A., Saba L., Vagal A., Leali M., Rossi A., Gaskill M., Sengupta S., Zhang B., Carriero A., Bachir S. et al. Imaging in Neurological Disease of Hospitalized COVID-19 Patients: An Italian Multicenter Retrospective Observational Study. Radiology. 2020. 297. E270-E273.
8. Parry A.H., Wani A.H., Yaseen M. Neurological Dysfunction in Coronavirus Disease-19 (COVID-19). Acad. Radiol. 2020. 27. 1329-1330.
9. Baig A.M., Sanders E.C. Potential neuroinvasive pathways of SARS-CoV-2: Deciphering the spectrum of neurological deficit seen in coronavirus disease-2019 (COVID-19). J. Med. Virol. 2020. 92. 1845-1857.
10. Adamczyk-Sowa M., Niedziela N., Kubicka-Baczyk K., Wierzbicki K., Jaroszewicz J., Sowa P. Neurological symptoms as a clinical manifestation of COVID-19: Implications for internists. Polish Arch. Intern. Med. 2020.
11. Wang H.Y., Li X.L., Yan Z.R., Sun X.P., Han J., Zhang B.W. Potential neurological symptoms of COVID-19. Ther. Adv. Neurol. Disord. 2020. 13. 1756286420917830.
12. Kumari P., Rothan H.A., Natekar J.P., Stone S., Pathak H., Strate P.G., Arora K., Brinton M.A., Kumar M. Neuroinvasion and Encephalitis Following Intranasal Inoculation of SARS-CoV-2 in K18-hACE2 Mice. Viruses. 2021 Jan 19. 13(1). 132. doi: 10.3390/v13010132. PMID: 33477869; PMCID: PMC7832889.
13. Kanjanaumporn J., Aeumjaturapat S., Snidvongs K., Seresirikachorn K., Chusakul S. Smell and taste dysfunction in patients with SARS-CoV-2 infection: A review of epidemiology, pathogenesis, prognosis, and treatment options. Asian Pac. J. Allergy Immunol. 2020. 38. 69-77.
14. Cantuti-Castelvetri L., Ojha R. et al. Neuropilin-1 facilitates SARS-CoV-2 cell entry and infectivity. Science. 2020. 370. 856-860.
15. Perlman S., Evans G., Afifi A. Effect of olfactory bulb ablation on spread of a neurotropic coronavirus into the mouse brain. J. Exp. Med. 1990. 172. 1127-1132.
16. Netland J., Meyerholz D.K., Moore S., Cassell M., Perlman S. Severe acute respiratory syndrome coronavirus infection causes neuronal death in the absence of encephalitis in mice transgenic for human ACE2. J. Virol. 2008. 82. 7264-7275. DOI: 10.1128/JVI.00737-08.
17. Dube M., Le Coupanec A., Wong A.H.M., Rini J.M., Desforges M., Talbot P.J. Axonal Transport Enables Neuron-to-Neuron Propagation of Human Coronavirus OC43. J. Virol. 2018. 92. e00404-e00418.
18. Lu R., Zhao X., Li J., Niu P., Yang B., Wu H. et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. Lancet. 2020. 395. 565-74
19. van Riel D., Verdijk R., Kuiken T. The olfactory nerve: A shortcut for influenza and other viral diseases into the central nervous system. J. Pathol. 2015. 235. 277-287.
20. Blinzinger K., Anzil A.P. Neural route of infection in viral di-seases of the central nervous system. Lancet. 1974. 2. 1374-1375.
21. Durrant D.M., Ghosh S., Klein R.S. The Olfactory Bulb: An Immunosensory Effector Organ during Neurotropic Viral Infections. ACS Chem. Neurosci. 2016. 7. 464-469.
22. De Santis G. SARS-CoV-2: A new virus but a familiar inflammation brain pattern. Brain, Behavior, and Immunity. 2020. 87. 95-96.
23. Armocida D., Pesce A., Raponi I., Pugliese F., Valentini V., Santoro A., Berra L.V. Anosmia in COVID-19: severe acute respiratory syndrome coronavirus 2 through the nasoliary epithelium and a possible spreading way to the central nervous system — A purpose to study. Neurosurgery. 2020. https://doi.org/10.1093/neuros/nyaa204.
24. Mahalaxmi I., Kaavya J., Mohana Devi S., Balachandar V. COVID-19 and olfactory dysfunction: A possible associative approach towards neurodegenerative diseases. J. Cell. Physiol. 2021. 236. 763-770. https://doi.org/10.1002/jcp.29937.
25. Alquisiras-Burgos I., Peralta-Arrieta I., Alonso-Palomares L.A. et al. Neurological Complications Associated with the Blood-Brain Barrier Damage Induced by the Inflammatory Response During SARS-CoV-2 Infection. Mol. Neurobiol. 2021. 58. 520-535. https://doi.org/10.1007/s12035-020-02134-7.
26. Keaney J., Campbell M. The dynamic blood-brain barrier. FEBS J. 2015. 282(21). 4067-4079. https://doi.org/10.1111/febs.13412.
27. Rhea E.M., Logsdon A.F., Hansen K.M. et al. The S1 protein of SARS-CoV-2 crosses the blood-brain barrier in mice. Nat. Neurosci. 2020. https://doi.org/10.1038/s41593-020-00771-8.
28. Buzhdygan T.P., DeOre B.J., Baldwin-Leclair A., Bul-lock T.A., McGary H.M., Khan J.A., Razmpour R., Hale J.F., Galie P.A., Potula R., Andrews A.M., Ramirez S.H. The SARS-CoV-2 spike protein alters barrier function in 2D static and 3D microfluidic in-vitro models of the human blood-brain barrier. Neurobiol. Dis. 2020 Dec. 146. 105131. doi: 10.1016/j.nbd.2020.105131. Epub 2020 Oct 11. PMID: 33053430; PMCID: PMC7547916.
29. Palasca O., Santos A., Stolte C., Gorodkin J., Jensen L.J. TISSUES 2.0: an integrative web resource on mammalian tissue expression. 2018. Database 2018, bay003.
30. Wrapp D., Wang N., Corbett K.S., Goldsmith J.A., Hsieh C.L., Abiona O., Graham B.S., McLellan J.S. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. Science. 2020. 367. 6483. DOI: 10.1126/science.abb2507.
31. Baig A.M., Khaleeq A., Ali U., Syeda H. Evidence of the COVID-19 Virus Targeting the CNS: Tissue Distribution, Host-Virus Interaction, and Proposed Neurotropic Mechanisms. ACS Chem. Neurosci. 2020 Apr 1. 11(7). 995-998. doi: 10.1021/acschemneuro.0c00122. Epub 2020 Mar 13. PMID: 32167747; PMCID: PMC7094171.
32. Lukiw W.J., Pogue A., Hill J.M. SARS-CoV-2 Infectivity and Neurological Targets in the Brain. Cellular and molecular neurobio-logy. 2020. doi: 10.1007/s10571-020-00947-7; doi:10.1007/s10571-020-00947-7.
33. Panariello F., Cellini L., Speciani M., De Ronchi D., Atti A.R. How Does SARS-CoV-2 Affect the Central Nervous System? A Wor-king Hypothesis. Front Psychiatry. 2020. 11. 582345. Published 2020 Nov 16. doi: 10.3389/fpsyt.2020.582345.
34. Shang J., Wan Y., Luo C., Ye G., Geng Q., Auerbach A. et al. Cell entry mechanisms of SARS-CoV-2. Proc. Natl Acad. Sci. USA. 2020. 117. 11727-34. doi: 10.1073/pnas.2003138117.
35. Li Y.-C., Bai W.-Z., Hashikawa T. The neuroinvasive potential of SARS-CoV2 may play a role in the respiratory failure of COVID-19 patients. J. Med. Virol. 2020. 92. 552-5. doi: 10.1002/jmv.25728.
36. Yan R., Zhang Y., Li Y., Xia L., Guo Y., Zhou Q. Structural basis for the recognition of SARS-CoV-2 by full-length human ACE2. Science. 2020. 367. 1444-8. doi: 10.1126/science.abb2762.
37. Bodro M., Compta Y., Sánchez-Valle R. Presentations and mechanisms of CNS disorders related to COVID-19. Neurol. Neuroimmunol. Neuroinflamm. 2020 Dec 11. 8(1). e923. doi: 10.1212/NXI.0000000000000923. PMID: 33310765; PMCID: PMC7808129.
38. Huang C., Wang Y., Li X. et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020. 395. 497-506.
39. Henderson L.A., Canna S.W., Schulert G.S. et al. On the alert for cytokine storm: immunopathology in COVID-19. Arthritis Rheumatol. 2020. 72. 1059-1063.
40. Reichard R., Kashani K.B., Boire N.A., Constantopoulos E., Guo Y., Lucchinetti C.F. Neuropathology of COVID-19: a spectrum of vascular and acute disseminated encephalomyelitis (ADEM)-like pathology. Acta Neropathol. 2020. 140. 1-6.
41. Mehta P., McAuley D.F., Brown M., Sanchez E., Tattersall R.S., Manson J.J. COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet. 2020. 395. 1033-1034.
42. Beyrouti R., Adams M.E., Benjamin L. et al. Characteristics of ischaemic stroke associated with COVID-19. J. Neurol. Neurosurg. Psychiatry. 2020. 91. 889-891.
43. Hess D.C., Eldahshan W., Rutkowski E. COVID-19-Related stroke. Transl. Stroke Res. 2020. 11. 322-325.
44. Helms J., Kremer S., Merdji H. et al. Neurologic features in severe SARS-CoV-2 infection. N. Engl. J. Med. 2020. 382. 2268-2270.
45. Richardson S., Hirsch J.S., Narasimhan M., et al. Presenting characteristics, comorbidities, and outcomes among 5700 patients hospitalized with COVID-19 in the New York City area. JAMA. 2020. 323. 2052-2059.
46. Al-Sarraj S., Troakes C., Hanley B., Osborn M., Richardson M.P., Hotopf M., Bullmore E., Everall I.P. Invited Review: The spectrum of neuropathology in COVID-19. Neuropathol. Appl. Neurobiol. 2021 Feb. 47(1). 3-16. doi: 10.1111/nan.12667. Epub 2020 Oct 20. PMID: 32935873.
47. Moriguchi T., Harii N., Goto J., Harada D., Sugawara H., Takamino J. et al. A first case of meningitis/encephalitis associated with SARS-Coronavirus-2. Int. J. Infect. Dis. 2020. 94. 55-8.
48. Huang Y.H., Jiang D., Huang J.T. SARS-CoV-2 detected in cerebrospinal fluid by PCR in a Case of COVID-19 Encephalitis. Brain Behav. Immun. 2020. 87. 149.
49. Dixon L., Varley J., Gontsarova A., Mallon D., Tona F., Muir D. et al. COVID-19-related acute necrotizing encephalopathy with brain stem involvement in a patient with aplastic anemia. Neurol. Neuroimmunol. Neuroinflamm. 2020. 7(5). e789.
50. Poyiadji N., Shahin G., Noujaim D., Stone M., Patel S., Griffith B. COVID-19-associated acute hemorrhagic necrotizing encephalopathy: CT and MRI features. Radiology. 2020. 201187.
51. Li Y., Wang M., Zhou Y., Chang J., Xian Y., Mao L. et al. Acute cerebrovascular disease following COVID-19: a single center, retrospective, observational study. Stroke Vasc. Neurol. 2020.
52. Lodigiani C., Iapichino G., Carenzo L., Cecconi M., Ferrazzi P., Sebastian T. et al. Venous and arterial thromboembolic complications in COVID-19 patients admitted to an academic hospital in Milan, Italy. Thromb. Res. 2020. 191. 9-14.
53. Klok F.A., Kruip M., van der Meer N.J.M., Arbous M.S., Gommers D., Kant K.M. et al. Incidence of thrombotic complications in critically ill ICU patients with COVID-19. Thromb. Res. 2020. 191. 145-7.
54. Zhao H., Shen D., Zhou H., Liu J., Chen S. Guillain-Barre syndrome associated with SARS-CoV-2 infection: causality or coincidence? Lancet Neurol. 2020. 19. 383-4.
55. Sedaghat Z., Karimi N. Guillain Barre syndrome associated with COVID-19 infection: a case report. J. Clin. Neurosci. 2020. 76. 233-5.
56. Toscano G., Palmerini F., Ravaglia S., Ruiz L., Invernizzi P., Cuzzoni M.G. et al. Guillain-Barre syndrome associated with SARS-CoV-2. N. Engl. J. Med. 2020. 382. 2574-6.
57. Domingues R.B., Mendes-Correa M.C., de Moura Leite F.B.V., Sabino E.C., Salarini D.Z., Claro I. et al. First case of SARS-COV-2 sequencing in cerebrospinal fluid of a patient with suspected demyelina-ting disease. J. Neurol. 2020. doi: 10.1007/s00415-020-09996-w.
58. Xu X.W., Wu X.X., Jiang X.G., Xu K.J., Ying L.J., Ma C.L. et al. Clinical findings in a group of patients infected with the 2019 novel coronavirus (SARS-Cov-2) outside of Wuhan, China: retrospective case series. BMJ. 2020. 368. m606.
59. Asadi-Pooya A.A., Simani L. Central nervous system manifestations of COVID-19. A systematic review. J. Neurol. Sci. 2020. 413. 116832.
60. Sudre C.H., Murray В., Varsavsky Т. et al. Attributes and predictors of Long-COVID: analysis of COVID cases and their symptoms collected by the Covid Symptoms Study App. medRxiv. 2020. https://doi.org/10.1101/2020.10.19.20214494.
61. Emergency use ICD codes for COVID-19 disease outbreak. World Health organisation. https://www.who.int/classifications/classification-of-diseases/emergency-use-icd-codes-for-covid-19-dise-ase-outbreak.
62. COVID-19 rapid guideline: managing the long-term effects of COVID-19. NICE guideline [NG188]. Published date: 18 December 2020. https://www.nice.org.uk/guidance/ng188/chapter/5-Management.
63. Goërtz Y.M.J., Van Herck M., Delbressine J.M., Vaes A.W., Meys R., Machado F.V.C. et al. Persistent symptoms 3 months after a SARS-CoV-2 infection: the post- COVID-19 syndrome? ERJ Open Res. 2020. DOI: 10.1183/23120541.00542-2020.
64. Long COVID: How to define it and how to manage it. BMJ. 2020. 370. m3489. doi: https://doi.org/10.1136/bmj.m3489.
65. Noor-Ul-Huda Maria, Ain Siddiq, Salman Yousuf. The Effects of COVID-19 on Hypothalamus: Is it Another Face of SARS-CoV-2 That May Potentially Control the Level of COVID-19 Severity? DOI: 10.13140/RG.2.2.24482.25289.
66. Lu Y., Li X., Geng D., Mei N., Wu P.Y., Huang C.C., Jia T., Zhao Y., Wang D., Xiao A., Yin B. Cerebral Micro-Structural Changes in COVID-19 Patients — An MRI-based 3-month Follow-up Study. EClinicalMedicine. 2020 Aug. 25. 100484. doi: 10.1016/j.eclinm.2020.100484. Epub 2020 Aug 3. PMID: 32838240; PMCID: PMC7396952.
67. Greenhalgh T., Knight M., A’Court C., Buxton M., Husain L. Management of post-acute covid-19 in primary care. Br. Med. J. 2020. 370. m3026. DOI: 10.1136/bmj.m3026.
68. Carvalho-Schneider C., Laurent E., Lemaignen A., Beaufils E., Bourbao-Tournois C., Laribi S. et al. Follow-up of adults with noncritical COVID-19 two months after symptom onset. Clin. Microbiol. Infect. 2020. DOI: 10.1016/j.cmi.2020.09.052.
69. Carfì A., Bernabei R., Landi F., Group ftGAC-P-ACS. Persistent Symptoms in Patients After Acute COVID-19. J. Am. Med. Assoc. 2020. 324(6). 603-605. DOI: 10.1001/jama.2020.12603.
70. Galea S., Merchant R.M., Lurie N. The Mental Health Consequences of COVID-19 and Physical Distancing: The Need for Prevention and Early Intervention. JAMA Intern. Med. 2020. 180(6). 817-818. DOI: 10.1001/jamainternmed.2020.1562.
71. Hampshire A., Trender W., Chamberlain S.R., Jolly A., Grant J.E., Patrick F. et al. Cognitive deficits in people who have recovered from COVID-19 relative to controls: An N = 84,285 online study. medRxiv 2020. DOI: 10.1101/2020.10.20.20215863.
72. Halpin S.J., McIvor C., Whyatt G., Adams A., Harvey O., McLean L. et al. Postdischarge symptoms and rehabilitation needs in survivors of COVID-19 infection: A cross-sectional evaluation. J. Med. Virol. 2020. 1-10. DOI: 10.1002/jmv.26368.
73. Cai X., Hu X., Ekumi I.O., Wang J., An Y., Li Z. et al. Psychological Distress and Its Correlates Among COVID-19 Survivors During Early Convalescence Across Age Groups. Am. J. Geriatr. Psychiatr. 2020. 28(10). 1030-1039. DOI: 10.1016/j.jagp.2020.07.003.
74. Guedj E., Campion J.Y., Dudouet P. 18F-FDG brain PET hypometabolism in patients with long COVID. Eur. J. Nucl. Med. Mol. Imaging. 2021. https://doi.org/10.1007/s00259-021-05215-4.
75. Bhadelia N., Belkina A.C., Olson А. et al. Distinct Autoimmune Antibody Signatures Between Hospitalized Acute COVID-19 Patients, SARS-CoV-2 Convalescent Individuals, and Unexposed Pre-Pandemic Controls. https://doi.org/10.1101/2021.01.21.21249176.
76. Becker R.C. COVID-19 and its sequelae: a platform for optimal patient care, discovery and training. J. Thromb. Thrombolysis. 2021. https://doi.org/10.1007/s11239-021-02375-w.
/12.jpg)
/13.jpg)

/9.jpg)