Інфекції центральної нервової системи (ЦНС) є основною причиною судом і набутої епілепсії в низці регіонів світу [1, 2]. Гострі напади часто відбуваються при тяжкому менінгіті, вірусному енцефаліті, малярії і нейроцистицеркозі, і вони пов’язані зі збільшенням смертності й захворюваності, включно з розвитком епілепсії. Збудливість нейронів, вторинна щодо прозапальних сигналів, викликаних інфекціями ЦНС, є важливим загальним механізмом генерації судом на додаток до інших специфічних механізмів [3]. Загальний ризик розвитку епілепсії внаслідок інфекцій ЦНС становить 3 %, але захворюваність значно відрізняється в різних регіонах через превалювання різних патернів інфекційних уражень ЦНС у світі [4, 5].
Інфекції ЦНС призводять до 15 % усіх випадків new-onset симптоматичних епілептичних нападів, а 20-річний ризик розвитку епілептичних нападів і епілепсії після перенесених інфекцій становить від 2,4 до 22 %. Ризик залежить від етіології інфекції, локалізації ураження й тяжкості. Високий ризик розвитку епілепсії відмічається при герпетичних енцефалітах і нейроСНІДі. Ризик значно збільшується з появою нападів у гострому періоді інфекцій ЦНС, і особливо при розвитку епілептичного статусу [5].
Напади, пов’язані з інфекціями ЦНС, можуть бути як гострими симптоматичними, так і непровокованими епілептичними нападами. Гострі симптоматичні напади виникають у тісному часовому зв’язку з гострою інфекцією ЦНС у 31 % випадків, як правило, протягом перших 7 днів, іноді навіть пізніше, але завжди під час гострого інфекційного процесу, і зазвичай не повторюються; однак існує підвищений ризик розвитку епілепсії в майбутньому [6]. Ризик розвитку епілепсії після інфекцій ЦНС становить від 6,8 до 8,3 % (у розвинених країнах) і є набагато вищим у країнах з низьким рівнем життя (так, у країнах Центральної Африки він досягає 26 %). Вірусні інфекції становлять майже половину таких випадків.
Вірусні інфекції ЦНС можуть перебігати у вигляді як легких, часто субклінічних менінгітів, так і тяжких гострих вірусних енцефалітів, смертність при яких досягає 70 % за відсутності адекватного лікування. Ризик розвитку епілепсії як наслідку вірусного енцефаліту збільшується в 7–10 разів. Такий ризик підвищується у 22 рази порівняно з преморбідним ризиком у пацієнтів, які перенесли ранні напади в гострому періоді. У більшості випадків напади розвиваються протягом 5 років після гострої інфекції, але можливі випадки маніфестації епілепсії і через 15 років. Вірогідних даних про підвищення ризику епілепсії після вірусних менінгітів немає [7, 8].
Пацієнти з ранніми судомами при енцефаліті мають сукупний ризик розвитку епілепсії 10 % — до 5 років і 22 % — до 20 років; цей ризик приблизно вдвічі більший, ніж у пацієнтів з енцефалітом, у яких не було ранніх нападів. У пацієнтів з постенцефалітичною епілепсією часто розвиваються резистентні мультифокальні епілептичні напади [10–14].
ВІЛ і СНІД
Залучення до патологічного процесу ЦНС реєструється в 90 % серопозитивних пацієнтів, крім того, у 5–10 % випадків захворювання маніфестує саме неврологічною симптоматикою. Епілептичні напади можуть бути наслідком ураження ВІЛ-інфекцією, але частіше вони є результатом розвитку опортуністичних інфекцій, прийому противірусної терапії, відміни алкоголю, наркотичних препаратів, системних захворювань [3, 10].
Зі збільшенням тягаря ВІЛ-інфекції у світі роль набутого імунодефіциту в розвитку гострих судом та епілепсії зростає. Хоча епілептичні напади зазвичай трапляються на пізній стадії захворювання, вони можуть виникати будь-коли; генералізовані напади трапляються частіше, ніж фокальні. У дорослих більшість нападів є вторинними щодо опортуністичних інфекцій ЦНС, таких як токсоплазмоз, криптококовий менінгіт і туберкуломи; а деякі є вторинними щодо неінфекційних причин (лімфома й прогресуюча мультифокальна лейкоенцефалопатія) [11].
Єдиної думки про частоту епілептичних нападів у ВІЛ-позитивних пацієнтів немає, і різні автори наводять показники від 2 до 20 % хворих. Причому більшість відзначає молодий вік пацієнтів з епілептичними нападами (32,1 ± 7,5 року) і наявність нейроВІЛ з ураженням головного мозку [12, 13]. У 2/3 випадків епілептичні напади генералізовані й розвиваються на тлі дифузного ураження головного мозку (менінгоенцефаліт, ВІЛ-енцефалопатія). Висока поширеність епілептичного статусу (8–18 %) асоціюється з поганим прогнозом [8, 13].
Опортуністичні інфекції (енцефаліти, викликані вірусом простого герпесу, токсоплазмоз, бактеріальні менінгіти), що розвиваються на пізніх стадіях захворювання, є причиною епілептичних нападів у 93 % випадків: мономікробні — 77 % і полімікробні — 16 %; неінфекційні ураження головного мозку — у 3 % пацієнтів [13]. Свій внесок у розвиток нападів і епілептичного статусу роблять також електролітні й метаболічні порушення (гіпонатріємія, гіпомагнезіємія, ниркові порушення). Наступною причиною епілептичних нападів у пацієнтів зі СНІДом є прогресуюча мультифокальна лейкоенцефалопатія і первинна лімфома. Електроенцефалографічні зміни в пацієнтів з ВІЛ і СНІДом зазвичай неспецифічні (регіональне й дифузне уповільнення, можливі періодичні латералізовані епілептиформні зміни — PLEDs), що можуть бути предиктором розвитку епілептичних нападів і енцефалопатії в майбутньому, але ці дані потребують подальшої систематизації [12, 14].
У різних дослідженнях показано, що майже половина ВІЛ-серопозитивних пацієнтів з епілептичними нападами не мають органічних уражень головного мозку й супутніх захворювань, і в таких випадках вважається, що сама ВІЛ-інфекція є причиною розвитку судом [15]. Вважається, що наявність ВІЛ або імунопов’язаних токсинів при пошкодженні або загибелі нейронів призводить до продукції нейротоксичних субстанцій (ейкозаноїдів, тромбоцит-активуючого фактора, квінолінату, цистеїну, цитокінів і вільних радикалів), що наприкінці цілого каскаду реакцій викликає підвищення глутаматної активності, активації вольтаж-залежних кальцієвих каналів і NMDA-рецепторів, вхід кальцію в клітину і клітинну загибель. Результатом такого дисбалансу збуджуючої та інгібіторної нейротрансмісії і може бути розвиток епілептичної активності [8, 16].
У ВІЛ-позитивних пацієнтів ризик повторення нападів після першого епізоду становить понад 70 %, тому призначення протиепілептичного препарату (ПЕП) необхідне вже після першого нападу [8, 10]. Ризик розвитку небажаних явищ і лікарських взаємодій у таких хворих дуже високий. Взаємодії між ПЕП та антиретровірусними препаратами, а також іншими лікарськими засобами у ВІЛ-позитивних пацієнтів зазвичай невідомі. ПЕП і антиретровірусні препарати, імовірно, мають множинні механізми взаємодії, такі як конкурентне зв’язування з протеїнами, підвищення/зниження активності печінкових ферментів, підвищення вірусної реплікації. Думки більшості дослідників збігаються щодо того, що леветирацетам, клобазам і габапентин мають найменші взаємодії з антиретровірусними препаратами і можуть бути рекомендовані ВІЛ-позитивним хворим.
Вірусні енцефаліти
Вірусні енцефаліти викликаються багатьма як відомими, так і невстановленими вірусними агентами. Під цим терміном ми розуміємо гострі вірусні енцефаліти, постінфекційні енцефаломієліти, повільні вірусні інфекції ЦНС і хронічні дегенеративні захворювання ЦНС, щодо яких передбачається вірусна етіологія [17].
Вірусний енцефаліт — часта причина епілептичних нападів, особливо в дітей. Понад 100 вірусів можуть спричинити енцефаліт; однак через неспецифічний характер хвороби й відсутність надійних засобів діагностики етіологія в більшості випадків залишається не виявленою [18, 19].
Поширеність вірусних енцефалітів значно змінюється залежно від географічного регіону. У західноєвропейських розвинених країнах реєструється близько 10,5 випадку на 100 000 дітей і 2,2 випадку на 100 000 дорослих осіб [20]. Більшість випадків епідемічного енцефаліту пов’язані з арбовірусами і мають характерний географічний розподіл як між країнами, так і всередині них. Для України значний інтерес становлять спорадичні (неспецифічні) енцефаліти.
Спорадичні форми вірусних енцефалітів: герпесвірусні (herpes simplex virus 1-го i 2-го типу (HSV-1 i HSV-2), herpes varicella zoster (VZV), human herpesvirus 6 (HHV-6), Epstein-Barr virus (ЕВV), cytomegalovirus (CMV)), РНК-віруси (measles, mumps, influenza), ентеровіруси (Сoxsackie viruses, echoviruses). Герпесвірусні енцефаліти, що є найчастішими спорадичними енцефалітами, викликають високу смертність і мають тяжкі наслідки.
Клінічні ознаки захворювання
Вірусні енцефаліти характеризуються гострим початком, значною гіпертермією, головним болем, нудотою, сонливістю та іншими неспецифічними симптомами, що характерні для інфекційного захворювання, також розвивається симптоматика лептоменінгеальної іритації. Розвиток вірусної інфекції супроводжується набряком паренхіми мозку, нейрональною і гліальною дегенерацією, запальною інфільтрацією, некротичними змінами. Рання неврологічна симптоматика може проявлятися поведінковими розладами (ажитація, збентеженість, дратівливість, розлади мовлення, дисфазія), геміпарези розвиваються в третині випадків. Часто тільки тоді, коли в пацієнта розвиваються епілептичні напади, ступор або кома, діагностується тяжке захворювання [4, 5].
Герпесвірусні ураження (HSV-1 i HSV-2, цитомегаловірус, вірус вітряної віспи, вірус Епштейна — Барр, людський вірус герпесу 6-го типу) вірогідно діагностуються за допомогою полімеразної ланцюгової реакції (ПЛР). При неможливості ранньої диференціальної ПЛР-діагностики вірусного й бактеріального ураження й за наявності характерної клінічної картини рекомендовано ранній початок лікування комбінацією противірусних препаратів (ацикловір) і антибіотиків широкого спектра дії.
Герпесвірусні інфекції
Вірус простого герпесу (HSV-1 i HSV-2) є найбільш частим чинником, що викликає спорадичний (неепідемічний) енцефаліт. HSV-1-енцефаліт є найчастішою формою в дітей старше від 3 місяців і в дорослих осіб, що становить понад 20 % усіх вірусних енцефалітів. Ураження превалює в скроневих і фронтотемпоральних ділянках. HSV-2 превалює в немовлят і передається від інфікованої матері під час пологів, генітальне ураження HSV-2 виявляється в 85 % таких випадків [21]. У дорослих HSV-2-енцефаліт частіше розвивається за наявності імуносупресії (частіше при ВІЛ).
У більшості випадків HSV-1-енцефаліт є результатом реактивації латентної інфекції, особливо в осіб похилого віку. Первинні випадки інфікування виявляються в 1/3 пацієнтів молодого віку (до 20 років). Причини реактивації латентної інфекції в імунокомпетентних пацієнтів невідомі.
Вірус простого герпесу 1-го типу є найпоширенішою причиною спорадичного енцефаліту і причиною епілептичних нападів у понад 50 % хворих. Схильність вірусу простого герпесу 1-го типу до ураження мезіальної скроневої частки, включно з гіпокампом, пояснює високу частоту нападів. HSV-1 також призводить до латентної і стійкої інфекції з пізніми рецидивами й реактивацією. Пізні непровоковані судоми й епілепсія трапляються в 42–60 % хворих і часто є резистентними.
Дані нейровізуалізації (магнітно-резонансної томографії (МРТ)) часто не визначають патології на першому тижні захворювання. Пізніше характерними МРТ-ознаками є підвищення інтенсивності сигналу, набряк, геморагії, вогнища ураження сірої/білої речовини в скроневій частці корі острівця, цингулярній корі. Дифузно-зважена МРТ може використовуватись для виявлення ранніх уражень [22].
Треба відзначити, що електроенцефалографічні зміни (ЕЕГ) наявні в більшості пацієнтів з герпетичним енцефалітом, але тільки 40 % пацієнтів мають епілептичні напади в гострому періоді. Найбільш частим є дифузне високоамплітудне уповільнення в скроневих регіонах, можлива наявність фокальної темпоральної або латералізованої дельта-активності з PLEDS, що повторюються з інтервалом 1–5 секунд переважно в скроневих регіонах протягом 4 тижнів від початку захворювання. Такі комплекси можуть бути унілатеральними або білатеральними, синхронними/асинхронними і зазвичай супроводжують поширення патології на ураженій стороні. Ці зміни є однією з діагностичних ознак HSV-енцефаліту. У дітей можуть бути нетипові риси, генералізовані судоми і відсутність PLEDs [5, 22].
Нелікований HSV-енцефаліт призводить до смерті хворого в 70 % випадків, при належному лікуванні — у середньому у 20 % випадків, а ранній початок лікування знижує смертність до 10 %. Епілепсія розвивається частіше за наявності ураження скроневої частки. Напади переважно фокальні з еволюцією в двобічні тоніко-клонічні судоми або без неї, характерні порушення поведінки від початку захворювання. У значній кількості випадків епілептичний напади резистентні до протиепілептичних препаратів, за наявності операбельного вогнища успішним є хірургічне лікування. Наявні дослідження, що свідчать про можливість тривалого персистування герпесвірусної інфекції (хронічний герпесвірусний енцефаліт) у хворих з резистентною епілепсією.
Лікування епілептичних нападів у гострому періоді значною мірою визначає подальший прогноз, оскільки неконтрольовані напади в гострому періоді є чинниками несприятливого прогнозу захворювання [23, 24].
Вірус Епштейна — Барр є дуже поширеним у людській популяції, дослідження свідчать, що більшість осіб інфікуються до досягнення віку 40 років. У дитячій популяції цей вірус рідко викликає клінічні прояви, у підлітків в 1/3–1/2 випадків розвивається інфекційний мононуклеоз.
Залучення ЦНС в інфекційний процес відбувається досить рідко, але може призводити до розвитку енцефаліту, асептичного менінгіту, менінгоенцефаліту. Вірус EBV є причиною 5 % усіх випадків вірусних енцефалітів, частіше розвивається у дітей або імуноскомпрометованих дорослих. Зазвичай пацієнти з EBV-енцефалітом не мають симптомів, типових для інфекційного мононуклеозу. Захворювання маніфестує неспецифічним продромом і судомами [17, 25]. Епілептичні напади відзначають в 36–48 % випадків у педіатричній популяції [26], розвиток епілептичного статусу в гострій стадії захворювання нехарактерний. Епілепсія, на думку багатьох дослідників, розвивається в 1/3 випадків.
Людський вірус герпесу 6-го типу, так само, як і EBV, значно поширений, первинне інфікування відбувається в дитинстві з класичними проявами у вигляді лихоманки, слабкості, кашлю, класичної висипки (roseola infantum), симптоматика зазвичай нетривка. Однак HHV-6 нерідко асоціюється з фебрильними нападами в дітей віком до 5 років, що спостерігаються в 5 % інфікованих дітей, інфікування HHV-6 виявляють у 1/3 дітей до 2 років з фебрильними судомами. У подальшому у 2 % таких дітей діагностується епілепсія. Енцефаліти HHV-6 здебільшого розвиваються за наявності імуносупресії (пацієнти після трансплантації, ВІЛ-інфіковані тощо) і мають тяжкий перебіг і несприятливий прогноз (смертність до 50 %) [5, 17].
Цитомегаловірусний енцефаліт є однією з найбільш частих опортуністичних інфекції у ВІЛ-інфікованих пацієнтів і досить рідко діагностується в імунокомпетентних осіб. Захворювання маніфестує лихоманкою, головним болем, розвиваються сплутаність свідомості, дисфазія, парез краніальних нервів, епілептичні напади, можлива кома. У гострій стадії на МРТ часто визначається перивентрикулярний набряк і підвищення сигналу у фронтальних і парієтальних регіонах на Т2-зважених зображеннях. В імунокомпетентних осіб персистування епілептичних нападів після одужання є нетиповим. У пацієнтів з ураженням імунної системи часто розвивається епілепсія, а в дітей із симптоматичним конгенітальним CMV — в 20–25 % випадків [5, 17].
Вірус вітряної віспи є другою за частотою причиною розвитку вірусного енцефаліту, що діагностується в 1 : 2000 інфікованих осіб з однаковою частотою в дорослих і дітей, має високий ризик смерті — до 15 % навіть в імунокомпетентних хворих. Енцефаліт може розвиватися як складова клінічних проявів вітряної віспи з класичними енцефалітичними проявами через тиждень після появи везикулярної висипки, а також як реактивація латентної інфекції (через роки після вітряної віспи), частіше в імуноскомпрометованих пацієнтів. Епілептичні напади є найбільш частим клінічним проявом і спостерігаються в 29–52 % у гострій стадії захворювання. Визначають два основних механізми ураження при VZV-енцефаліті — це пряма пошкоджуюча дія вірусу й розвиток автоімунного енцефаліту у відповідь на вірусну агресію [27]. При МРТ-дослідженні виявляються множинні ішемічні вогнища (васкуліт) з підвищенням сигналу субкортикально [22].
РНК-віруси
Кір часто залучає в патологічний процес ЦНС, вірус кору може викликати гострий енцефаліт, підгострий склерозуючий паненцефаліт, частіше в дітей шкільного віку. Енцефаліт розвивається в 1 на 1000 випадків кору зазвичай через тиждень від початку захворювання. Ризик смерті становить до 15 %, а тяжкі неврологічні наслідки — епілепсія, когнітивний дефіцит — спостерігаються в 1/3 випадків [28, 29]. У цереброспінальній рідині (ЦСР) при енцефаліті визначається помірний плеоцитоз, антитіла до вірусу кору відсутні.
Підгострий склерозуючий паненцефаліт — рідкісне прогресуюче дегенеративне захворювання, що розвивається в 1 на 100 000 випадків кору. Розвивається в дітей і молодих дорослих осіб у середньому через 7 років після перенесеного кору. Захворювання прогресує, перебіг дуже варіабельний, але смерть у більшості випадків настає через 1–3 роки. Клінічна картина характеризується тяжкими міоклонічними нападами, прогресуючою деменцією і моторним дефіцитом. У ЦСР визначається високий рівень антитіл до вірусу кору. На МРТ показовими є значні зміни білої речовини й тяжка церебральна атрофія [19, 22].
Інфекційний паротит. Менінгіти внаслідок інфекційного паротиту розвиваються в 10 % усіх інфікованих, причому тяжкість перебігу первинного захворювання (паротиту) майже не впливає на розвиток ураження ЦНС. Захворювання характеризується тяжким перебігом, високою смертністю й розвитком неврологічних наслідків. Паротитний енцефаліт — рідкісне ускладнення (0,1 %). Першими симптомами зазвичай є епілептичні напади, порушення свідомості і фокальні неврологічні симптоми, що частіше розвиваються в дорослих осіб [30].
Грип (influenza). Обидва штами (А і В) можуть викликати фебрильні судоми й пов’язані з ризиком розвитку енцефаліту, але штам А визначає більш високий ризик неврологічних наслідків. Вірус А асоціюється з розвитком фебрильних нападів у 20 % дітей. Енцефаліт є нетиповим ускладненням вірусу А. Ризик захворюваності і смертності під час епідемій значний і становить 27–50 % і 31 % відповідно. Вакцинація знижує ризик розвитку фебрильних судом.
Ентеровіруси. Група людських ентеровірусів включає поліовіруси, віруси Коксакі, ентровірус-71, що передаються фекально-оральним і гематогенним шляхом. Зазвичай вірусна реплікація відбувається в гастроінтестинальному тракті, але під час віремічної фази також можливе ураження інших систем (ЦНС, міокард, мозкові оболонки, шкіра), інкубаційний період становить від 2 до 40 діб. Усі людські ентеровіруси асоціюються з асептичним менінгітом. Частим ускладненням вірусної інфекції в дітей є фебрильні судоми. Лікування ентеровірусної інфекції проводять специфічним імуноглобуліном, але він має низьку проникність до ЦНС. Тяжкі неврологічні наслідки й епілепсія розвиваються рідко [5, 17].
Механізми розвитку епілептичних нападів і епілепсії при вірусних ураженнях ЦНС
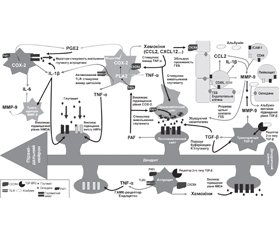
Механізми розвитку епілептичних нападів і епілепсії після інфекцій ЦНС недостатньо визначені. Такі структурні пошкодження, як кортикальний некроз при ураженні вірусом простого герпесу, інфаркт при менінгіті, гіпоксично-ішемічна травма при церебральній малярії і гліоз, можуть утворювати епілептогенні вогнища. Тривала стимуляція прозапальних сигналів як хронічним запаленням, так і самими судомами може призвести до залишкового патологічного стану, такого як пошкодження гематоенцефалічного бар’єра, загибель нейронів і стійка гіперзбудливість нейронів, — усе це може сприяти епілептогенезу (рис. 1) [8].
Запальний каскад призводить до руйнування гематоенцефалічного бар’єра, набряку мозку, підвищеного внутрішньочерепного тиску, церебральних крововиливів та інфарктів, що сприяє розвитку епілептичних нападів. Гіпертермія, пов’язана з різними інфекціями ЦНС, сама по собі може призвести до гіперзбудливості нейронів. Нейротоксини, такі як хінолінова кислота, автоантитіла проти рецепторів глутамату і N-метил-D-аспартату, зміни функції кальцієвих і калієвих каналів, вплив антифосфоліпідних, антикардіоліпінових та антинуклеарних антитіл вважаються іншими механізмами, що відповідають за судоми [16, 31].
/77.jpg)
Отже, вірусні інфекції часто ускладнюються епілептичними нападами в гострій фазі захворювання (ранні напади) і визначають підвищений ризик розвитку епілепсії в подальшому. Механізми розвитку ранніх і пізніх судом різні. За винятком герпетичного енцефаліту (herpes simplex), при якому ризик епілепсії за наявності ранніх нападів становить до 60 %, ризик розвитку пізніх судом при інших вірусних енцефалітах точно не з’ясований. Своєчасне лікування вірусної інфекції і ранніх судом може знизити ризик розвитку епілепсії [3, 8, 22].
Ризик постенцефалітної епілепсії зростає у 22 рази в осіб з нападами в гострій стадії енцефаліту порівняно зі зростанням у 10 разів в осіб без гострих нападів [9, 32]. Більшість неспровокованих судом виникає протягом перших 5 років після епізоду енцефаліту, але ризик маніфестації нападів зберігається протягом 20 років і більше. Хворі з епілептичним статусом, повільною фоновою активністю й мультифокальними спайками на ЕЕГ, ВІЛ-позитивні та особи з HSV-1-енцефалітом мають значно вищий ризик розвитку резистентної епілепсії [33–36].
Лікування
Лікування епілепсії, що виникла внаслідок інфекційного ураження ЦНС, аналогічне лікуванню інших симптоматичних епілепсій, а протиепілептичний препарат обирається відповідно до семіології нападів.
Перед початком лікування необхідно відповісти на низку конкретних питань:
1. Яка взаємодія між ПЕП і протиінфекційною терапією?
2. Чи може раннє лікування основної інфекції ЦНС запобігти розвитку судом та епілепсії або змінити їх перебіг?
3. Чи існують інші способи лікування для зменшення частоти нападів та епілепсії при інфекціях ЦНС?
4. Яка оптимальна тривалість терапії ПЕП?
Взаємодія між ПЕП і протиінфекційною терапією може суттєво змінити рівень кожного препарату, що призведе або до зниження ефективності, або до токсичності. Це особливо важливо для осіб з ВІЛ, у яких антиретровірусні засоби вступають у значну взаємодію з ПЕП. Оскільки напади та епілепсія часто пов’язані з тяжкістю й ускладненнями основної інфекції, видається логічним, що рання ефективна терапія інфекційного захворювання може запобігти розвитку пізніх судом та епілепсії. Однак систематичних досліджень, що підтверджують це, немає. Оскільки генерація судом при більшості інфекцій ЦНС пов’язана із запальною реакцією, можна припустити можливість зменшення судом при застосуванні протизапальних засобів і противірусної терапії [37, 39].
Тривалість протиепілептичної терапії неодноразово обговорювалась, але рекомендацій, заснованих на фактичних даних, немає. При ВІЛ-інфекції гострі напади мають значну тенденцію до рецидивів, отже, ПЕП призначають протягом тривалого періоду часу, також і при герпетичних енцефалітах. Інші вірусні ураження значно рідше викликають епілепсію в подальшому, отже, тривалість терапії ПЕП залежить від кількох факторів і потребує індивідуалізації [8, 38–40].
Отже, лікування епілепсії після перенесеного вірусного ураження ЦНС має проводитися за такими правилами:
1. Раннє й ефективне лікування вірусної інфекції.
2. Призначення ПЕП відповідно до типу епілептичних нападів.
3. Перевага віддається ПЕП широкого спектра дії з мінімально можливими взаємодіями з іншими лікарськими засобами, які отримує пацієнт.
4. Вибір ПЕП, які не мають гепатотоксичної дії (наскільки це можливо) і не індукують печінкові ферменти.
5. Перевага віддається ПЕП з можливістю швидкої титрації дози з урахуванням можливого розвитку епілептичного статусу при низці вірусних енцефалітів.
6. Тривалість лікування визначається індивідуально й певною мірою залежить від перенесеної вірусної інфекції.
Таким вимогам найкраще відповідає леветирацетам, що майже не має міжлікарських взаємодій з противірусними препаратами, не метаболізується в печінці, може відразу призначатися в терапевтичній дозі, має широкий спектр дії на всі типи нападів.
Конфлікт інтересів. Не заявлений.
UA-LEVI-PUB-042021-062
Отримано/Received 02.02.2021
Рецензовано/Revised 18.02.2021
Прийнято до друку/Accepted 22.02.2021
Список литературы
1. Bhalla D., Godet B., Druet-Cabanac M. et al. Etiologies of epilepsy: a comprehensive review. Expert Rev. Neurother. 2011. 11. 861-876.
2. Fujiwara T., Shigematsu H. Etiologic factors and clinical features of symptomatic epilepsy: focus on pediatric cases. Psychiatry Clin. Neurosci. 2004. 58. S9-S12
3. Singh T.D., Fugate J.E., Hocker S.E., Rabinstein A.A. Postencephalitic epilepsy: Clinical characteristics and predictors. Epilepsia. 2015. 56(1). 133-138.
4. Sander J.W., Hart Y.M., Johnson A.I., Shorvon S.D. National general practice Study of Epilepsy: newly diagnosed epileptic seizures in general population. Lancet. 1990. Vol. 336. P. 1267-1271.
5. The Treatment of Epilepsy. Ed. by S.D. Shorvon, E Perukka, J. Engel. 3rd edition. Blackwell Publishing Ltd, UK, 2009. 1075 p.
6. Ziai W.C., Lewin J.J. Update in the diagnosis and management of central nervous system infections. Neurol. Clin. 2008. 26. 47-68.
7. Duncan J.S., Shorvon S.D., Fish D.R. Clinical Epilepsy. London: Churchill Livingstone, 1995. 540 p.
8. The Causes of Epilepsy. Ed. by Shorvon S.D., Andermann F., Guerrini R. Cambridge, UK: Cambridge Univers. press, 2011. 787 p.
9. Annegers J.F., Hauser W.A., Beghi E. et al. The risk of unprovoked seizures after encephalitis and meningitis. Neurology. 1988. 38. 1407-1410.
10. Satishandra P., Sinha S. Seizures in HIV seropositive individuals: NIMHANS experience and review. Epilepsia. 2008. Vol. 49. P. 33-41.
11. Mintz M. Clinical comparison of adult and pediatric neuro-AIDS. Adv. Neuroimmunol. 1994. 4. 207-21.
12. Kellingaus C., Engbring C., Kovac S. et al. Frequency of seizures and epilepsy in neurological HIV-infected patients. Seizure. 2008. Vol. 17. P. 23-33.
13. Sinha S., Satishandra P., Nalini at al. New-onset seizures among HIV infected drug naïve patients from south India. Neurology Asia. 2005. Vol. 10. P. 29-33.
14. Cury R.F., Wichert-Ana L., Sacamoto A.C., Fernandes R.M. Focal non-convulsive status epilepticus associated to PLEDs and intense focal hyperemia in an AIDS patient. Seizure. 2004. Vol. 13. P. 358-361.
15. Wong M.C., Suite N.D.A., Labar D.R. Seizures in human immunodeficiency virus infection. Arch. Neurol. 1990. Vol. 47. P. 640-642.
16. Udgicar V.S., Tullu M.S., Bavdecar S.B. et al. Neurological manifestations of HIV infection. Ind. Pediatr. 2003. Vol. 40. P. 230-234.
17. Zelano J., Westman G. Epilepsy after brain infections in adults: A register-based population-wide study. Neurology. 2020 Sep 28. doi: 10.1212/WNL.0000000000010954. Online ahead of print.
18. Granerod J., Crowcroft N.S. The epidemiology of acute encephalitis. Neuropsychol. Rehabil. 2007. 17. 406-28.
19. Singhi P. Infectious causes of seizures and epilepsy in the developing world. Developmental Medicine & Child Neurology. Mac Keith Press, 2011. P. 600-609.
20. Jmor F., Emsley H.C., Fosher M., Solomon T., Lewthwaite P. The incidence of acute encephalitis syndrome in Western industrial and tropical countries. Virol. J. 2008. Vol. 5 . P. 134-136.
21. Whitley R.J. Herpes simplex encephalitis: adolescents and adults. Antiviral Res. 2006. Vol. 71. P. 141-148.
22. Solomon T., Hart I.J., Beeching N.J. Viral encephalitis: a clinical guide. Pract. Neurol. 2007. Vol. 7. P. 288-305.
23. Yamada S., Kameyama T., Nagava S., Hashizume Y., Yoshida M. Relapsing herpes simplex encephalitis: pathological confirmation of viral reactivation. Neurol. Neurosurg. Psychiatry. Vol. 74. P. 262-264.
24. Kim M.A., Park K.M., Kim S.E., Oh M.C.K. Acute sympto-matic seizures in CNS infection. 2008. Vol. 15. P. 38-41.
25. Doja A., Bitnum A., Jones E.L. et al. Pediatric Epstein-Barr virus-associated encephalitis: 10 year review. J. Child. Neurol. 2006. Vol. 21. P. 385-391.
26. Hung K.L., Liao H.T., Tsai M.L. Epstein-Barr virus encephalitis in children. Acta Paediatr. Taiwan. 2000. Vol. 41. P. 140-146.
27. Hausler M., Schaade L., Kemeny S. et al. Encephalitis related to primery varicella-zoster virus infection in immunocompetent children. J. Neurol. Sci. 2002. Vol. 195. P. 111-116.
28. Perry R.T., Halsey N.A. The clinical significance of measles: a review. J. Infect. Dis. 2004. Vol. 189. P. 4-16.
29. Cherry J.D. Measles virus. Feigin R.D., Cherry J.D. (eds.) Textbook of Pediatric Infectious Diseases, 5th edition. Philadelphia, PA: WB Saunders, 2004. P. 2283-2299.
30. Hviid A., Rubin S., Mihlemann K. Mumps. Lancet. 2008. Vol. 371. P. 932-944.
31. Vincent A., Irani S.R., Lang B. Potentially pathogenic autoantibodies associated with epilepsy and encephalitis in children and adults. Epilepsia. 2011. 52(Suppl. 8). 8-11. doi: 10.1111/j.1528-1167.2011.03224.
32. Granerod J., Cunningham R., Zuckerman M. et al. Causa-lity in acute encephalitis: defining aetiologies. Epidemiol. Infect. 2010. 138. 783-800.
33. Chen Y.J., Fang P.C., Chow J.C. Clinical characteristics and prognostic factors of postencephalitic epilepsy in children. J. Child Neurol. 2006. 21. 1047-51.
34. Pillai S.C., Mohammad S.S., Hacohen Y. et al. Postencephalitic epilepsy and drug-resistant epilepsy after infectious and antibody-associated encephalitis in childhood: clinical and etiologic risk factors. Epilepsia. 2015. Epub 2015 Nov 22.
35. Armangue T., Moris G., Cantarın-Extremera V. et al. Autoimmune post-herpes simplex encephalitis of adults and teenagers. Neuro-logy. 2015. 85. 1736-1743.
36. Bradshaw M.J., Pawate S., Lennon V.A. et al. Herpes simplex virus 1 encephalitis associated with voltage-gated calcium channel autoimmunity. Neurology. 2015 Dec 15. 85(24). 2176-7.
37. Titulaer M.J., McCracken L., Gabilondo I. et al. Treatment and prognostic factors for long-term outcome in patients with anti-NMDA receptor encephalitis: an observational cohort study. Lancet Neurol. 2013. 12. 157-165.
38. Spatola M., Dalmau J. Seizures and risk of epilepsy in autoimmune and other inflammatory encephalitis. Curr. Opin. Neurol. 2017 June. 30(3). 345-353. doi: 10.1097/WCO.0000000000000449.
39. Murthy J.M.K., Prabhakar S. Bacterial meningitis and epilepsy. Epilepsia. 2008. 49 (Suppl. 6). 8-12. doi: 10.1111/j.1528-1167.2008.01750.
40. Gaspard N., Foreman B.P., Alvarez V. et al. New-onset refractory status epilepticus: etiology, clinical features, and outcome. Neurology. 2015. 85. 1604-1613.

/77.jpg)