Резюме
Актуальність. Лікування патології суглобів як дегенеративного, так і травматичного генезу — процес тривалий, багатокомпонентний, завжди вимагає спільних зусиль лікаря та пацієнта. Вибір оптимальних засобів терапії складний та неоднозначний. Біологічно активні речовини — одні з потужних засобів боротьби із запальним процесом, що є постійним супутником пошкодження. Завдяки своїм антиоксидантним, імуномодулюючим та регенеративним властивостям фрагменти плаценти визнані перспективним засобом лікування артропатій різної етіології. Мета дослідження — визначення морфологічних характеристик складових структур колінних суглобів щурів у нормі в умовах експериментального артриту та після введення кріоконсервованої плаценти. Матеріали та методи. Експериментальне дослідження проводилось на 115 білих щурах. З інтактною групою (10 тварин) порівнювались 3 контрольні групи по 35 тварин кожна, яким виконувались: 1) моделювання каргінаніндукованого асептичного запалення колінного суглоба; 2) підшкірна імплантація фрагмента плаценти; 3) підшкірна імплантація фрагмента плаценти на фоні асептичного запалення колінного суглоба. Гістологічні препарати готували за загальними методиками із забарвленням гематоксиліном та еозином та за Ван Гізоном. Результати. При створенні запального вогнища зміни в хрящовій тканині визначались із третьої доби у вигляді лакунарності, каріопікнозу як етап некробіозу хондроцитів, що був особливо виражений із 10-ї до 14-ї доби. Морфологічні зміни кісткової тканини щурів, яким вводився ƛ-карагінан, відмічались на 7-му добу дослідження у вигляді резорбції та деструкції кісткових балок. У подальшому (10-та доба) запальний процес призводив до картини фрагментованої архітектоніки кісткової тканини, що спостерігалась до 21-ї доби. Із боку синовіальної оболонки спостерігаються гіперплазія ворсин, лімфоїдна інфільтрація, поява додаткових шарів синовіїцитів як результат проліферативної реакції. Найбільш виражені зміни спостерігались у покривному шарі синовіальної оболонки. При однократному введенні кріоконсервованої плаценти ознаки запалення вірогідно зменшувались: обмежувалась площа деструкції хряща та кістки, у синовіальній оболонці знижувались ознаки мукоїдного набухання. Процеси функціонального кровонаповнення мікроциркуляторного русла переважали над ішемічними. Стимуляція регенеративних процесів забезпечувала структурне відновлення на 21-шу добу спостереження. Висновки. Препарати кріоконсервованої плаценти впливають на перебіг запального процесу в умовах експериментального остеоартриту. Найбільш вірогідний терапевтичний ефект визначається з боку синовіальної оболонки.
Background. Treatment of joint pathology, both degenerative and traumatic, is a long, multicomponent process that requires joint efforts of the doctor and the patient. The choice of the optimal therapy is complex and ambiguous. Biologically active compounds are one of the most powerful things for fighting with inflammatory process, which is a constant companion of damage. Due to their antioxidant, immunomodulatory and regenerative properties, placental fragments were admitted as a perspective treatment for arthropathies of various etiologies. Purpose of the research: to determine the morphological characteristics of the constituent structures of the knee joints of rats in a comparative aspect under normal conditions, in experimental arthritis and after exposure to a cryopreserved placenta. Material and methods. An experimental study was carried out on 115 white rats. With the intact group (10 animals) we compared 3 control groups of 35 animals each, who underwent: 1) modeling of carrageenan-induced aseptic inflammation of the knee joint; 2) subcutaneous implantation of placental fragment; 3) subcutaneous implantation of placental fragment against the background of aseptic inflammation of the knee joint. Histological preparations were prepared according to the general methods with hematoxylin-eosin and Van Gieson staining. Results. During the creating an inflammatory focus, changes in the cartilaginous tissue were determined from day 3 in the form of lacunarity, karyopyknosis as a stage of necrobiosis of chondrocytes, especially pronounced on days 10–14. Morphological changes in the bone tissue of rats, which were injected λ-carrageenan, were noted on the 7th day of the research in the form of resorption and destruction of bone trabeculae. Later (day 10), the inflammatory process led to a picture of the fragmented architectonics of bone tissue, which was observed up to 21 days. From the side of the synovial membrane, villous hyperplasia, lymphoid infiltration, and the appearance of additional layers of synoviocytes were observed as a result of a proliferative reaction. The most pronounced changes were observed in the integumentary layer of the synovium. After a single injection of a cryopreserved placenta, the signs of inflammation significantly decreased: the area of destruction of cartilage and bone was limited, and signs of mucoid swelling in the synovium decreased. Processes of functional blood filling of the microvasculature prevailed over ischemic ones. Stimulation of regenerative processes provided structural recovery on day 21 of observation. Conclusions. Prepartions of cryopreserved placenta influence the course of the inflammatory process in experimental osteoarthritis. The most reliable therapeutic effect is determined from the side of the synovium.
Вступ
Запальний процес є невід’ємним супутником травматичних пошкоджень, у тому числі і ятрогенних. Практично кожне оперативне ургентне чи планове втручання в травматології та ортопедії приводить до обґрунтованого призначення протизапальних препаратів, вибір яких нерегламентований і тому нерідко дискутабельний. Пошуки універсальних засобів для ліквідації запальних явищ — стимул для проведення наукових досліджень не лише лікарів-клініцистів, а й фахівців теоретичної медицини.
Фармацевтичні засоби, які використовуються в клінічній практиці, нерідко мають широкий спектр обмежень для використання, низьку ефективність або сповільнено діють на патологічний процес. Останнім часом при лікуванні артритів заслуговує на увагу використання синтезованих із плаценти біологічно активних речовин із подальшою кріоконсервацією.
Препарати на основі плаценти з доведеною високою ефективністю лікування патологічних процесів використовують фахівці багатьох медичних спеціальностей: акушери-гінекологи, дерматологи, ендокринологи [1, 2]. Значною мірою цьому сприяють розробки вітчизняних вчених, роботи яких присвячені дослідженню кріоконсервованих екстрактів плаценти людини [3, 4].
Однак застосуванню в комплексному лікуванні артропатій даного потужного засобу боротьби із запаленням практично не приділяється належна увага в медичній літературі. Окремі повідомлення про клінічні спостереження, що присвячені використанню гідролізатів плаценти при лікуванні ревматоїдного артриту шляхом інтраартикулярного введення [5, 6] або монофокальній локалізації процесу шляхом ін’єкцій в акупунктурні точки [7–9], не висвітлюють повною мірою актуальності вказаної теми.
Безумовно, клінічні дослідження повинні бути заздалегідь підтверджені експериментально. Створення моделей остеоартриту досить ретельно відпрацьовано вченими світу з урахуванням великої кількості критеріїв: етіології, терміновості, об’єкта та матеріалу дослідження, практичної значимості тощо [10–12]. Більшість морфологічних робіт присвячена вивченню окремих компонентів суглобового комплексу (хрящ, субхондральна кістка, синовіальна оболонка, меніски) [13–15]. Визначенню комплексної тканинної реакції на дію біоактивних речовин у літературі увага дослідників приділяється не часто [16]. Особливо дефіцитними є роботи з вивчення суглобової реакції на вплив кріоконсервованої плаценти (ККП) [17–19].
Відсутність вірогідних даних рандомізованих конт-рольованих досліджень позитивного впливу кріоконсервованої плаценти на перебіг патологічних інтраартикулярних процесів з екстраполяцією експериментальних та клінічних спостережень робить дану тему актуальною на сучасному етапі [20].
Мета — визначення морфологічних характеристик складових структур колінних суглобів щурів у нормі за умов експериментального артриту та після введення кріоконсервованої плаценти.
Матеріал та методи
Експериментальне дослідження проводилось на 115 білих амбулаторних ссавцях щурів лінії Вістар. Піддослідні тварини віком 12 тижнів мали масу 130–150 г утримувались у звичайних умовах віварію Української медичної стоматологічної академії без обмежень харчування, питної води, світлового режиму та руху з дотриманням правил використання лабораторних експериментальних тварин.
З інтактною групою (10 тварин) порівнювались три експериментальні групи по 35 тварин кожна, яким виконувалось:
— ІІ група — моделювання асептичного запалення колінного суглоба;
— ІІІ — підшкірна імплантація кріоконсервованого фрагмента плаценти;
— IV — підшкірна імплантація кріоконсервованого фрагмента плаценти на фоні асептичного запалення колінного суглоба.
Гостре запалення суглобів створювалось шляхом внутрішньоочеревинного введення 5 мг λ-карагінану (Sigma, США), розведеного в 1 мл ізотонічного розчину хлориду натрію.
Препарат кріоконсервованої плаценти після розморожування на водяній бані вводився під загальним знеболюванням підшкірно в ділянку стегна щура з дотриманням асептичних правил в умовах експериментальної операційної Української медичної стоматологічної академії. Відповідно до запланованих термінів дослідження (1–21-ша доба) тварини виводились з експерименту шляхом передозування наркозу.
Підготовка матеріалу (фрагменти дистальних метаепіфізів стегнових та проксимальних метаепіфізів великогомілкових кісток) до гістологічного дослідження містила загальноприйняті етапи: фіксація 10% нейтральним формаліном, декальцинація кісткової тканини, зневоднення в спиртах із концентраціями, що зростали, та занурення у парафін.
Забарвлення отриманих на мікротомі зрізів проводилось за методикою Ван Гізона та гематоксиліном та еозином із подальшим вивченням матеріалу за допомогою мікроскопа Biorex-3 ВМ-500Т із цифровою мікрофотонасадкою DCM 900 з адаптованими для даних досліджень програмами.
Результати та їх обговорення
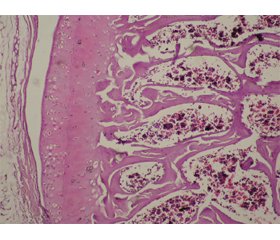
У серії тварин (ІІ група) за умов моделювання неспецифічного артриту морфологічні зміни синовіальної оболонки щурів відмічались із 1-ї доби. Потовщення апікальних відділів ворсин, загальний їх набряк із дезорганізацією колагенових волокон свідчили про наявність запального процесу. Ознаки синовіїту ставали більш вираженими до 5-ї доби експерименту: з’являлись вогнища некрозу синовіоцитів із фрагментацією покривного шару, визначалась активна проліферація синовіальної оболонки з утворенням від 3 до 9 рядів клітин (рис. 1).
Характерні зміни спостерігались із боку судинного компонента: периваскулярний набряк, значне напов-нення судин із появою тромбів, що знаходяться переважно пристінково.
Наявність застійних процесів у мікроциркуляторному руслі швидко призводила до ішемізації субхондральної кістки та її остеолізису.
На 10-ту добу експерименту відмічалась дифузна лімфоцитарна інфільтрація з наявністю деструктивних процесів кісткової та хрящової тканин (рис. 2, 3).
На 14-ту добу хондральна структура частково порушена, відсутня стовпчикова організація хондроцитів, наявні вогнищеві випадки каріорексису та каріолізису з утворенням множинних порожнин. Втрачена векторність кісткових балок на фоні їх масивної деструкції. У мікроциркуляторному руслі синовіальної оболонки венозний компонент, судинна стінка артеріол потовщена, навколо судин спостерігаються лакунарність, фрагментація колагенових волокон. Покривний шар місцями стоншений чи відсутній (рис. 4).
Через 3 тижні деструктивні процеси суглобових тканин виражені значною мірою: хрящ практично відокремлений від кістки, у хондроцитах спостерігаються пікнотичні зміни. Кісткова тканина зруйнована в межах візуалізації з практичною відсутністю кісткового мозку. У морфологічній картині синовіального компоненту зберігаються гіперплазія апікальних відділів ворсин, інфільтрація лейкоцитами, дезорганізація сполучної тканини, судинні порушення з тенденцією до тромбоутворення.
/75.jpg)
Після введення ККП (ІІІ група) вже на 1-шу добу спостерігалось виражене наповнення судин синовіального компонента. Вказане повнокров’я відмічене протягом усього періоду спостереження (до 21-ї доби). На ранніх етапах (3-тя — 5-та доба) нерідко спостерігався сладж-феномен (агрегація еритроцитів у великих судинах). У певних умовах даний феномен може свідчити про запуск процесу підвищення ефективності переносу формених елементів і в кінцевому результаті — оксигенацію тканин даної ділянки. Відсутність вказаного явища в більш пізніх серіях зрізів дозволяє зробити висновок про оборотність даного процесу. Центральне та поздовжнє розташування еритроцитів у просвіті судин свідчить про фізіологічність виявленого феномена (рис. 5).
Перший тиждень експерименту характеризувався, крім змін у мікроциркуляторному руслі синовіальної оболонки, появою набряку та проліферації покривного шару означеної тканини. Поява в збільшеній кількості мегакаріоцитів свідчила про підвищену здатність організму до захисної реакції через активацію тромбоцитарної ланки (рис. 6).
Патологічні зміни в щільних суглобових тканинах були більш виражені в субхондральній кістці. Вірогідні дані про остеопоротичні порушення з’являлися на 14-ту добу. Деструктивні зміни в кістці супроводжувались порушенням спрямованості колонок та каріопікнозом хондроцитів (рис. 7).
При введенні ККП в умовах асептичного запалення (IV група) морфологічна картина відрізнялась відсутністю стадії ішемізації тканин. Під час усього терміну спостереження судини залишались повнокровними, резорбція кісткових балок була менш виражена. Десквамація покривного шару синовіальної оболонки без констатації наявності проліферативних процесів виявлена в окремих препаратах на 3-тю добу експерименту. На 5-ту добу спостерігалась лейкоцитарна інфільтрація навколосудинних зон. До 14-ї доби спостерігались прогнозовані явища набряку колагенових волокон, значно менш виражені порівняно з групою тварин, яким не проводилась корекція запального процесу. Через 3 тижні після початку експерименту суглобові тканини практично не відрізнялись від інтактної групи (рис. 8).
Висновки
Установлено, що при трансплантації ККП на тлі змодельованого гострого асептичного остеоартриту відновлення всіх показників структурних компонентів до значень інтактної групи проявлялося на 10–14-ту добу.
Введення ККП зменшувало прояви запалення на стадіях альтерації та ексудації, посилювало репаративні процеси, скорочувало терміни відновлення структурних компонентів суглоба, уражених запальним процесом, на 5-ту — 7-му добу.
Препарати ККП людини відповідно до експериментальних морфологічних досліджень після проведення додаткових клінічних випробовувань можуть ефективно використовуватись у комплексному лікуванні остеоартриту.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 02.04.2021
Рецензовано/Revised 13.04.2021
Прийнято до друку/Accepted 19.04.2021
Список литературы
1. Gromova O.A., Torshin I.Y., Dibrova E.A., Gilel’s A.V., Demidov V.I. Human placenta hydrolyzates in reconstructive therapy of connective tissue of cartilage and joints. Medical Council. 2017. № 5. P. 178-185. https://doi.org/10.21518/2079-701X-2017-5-178-185.
2. Pogozhykh O., Prokopyuk V., Figueiredo C., Pogozhykh D. Placenta and Placental Derivatives in Regenerative Therapies: Experimental Studies, History, and Prospects. Stem Cells International. 2018. 14 p. doi: 10.1155/2018/4837930.
3. Goltsev A.N., Gayevskaya Yu.A., Dubrava T.G., Ostankova L.V. Effect of cryopreservation on functional status of bone marrow hematopoietic and mesenchymal stem cells in animalswith autoimmune pathology. Probl. Cryobiol. Cryomed. 2016. № 26(1). P. 63-72.
4. Lutsenko M.V., Ostankov N.A., Bondarovich, Goltsev A.N. Influence of Application of Cryopreserved Placental Cell Suspension on Indices of Peripheral Blood and Bone Marrow of Animals with Adjuvant Arthritis. Problems of cryobiology and cryomedicine. 2019. № 1(29). P. 29-43. doi: 10.15407/cryo29.01.028.
5. Gulida M.O., Miroshnichenko E.V., Berezka M.I., Garyachiy E.V. Application of placenta extract in complex treatment of patients with rheumatoid arthritis. Probl. Cryobiol. Cryomed. 2019. № 29(1). P. 28-43.
6. Kim S.H., Djaja Y.P., Park Y.B., Park J.G., Ko Y.B., Ha C.W. Intra-articular Injection of Culture-Expanded Mesenchymal Stem Cells Without Adjuvant Surgery in Knee Osteoarthritis: A Systematic Review and Meta-analysis. Am. J. Sports Med. 2020. № 48(11). P. 2839-2849. doi: 10.1177/0363546519892278.
7. Park K.M., Cho T.H. Therapeutic effect of acupuncture point injection with placental extract in knee osteoarthritis. Journal of Integrative Medicine. 2017. № 15(2). P. 135-141.
8. Delanois R.E., Etcheson J.I., Sodhi N. et al. Biologic Therapies for the Treatment of Knee Osteoarthritis. J. Arthroplasty. 2019. № 34. P. 801-813.
9. Mohamed N.S., Wilkie W.A., Remily E.A., Delanois R.E. Can human placental extract help patients with osteoarthritis? Ann. Transl. Med. 2020. № 8(4). P. 62.
10. Gromyko M.V., Gritsuk A.I. Experimental models of rheumatoid arthritis. Health and Ecology Issues. 2012. № 2. P. 115-118.
11. McCoy A.M. Animal Models of Osteoarthritis: Comparisons and Key Considerations. Vet. Pathol. 2015. № 52(5). P. 803-818. doi: 10.1177/0300985815588611.
12. Kuyinu E.L., Narayanan G., Nair L.S., Laurencin C.T. Animal models of osteoarthritis: classification, update, and measurement of outcomes. J. Orthopaedic Surg. Res. 2016. 2. P. 11-19.
13. Chaikovsky Y.B., Herashchenko S.B., Deltsova O.I. Problems and Perspectives of Using Stem Cells of Cartilage Tissues. Probl. Cryobiol. Cryomed. 2019. № 29(4). P. 303-316. doi: 10.15407/cryo29.04.303.
14. Tkachuk P.V., Strafun S.S., Savosko S.I., Makarenko O.M. Structural disturbances of the knee joint while modeling osteoarthritis. Travma. 2019. № 20(1). С. 73-78. doi: 10.22141/1608-1706.1.20.2019.158673.
15. Wen Ch., Lu W.W., Chiu K.Y. Importance of subchondral bone in thepathogenesis and management ofosteoarthritis from bench to bed. Journal of Orthopaedic Translation. 2014. № 2. P. 16-25. doi: 10.1016/j.jot.2013.11.004.
16. Sultan A.A., Samuel L.T., Roth A. et al. Operative Applications of Placental Tissue Matrix in Orthopaedic Sports Injuries: A Review of the Literature. Surg. Technol. Int. 2019. № 15(34). P. 397-402.
17. Pelypenko O.V., Shepitko V.I., Pelypenko L.B. Morphofunctional characteristics of a microcirculatory beds subchondral bone at the introduction of cryo-conversed placenta on the background of aseptic inflammation in the rat. World of Medicine and Biology. 2019. P. 187-191.
18. McIntair J.A., Jones L.A., Danilkovich A. et al. The Placenta: Applications in Orthopaedic Sports Medicine. Am. J. Sports Med. 2018. № 46(1). P. 234-247.
19. Gwam C., Ohanele C., Hamby J. et al. Human placental extract: a potential therapeutic in treating osteoarthritis. Ann. Transl. Med. 2019. http://dx.doi.org/10.21037/atm.2019.10.20.
20. Emara A.K., Anis H., Piuzzi N.S. Human placental extract: the feasibility of translation from basic science into clinical practice. Ann. Transl. Med. 2020. № 8(5). 156. doi: 10.21037/atm.2020.01.50.

/75.jpg)
/76.jpg)