Вступ
Останнім часом зростає кількість злоякісних новоутворень довгих трубчастих кісток [6]. Найбільш часто, за нашими даними, патологічний процес зустрічається у стегновій кістці (СК) [5, 7]. Результат їх оперативного лікування значною мірою залежить від знання реальної картини величини ураження кісткової тканини і м’яких тканин. Методи візуалізації обсягу онкологічного ураження і його структури постійно удосконалюються. Уже давно традиційними стали рентгенографія, ехографія, магнітно-резонансна томографія (МРТ), комп’ютерна томографія (КТ). Вони дуже важливі для правильного передопераційного планування техніки оперативного втручання, величини резекції уражених тканин. Проте ці дослідження дають мало інформації для формування конструкції фіксатора, що забезпечить стабільну фіксацію фрагментів кістки, тутопласту чи іншого трансплантата, який заповнює утворений дефект несучої основи. У такому випадку об’єктивну картину ураження може суттєво доповнити віртуальне моделювання в рамках МРТ і КТ практично не вивчене в Україні 3D-моделювання процесу [10, 11].
Проведене на цій основі реальне твердотільне моделювання сегмента скелета із пухлиною може виробити найбільш оптимальний обсяг резекції і формування конструкції для стабільної фіксації фрагментів кістки. Оперативне лікування патологічних процесів у СК дає позитивний результат при глибокому знанні стану кістки й оточуючих тканин, процесу зрощення фрагментів із трансплантатом, взаємодії «фіксатор — кістка», елементів, що їх визначають, з позицій системного підходу [1, 3].
Мета роботи — удосконалити методику 3D-моде-лювання пухлин стегна для передопераційного планування оперативного втручання й розробки найбільш оптимальної конструкції пристрою, що забезпечує стабільну фіксацію фрагментів СК.
Матеріали та методи
Проведено аналіз доступних даних літератури, вивчення рентгенограм, історій хвороби 15 пацієнтів із пухлинами СК. Добрі результати лікування останніх можливі за умови ґрунтовного доопераційного планування, наявності у хірурга власного клінічного досвіду. Першим етапом, поряд із загальними і біохімічними аналізами крові, особливо важливим є встановлення наявності метастазів, визначення стану серцево-судинної, ендокринної систем. Усім хворим проводилась рентгенографія стегна (рис. 1), МРТ, КТ.
Ці обстеження дають інформацію про величину, обсяг уражених тканин. Крім того, аналізувався стан здорової кісткової тканини, оточуючих м’язів, обмінних процесів в організмі. Це певною мірою допомагає застосувати адекватний терапевтичний вплив.
До 2017 року остеосинтез проводився залежно від отриманих даних інтрамедулярним стрижнем або довгою накістковою пластиною. Останні 3 роки ми застосовуємо технології 3D-моделювання та 3D-друку твердотільних моделей конкретних СК і пухлин (рис. 2). Це дозволяє спланувати лінію передбачуваної резекції кістки, правильно сформувати трансплантат із біоактивної кераміки, тутопласту або власних кісток [4, 9].
/46.jpg)
3D-моделювання також допомагає створити найбільш оптимальну конструкцію пристрою, що забезпечує стабільну фіксацію цих трансплантатів до фрагментів СК [10, 11]. Розрахунок протяжності резекції сегмента СК з пухлиною проводили за допомогою мультидетекторної комп’ютерної томографічної (МДКТ) перфузіографії. При цьому враховувались також результати цитологічних досліджень. Так, у хворого П. після такого дослідження діагностовано саркому СК. Це дозволило правильно визначити межі патологічного вогнища, провести резекцію кістки в межах здорової тканини. Під час оперативного втручання виявлено проростання пухлини у кістковий канал у підвертлюжній ділянці СК (рис. 3). Після радикального видалення пухлини встановлено ніжку протеза W-cap на цемент (рис. 4).
/47.jpg)
Крім того, є можливість провести передопераційний тренінг мануальних навичок щодо встановлення конструкцій сформованих фіксаторів на сегмент фрагменти кістки — трансплантат (ФКТ), визначити його несучу здатність. На основі планування і перед-операційного тренування виконано 5 операцій на СК. Таке тренування дозволяє лікарю почувати себе більш впевнено, посилити ситуаційну обізнаність, вибрати для конкретного випадку оптимальне рішення, скоротити тривалість оперативного втручання. Найбільш часто для стабілізації сегмента ФКТ застосовувались оптимізовані конструкції на основі фіксатора типу DHS-, LCP-пластин або фіксатором для малоконтактного багатоплощинного остеосинтезу (МБО) [2]. Останній усуває тиск пластини на кістку, забезпечує стабільну фіксацію при коротшій довжині пластини. Завдяки наявності у конструкції півкілець кортикальні гвинти можна провести в різних площинах, що додатково стабілізує пересаджений трансплантат і фрагменти СК.
В окремих випадках проводилась мультидетекторна коп’ютерна ангіографія для дослідження кровотоку в пухлинах. На основі такого обсягу обстежень проводився системний аналіз (СА) факторів, що можуть впливати на кінцевий результат [3]. Це допомагає розробити запобіжні заходи й передбачити можливі ускладнення. СА — прогресивна методологія наукового дослідження, що розглядає елементи й підсистеми у взаємозв’язку, орієнтованому на досягнення кінцевої мети.
Аналізувалась радикальність видалення патологічно змінених тканин, обґрунтованість, ефективність застосування сформованої конструкції фіксатора для конкретного випадку, його вплив на зрощення фрагментів. Вивчалась динаміка розвитку мозолі, її величина залежно від жорсткості фіксації, якості контактів в сегменті ФКТ [1]. Аналізувалась правильність проведення післяопераційного періоду, величина і тривалість дозованого й повного навантаження. Вивчалося чимало інших об’єктивних і суб’єктивних факторів, що мали вплив на кінцевий результат лікування. Усе це має великий вплив на кінцевий результат лікування. Він значною мірою залежить від сучасного стану технічного забезпечення, а також правильного розуміння тих процесів, що проходять у патологічно зміненій кістці.
Результати та обговорення
Останнім часом намітилась тенденція механістичного підходу в лікуванні пухлин СК. Часто лікар, приймаючи рішення на користь певної конструкції, сподівається на фіксуючі можливості фіксатора, при цьому маючи погане уявлення про біомеханіку взаємодії «фіксатор — кістка». Результат лікування патологічних процесів у СК значною мірою залежить від знання біомеханіки кінцівки, розуміння процесу репаративної регенерації кістки, механізму впливу на неї багатьох факторів. На тактику лікування впливає наявність віддалених метастазів у різні органи. За їх відсутності після детального лабораторного, інструментального обстеження, 3D-моделювання важливу інформацію дає характерна клінічна картина. Отримані дані піддаються ґрунтовному СА, що є важливою передумовою прийняття оптимального рішення, що забезпечує позитивний результат.
Сказане підтверджує клінічне спостереження хворого Д., 37 років. Протягом 2 років його турбували болі після фізичного навантаження у верхній третині правого стегна. На рентгенограмі виявлено вогнище остеолізису в підвертлюжній ділянці СК. Детальне клінічне, лабораторне й інструментальне обстеження не виявило метастатичних утворень, нічних болів. Прийнято рішення про оперативне лікування. Величину резекції сегмента СК з пухлиною визначили за допомогою МДКТ-перфузіографії. Під час оперативного втручання проведено видалення патологічно зміненої кістки, проведений остеосинтез фіксатором для МБО, часткове заміщення дефекту кістковою автоспонгіозною тканиною (рис. 5А). Повне навантаження прооперованої кінцівки дозволено через 10 місяців. У цей час на контрольній рентгенограмі відмічається зрощення фрагментів СК (рис. 5Б). Хворий спостерігається 3 роки, скарг не пред’являє, ходить без допоміжних засобів.
Більші кісткові дефекти заповнюються тутопластом. Перед операцією дуже важливо знати довжину цього трансплантата. Максимальна довжина тутопласту, яку ми використовували, — 55 мм. Дуже важливо перед оперативним втручанням на 2–3 години помістити його у стерильний фізіологічний розчин. Це сприяє кращому зрощенню його із фрагментами СК. Поряд із рентгенологічною картиною, даними КТ дуже важливу інформацію для визначення величини резекції сегмента СК із пухлиною дає МДКТ-перфузіографія.
За відсутності метастатичних уражень при патологічних переломах СК добрий кінцевий результат можливий при радикальній резекції зміненої кісткової тканини, заміні її тутопластом, правильному веденні післяопераційного періоду [8]. Крім того, дуже важливо забезпечити добрий контакт і стабільність в сегменті ФКТ.
Поряд із рентгенологічною картиною, даними КТ дуже важливу інформацію для визначення величини резекції сегмента СК із пухлиною дає МДКТ-перфузіографія. За відсутності метастатичних уражень при патологічних переломах СК добрий кінцевий результат можливий при радикальній резекції зміненої кісткової тканини, заміні її тутопластом, правильному веденні післяопераційного періоду.
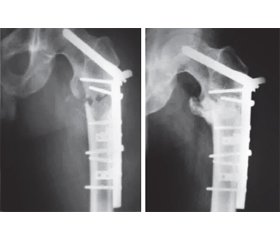
Саме таку методику ми застосували у хворого К., 72 роки, із патологічним переломом СК на рівні кістки підвертлюжної ділянки. Детальне обстеження хворого із використанням 3D-моделювання виявило можливість ефективного оперативного втручання із резекцією кістоподібного утворення. Комп’ютерне моделювання і КТ уточнили істинні межі ушкодження кістки. Це дозволило правильно підібрати довжину тутопласту. Під час оперативного втручання ці межі підтверджено, малий вертлюг виявився неушкодженим. Проведено резекцію кісти, остеосинтез сегмента ФКТ фіксатором для МБО. Через великий вертлюг в шийку СК введено міцний спонгіозний гвинт із свердлом на робочому кінці. На рівні проксимального фрагмента розміщене півкільце, через отвори якого проведено 2 гвинти в різних площинах. Двома півкільцями і чотирма кортикальними гвинтами фіксований тутопластовий трансплантат, на рівні дистального фрагмента СК розміщено два півкільця. Через їх отвори і пластину проведено 7 кортикальних гвинтів (рис. 6А). Це забезпечило добрий контакт і стабільну фіксацію в сегменті ФКТ, оптимальні умови для зрощення тутопласту із фрагментами СК. Через 11 місяців на контрольній рентгенограмі відмічається проростання кістки в тутопласт через малий вертлюг і кінці фрагментів (рис. 6Б).
/48.jpg)
Часткове навантаження кінцівки дозволено через 15 місяців після оперативного втручання. Хворий спостерігається 2 роки, скарг не пред’являє, ходить із паличкою. З метою профілактики рецидивів і метастазів злоякісних пухлин СК до та після оперативного втручання застосовуємо превентивну терапію даларгіном.
Висновки
Перед оперативним втручанням з приводу патологічних утворень CК важливе значення має ґрунтовне обстеження пацієнта, включаючи рентгенографію стегна МРТ, КТ. Для визначення величини резекції СК при її ураженні необхідно застосовувати технології 3D-моделювання та 3D-друку твердотільних моделей конкретних СК і пухлин. Останні дають можливість спланувати лінію передбачуваної резекції кістки, правильно сформувати трансплантат із біоактивної кераміки, тутопласту або власних кісток. Така методика дозволяє створити конструкцію фіксатора, що забезпечує стабільність у сегменті ФКТ. Крім того, важливо провести на отриманій моделі тренінг, що полегшує проведення оперативного втручання. Все це допомагає значно покращити підготовку, обрати найбільш оптимальну тактику лікування, що безперечно поліпшує його кінцевий результат.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 06.06.2021
Рецензовано/Revised 17.06.2021
Прийнято до друку/Accepted 24.06.2021
Список литературы
1. Андрейчин В.А., Білінський П.І. Системний аналіз оперативного методу лікування діафізарних переломів і фактори впливу на репаративну регенерацію. Травма. 2014. 6. 59-64.
2. Білінський П.І. Теорія і практика малоконтактного багатоплощинного остеосинтезу. К.: Макрос, 2008. 375 с.
3. Сименач Б.И. Фрактурология — некоторые аспекты теоретизации учения о переломах костей. Часть 2. Управление процессами репарации. Ортопедия, травматология и протезирование. 2000. 4. 105-117.
4. Cartiaux O., Paul L., Francq B.G., Banse X., Docqu-ier P.L. Improved accuracy with 3D planning and patient-specific instruments during simulated pelvic bone tumor surgery. Ann. Biomed. Eng. 2014. 42. 205-13. PMID: 23963884.
5. Malik A.T., Alexander J.H., Myerson J.L., Khan S.N., Scharschmidt T.J. Is Surgical Resection of the Primary Site Associated with an Improved Overall Survival for Patients with Primary Malignant Bone Tumors Who Have Metastatic Disease at Presentation. Clin. Orthop. Relat. Res. 2020 Oct. 478(10). 2284-2295. doi: 10.1097/CORR.0000000000001361. PMID: 32667758; PMCID: PMC7491913.
6. Misaghi A., Goldin A., Awad M., Kulidjian A.A. Osteosarcoma: a comprehensive review. SICOT J. 2018. 4. 12. doi: 10.1051/sicotj/2017028. Epub 2018 Apr 9. PMID: 29629690; PMCID: PMC5890448.
7. Siegel R.L., Miller K.D., Jemal A. Cancer statistics, 2018. CA Cancer J. Clin. 2018 Jan. 68(1). 7-30. doi: 10.3322/caac.21442. Epub 2018 Jan 4. PMID: 29313949.
8. Ferguson J.L., Turner S.P. Bone Cancer: Diagnosis and Treatment Principles. Am. Fam. Physician. 2018 Aug 15. 98(4). 205-213. PMID: 30215968.
9. Jud L. et al. Joint-preserving tumors resection around the knee with allograft reconstruction using three-dimensional preoperative planning and patient-specific instruments. The Knee. 2019. 26(3). 787-793. doi: https://doi.org/10.1016/j.knee.2019.02.015.
10. Luo W. L., H. Huang, Liu W. Customized knee prosthesis in treatment of Giant cell tumors of the proximal tibia: application of 3-dimensional printing Technology in Surgical Design. Med. Sci. Monit. 2017. 23. 1691-1700.
11. Chieh-Tsai Wu, Ting-Chen Lu, Chun-Sheng Chan, Tzu-Chin Lin Patient-specific 3D printing guide for single-stage skull bone tumor surgery: Novel software workflow with manufacturing of pre-fabricated jigs for bone resection and reconstruction World Neurosurgery (IF 1.829) Pub Date: 2020-12-23. DOI: 10.1016/j.wneu.2020.12.072.
/46.jpg)
/47.jpg)

/48.jpg)