Вступ
На сьогодні прийнято вважати, що рівень захворюваності й смертності, що пов’язані з кардіоваскулярним ризиком, значною мірою залежить від підвищення артеріального тиску (АТ), індексу маси тіла, рівня глюкози й холестерину. Ці фактори ризику є одними з основних причин понад 60 % загальної смертності від серцево-судинних захворювань (ССЗ), хронічної хвороби нирок (ХХН) і цукрового діабету (ЦД). При цьому погано контрольована артеріальна гіпертензія (АГ) є незалежним чинником ризику розвитку ССЗ, інсульту, ниркової недостатності й зростання смертності [4, 31]. У віці 40–70 років при збільшенні рівня АТ понад 115/75 мм рт.ст. на 20/10 мм рт.ст. ризик ССЗ подвоюється [14]. Зниження систолічного артеріального тиску (САТ) на 10 мм рт.ст. зменшує ризик основних ССЗ на 20 %, ішемічної хвороби серця (ІХС) — на 17 %, інсульту — на 27 %, серцевої недостатності (СН) — на 28 % і смертності від усіх причин — на 13 %. Зниження діастолічного АТ (ДАТ) до нормального рівня асоціюється з більш низьким ризиком повторного інсульту (р = 0,026) і смертності від усіх причин (р = 0,009) [27, 29].
У європейських рекомендаціях 2018 року для нормалізації і подальшого підтримання цільового рівня АТ як терапію першої лінії рекомендовано 5 основних класів антигіпертензивних препаратів (АГП): інгібітори ангіотензинперетворюючого ферменту (іАПФ), блокатори рецепторів ангіотензину II (БРА), бета-адреноблокатори (ББ), блокатори кальцієвих каналів (БКК) і діуретики (тіазидні й тіазидоподібні) [62]. Дані групи препаратів довели свою ефективність і безпеку в пацієнтів з АГ, однак існують стани, при яких той чи інший клас є пріоритетним.
Вибір на користь того чи іншого класу препаратів робиться для кожного конкретного пацієнта з урахуванням ознак ураження органів-мішеней, характеру коморбідної патології. З огляду на еквівалентні антигіпертензивні властивості класи препаратів схожі за впливом на загальний ризик ССЗ, але можна відзначити деяке розходження в зниженні специфічних ризиків: діуретики зменшують ризик розвитку СН; БКК запобігають ризику розвитку інсульту й смерті від всіх причин, але поступаються в профілактиці ІХС; ББ менш ефективні для захисту від інсульту; БРА більш ефективні в лікуванні й профілактиці як СН, так і ХХН [45, 56].
Клас БРА — один з останніх класів АГП з достатньою доведеною базою і позитивним впливом на кінцеві клінічні точки, достатнім рівнем зниження й контролю артеріального тиску, з високим профілем безпеки й доброю переносимістю (порівняно з плацебо), що обумовлює найбільш високу прихильність до терапії і дозволяє призначати дану групу препаратів пацієнтам різних вікових категорій. Дійсно, призначення БРА асоціюється з достовірним зниженням стадії СН (–10 %), ризику розвитку інсульту (–9 %) і основних серцево-судинних подій — сукупності інсульту, ІХС, СН (–9 %) [13, 57]. Блокатори рецепторів ангіотензину II мають додаткові органопротективні властивості, що роблять їх особливо ефективними при ремоделюванні лівого шлуночка (ЛШ) при його гіпертрофії на тлі АГ і після перенесеного інфаркту міокарда (ІМ), здатні зменшувати вираженість мікроальбумінурії (МАУ), протеїнурії, порушень вуглеводного обміну, прогресування хронічної СН [15, 31]. Ці властивості особливо важливі для лікування пацієнтів з гіпертонічною і діабетичною нефропатією, оскільки зв’язок між АТ і прогресуванням ХХН із розвитком ниркової недостатності є прямолінійним [47].
Олмесартану медоксоміл — ефективний сартан з унікальними додатковими ефектами
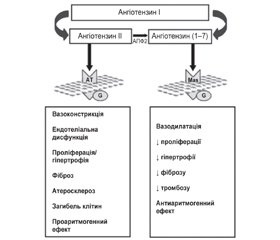
Олмесартану медоксоміл (ОЛМ) є сьомим блокатором рецепторів ангіотензину II, схваленим Управлінням з контролю за продуктами і лікарськими препаратами (FDA) для лікування АГ. БРА відзначаються загальновизнаною антигіпертензивною активністю, і хоча вони мають багато спільних рис, ОЛМ має унікальні особливості будови молекули й дає додаткові ефекти. Як відомо, ренін-ангіотензин-альдостеронова система (РААС) — це важливий гуморальний регулятор серцево-судинної системи. Ключовим ферментом РААС є ангіотензинпере-творюючий фермент (АПФ), що забезпечує перетворення ангіотензину І в ангіотензин ІІ (рис. 1). Ангіотензин II є первинним ефекторним пептидом РААС, який, активуючи рецептор ангіотензину 1 (AT1), призводить до гострої вазоконстрикції і збільшення затримки натрію, об’єму рідини, секреції альдостерону й підвищення симпатичної активності, тоді як активація рецептора ангіотензину 2 (AT2) дає протилежні ефекти [8].
/12.jpg)
Дисрегуляція РААС значною мірою сприяє дез-адаптивному ремоделюванню серця, гіпертрофії серця, апоптозу, фіброзу й ендотеліальній дисфункції, що призводять до термінальної стадії СН [21]. Відкриття у 2000 році ангіотензинперетворюючого ферменту 2 (АПФ2) дозволило встановити, що РААС включає дві контррегуляторні підсистеми: AПФ/ангіотензин II і AПФ2/ангіотензин (1–7), а їх баланс — основний механізм підтримання серцево-судинного гомеостазу. AПФ2 — гомолог AПФ, що бере активну участь у перетворенні вазоактивного ангіотензину II в ангіотензин (1–7) шляхом зв’язування з G-білком рецептора (Mas), забезпечуючи тим самим контррегуляторну відповідь на ней-рогормональну активацію [9].
Експериментально встановлено, що ОЛМ конкурентно інгібує зв’язування ангіотензину II зі специфічним рецептором АТ1 з високим ступенем селективності і з більшою афінністю, ніж більшість інших БРА, не впливаючи на рецептори АТ2 [19, 37]. Так, зв’язок олмесартану з рецептором AT1 у бичачій тканині в 12 500 разів вище, ніж з рецептором AT2 [42]. Дослідження in vitro продемонстрували виражену здатність ОЛМ до пригнічення опосередкованої ангіотензином II вазоконстрикції в аорті свині: фармакологічна активність ОЛМ була вище в 1,2 раза від активності кандесартану, в 4,2 раза — від активності валсартану, у 30,7 раза — від активності ірбесартану і в 203 рази — від активності лозартану [26]. При цьому слід підкреслити, що ефект ОЛМ є дозозалежним. Також важливо відзначити, що в препарованих тканинах антагоністичний ефект ОЛМ щодо взаємодії ангіотензину II з АТ1-рецепторами зростає зі збільшенням часу експозиції препарату в тканинах і триває принаймні протягом 90 хв після його виведення [33].
Цю здатність можна пояснити унікальним механізмом зв’язування з АТ1-рецепторами ангіотензину II. Молекула ОЛМ, на відміну від інших сартанів, містить дві фенольні групи: OH- і α-COOH-групу [2, 36]. За допомогою так званого домену подвійного ланцюга (double chain domain) препарат здійснює контакт з двома сайтами специфічного рецептора, забезпечуючи стійкий гіпотензивний ефект. Решта представників класу БРА зазвичай зв’язуються виключно лише з доменом рецептора, що містить OH-групу. Цей механізм блокади рецептора ангіотензину II дозволяє ОЛМ реалізовувати більш пролонгований інгібуючий ефект, що вигідно відрізняє даний препарат від інших представників цього класу лікарських засобів [36].
ОЛМ міє ще одну унікальну відмінність від інших БРА. Вважається, що сартани підвищують рівень плазмового ангіотензину II, впливаючи на активність реніну, через відсутність негативного зворотного зв’язку. Блокуючи взаємодію ангіотензину II з його рецептором AT1, олмесартан дозозалежно пригнічує пресорні реакції, викликані ангіотензином II, в ізольованій тканині аорти морських свинок на внутрішньовенно введений ангіотензин II у нормотензивних щурів [3, 37].
Доведено, що одноразова доза ОЛМ 5–40 мг приводила до сталого збільшення рівня активності реніну в амбулаторній плазмі протягом 24 годин і зменшувала середні показники 24-годинної екскреції альдостерону із сечею у здорових добровольців, які були обмежені у вживанні натрію. Рівень збільшення активності реніну в плазмі був пропорційний ступеню зниження АТ [25].
До 2001 року не було відомо, яким чином тривале застосування ОЛМ у хворих АГ призводило до зниження рівня плазмового ангіотензину II [24]. Групою дослідників було показано, що ОЛМ, крім здатності блокувати рецептори ангіотензину II, підвищує експресію АПФ2 і тим самим збільшує рівень кардіального окису азоту й ендогенного ангіотензину (1–7), який є прямим конкурентом ангіотензину II і дає прямий вазодилатаційний ефект, що призводить до значного зниження артеріального тиску, а також обумовлює антипроліферативну дію і кардіопротекторні ефекти за рахунок зменшення рівня маркерів запалення, зворотного розвитку ремоделювання міокарда й судин, уповільнення прогресування і регресії атеросклерозу в різних категорій пацієнтів, у тому числі із ЦД 2-го типу [7, 16].
Ця нова концепція дуже важлива для вивчення плейотропного механізму ОЛМ при ССЗ, що чинить захисну дію на органи-мішені, включно з ренопротекцією і антиатеросклеротичною активністю [60].
Фармакологічні властивості олмесартану медоксомілу
ОЛМ є проліками, що швидко всмоктуються з шлунково-кишкового тракту після перорального прийому і за допомогою естераз швидко і повністю метаболізуються до фармакологічно активного метаболіту — олмесартану [11, 34]. Абсолютна біодоступність ОЛМ після однократного перорального прийому 20 мг у здорових добровольців становить 26 %, а пікові рівні концентрації в плазмі крові досягаються в середньому приблизно через 2 години (1,7–2,5 год). Концентрація олмесартану в плазмі досягає стабільного стану приблизно після 5 днів прийому ОЛМ один раз на день; середнє значення максимальної концентрації (Cmax) на 10-й день у здорових добровольців, які отримували 20 мг/день, становить 0,51 мг/мл [48].
На всмоктування ОЛМ їжа не чинить істотного впливу [11]. Олмесартан тісно пов’язаний з білками плазми (99,7 %) і має невисокий обсяг розподілу. Середній об’єм розподілу одноразової внутрішньовенної дози ОЛМ (еквівалент 20 мг ОЛМ) для здорових добровольців становить 15–25 л, у той час як середній об’єм розподілу після пероральної дози 20 мг ОЛМ становить 35 л [48].
Після абсорбції олмесартан надалі не метаболізується й виводиться в основному з калом через жовчовивідні шляхи, елімінація одноразової міченої дози 20 мг ОЛМ через гепатобіліарну систему в здорових добровольців становить у середньому 77 % дози [32]. Решта 13 % дози виводиться із сечею, більша кількість — у перші 12 годин [79]. Загальний плазмовий кліренс становив 1,31 л/год після перорального прийому ОЛМ і внутрішньовенного введення олмесартану [48]. Нирковий кліренс після перорального введення явно не залежить від дози і коливається від 0,42 до 0,92 л/год. Середній період напіввиведення олмесартану варіює від 11,8 до 14,7 год після одноразового введення ОЛМ у дозі 10–320 мг/мл у здорових добровольців, що дозволяє приймати препарат один раз на день [32, 48].
Середнє значення максимальної концентрації олмесартану в літніх пацієнтів збільшується на 14 %, проте це збільшення не вважається клінічно значущим і, отже, не вимагає корекції дози в даної категорії пацієнтів [6, 11].
При зниженні швидкості клубочкової фільтрації середнє значення величини площі під кривою «концентрація — час» (AUC) олмесартану було підвищене порівняно з таким у здорових добровольців [6]. Отже, ОЛМ 20 мг/день є максимальною рекомендованою дозою в пацієнтів з легкою або помірною нирковою недостатністю, а пацієнтам з тяжкою нирковою недостатністю прийом препарату не рекомендується [11]. Олмесартан не метаболізується через систему цитохрому P-450 (CYP), тому не має клінічно значущих фармакокінетичних взаємодій з іншими препаратами (включно з варфарином, дигоксином, антацидами) [11].
Олмесартан: антигіпертензивна ефективність порівняно з іншими АГП
У численних великих рандомізованих багатоцентрових клінічних дослідженнях ОЛМ зарекомендував себе як високоефективний препарат для лікування як помірної, так і тяжкої АГ. ОЛМ показав досить добру переносимість і безпеку, він не викликає гіпотензії першої дози й ортостатичної гіпотензії, відсутній феномен відміни при припиненні прийому препарату. Початкова стартова доза препарату — 10 мг/добу. Оскільки гіпотензивна дія ОЛМ дозозалежна, його призначають у дозах 10–40 мг/добу [55]. Метааналіз семи рандомізованих подвійних сліпих плацебо-контрольованих досліджень тривалістю до 12 тижнів підтвердив дозозалежний антигіпертензивний ефект ОЛМ (діапазон доз 2,5–80 мг/день), у ньому оцінювали рівень зниження ДАТ і САТ на основі аналізу періоду напіввиведення (n = 2693 або n = 3055), причому всі дози були значно більш ефективними, ніж плацебо [24]. Ефект зниження рівня артеріального тиску спостерігався починаючи з 1-го тижня лікування ОЛМ і був максимальним вже через 2 тижні з оптимальними перевагами, які спостерігаються при дозах понад 5 мг/день (а саме 10, 20 і 40 мг/день; p < 0,05; статистичний аналіз відсутній для даних 80 мг/день) [35, 41]. При цьому число пацієнтів, які досягли цільового значення ДАТ (< 90 мм рт.ст.) і САТ (< 140 мм рт.ст.), після 8 тижнів лікування на дозі 40 мг становило 62 і 49 % відповідно порівняно з 28 і 20 % відповідно в групі плацебо [43].
У дослідженні Oparil et al. гіпотензивний ефект ОЛМ (доза 20 мг) порівнювали з ефектами інших сартанів в еквівалентних дозах: лозартану (50 мг), валсартану (80 мг) та ірбесартану (150 мг). У дослідженні взяли участь 588 пацієнтів з ДАТ 100–115 мм рт.ст. і денним ДАТ при амбулаторному моніторуванні > 90 мм рт.ст. і < 120 мм рт.ст. [41]. Через 8 тижнів терапії ОЛМ на 11,5 мм рт.ст. знизив офісний ДАТ, у той час як у групі лозартану, валсартану й ірбесартану зменшення ДАТ становило 8,2; 7,9 і 8,9 мм рт.ст. відповідно. Зниження рівня САТ у групі ОЛМ також було більш значним порівняно з іншими сартанами (11,3 мм рт.ст. проти 9,5; 8,4 і 11 мм рт.ст. відповідно). Число пацієнтів, які відповіли на терапію ОЛМ (70 %), було також значно вищим порівняно з іншими препаратами: 63 % відповіли на ірбесартан, 56 % — на валсартан, 56 % — на лозартан і 53 % — на кандесартан. Аналогічні зміни спостерігали й при добовому моніторуванні артеріального тиску. Середньодобовий САТ при використанні ОЛМ через 8 тижнів лікування знизився на 12,5 мм рт.ст. При терапії іншими препаратами динаміка САТ була не такою вираженою: для лозартану — 9 мм рт.ст., валсартану — 8,1 мм рт.ст., ірбесартану — 11,3 мм рт.ст. Автори зробили висновки, що ОЛМ у стартовій дозі більш ефективно знижує артеріальний тиск порівняно зі стартовими дозами інших представників класу БРА [49].
У раніше виконаних плацебо-контрольованих клінічних дослідженнях було показано, що антигіпертензивна ефективність монотерапії як у стартовій (20 мг/добу), так і в максимальній дозі (40 мг/добу) ОЛМ не поступається такій при лікуванні іншими антигіпертензивними засобами. У метааналізі Fabia et al., який включив 27 плацебо-контрольованих досліджень, оцінювали гіпотензивний ефект низьких і високих доз сартанів та інших АГП у пацієнтів з АГ за допомогою добового моніторування АТ у добовій дозі: лозартан — 50–100 мг, валсартан — 80–160 мг, ірбесартан — 150–300 мг, кандесартан — 8–16 мг, телмісартан — 40–80 мг, епросартан — 600–900 мг, ОЛМ — 20–40 мг, амлодипін (АМЛ) — 5–10 мг, еналаприл — 20–40 мг, гідрохлортіазид — 25–50 мг [14]. ОЛМ порівняно з іншими сартанами (лозартан, валсартан, ірбесартан, телмісартан, кандесартан і епросартан) у зазначених дозах мав найбільш виражений гіпотензивний вплив на величину офісного АТ, цілодобового, нічного АТ і АТ за останні 4–6 год ранкового вимірювання. Порівняно з іншими БРА ОЛМ виявляв ефективність у зниженні 24-годинного САТ (р = 0,03) і ДАТ (р = 0,002), денного АТ зі значною різницею лише для ДАТ (р = 0,04), нічного САТ (р = 0,008) і ДАТ (р = 0,002) і САТ (р = 0,02) і ДАТ (р = 0,04) протягом останніх 4 годин інтервалу дозування. Отже, ОЛМ дає додаткові переваги щодо контролю АТ порівняно з іншими БРА, оскільки дозволяє досить ефективно знижувати артеріальний тиск протягом 24 год [14, 52].
У 2013 році Minatoguchi et al. опублікували дані дослідження DOHSAM. Це рандомізований незасліплений протокол порівняння гіпотензивного ефекту кандесартану, валсартану, лозартану, телмісартану й ОЛМ у хворих з АГ [35]. Додатково ефект кандесартану порівнювався з АМЛ. Дослідження тривало 12 місяців, особлива увага приділялася рівню ранкового АТ перед прийомом чергової дози. Єдиним антагоністом рецепторів ангіотензину, перед яким кандесартан не показав переваг, був ОЛМ. У групах інших препаратів, включно з АМЛ, не вдавалося домогтися повноцінної 24-годинної нормалізації артеріального тиску. При порівнянні ОЛМ з телмісартаном Arao et al. було виявлено суттєве зниження індексу HOMA-IR і рівня високочутливого С-реактивного білка (СРБ) в групі ОЛМ серед пацієнтів з АГ і ЦД 2-го типу. Другий препарат не мав істотного впливу на ці показники. Це дослідження підтверджують більш ранні дані Nakayama et al., які виявили, що ОЛМ у пацієнтів з АГ і ЦД дає більш виражений гіпотензивний і протизапальний ефекти порівняно з телмісартаном. Це важливо ще й тому, що доза ОЛМ була у 2 рази нижче, ніж телмісартану, і в 4 рази нижче, ніж валсартану (20, 40 і 80 мг відповідно), що, безумовно, вплинуло на меншу частоту побічних реакцій [35].
У дослідженні CHAOS, яке включало 60 амбулаторних клінічно стабільних пацієнтів з АГ після кардіохірургічного втручання, порівнювали ефективність ОЛМ з азилсартаном [50]. Однією з основних кінцевих точок було визначення рівня активності реніну в плазмі, ангіотензину II і альдостерону. Якщо протягом року цільовий рівень АТ (140/90 мм рт.ст.) не був досягнутий, до терапії додавали БКК. Так, у групі ОЛМ призначення останнього було потрібно 4 хворим, у групі азилсартану — 12 пацієнтам, що достовірно більше, ніж у групі ОЛМ (p < 0,03). Через 1 рік лікування індекс маси міокарда ЛШ у групі ОЛМ був вірогідно нижче (p < 0,0001), ніж у групі азилсартану. Цікавим є факт вірогідного зниження альдостерону (p < 0,011) і ангіотензину II (p < 0,028) в групі ОЛМ порівняно з такими в групі азилсартану. Автори дослідження зробили висновок, що така перевага обумовлена впливом ОЛМ на АПФ2, що збільшує утворення кардіального окису азоту і ендогенного ангіотензину (1–7) унаслідок підвищеної експресії АПФ2. На основі отриманих даних автори зробили висновок, що ОЛМ знижує рівень ангіотензину II і альдостерону ефективніше, ніж азилсартан, забезпечуючи більш стабільний гіпотензивний ефект, а також викликає більш виражений регрес гіпертрофії ЛШ [50].
Плейотропні ефекти олмесартану медоксомілу
У низці клінічних досліджень були вивчені плейотропні ефекти ОЛМ. У проспективному рандомізованому багатоцентровому дослідженні OLIVUS оцінювали вплив ОЛМ на регрес розвитку атеросклеротичних бляшок у пацієнтів зі стабільною формою стенокардії напруги (n = 247), яким після проведення черезшкірного коронарного втручання проводили внутрішньосудинне ультра–звукове дослідження коронарних артерій (IVUS), з гемодинамічно незначущим атеросклерозом (стеноз < 50 %) [22]. За допомогою IVUS на початку й через 14 місяців спостереження оцінювали рівень просвіту коронарних судин, визначали відсоток обсягу атероми (PAV), зміни відсотка загального обсягу атероми (TAV).
До основного лікування, яке включало комбінацію ББ, БКК, діуретиків, нітратів, засобів контролю глікемії і/або статинів, пацієнтам додавали від 10 до 40 мг ОЛМ або плацебо. Групи були порівнянні за характеристиками пацієнтів і рівнем артеріального тиску, а також між конт–рольною групою (n = 65) і групою ОЛМ (n = 70) не було виявлено відмінностей в кінцевих точках — серцево-судинна смерть, нефатальний ІМ або нефатальний інсульт, коронарна реваскуляризація, частота госпіталізації з приводу застійної СН або погіршення функції нирок.
Додатково в дослідженні вивчався вплив ОЛМ на рівень біомаркерів атеросклерозу й взаємозв’язок між змінами їх рівня і ступенем прогресування атеросклеротичної бляшки. Зміна рівня високочутливого СРБ (мг/л) і адипонектину (мкг/мл) була достовірно більше в групі ОЛМ порівняно з групою конт–ролю (різниця між групами: 0,5 і –0,7; 95% довірчий інтервал: від 0,2 до –0,8 і від –1,3 до –0,1; р = 0,001 і 0,02 відповідно). Через 14 місяців активної терапії IVUS показав значне зниження TAV і значне відсоткове покращання PAV у пацієнтів, які приймали ОЛМ (5,4 % проти 0,6 % для TAV і 3,1 % проти –0,7 % для PAV для плацебо проти групи ОЛМ відповідно, р < 0,05). Множинний регресійний аналіз показав, що початкові зміни загального об’єму атероми й відсоткового об’єму атероми мали статистично достовірний зв’язок з номінальною зміною СРБ у групі ОЛМ, що не спостерігалося в конт–рольній групі. ОЛМ знижував рівень високочутливого СРБ у пацієнтів зі стабільною стенокардією напруги, що корелювало зі зміною атеросклеротичної бляшки коронарної артерії (від 3 до –0,1; р = 0,001 і р = 0,02 відповідно). Дослідження OLIVUS продемонструвало, що ОЛМ уповільнює прогресування коронарного атеросклерозу в пацієнтів зі стабільною стенокардією напруги незалежно від ступеня зниження АТ [22].
Вплив олмесартану медоксомілу на ендотеліальну дисфункцію, окиснювальний стрес і запалення
ОЛМ поряд з антигіпертензивним ефектом позитивно впливає на процеси атеросклерозу і рівень серцево-судинного ризику (ССР) у пацієнтів з АГ і атеросклерозом. У дослідженні EUTOPIA (European Trial on Olmesartan and Pravastatin in Inflammation and Atherosсlerоsis) протягом 12 тижнів оцінювали вплив 20 мг ОЛМ на маркери запалення в пацієнтів з АГ порівняно з плацебо [18]. Через 6 тижнів лікування ОЛМ знижував рівень СРБ на 15 % (р < 0,05), фактора некрозу пухлини α (ФНП-α) — на 8,9 % р < 0,02), інтерлейкіну-6 (ІЛ-6) — на 14 % (р < 0,05), у групі плацебо достовірні зміни цих показників були відсутні. Через 6 тижнів усім пацієнтам додавали правастатин 20 мг/добу. У кінці дослідження комбінація ОЛМ + правастатин ще більше знижувала показники судинного запалення: СРБ — на 21,1 % (р < 0,01), ФНП-α — на 13,6 % (р < 0,01), ІЛ-6 — на 18 % (р < 0,01).
У 2010 році Lorenzen et al. виявив білок остеопонтин — плейотропний цитокін, якому надають ключове значення в прогресуванні атеросклерозу при АГ. На початку дослідження EUTOPIA рівень остеопонтину у хворих був 32,85 нг/мл, тоді як у здорових осіб групи контролю — 23,82 нг/мл (p = 0,027). На тлі ізольованого прийому правастатину динаміка була відсутня — його прийом приводив тільки до істотного зниження рівня холестерину ліпопротеїдів низької щільності як у групі ОЛМ, так і в групі плацебо. Монотерапія ОЛМ і подвійна терапія з правастатином достовірно знижували рівень циркулюючого в сироватці остеопонтину порівняно з групою плацебо (p < 0,001). Рівень цього білка, крім того, позитивно корелював з маркерами клітинного запалення VCAM-1 (Vascular Cell Adhesion Moleсule 1) (r = 0,27), ICAM-1 (Intercelluar Cell Adhesion Moleсule 1) (r = 0,18), ІЛ-6 (r = 0,35) і високочутливим СРБ (r = 0,22). Це дослідження підтвердило плейотропні ефекти ОЛМ [18].
Вплив олмесартану медоксомілу на периферичний атеросклероз
У рандомізованому клінічному дослідженні VIOS (Vascular Improvement with Olmesartan medoxomil Study) було вивчено вплив ОЛМ (20–40 мг/добу) на процеси ремоделювання артерій нижніх кінцівок малого діаметра в пацієнтів (61 % чоловіків; вік від 38 до 67 років) з м’якою АГ (n = 100) порівняно з атенололом (50–100 мг/добу) [53]. У кінці дослідження, що тривало 12 місяців, терапія ОЛМ, на відміну від атенололу, приводила до достовірного зниження відношення товщини судинної стінки до діаметра просвіту судини, що вказувало на зворотний розвиток гіпертрофії судинної стінки, пов’язаної з АГ.
Ці дані свідчать про ангіопротективні ефекти ОЛМ. Причому ці ефекти не залежали від антигіпертензивної дії, оскільки ступінь зниження артеріального тиску в обох препаратах виявився однаковим [53].
В іншому дослідженні MORE (Multicentre Olmesartan atheroscle rosis Regression Evaluation) вивчалася динаміка показників атеросклеротичного ураження артерій — товщини комплексу інтима/медіа (ТКІМ) і обсягу атеросклеротичних бляшок у 165 пацієнтів (середній вік пацієнтів 62,3 року в групі ОЛМ і 62,1 року в групі атенололу) з АГ (САТ/ДАТ — 140–180/90–105 мм рт.ст.) на тлі терапії ОЛМ або атенололом протягом 2 років [54]. За даними 3D-ультразвукового дослідження вивчали зміни ТКІМ судинної стінки й об’єму атеросклеротичних бляшок на тлі прийому 20–40 мг ОЛМ порівняно з атенололом у дозі 50–100 мг через 28, 52 і 104 тижні безперервної терапії. ОЛМ достовірно зменшував показники ТКІМ сонних артерій, що підтверджувало вазопротекторний ефект цього препарату. ТКІМ і АТ зменшувалися однаково на тлі прийому ОЛМ і атенололу, але тільки при прийомі ОЛМ, а не атенололу спостерігалося зменшення на 11,5 мкл об’єму великих атеросклеротичних бляшок. За результатами аналізу холестерину терапія ОЛМ асоціювалася з більш вираженим зменшенням об’єму атеросклеротичних бляшок сонних артерій порівняно з атенололом незалежно від антигіпертензивного ефекту препаратів [54].
Нефропротекторний ефект олмесартану медоксомілу
Запобігання розвитку мікроальбумінурії було продемонстровано у великому дослідженні ROADMAP (Randomised Olmesartan and Diabetes Microalbuminuria Prevention). У багатоцентровому подвійному сліпому плацебо-контрольованому дослідженні брали участь 4449 пацієнтів із ЦД 2-го типу [20]. Основна мета дослідження — вивчення ефективності ОЛМ (40 мг/добу) для уповільнення або запобігання розвитку мікроальбумінурії протягом 3,2 року. Хворі рандомізовані на дві групи: в основній групі до базового лікування пацієнтів додавали ОЛМ (40 мг/добу), а в контрольній групі — плацебо. При цьому в контрольній групі як антигіпертензивну терапію застосовували всі класи препаратів, крім ІАПФ і БРА. В обох групах для досягнення цільових рівнів АТ (< 130/80 мм рт.ст.) могли додаватися будь-які АГП (крім ІАПФ і БРА). У дослідженні брали участь пацієнти як з АГ, так і без АГ.
Головний результат дослідження полягав у тому, що в групі ОЛМ частота виникнення МАУ була істотно нижче, ніж у групі хворих, які перебували на традиційній терапії. Ця різниця була вираженою (23 %) і достовірною (коефіцієнт імовірності виникнення мікроальбумінурії 0,77; 95% довірчий інтервал від 0,63 до 0,94; р = 0,01), а також була показана ефективність ОЛМ в уповільненні прогресування ниркової патології і збільшенні часу виникнення МАУ порівняно з плацебо в середньому на 146 днів [20].
Трохи менше пацієнтів у групі ОЛМ, ніж у групі плацебо, мали нефатальні серцево-судинні події — 81 з 2232 пацієнтів (3,6 %) порівняно з 91 з 2215 пацієнтів (4,1 %, р = 0,37), але було більше смертельних випадків від серцево-судинних подій — 15 пацієнтів (0,7 %) порівняно з 3 пацієнтами (0,1 %, р = 0,01). Ця різниця частково пояснюється великою кількістю пацієнтів з ІХС у групі ОЛМ, ніж у групі плацебо (11 з 564 пацієнтів [2,0 %] проти 1 з 540 [0,2 %], р = 0,02 відповідно). Отже, дослідження ROADMAP довело ефективність ОЛМ у запобіганні виникненню МАУ. Це було перше дослідження, у якому продемонстровано ранній нефропротекторний ефект БРА [20].
Комбінації олмесартану медоксомілу з іншими гіпотензивними препаратами
У більшості пацієнтів з АГ для контролю артеріального тиску необхідне призначення двох і більше антигіпертензивних засобів. Згідно з рекомендаціями Європейського товариства кардіологів 2018 р., монотерапія можлива тільки в пацієнтів низького ризику з АГ 1-го ступеня (САД < 150 мм рт.ст.), дуже літніх (≥ 80 років) або в пацієнтів зі старечою астенією. Терапія інших груп пацієнтів повинна починатися з подвійної комбінації АГП в одній таблетці, що пояснюється кращою довгостроковою прихильністю до терапії і збільшенням частоти нормалізації артеріального тиску [62]. Важливим аргументом щодо вибору комбінації препаратів є багатофакторність патофізіологічних ланок розвитку АГ. Серед осіб з гіпертонією лише в невеликого числа виявляється тільки АГ, у більшості ж часто виявляються й інші чинники ССР, що впливає на вибір раціональної комбінації препаратів у даної категорії хворих.
У свою чергу, комбінації препаратів мають важливі переваги: вплив на різні патогенетичні ланки формування й прогресування АГ, що сприяє досягненню цільового рівня артеріального тиску; нівелювання несприятливих ефектів кожного препарату; можливість застосування більш низьких доз обох груп лікарських препаратів, що забезпечує зменшення кількості побічних ефектів; забезпечення більш ефективної органопротекції; зниження загального ССР [10, 62].
Для стартової гіпотензивної терапії рекомендованими комбінаціями залишаються поєднання блокаторів РААС (іАПФ або БРА) з діуретиками або БКК, переважно в одній таблетці (АІ). При цьому в низці рандомізованих клінічних досліджень (РКД) доведено перевагу саме фіксованих комбінацій АГП, метою яких є спростити терапію, зберегти її ефективність і підвищити комплаєнс пацієнтів [12, 59].
Діуретики є одним з провідних класів препаратів антигіпертензивної терапії, а їх ефективність щодо запобігання всім видам ССЗ, особливо щодо профілактики СН і причин смерті, підтверджена численними рандомізованими клінічними дослідженнями й метааналізами [12, 56]. У клінічній практиці при АГ широке застосування отримали тіазидні і тіазидоподібні діуретики, що відрізняються за фізико-хімічними властивостями, механізмом, силою і тривалістю дії. Єдиними їх спільними загальними рисами є сульфгідрильна група в молекулах, а також їх загальний механізм і сечогінна дія. Саме в результаті застосування діуретиків під час РКД були отримані перші докази на користь необхідності постійного контролю артеріального тиску і можливості ефективного зниження ССР [63]. У даний час існує декілька тіазидних діуретиків, але гідрохлортіазид (ГХТЗ) продовжує залишатися найбільш популярним тіазидом, що використовується для лікування високого артеріального тиску. І це — незважаючи на кілька клінічних досліджень, у яких було задокументовано переваги хлорталідону щодо лікування АГ [12, 17].
Хоча вважають, що тіазидоподібні діуретики мають значні переваги перед тіазидами, у нещодавно закінченому крупномасштабному ретроспективному дослідженні, у якому порівнювали ефективність і безпеку хлорталідону і ГХТЗ як препаратів першої лінії для лікування АГ у 730 225 пацієнтів, G. Hripcsak et al. показали, що ГХТЗ був таким же ефективним, як і хлорталідон, у запобіганні таким серцево-судинним ускладненням, як гострий ІМ, госпіталізація з приводу СН, ішемічний або геморагічний інсульт, а також комбінований результат ССЗ із перших 3 кінцевих точок і раптова серцева смерть. При цьому для хлорталідону спостерігався значно гірший профіль безпеки, тому що такі побічні явища, як нові випадки ЦД, гіпокаліємії, подагри і ХХН, зустрічалися достовірно рідше в групі, що одержувала ГХТЗ [23].
Основним фактором, що обґрунтовує дані переваги ГХТЗ перед хлорталідоном, є відмінність у фармакокінетиці. Період напіввиведення хлорталідону варіює від 40 до 72 год, у той час як для ГХТЗ цей показник становить 6–15 год. У популяціях пацієнтів з порушеннями ниркової функції уникнення призначення препаратів з тривалим періодом напіввиведення допомагає зменшити ймовірність побічних ефектів. Більш короткий період напіввиведення ГХТЗ потенційно міг би розглядатися як недолік відносно 24-годинного контролю артеріального тиску. Проте доведено, що комбінована терапія ОЛМ/ГХТЗ забезпечує підтримання антигіпертензивного ефекту протягом усього 24-годинного міждозового інтервалу в різних підгрупах пацієнтів [38, 51].
За даними ще одного метааналізу плацебо-контрольованих досліджень з використанням тіазидів, хлорталідону й індапаміду, ефективність ГХТЗ щодо серцево-судинних кінцевих точок була такою ж, як і тіазидоподібних діуретиків [46, 56]. Що ж стосується гіпотензивного ефекту, то як ГХТЗ, так і хлорталідон виявилися досить ефективними [30]. У вигляді монотерапії або в комбінації з калійзберігаючими препаратами ГХТЗ використовувався в РКД як антигіпертензивний засіб і також продемонстрував добру ефективність [44].
Гідрохлортіазид також широко застосовується в комбінації з іншими АГП [58]. ГХТЗ активує РААС, що обумовлює користь його спільного призначення з БРА й інгібіторами АПФ. Антигіпертензивна відповідь ГХТЗ відрізняється варіабельністю й закономірністю: чим вище вихідний рівень АТ, тим більше його зниження. Хоча в деяких пацієнтів препарат може бути ефективним у добовій дозі 12,5 мг, у складі комбінованої антигіпертензивної терапії активно використовується доза 25 мг [44].
У даний час для тривалої терапії виправдане використання лише низьких доз тіазидних діуретиків. У низьких дозах ГХТЗ є метаболічно нейтральним препаратом, тому не викликає суттєвих порушень вуглеводного й ліпідного обміну, значного підйому рівня сечової кислоти [39]. Другим варіантом зниження ризику розвитку побічних ефектів при застосуванні ГХТЗ може бути його використання разом з ІАПФ або БРА. Інтерес становить фіксована комбінація ГХТЗ у поєднанні з потужним і високоефективним БРА тривалої дії ОЛМ. У численних РКД із застосуванням цієї комбінації була переконливо доведена, з одного боку, можливість зниження ризику гіпокаліємії, а з іншого — посилення ефективності діуретиків у даній комбінації [1].
Посилення гіпотензивного ефекту фіксованої комбінації ОЛМ/ГХТЗ порівняно з монотерапією низькими дозами оцінили в дослідженні OLMEBEST, у якому вивчалася ефективність і переносимість олмесартану в пацієнтів з м’якою і помірною АГ як у монотерапії, так і в комбінації з ГХТЗ, якщо це було необхідно для досягнення цільових рівнів АТ [5]. Усі комбінації OЛM/ГХТЗ давали більше зниження артеріального тиску, ніж їх окремі компоненти, і добре переносилися пацієнтами.
В іншому дослідженні BENIFICIARY проводили оцінку ефективності добового амбулаторного АТ у пацієнтів з АГ і ЦД 2-го типу при посиленні монотерапії ОЛМ (20–40 мг) комбінацією OЛM/ГХТЗ (40/12,5 і 40/25 мг) для досягнення цільового рівня АД ≤ 120/70 мм рт.ст. Ґрунтуючись на цих результатах, розробили алгоритм лікування з використанням OЛM/ГХТЗ у 12-тижневому відкритому багатоцентровому дослідженні BeniSILVER; він виявився ефективним і досить безпечним у забезпеченні 24-годинного контролю артеріального тиску в літніх людей старше від 65 років з АГ [3, 28].
Отже, призначення фіксованої комбінації ОЛМ з ГХТЗ у низьких дозах (12,5–25 мг) у пацієнтів з АГ, що представлена на фармакологічному ринку препаратом Олметек плюс, забезпечує додатковий добрий контроль АГ протягом доби при сприятливій його переносимості в різних групах пацієнтів. Препарат Олметек плюс використовується для стартової терапії АГ при неефективності інших комбінацій або монотерапії.
Другий крок лікування АГ — потрійна комбінація в одній таблетці
Подвійна комбінація антигіпертензивних препаратів, згідно з результатами клінічних досліджень, може дозволити досягти контролю АТ приблизно у двох третин пацієнтів [31]. Пацієнтам, які не досягають адекватного зниження артеріального тиску на фоні подвійної комбінації або не досягають цільових цифр АТ на інших потрійних комбінаціях, пацієнтам високого й дуже високого ризику з початково високими значеннями АТ, коморбідним пацієнтам з низькими цільовими значеннями АТ (при ураженні нирок, ЦД) показане посилення терапії з призначенням трьох антигіпертензивних препаратів. За даними клінічних досліджень, потрійна комбінація забезпечує контроль АТ у > 80 % хворих, що істотно перевищує нинішні показники європейських країн серед пацієнтів, які отримують лікування [63]. При цьому, згідно з європейськими рекомендаціями лікування АГ за 2018 рік, як базова зберігає свій пріоритет потрійна комбінація блокаторів РААС, БКК і тіазидних діуретиків (АІ) в одній таблетці.
У низці досліджень було доведено, що включення третього компонента в комбінацію більш ефективне щодо посилення антигіпертензивної дії порівняно з тактикою, яка передбачає підвищення доз препаратів. Так, у багатоцентровому рандомізованому подвійному сліпому дослідженні TRINITY (Therapy With Olmesartan Medoxomil, Amlodipine, and Hydrochlorothiazide in Hypertensive Patients Study) у пацієнтів (n = 2492) віком ≥ 18 років (середній вік 55,1 ± 10,9 року) з ГХ, які отримували лікування двома антигіпертензивними засобами, для досягнення нормалізації артеріального тиску використовували комбінації трьох препаратів [40].
S. Oparil et al. визначили, що на 12-му тижні лікування потрійна комбінація (ОЛМ 40 мг/АМЛ 10 мг/ГХТЗ 25 мг) мала клінічні переваги у вигляді значно більшого зниження середнього ДАТ і САТ у положенні сидячи порівняно з подвійними комбінаціями (ОЛМ 40 мг/ГХТЗ 25 мг і АМЛ 10 мг/ГХТЗ 25 мг) у пацієнтів, які мали середній і тяжкий ступінь АГ. А також значно більший відсоток пацієнтів, які отримували потрійне комбіноване лікування (69,9 %), досягли цільових показників АТ < 140/90 мм рт.ст. на 12-му тижні порівняно з подвійними комбінаціями (52,9; 53,4 і 41,1 % у групах, які отримували OЛM 40 мг/AMЛ 10 мг, OЛM 40 мг/ГХТЗ 25 мг і AMЛ 10 мг/ГХТЗ 25 мг відповідно, р < 0,001). Усі схеми лікування в цьому дослідженні, як правило, добре переносилися [40].
В іншому цільовому відкритому багатоцентровому дослідженні BP-CRUSH (4-та фаза) оцінювали ефективність переходу пацієнтів, які не конт–ролювалися антигіпертензивною монотерапією, на комбінації фіксованих доз АМЛ і ОЛМ з подальшим додаванням ГХТЗ для 20-тижневого активного періоду лікування [61]. У дослідженні брали участь 1406 пацієнтів (середній вік 55,6 ± 11,4 року) з гіпертонічною хворобою, які мали неконтрольовані цифри АТ через місяць антигіпертензивної монотерапії (середній САТ 140–180 мм рт.ст. і ДАТ 100–110 мм рт.ст.) протягом 2 послідовних вимірювань під час скринінгу. Пацієнти, які не досягли цільових цифр АТ, були переведені на терапію з фіксованою дозою AMЛ/OЛM 5/20 мг. Кожні 4 тижні для досягнення цільового рівня АТ < 120/70 мм рт.ст. пацієнтам посилювали терапію збільшенням дози AMЛ/OЛM до 5/40 мг і 10/40 мг. Потім через 4 тижні пацієнтам до терапії AMЛ/OЛM 10/40 мг додавали ГХТЗ у дозі 12,5 мг або 25 мг. До кінця 12-го і 20-го тижнів сукупний відсоток пацієнтів, які досягли цільового рівня артеріального тиску, становив 71,3 і 84,8 % відповідно. Добовий моніторинг АТ (n = 243) показав, що ефективність терапії зберігалася 24 години. На 12-му і 20-му тижнях лікування 73,4 і 90,5 % пацієнтів відповідно досягли цільового рівня середньодобового амбулаторного АТ (р < 0,01). Також було виявлено, що на 12-му і 20-му тижнях терапії достовірно більша частка пацієнтів досягла цільового рівня (< 135/85 мм рт.ст.) середньоденного АТ (72,9 і 88,4 % пацієнтів відповідно) і середньонічного АТ (62,0 і 78,9 % пацієнтів відповідно). З 150 пацієнтів, які були на початку лікування, за даними добового моніторингу артеріального тиску, dippers, на 20-му тижні лікування 112 (74,7 %) залишилися dippers і 38 (25,3 %) стали non-dippers. У більшості випадків терапія переносилася задовільно, побічні явища, викликані лікуванням, спостерігалися переважно легкого й середнього ступеня тяжкості (53,0 %). Цей алгоритм терапії, що добре переносився, дозволив безпечно досягти в більшого відсотка пацієнтів з неконтрольованою гіпертензією на монотерапії контролю над АТ на медикаментозному лікуванні комбінацією АМЛ/ОЛМ з додаванням ГХТЗ [61]. Отже, фіксована комбінація ОЛМ/АМЛ/ГХТЗ (Севікар НСТ) — новий препарат з покращеними властивостями, завдяки яким можливий більш якісний контроль артеріального тиску в пацієнтів з коморбідною патологією при задовільній безпеці й добрій переносимості, що забезпечує більш виражену дію, ніж кожен з компонентів у монотерапії або при їх поєднанні.
Висновки
1. Олмесартан — сьомий блокатор АТ1-рецептора АТII, що має унікальні особливості будови молекули (подвійний зв’язок з рецепторами, здатність потенціювати АПФ2), за рахунок чого забезпечує незалежно від ранкового або вечірнього прийому потужний добовий гіпотензивний ефект, який порівняно з іншими препаратами з групи сартанів настає достовірно раніше.
2. Олмесартан — препарат вибору в пацієнтів з помірною і вираженою АГ і коморбідною патологією, у тому числі в пацієнтів з ІХС, ЦД 2-го типу і хронічною хворобою нирок, оскільки має плейотропні ефекти, а також кардіо-, ангіо- і ренопротективні властивості.
3. Включення другого і третього компонента в комбіновану терапію АГ є більш ефективним підходом щодо посилення антигіпертензивної дії порівняно з тактикою, що передбачає підвищення доз препаратів. Застосування в клінічній практиці фіксованих подвійних (Олметек плюс) і потрійних комбінацій (Севікар НСТ) дозволить збільшити прихильність пацієнтів до терапії, що значно покращить можливості ефективного лікування хворих на АГ.
Конфлікт інтересів. Не заявлений.
Отримано/Received 17.05.2021
Рецензовано/Revised 27.05.2021
Прийнято до друку/Accepted 04.06.2021
Список литературы
1. Бубнова М.Г. Блокатор рецепторов ангиотензина II олмесартан в прерывании сердечно-сосудистого и кардиоренального континуума: антигипертензивные и нефропротективные эффекты. Часть 1. Кардиосоматика. 2014. № 5 (3–4). C. 32-37.
2. Несукай Е.Г. Возможности сартанов в лечении артериальной гипертензии и коморбидных состояний: выбор олмесартана. Артертериальная гипертензия. 2016. № 2(46). C. 11-20.
3. Сиренко Ю.Н., Рековец О.Л. Роль олмесартана в лечении артериальной гипертензии. Артериальная гипертензия. 2009. № 2(4).
4. Стрес і хвороби системи кровообігу. За ред. В.М. Коваленка, В.М. Корнацької. Київ, 2015. 354 с.
5. Barrios et al. Blood pressure goal achievement with olme-sartan medoxomil-based treatment: additional analysis of the OLMEBEST study. Vascular Health and Risk Management. 2009. Vol. 5. P. 723-729.
6. Bergmann K., Laeis P., Puchler K. et al. Olmesartan medoxomil: influence of age, renal and hepatic function on the pharmacokinetics of olmesartan medoxomil. J. Hypertens. 2001. Vol. 19. Suppl. 1. P. 33-40.
7. Brunner H.R. Clinical efficacy and tolerability of olmesartan. Clin. Ther. 2004. Vol. 26. Suppl. A. P. 28-32.
8. Burnier M. Angiotensin II type 1 receptor blockers. Circulation. 2001. Vol. 103(6). P. 904-912.
9. Chamsi-Pasha M.A.R., Shao Z., Tang W.H.W. Angiotensin-Converting Enzyme 2 as a Therapeutic Target for Heart Failure. Curr. Heart Fail. Rep. 2014. Vol. 11. P. 58-63.
10. Chrysant S.G., Marbury T., Robinson T.S. Antihypertensive efficacy and safety of olmesartan medoxomil compared with amlodipine for mild-to-moderate hypertension. J. Hum. Hypertens. 2003. Vol. 17. P. 425-432.
11. Daiichi Sankyo UK Limited. Olmetec Plus film-coated tablets; summary of product characteristics. http://emc.medicines.org.uk [Accessed 2006 Mar 6].
12. Dineva S., Uzunova K., Pavlova V. et al. Network meta-analysis of efficacy and safety of chlorthalidone and hydrochlorothiazide in hypertensive patients. Blood Press. Monit. 2021. Vol. 26(2). P. 160-168.
13. Ettehad D., Emdin C.A., Kiran A. et al. Blood pressure lowering for prevention of cardiovascular disease and death: a systematic review and meta-analysis. Lancet. 2016. Vol. 87(10022). P. 957-967. [PubMed] [Google Scholar]
14. Fabia M.J., Abdilla N., Oltra R. et al. Antihypertensive activity of angiotensin II AT1 receptor antagonists: a systematic review of studies with 24 h ambulatory blood pressure monitoring. Journal of Hypertension. 2007. Vol. 25. № 7. Р. 1327-1336. [PubMed] [Google Scholar]
15. Ferrario C.M. Cardiac remodeling and RAS inhibition. Ther. Adv. Cardiovasc. Dis. 2016. Vol. 10(3). P. 162-171. [PMC free article] [PubMed] [Google Scholar]
16. Ferreira A.J., Santos R.A.S., Almeida A.P. Angiotensin-(1-7): cardioprotective effect in myocardial ischemia reperfusion. Hypertension. 2001. Vol. 38. P. 665-668.
17. Flack J., Sica D., Nesbitt S. Chlorthalidone versus hydrochlorothiazide as a preferred diuretic: is there a verdict yet. Hypertension. 2011. Vol. 57. P. 665-666.
18. Fliser D., Buchholz K., Haller H.; European Trial on Olmesartan and Pravastatin in Inflammation and Atherosclerosis (EUTOPIA) Investigators. Circulation. 2004. Vol. 110(9). P. 1103-1107.
19. Goodfriend T.L., Elliott M.E., Catt K.J. Angiotensin receptors and their antagonists. N. Engl. J. Med. 1996. Vol. 334(25). P. 1649-1654.
20. Haller H., Viberti G.C., Mimran A. et al. Preventing microalbuminuria in patients with diabetes — rationale and design of the Randomised Olmesartan And Diabetes MicroAlbuminuria Prevention (ROADMAP) Study. J. Hypertens. 2008. Vol. 24(2). P. 403-408.
21. Hartupee J., Mann D.L. Neurohormonal activation in heart failure with reduced ejection fraction. Nat. Rev. Cardiol. 2016. Vol. 14. P. 30-38.
22. Hirohata A., Yamamoto K., Miyoshi T. et al. Impact of olmesartan on progression of coronaryatherosclerosis a serial volumetric intravascular ultrasound analysis from the OLIVUS (impact of OLmesartan on progression of coronary atherosclerosis: evaluation by IntraVascular UltraSound) trial. J. Am. Coll. Cardiol. 2010. Vol. 55(10). P. 976-982.
23. Hripcsak G., Suchard M., Shea S. et al. Comparison of Cardiovascular and Safety Outcomes of Chlorthalidone vs Hydrochlorothiazide to Treat Hypertension. JAMA Intern. Med. 2020. Vol. 180(4). P. 542-551.
24. Ichikawa S., Takayama Y. Long-term effects of olme-sartan, an Ang II receptor antagonist, on blood pressure and the reninangiotensin-aldosterone system in hypertensive patients. Hypertension Res. 2001. Vol. 24. P. 641-646.
25. Jones M.R., Sealey J.E., Laragh J.H. Effects of angiotensin receptor blockers on ambulatory plasma Renin activity in healthy, normal subjects during unrestricted sodium intake. Am. J. Hypertension. 2007. Vol. 20(8). P. 907-916.
26. Kakuta H., Sudoh K., Sasamata M. et al. Telmisartan has the strongest binding affinity to angiotensin II type 1 receptor: comparison with other angiotensin II type 1 receptor blockers. Int. J. Clin. Pharmacol. Res. 2005. Vol. 25(1). P. 41-46.
27. Katsanos A.H., Filippatou A., Manios E. et al. Blood pressure reduction and secondary stroke prevention: a systematic review and metaregression analysis of randomized clinical trials. Hypertension. 2017. Vol. 69(1). P. 171-179. [PubMed] [Google Scholar]
28. Kereiakes D.J., Neutel J.M. Seated Cuff Blood Pressure-Lowering Efficacy of an Olmesartan Medoxomil-Based Treatment Regimen in Patients with Type 2 Diabetes Mellitus. Drugs R and D. 2011. Vol. 11(3). P. 251-257.
29. Kereiakes D.J., Neutel J.M., Stoakes K.A. et al. The effect of the olmesartan medoxomil-based treatment algorithm on 24-hour blood pressure in elderly patients aged 65 years and older. J. Clin. Hypertens (Greenwich). 2009. Vol. 11(8). P. 411-421. [PubMed] [Google Scholar]
30. Neff K.M., Nawarskas J.J. Hydrochlorothiazide versus chlorthalidone in the management of hypertension. Cardiol. Rev. 2010. Vol. 18(1). P. 51-56.
31. Kunz R., Friedrich C., Wolbers M., Mann J.F. Meta-analysis: effect of monotherapy and combination therapy with inhibitors of the renin angiotensin system on proteinuria in renal disease. Ann. Intern. Med. 2008. Vol. 148. P. 30-48. [PubMed] [Google Scholar]
32. Laeis P., Puchler K., Kirch W. The pharmacokinetic and metabolic profile of olmesartan medoxomil limits the risk of clinically relevant drug interaction. J. Hypertens. 2001. 19 Suppl. 1. P. 21-32.
33. Le M.T., Pugsley M.K., Vauquelin G. et al. Molecular characterisation of the interactions between olmesartan and telmisartan and the human angiotensin II AT1 receptor. Br. J. Pharmacol. 2007. Vol. 151(7). P. 952-62.
34. Ma S.F., Anraku M., Iwao Y. et al. Hydrolysis of angiotensin II receptor blocker prodrug olmesartan medoxomil by human serum albumin and identification of its catalytic active sites. Drug Metab. Dispos. 2005. Vol. 33(12). P. 1911-1919.
35. Minatoguchi S., Aoyama T., Kawai N. et al. Comparative effect of candesartan and amlodipine and effect of switching from valsartan, losartan, telmisartan and olmesartan to candesartan on early morning hypertension and heart rate. Blood Press. 2013. Vol. 22 (Suppl. 1). P. 29-37.
36. Miura S., Fujino M., Hanzawa H. et al. Molecular mechanism underlying inverse agonist of angiotensin II type 1 receptor. J. Biol. Chem. 2006. Vol. 281. P. 19288-19295.
37. Mizuno M., Sada T., Ikeda M. et al. Pharmacology of CS-866, a novel nonpeptide angiotensin II receptor antagonist. Eur. J. Pharmacol. 1995. Vol. 285(2). P. 181-188.
38. Neutel J.M. Clinical studies of CS-866, the newest angiotensin II receptor antagonist. Am. J. Cardiol. 2001. Vol. 87. Suppl. 8A. P. 37-43.
39. Olde Engberink R.H., Frenkel W.J. et al. Effects of thiazide-type and thiazide-like diuretics on cardiovascular events and mortality: systematic review and meta-analysis. Hypertension. 2015. Vol. 65. P. 1033-1040.
40. Oparil S. et al. Triple therapy with olmesartan medoxomil, amlodipine besylate, and hydrochlorothiazide in adult patients with hypertension: The TRINITY multicenter, randomized, double-blind, 12-week, parallel-group study. Clin. Ther. 2010, Jul. Vol. 32(7). P. 1252-1269.
41. Oparil S., Williams D., Chrysant S.G. et al. Comparative efficacy of olmesartan, losartan, valsartan, and irbesartan in the control of essential hypertension. J. Clin. Hypertens. 2001. Vol. 3. P. 283-291.
42. Papademetriou V. Inhibition of the renin-angiotensin-aldosterone system to prevent ischemic and atherothrombotic events. Am. Heart J. 2009. Vol. 157 (6 Suppl. 1). P. S25-30.
43. Puchler K., Laeis P., Stumpe K.O. Blood pressure response, but not adverse event incidence, correlates with dose of angiotensin II antagonist. J. Hypertens. 2001. Vol. 19. Suppl. 1. P. 41-48.
44. Punzi H.A. Integrated control of hypertension by olme-sartan medoxomil and hydrochlorothiazide and rationale for combination. Integrated Blood Pressure Control. 2011. Vol. 4. P. 73-83.
45. Resnick L.M., Catanzaro D., Sealey J.E. et al. Acute vascular effects of the angiotensin II receptor antagonist olmesartan in normal subjects: relation to the renin-aldosterone system. Am. J. Hypertens. 2004. Vol. 17(3). P. 203-208.
46. Roush G.C., Ernst M.E., Kostis J.B. et al. Head-to-head comparisons of hydrochlorothiazide with indapamide and chlorthalidone: antihypertensive and metabolic effects. Hypertension. 2015. Vol. 65. P. 1041-1046.
47. Schmieder R.E., Hilgers K.F., Schlaich M.P., Schmidt B.M. Renin-angiotensin system and cardiovascular risk. Lancet. 2007. Vol. 369. P. 1208-1219. [PubMed] [Google Scholar]
48. Schwocho L.R., Masonson H.N. Pharmacokinetics of CS-866, a new angiotensin II receptor blocker, in healthy subjects. J. Clin. Pharmacol. 2001. Vol. 41(5). P. 515-527.
49. Scott L.J., McCormack P.L. Olmesartan: a review of its use in the management of hypertension. Drugs. 2008. Vol. 68(9). P. 1239-1272.
50. Sezai A. et al. Changeover Trial of Azilsartan and Olme-sartan Comparing Effects on the Renin-Angiotensin-Aldosterone System in Patients with Essential Hypertension after Cardiac Surgery (CHAOS Study). Ann. Thorac. Cardiovasc Surg. Advance Published Date: April 18. 2016. Vol. 22(3). P. 161-167.
51. Smith D., Dubiel R., Jones M. Use of 24-hours ambulatory blood pressure monitoring to assess antihypertensive efficacy. Am. J. Cardiovasc. Drugs. 2005. Vol. 5(1). P. 41-50. [PubMed] [Google Scholar]
52. Smith D.G. Dose-response characteristics of olmesartan medoxomil and other angiotensin receptor antagonists. Am. J. Cardiovasc. Drugs. 2007. Vol. 7(5). P. 347-356.
53. Smith R.D., Yokoyama H., Averill D.B. et al. Reversal of vascular hypertrophy in hypertensive patients through blockade of angiotensin II receptors. J. Am. Society Hypertens. 2008. Vol. 2(3). P. 165-172.
54. Stumpe K.O., Agabiti-Rosei E., Zielinski T. et al. Carotid intima-media thickness and plaque volume changes following 2-year angiotensin II-receptor blockade. The Multicentre Olme-sartan atherosclerosis Regression Evaluation (MORE) study. Therap. Adv. Cardiovasc. Dis. 2007. Vol. 1(2). P. 97-106.
55. Stumpe K.O., Ludwig M. Antihypertensive efficacy of olmesartan compared with other antihypertensive drugs. J. Hum. Hypertens. 2002. Vol. 16. Suppl. 2. P. S24-S28.
56. Thomopoulos C., Parati G., Zanchetti A. Effects of blood pressure-lowering on outcome incidence in hypertension: 5. Head-to-head comparisons of various classes of antihypertensive drugs — overview and meta-analyses. J. Hypertens. 2015. Vol. 33(7). P. 1321-1341. [PubMed] [Google Scholar]
57. Turnbull F. Effects of different blood-pressure-lowering regimens on major cardiovascular events: results of prospectively-designed overviews of randomised trials. Lancet. 2003. Vol. 362. P. 1527-1535.
58. Vishram J.K., Borglykke A., Andreasen A.H. et al. Impact of age on the importance of systolic and diastolic blood pressures for stroke risk: the Monica, Risk, Genetics, Archiving, and Monograph (MORGAM) project. Hypertension. 2012. Vol. 60. P. 1117-1123.
59. Wald D.S., Law M., Morris J.K. et al. Combination therapy versus monotherapy in reducing blood pressure: metaanalys is on 11,000 participants from 42 trials. Am. J. Med. 2009. Vol. 112. P. 290-300.
60. Walters P.E., Gaspari T.A., Widdop R.E. Angiotensin-(1-7) acts as a vasodepressor agent via angiotensin II type 2 receptors in conscious rats. Hypertension. 2005. Vol. 45. P. 960-966.
61. Weir M.R., Hsueh W.A., Shawna D. A Titrate-to-Goal Study of Switching Patients Uncontrolled on Antihypertensive Monotherapy to Fixed-Dose Combinations of Amlodipine and Olmesartan Medoxomil Hydrochlorothiazide. J. Clin. Hypertens. 2011. Vol. 13. P. 404-412.
62. Williams B., Mancia G., Spiering W. et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology (ESC) and the European Society of Hypertension (ESH). Europ. Heart J. 2018. Vol. 39(33). P. 3021-3104.
63. Zhang X., Zhang H., Ma Y. et al. Management of Hypertension Using Olmesartan Alone or in Combination. Cardiol. Ther. 2017. Vol. 6(1). P. 13-32. [PMC free article] [PubMed] [Google Scholar]
/12.jpg)