Вступ
Винайдення вакцин є одним із найвизначніших досягнень охорони громадського здоров’я за останні 100 років. Вакцини внесли значний вклад у боротьбу з багатьма інфекційними захворюваннями. За даними Всесвітньої організації охорони здоров’я (ВООЗ), до початку пандемії SARS-CoV-2 сучасні програми вакцинації населення запобігали близько 6 млн смертей на рік по всьому світу [1]. Останнім часом з’являється все більше повідомлень про ефективне використання вакцин для лікування неінфекційних захворювань, зокрема, імунотерапії злоякісних пухлин (ЗП). Вперше вакцину проти ЗП, яка складалася з термічно інактивованих бактерій Erysipelothrix rhusiopathiae, застосував наприкінці XIX сторіччя американський хірург Вільям Колі. Підґрунтям для цього стали описані на той час в літературі випадки спонтанної регресії злоякісних пухлин у хворих на фоні гострих інфекційних захворювань, в першу чергу еризипелоїду. В подальшому для виготовлення вакцини В. Колі використовував суміш вбитих нагріванням Streptococcus pyogenes та Serratia mersacems, яка отримала назву «токсини Колі». Загалом В. Колі провів вакцинацію близько 1000 хворим із неоперабельними ЗП, і у близько половини всіх випадків спостерігалася спонтанна регресія пухлин, а в частини хворих тривалість регресії могла свідчити про вилікування від ЗП. Однак через відсутність теоретичного підґрунтя та чіткої методології запропоноване В. Колі лікування підлягало активній критиці, а з упровадженням променевої та хіміотерапії його підхід було надовго виключено з клінічної практики. В сучасній онкологічній практиці широко застосовується аналогічний запропонованому В. Колі метод протипухлинної терапії, а саме інстиляція вакцини БЦЖ у хворих на рак сечового міхура [2].
Успіхи імунотерапії злоякісних пухлин (інтерферони, моноклональні антитіла, інгібітори імунних контрольних точок тощо) сприяли відновленню інтересу до можливого використання вакцин для лікування злоякісних пухлин. Ідеальна модель терапевтичної протипухлинної вакцини має базуватися на специфічній (адаптивній) імунній відповіді на пухлина-асоційовані антигени (ПАА), що забезпечить ефективне та безпечне лікування злоякісних пухлин та вироблення тривалого протипухлинного імунітету [3]. В дослідженнях, які вивчали антигенний склад клітин ЗП, виявлено аномально високу експресію деяких антигенів, характерних для нормальних клітин, але більшість з них мають необхідні для клінічної ефективності специфічність та імуногенність. Також у пухлинних клітинах виявлено низку антигенів (неоантигенів), що мають високу пухлинну специфічність порівняно з нормальними клітинами та достатню імуногенність для забезпечення клінічної ефективності вакцин. Близько 95 % неоантигенів унікальні для кожного хворого, що значно ускладнює адаптацію протипухлинної вакцини для великої кількості пацієнтів і тим самим унеможливлює промислове виробництво вакцин. Тому нині для виробництва протипухлинних вакцин найчастіше використовують персоналізований та/або поліклональний підхід. Поліклональний підхід виготовлення протипухлинних вакцин полягає у використанні автологічних цільноклітинних вакцин або пухлинних лізатів, включаючи неоантигени, і не вимагає ідентифікації окремих антигенів, зокрема і ПАА. Пухлинні клітини під впливом фізичних факторів (швидке заморожування/відтаювання, тепловий шок, опромінення тощо) втрачають здатність проліферувати, або проводять їх лізис з утворенням лізатів пухлин. Під час аналізу 173 опублікованих досліджень, в яких брали участь понад 3000 хворих, які отримували вакцини на основі пухлинних клітин або лізатів пухлини, об’єктивна відповідь на терапію зафіксована у 8,1 % проти 3,6 % хворих, яким проводилася антиген-специфічна терапія [4]. Однак у клінічних випробуваннях більшість вакцин не продемонстрували значної терапевтичної ефективності та не сприяли виробленню стійкого адаптивного протипухлинного імунітету. В низці досліджень виявлено, що використання вакцин для запобігання виникненню ЗП є більш ефективним, ніж застосування терапевтичних протипухлинних вакцин. З огляду на бурхливий розвиток імунотерапії ЗП в цілому та застосування протипухлинних вакцин зокрема, в даній роботі наведені узагальнені дані про доцільність, ефективність та безпечність використання вакцин для профілактики та лікування хворих на злоякісні пухлини, а також перспективи розвитку цього напрямку [5].
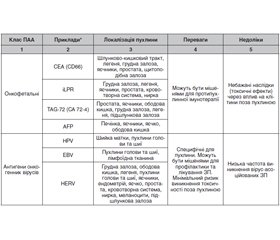
Антигени пухлини
Антигенна структура клітин пухлини має вирішальне значення у розробці протипухлинних вакцин. Мішенню більшості протипухлинних вакцин є пухлина-асоційовані антигени, які аномально експресуються клітинами ЗП. Виділяють такі класи ПАА: онкофетальні та антигени, які походять з онкогенних вірусів, пухлинні антигени зародкової тканини (Cancer-testis antigens), тканиноспецифічні антигени пухлин, пухлиноспецифічні мутовані антигени, нормальні клітинні білки, що аберантно експресуються пухлинними клітинами. В табл. 1 наведено основні класи ПАА [6].
Є декілька перешкод на шляху розробки вакцин, дія яких спрямована на ПАА.
По-перше, до ПАА, які є автоантигенами, існує природна або набута імунна толерантність, тому В- та Т-лімфоцити, які розпізнають ці антигени, могли бути вилучені з пулу імунних клітин організму. Тому протипухлинна вакцина повинна «порушити» імунну толерантність до ПАА шляхом стимуляції Т-клітини внаслідок використання сильних ад’ювантів, костимуляторів та повторної вакцинації. Але попри ці модифікації в клінічних випробуваннях протипухлинні вакцини, спрямовані на ПАА, не продемонстрували достатньої імунної відповіді, необхідної для досягнення вираженого клінічного ефекту. В більшості випадків такі вакцини призводять до активації та проліферації CD8 антиген-специфічних Т-лімфоцитів до рівня < 1 % від загальної кількості циркулюючих CD8-Т-лімфоцитів, що значно нижче порівняно з ефективними противірусними вакцинами, застосування яких призводить до рівня CD8 антиген-специфічних Т-клітин > 5 % від загальної кількості [7]. Наприклад, вакцина проти віспи (Dryvax) стимулює збільшення до 40 % від загальної кількості активованих противірусних CD8-Т-клітин, а вакцина PROSTVAC-VF, націлена на PSA, при метастатичному раку передміхурової залози індукує близько 0,03 % антиген-специфічних Т-лімфоцитів, що стало причиною зупинки клінічного випробування вакцини PROSTVAC-VF у ІІІ фазі [8]. Окрім збільшення кількості антиген-специфічних Т-лімфоцитів у периферичній крові, важливим прогностичним показником ефективності протипухлинних вакцин є кількість Т-лімфоцитів, що інфільтрують пухлину (ЛІП). Кількість ЛІП може бути більш інформативним показником прогнозування ефективності в клінічних дослідженнях, але обмежує вивчення ефективності протипухлинних вакцин у ад’ювантному режимі.
По-друге, вакцини проти ПАА можуть мати побічний вплив на здорові клітини, які також можуть експресувати, хоча і меншою мірою, порівняно з клітинами пухлини, ці антигени. Протипухлинні вакцини, що нині існують, мають незначні побічні ефекти, але у багатьох випадках вони були неефективними, що свідчить про їх низьку активність, зокрема і проти антигенів нормальних клітин. Так, наприклад, Т-клітинна вакцина, спрямована на раково-ембріональний антиген (СЕА), що також експресується в нормальній кишковій тканині, продемонструвала клінічну ефективність у хворих на метастатичний колоректальний рак, але викликала тяжкий коліт [9]. Цілком імовірно, що при підвищенні клінічної ефективності протипухлинних вакцин, особливо на основі ПАА, які експресуються нормальними клітинами, можливе збільшення кількості або вираженості їх побічних ефектів. Тому дослідження та подальший вибір ПАА має вирішальне клінічне значення для розробки протипухлинних вакцин.
Характеристика протипухлинних вакцин
Накопичені на сьогодні дані про канцерогенез свідчать, що імунна система має здатність розпізнавати трансформовані злоякісні клітини та обмежувати ріст пухлини, тому вакцинація розглядається як перспективний метод профілактики та лікування раку. Управління з санітарного нагляду за якістю харчових продуктів та медикаментів (FDA) схвалило застосування з метою профілактики раку шийки матки вакцин (Gardasil® та Cervarix®) проти віруса папіломи людини (тип 16 та 18), який є причиною близько 70 % всіх випадків раку шийки матки. Обидві вакцини мають добру переносимість та високу імуногенність, але відсутність чітких критеріїв вибору груп населення і даних стосовно тривалості набутого після вакцинації імунітету, а також висока вартість вакцин обмежують їх широке застосування, особливо в країнах, що розвиваються, на які наразі припадає близько 80 % випадків захворювання на рак шийки матки [10]. Ще однією вакциною, що застосовується для профілактики ЗП, є вакцина проти вірусу гепатиту В (HBV). Близько 80 % випадків захворювання на первинний рак печінки пов’язано з хронічним вірусним гепатитом В. Вакцина проти HBV характеризується доброю переносимістю, високою імуногенністю й забезпечує пожиттєвий імунітет [11]. Геномна нестабільність і неповне розуміння імунної відповіді обмежують розробку ефективних профілактичних вакцин проти вірусу гепатиту С, вірусу Епштейна — Барр, Helicobacter pylori та інших інфекційних агентів, участь яких у канцерогенезі є беззаперечною. Канцерогенез більшості пухлин — процес складний і поліетіологічний, а роль інфекційних агентів у ньому або незначна, або взагалі відсутня (не доведена), що є значною перепоною на шляху винайдення профілактичних протипухлинних вакцин.
Розробка та впровадження терапевтичних протипухлинних вакцин є перспективним напрямком імунотерапії ЗП і має на меті посилення пухлиноспецифічної імунної відповіді. На сучасному етапі всі методи розробки протипухлинних вакцин можна поділити на три основні категорії: клітинні вакцини, пептидні вакцини та вакцини на основі нуклеїнових кислот. Більшість вакцин добре переносяться та мають мало побічних ефектів [3, 12, 13]. Протипухлинні вакцини на основі неочищених пухлинних лізатів, очищених пухлинних антигенів, ослаблених пухлинних клітин мають тривалу історію застосування, але низьку клінічну ефективність. Потенційні обмеження цих підходів до розробки протипухлинних вакцин пов’язані зі складністю в отриманні у великій кількості специфічних для пацієнта клітин пухлини, виробництвом вакцини (особливо при необхідності повторних вакцинацій) та наявністю великої кількості побічних контамінантів [14]. Ефективність вакцин на основі автологічних пухлинних клітин вивчалася при раку легені, колоректальному раку, меланомі, нирково-клітинному раку та раку простати. В багатьох дослідженнях для підвищення імуногенності вакцини пухлинні клітини підлягали генетичній модифікації. Наприклад, GVAX — протипухлинна вакцина на основі генетично модифікованих пухлинних клітин, що здатні до секреції гранулоцитарно-макрофагального колонієстимулюючого фактора (GM-CSF). Застосування вакцини GVAX показало обнадійливі результати в І та ІІ фазі клінічних досліджень при недрібноклітинному раку легенів, раку підшлункової та передміхурової залоз. Однак монотерапія GVAX в ІІІ фазі досліджень не була ефективною, тому наразі продовжуються дослідження ефективності комбінації цієї вакцини з іншими методами протипухлинного лікування у хворих на рак підшлункової залози та гормон-резистентний рак простати [15]. Відсутність клінічної ефективності монотерапії вакциною gemogenovatucel-T (Vigil) зафіксована при лікуванні хворих на ІІІ–ІV стадію раку яєчників [16].
Дендритні клітини (ДК) здатні поглинати та презентувати ПАА за допомогою різних механізмів, ініціюючи потужні ефекторні протипухлинні реакції. Ефективність протипухлинних вакцин на основі ДК вивчалася протягом останніх 30 років у понад 300 дослідженнях [17]. Майже всі відомі на сьогодні ПАА потенційно можуть бути завантажені та презентовані ДК, але не всі антигени, презентовані ДК, можуть стимулювати активацію імунної відповіді [18]. В 2010 році FDA схвалило застосування вакцини sipuleucel-T (Provenge) на основі автологічних ДК для лікування метастатичного гормон-резистентного раку передміхурової залози. Вакцина являє собою неочищену фракцію лейкоцитів периферичної крові пацієнта, які культивують з простатичною кислою фосфатазою (РАР) в середовищі з GM-CSF. ДК є основним активним компонентом вакцини (близько 11,2 %) і презентують антиген РАР для подальшої стимуляції та індукції антиген-специфічних Т-лімфоцитів. Ефективність терапії вивчалась у дослідженні IMPACT. Серед 512 пацієнтів з метастатичним гормон-резистентним раком простати без вісцеральних метастазів 2 : 1 отримували лікування sipuleucel-T або плацебо. Результати дослідження продемонстрували незначне, але статистично значуще збільшення загальної виживаності на 4,1 місяця хворих, які отримували Provenge, порівняно з плацебо (25,8 проти 21,7 місяця відповідно), тоді як не було значної переваги у медіані виживання без ознак прогресування (3,7 та 3,6 місяця) у групі sipuleucel-T та плацебо відповідно. У 2011–2017 роках проводилися дослідження PROCEED, в яких брали участь 1976 хворих на метастатичний гормон-резистентний рак простати. Середній вік хворих становив 72 роки, а вихідний середній рівень PSA — 15,0 нг/мл; 86,7 % були білими, а 11,6 % — афроамериканцями. При медіані спостереження 46,6 міс. зафіксовано 1255 померлих пацієнтів, 964 особи (76,8 %) померли від прогресування раку передміхурової залози. Середній час від першої інфузії sipuleucel-T до смерті від раку простати становив 42,7 місяця (95% довірчий інтервал (ДІ) 39,4–46,2 місяця). Один або декілька препаратів (абіратерон, ензалутамід, доцетаксел, кабазитаксел або радій-223) отримували 77,1 % пацієнтів після інфузії sipuleucel-T [19]. Найпоширенішими побічними явищами терапії sipuleucel-T були озноб, втома, лихоманка, біль у спині, нудота, висип, біль у суглобах та головний біль переважно легкого та середнього ступеня тяжкості. Частота побічних ефектів 3-го та 4-го ступенів становила 23,6 та 4,0 % відповідно. Результати дослідження PROCEED свідчать про ефективність та безпечність застосування вакцини Provenge у хворих на метастатичний гормон-резистентний рак передміхурової залози, але всі процеси, пов’язані з виробництвом персоналізованої вакцини, потребують дуже великих матеріальних витрат [19–21]. Висока вартість вакцини Provenge є лімітуючим фактором у її широкому клінічному використанні.
Пептидні вакцини здатні індукувати імунну відповідь на специфічні антигенні епітопи клітин ЗП і переважно не експресуються клітинами нормальних тканин. Вакцини на основі пептидів мають низьку токсичність, а їх виготовлення є відносно простою технологією. Але більшість з них мають низьку імуногенність, що пов’язано з використанням коротких пептидів (< 15 амінокислот), включаючи епітопи мінімальної довжини. Ці вакцини для посилення імуногенності потребують додавання ад’юванта: GM-CSF, білки теплового шоку (HSP), солі алюмінію, емульсії «масло у воді» (MF59) та монофосфорильний ліпід А (MPL-А) з алюмінієвою сіллю, імідазохінолін. З метою підвищення ефективності пептидних вакцин розроблені імунотерапевтичні засоби, що складаються з високоімуногенних синтетичних довгих пептидів (synthetic long peptide (SLP)). Вакцини на основі SLP здатні запобігати центральним механізмам розвитку імунної толерантності завдяки ефективній доставці антигенів до ДК, активуючи CD4+ та CD8+ Т-клітинні імунні реакції. Протипухлинні SLP вакцини (ISA101, SVN53-67/M57-KLH) продемонстрували обнадійливі результати в доклінічних випробуваннях, тому зараз їх ефективність вивчають у клінічних дослідженнях [3, 13, 22].
Перевагою протипухлинних вакцин на основі нуклеїнових кислот, як і пептидних вакцин, є відносно просте та недороге виробництво, а також їх здатність поглинатися різними антигенпрезентуючими клітинами та активувати імунну відповідь до декількох епітопів. Але через низьке поглинання клітинами нуклеїнових кислот ДНК- та РНК-вакцини демонструють низьку клінічну ефективність. Для збільшення поглинання клітинами вакцин на основі нуклеїнових кислот використовують такі методи доставки: вірусні вектори, наночастинки, генні гармати, масив мікроголок, електропорація та ін., які підвищують імуногенність до 100–1000 разів порівняно з «голими» ДНК- та РНК-вакцинами [23]. ДНК-вакцини продемонстрували протипухлинну ефективність в доклінічних дослідженнях. Так, наприклад, застосування вакцини VGX-3100, яка містить антигени Е6 та Е7 HPV, сприяє регресії пухлини у 48,2 % жінок з цервікальною інтраепітеліальною неоплазією 2-го та 3-го ступенів (CIN 2/3) порівняно з 30% регресією у хворих із групи плацебо [24]. Ефективність застосування VGX-3100 у хворих на плоскоклітинний рак шийки матки вивчається в клінічному дослідженні NCT03185013. Вакцини на основі РНК на відміну від ДНК-вакцин не вбудовуються в геном, що попереджує канцерогенність, функціонують в цитоплазмі, здатні до самовідтворення, тому зберігаються в клітині довше, і відповідно необхідна менша доза вакцини порівняно з вакцинами на основі ДНК. Нині декілька вакцин на основі РНК продемонстрували ефективність при раку нирки та меланомі у І–ІІ фазі клінічних випробувань [25].
Найпоширенішим способом введення вакцин на основі нуклеїнових кислот у клітини є вірусна трансдукція (використання вірусних векторів). Найчастіше як вектори вакцин використовують віруси з родини покс-вірусів, аденовірусів та альфа-вірусів, які ослаблені або мають дефекти реплікації для нівелювання можливих побічних ефектів вакцинації. Суттєвим недоліком використання вірусних векторів можна вважати противірусний імунітет, який обмежує ефективність повторних вакцинацій. Стратегія гетерологічної первинної імунізації, що полягає у повторному введенні одного й того ж пухлинного антигена з різними вірусними векторами, слугує для вирішення цієї проблеми. Одним із вдалих прикладів ефективного використання гетерологічної первинної імунізації для протипухлинних вакцин є препарат PROSTVAC-VF/TRICOM. У цій протипухлинній вакцині для праймінгу використовується вірус вісповакцини, який кодує простатоспецифічний антиген, а в подальшому вводяться шість бустер-доз вірусу віспи птиці, що кодує PSA. Застосування протипухлинної вакцини PROSTVAC-VF/TRICOM порівняно з плацебо призвело до збільшення загальної виживаності хворих на метастатичний гормон-резистентний рак простати на 8,5 міс. у ІІ фазі клінічних випробувань. Проте в ІІІ фазі випробування застосування вакцини не сприяло збільшенню загальної виживаності хворих на метастатичний гормон-резистентний рак простати, і дослідження було зупинено. Однією із можливих причин неефективності вакцини дослідники вважають нездатність вакцини PROSTVAC-VF/TRICOM подолати імуносупресивні механізми мікрооточення пухлини, а подальші дослідження будуть зосереджені на вивченні ефективності комбінації вакцини з іншими методами протипухлинної терапії [26].
До вакцинотерапії ЗП також можна зарахувати і застосування онколітичних вірусів. Переваги онковірусної імунотерапії порівняно з іншими протипухлинними вакцинами полягають в її специфічності щодо пухлинних клітин. Інфікування пухлинних клітин вірусами майже не залежить від експресії рецепторів, а також від мутаційної та транскрипційної стійкості, яка може виникнути у відповідь на введення вакцини. Онколітичні віруси можуть посилити або відновити вже існуючий протипухлинний імунітет, або викликати нову антигенну відповідь [27]. Вакцини на основі онколітичних вірусів мають високу імуногенність та відносно прості у виробництві. В наш час єдиною схваленою FDA онколітичною протипухлинною вакциною, що містить генетично модифікований вірус простого герпесу І типу, є талімоген лагерпарепвек (T-Vec або Imlygic) [13, 27]. В дослідженні OPTiM вивчалась ефективність застосування T-Vec у 436 хворих з нерезектабельною меланомою ІІІВ, ІІІС та ІV стадії, які раніше не отримували протипухлинного лікування. Всіх хворих рандомізували у співвідношенні 2 : 1 в групу T-Vec (295 хворих) та групу GM-CSF (141 пацієнт). Частота об’єктивної відповіді в групі T-Vec становила 26 % (11% повна регресія) проти 6 % (1% повна регресія) в групі GM-CSF. Медіана загальної виживаності дорівнювала 23,3 міс. в групі T-Vec та 18,9 міс. у контрольній групі [28]. Результати дослідження OPTiM стали потужним стимулом для розробки онколітичних імунотерапевтичних засобів.
Ефективність комбінації вакцин з іншими видами протипухлинної терапії
Монотерапія ЗП протипухлинними вакцинами у більшості випадків виявилася неефективною. Вважається, що низька клінічна ефективність монотерапії вакцинами пов’язана з адаптивними імуносупресивними властивостями пухлинних клітин та мікрооточення пухлини, а для подолання останніх доцільним є застосування протипухлинних вакцин у комбінації з іншими методами протипухлинної терапії. Комбінація протипухлинних вакцин з променевою чи хіміотерапією показала ефективність у доклінічних дослідженнях. Іонізуюче випромінювання викликає імунний стрес та загибель пухлинних клітин, що викликає активацію Т-лімфоцитів та їх міграцію в пухлину, а вакцина сприяє підтриманню пулу імунних клітин. Ефективність протипухлинної вакцини в умовах низької концентрації ПАА незначна, але завдяки цитотоксичному/цитолітичному впливу цитостатиків кількість ПАА збільшується. Наприклад, циклофосфамід з подальшим введенням протипухлинної вакцини може підвищити кількість та функціональну активність антигенспецифічних Т-лімфоцитів [29]. Дослідження з вивчення ефективності комбінованого застосування вакцини й інших методів лікування наведено в табл. 2.
/34.jpg)
/35.jpg)
У дослідженні D. Laheru та співавт. (2008) вивчали ефективність та безпечність застосування вакцини на основі двох алогенних клітинних ліній раку підшлункової залози, що генетично модифіковані для експресії GM-CSF поєднано з циклофосфамідом у хворих на поширений рак підшлункової залози. В когорті А (30 хворих) отримували тільки вакцину GVAX 1 раз на 21-й день, максимум 6 доз, а в когорті Б (20 хворих) пацієнтам вводили циклофосфамід по 250 мг/м2 внутрішньовенно за 1 день до вакцини, як когорті А. В результаті дослідження виявлено, що проведене лікування має мінімальну токсичність та сприяє стабілізації захворювання протягом 18 тижнів у 16,7 % пацієнтів з когорти А та у 40 % хворих з когорти Б. Середня тривалість життя (від уведення 1 дози вакцини до смерті пацієнта) становила 69 днів і 130 днів у когорті А та когорті Б відповідно. Медіана виживаності дорівнювала 2,3 міс. в когорті А проти 4,3 міс. у когорті Б [30].
Ефективність конкурентного використання вакцини GVAX з іпілімумабом вивчали D.T. Le та співавт. (2013) в дослідженні NCT00836407. Хворих із поширеною протоковою аденокарциномою підшлункової залози, які раніше отримували протипухлинну терапію з приводу цього захворювання, рандомізували в дві групи. В групі 1 15 хворих отримували монотерапію іпілімумабом по 10 мг/кг внутрішньовенно, а в групі 2 15 пацієнтам проводили комбіновану терапію: іпілімумаб по 10 мг/кг + GVAX перед інфузією іпілімумабу. Індукційні дози вводили кожні 3 тижні (всього 4 дози) з подальшим уведенням підтримуючих доз кожні 12 тижнів. Як і в інших дослідженнях, побічні імунні ефекти іпілімумабу 3–4-го ступеня тяжкості спостерігалися у 20 % хворих з обох груп. Медіана виживаності становила 3,6 міс. у пацієнтів групи 1 проти 5,7 міс. у групі 2 (р = 0,072). Кількість хворих, які прожили більше 1 року після початку терапії, була вище на 20 % у групі комбінованого лікування (7 % у групі 1 проти 27 % у групі 2) [31].
E. Lutz та співавт. (2011) в одноцентровому дослідженні фази ІІ вивчали ефективність та безпечність призначення вакцини GVAX для лікування 60 пацієнтів, хворих на резектабельний рак підшлункової залози, в комбінації з ад’ювантною хіміопроменевою терапією на основі 5-фторурацилу за протоколом RTOG 9704. Перше введення вакцини здійснювали через 8–10 тижнів після хірургічного лікування. Після завершення ад’ювантної хіміопроменевої терапії пацієнти отримували ще 2–4 курси лікування вакциною GVAX з інтервалом в 1 міс. П’ята та остання (шоста) ревакцинація виконувалася через 6 міс. після четвертого введення GVAX. Середня виживаність без ознак захворювання становила 17,3 міс., а дворічна загальна виживаність — 61 %. Для контролю ефективності лікування в дослідження було включено ретроспективні дані хворих на рак підшлункової залози, які проходили лікування в цій же клініці (Johns Hopkins Hospital, Балтимор, Меріленд, США) та мали аналогічні клініко-морфологічні характеристики. Медіана виживаності в групі GVAX становила 24,8 міс. проти 20,3 міс. в контрольній групі. Однорічна загальна виживаність хворих, яким проводилася тільки хіміопроменева терапія, була 81,8 %, а у групі хворих, які отримували вакцину GVAX, — 86 % [32].
Дослідження E.J. Small та співавт. (2009) мало на меті оцінити ефективність конкурентного застосування вакцини на основі клітин раку простати, що генетично модифіковані для експресії GM-CSF з доцетакселом, у хворих на метастатичний гормон-резистентний рак простати. В контрольній групі лікування передбачало призначення комбінації «доцетаксел + преднізолон». У цьому багатоцентровому дослідженні планувалась участь 600 пацієнтів, проте через відсутність ефективності експериментального лікування дослідження припинено завчасно. Серед включених у дослідження 408 хворих на гормон-резистентний рак простати медіана виживаності становила 12,2 міс. в групі «GVAX + доцетаксел» проти 14,1 міс. в контрольній групі [33].
В багатоцентровому рандомізованому дослідженні NCT00052156 оцінювалась ефективність призначення Canvaxin разом з БЦЖ у хворих на метастатичну меланому. Перед рандомізацією всім хворим проведено хірургічне видалення всіх метастатичних вогнищ. У групу 1 рандомізували 250 хворих, які отримували БЦЖ + плацебо, а у групу 2 — 246 пацієнтів з метастатичною меланомою, яким проводили комбіноване лікування Canvaxin + БЦЖ. Через низьку вірогідність ефективності лікування дослідження було припинено завчасно у квітні 2005 року. Медіана загальної виживаності та 5-річна загальна виживаність хворих становила 38,6 міс. та 44,9 % відповідно в групі 1 та 31,4 міс. та 39,6 % відповідно в групі 2. Проте в деяких центрах спостереження за хворими продовжувалось, і станом на березень 2010 року медіана загальної виживаності та 5- і 10-річна виживаність в групі 1 становила 39,1 міс. та 43,3 і 33,3 % відповідно, а у групі 2 — 34,9 міс. та 42,5 і 36,4 % відповідно. В групі БЦЖ + плацебо медіана виживаності без ознак захворювання та 5- і 10-річна безрецидивна виживаність дорівнювали відповідно 7,6 міс. та 23,8 і 21,7 % проти 8,5 міс. та 30 і 30 % у групі Canvaxin + БЦЖ [34]. Тобто призначення Canvaxin та БЦЖ не є ефективним лікуванням хворих на метастатичну меланому, а тривала виживаність може бути пов’язана з хірургічним видаленням метастатичних вогнищ [35].
В дослідженні J.L. Gulley та співавт. (2019) вивчали ефективність комбінації «PROSTVAC-VF/TRICOM + GM-CSF» у хворих на метастатичний гормон-резистентний рак простати порівняно з монотерапією PROSTVAC-VF/TRICOM або плацебо. Хворих шляхом рандомізації розподілили на три групи. Група V (n = 432) — хворі отримували монотерапію PROSTVAC, група VG (n = 432) — PROSTVAC + GM-CSF, група P (n = 433) — плацебо. Жодний застосований метод лікування не збільшив загальну виживаність хворих. Медіана загальної виживаності становила 34,4 міс. в групі V, 33,2 міс. в групі VG та 34,3 міс. в групі плацебо [26].
R.J. Amato та співавт. (2010) вивчали доцільність конкурентного застосування вакцини TroVax (MVA-5T4) та стандартної терапії (інтерлейкінотерапія, інтерферонотерапія або сунітиніб) у хворих на метастатичний світлоклітинний рак нирки у багатоцентровому рандомізованому дослідженні. TroVax — протипухлинна вакцина, що містить атенуйований вірус вісповакцини, модифікований вірусом коров’ячої віспи Ankara (MVA), який доставляє онкофетальний антиген 5T4. Всіх 733 хворих рандомізували (1 : 1) на однорідні групи за клініко-морфологічними факторами та методами стандартної протипухлинної терапії. Медіана загальної виживаності хворих, які отримували TroVax + стандартну терапію, дорівнювала 20,1 міс. проти 19,2 міс. у хворих, які отримували плацебо разом зі стандартною терапією [36].
Обговорення
Використання вакцин для лікування злоякісних пухлин має багаторічну історію. Досягнення у вивченні імунобіології злоякісних пухлин за останні десятиліття забезпечили прорив у розробці ефективних методів імунотерапії новоутворень. Зокрема, моноклональні антитіла та інгібітори контрольних імунних точок (CTLA-4 і PD-1/PD-L1) збільшили частоту регресії пухлини та виявились ефективними у хворих із пухлинами, резистентними до інших методів протипухлинної терапії. Ці досягнення стали поштовхом до подальшого вивчення імунологічних особливостей пухлинного процесу і підґрунтям для розробки нових та вдосконалення існуючих методів імунотерапії злоякісних пухлин загалом та протипухлинних вакцин зокрема. Терапевтичні протипухлинні вакцини можуть стати альтернативою імунотерапії, яка має безліч побічних ефектів, завдяки потенційній безпечності, специфічності та тривалості ефекту лікування. Теоретично можливо, що завдяки стимуляції імунної пам’яті протипухлинні вакцини можуть викликати тривалу ремісію або навіть вилікування хворих. На жаль, за рідкісним винятком, всі спроби розробки ефективної протипухлинної вакцини були невдалими. До основних проблем, які необхідно подолати для розробки ефективних протипухлинних вакцин, можна віднести такі: ідентифікація повного спектра антигенів пухлини, розробка векторів, які забезпечать максимально можливу Т-клітинну відповідь, адаптація структури вакцини для досягнення оптимальної презентації антигена антигенпрезентуючими клітинами, розробка методів подолання механізмів уникнення пухлини від імунного нагляду. Стратегії комбінації протипухлинних вакцин з іншими методами протипухлинної терапії не підвищили ефективність лікування. Багато протипухлинних вакцин було розроблено, але більшість з них не довели свою ефективність у клінічних дослідженнях. Сподіваємося, що подальші дослідження допоможуть розробити ефективні, безпечні та універсальні протипухлинні вакцини, виробництво яких не потребуватиме значних матеріальних витрат.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 09.07.2021
Рецензовано/Revised 20.07.2021
Прийнято до друку/Accepted 27.07.2021

/29.jpg)
/30.jpg)
/31.jpg)
/34.jpg)
/35.jpg)