Газета «Новости медицины и фармации» №9 (763), 2021
Вернуться к номеру
Порівняльний аналіз сучасних підходів до надання екстреної медичної допомоги при гострому коронарному синдромі в міжнародній практиці та в Україні
Авторы: Федак Б.С.(1), Забашта В.Ф.(2), Лобова І.О.(1)
(1) — Харківська медична академія післядипломної освіти, м. Харків, Україна
(2) — КНП ХОР «Центр екстреної медичної допомоги та медицини катастроф», м. Харків, Україна
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
Вступ
Останнім часом погляди на стратегію й тактику ведення хворих з гострим коронарним синдромом (ГКС) суттєво змінилися, що обумовлено впровадженням реперфузійної терапії для широкого кола пацієнтів шляхом проведення первинних перкутанних коронарних втручань і тромболітичної терапії. Як відомо, при ГКС невідкладне втручання є необхідним для запобігання розвитку або обмеження розмірів некрозу міокарда. У разі оклюзії коронарної артерії необоротні зміни в міокарді з’являються через 30–40 хвилин і в основному закінчуються через 3–6 годин залежно від стану розвитку колатерального кровотоку, потреби міокарда в кисні й деяких інших чинників. Тому відновлення коронарного кровотоку (КК) у закритій тромбом судині може обмежити ішемічний некроз лише в цей період [1–3].
Результатом розвитку наукових досліджень у галузі кардіології стала можливість реалізації концепції «золотої години» для відновлення КК, яка сформувала нове ставлення до інфаркту міокарда (ІМ) з визнанням його невідкладним станом, лікування якого вимагає екстреної госпіталізації, а надання медичної допомоги здійснюється в перші хвилини, години з моменту його розвитку в спеціалізованих кардіологічних відділеннях з блоком інтенсивної терапії, відділеннями реабілітації та санаторно-курортної реабілітації. Терапевтичне вікно для проведення реперфузійної терапії хворому є досить вузьким, особливо важливі перші хвилини та перші 6 годин після початку інфаркту, оскільки вже після 6-ї години вона є малоефективною, а після 12 годин від початку серцевого нападу — неефективною і недоцільною [3]. Саме тому успіх лікування хворих з ГКС значною мірою визначається чинником часу, а отже, і надзвичайно важливою постає роль догоспітального етапу медичної допомоги.
Останніми роками була проведена достатня кількість мультицентрових досліджень, дані яких дали можливість сформулювати основні стратегічні напрямки надання допомоги хворим з ГКС та стали підґрунтям для розробки клінічних настанов провідними національними та міжнародними організаціями, зокрема: «Рекомендацій щодо ведення хворих з гострим інфарктом міокарда з елевацією сегмента ST» (2017 р.), «Рекомендацій щодо ведення хворих з гострим коронарним синдромом без стійкої елевації сегмента ST» (2020 р.) Європейського товариства кардіологів (ESC) [4, 5], «Рекомендацій щодо ведення хворих з гострим коронарним синдромом без стійкої елевації сегмента ST» (2014 р.) Американської асоціації серця (AHA) та Американського коледжу кардіології (ACC) [6], а також уніфікованих клінічних протоколів екстреної, первинної, вторинної (спеціалізованої), третинної (високоспеціалізованої) медичної допомоги та медичної реабілітації «Гострий коронарний синдром з елевацією сегмента ST» (2014 р.) і «Гострий коронарний синдром без елевації сегмента ST» (2016 р.) України [7, 8].
З метою визначення схожих підходів і відмінностей у лікувальній стратегії хворих з ГКС у країнах світу та в Україні нами був проведений їх порівняльний аналіз відповідно до рекомендацій ESC, AHA/ACC та протоколів лікування ГКС в Україні.
Матеріали та методи
Нами був проведений порівняльний аналіз сучасних підходів до лікування гострого коронарного синдрому в Україні та за кордоном. Під час дослідження використано логічний, графічний методи та метод системного аналізу.
Відповідно до поставленої мети, матеріалами дослідження визначені дані з міжнародних рекомендацій і вітчизняних клінічних протоколів лікування хворих з гострим коронарним синдромом.
Результати та обговорення
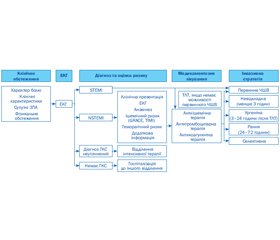
Сучасні підходи до лікування гострого ІМ, згідно з вітчизняним клінічним протоколом і міжнародними рекомендаціями, наведено на рис. 1.
Сучасний підхід вітчизняних лікарів до діагностики та лікування пацієнтів з ГКС суттєво не відрізняється від такого в інших країнах. Успішною практикою виявилося прагнення лікарів Європи до навчання населення своєчасно звертатися за допомогою при виникненні будь-якого болю у грудях, оскільки від швидко проведеної діагностики та призначеного лікування залежить подальший прогноз захворювання. За результатами дослідження «System delay and mortality among patients with STEMI treated primary percutaneous coronary intervention», мета якого полягала у визначенні залежності показників довготривалої летальності від затримки в роботі системи охорони здоров’я, встановлено, що при затримці проведення черезшкірного коронарного втручання збільшується смертність хворих упродовж 7 років. Так, при затримці проведення лікування на 181–360 хвилин смертність хворих на 7-й рік після перенесеного ГКС становить 30,8 %, водночас при затримці на 0–60 хвилин смертність становить 15,4 % випадків [9].
Саме тому в європейських рекомендаціях окремо зазначається, що від часу першого контакту медичного працівника з хворим до проведення електрокардіографії (ЕКГ) має пройти не більше 10 хвилин, від часу першого контакту до проведення фібринолітичної терапії — не більше 30 хвилин та до доставки хворого в катетеризаційну лабораторію — не більше 90 хвилин [4].
Таким чином, значна увага повинна приділятися невідкладності надання медичної допомоги при ГКС, не менш важливим є також і своєчасне звернення пацієнта до лікарів.
Згідно з сучасними як європейськими, американськими, так і національними рекомендаціями, особлива увага в діагностиці ГКС надається деталізації скарг (характеристик болю у грудях), електрокардіографічному обстеженню, а також обов’язково визначається ішемічний ризик (за критеріями GRACE, TIMI) та геморагічний ризик, від яких залежить подальша тактика ведення хворого. Основні методи лікування також включають антиішемічну, антитромбоцитарну й антикоагулянтну терапію [4–8].
Як відомо, під ГКС розуміють клінічні прояви гострої недостатності коронарного кровообігу, яка виникає, як правило, внаслідок атеросклерозу коронарних артерій. У більшості випадків патоморфологічною основою цього стану є порушення цілісності атеросклеротичної бляшки, що супроводжується її тромбозом. Згідно з сучасними уявленнями, ГКС включає три основні стани, зокрема з підйомом сегмента SТ, ІМ без підйому сегмента SТ і нестабільну стенокардію. Необхідно зазначити, що особливості патогенезу й клінічної картини ГКС зумовлюють найбільш істотні організаційні принципи та особливості лікувально-діагностичних підходів [3, 10].
Не викликає сумніву, що провідне місце в діагностиці ГКС займає ЕКГ, оскільки вона є найбільш інформативним методом дослідження. Значною мірою саме динаміка сегмента SТ на ЕКГ у хворого з ГКС визначає часові терміни для відновлення КК, основного патогенетичного методу лікування ГКС, а також і методи його реалізації — транслюмінальна коронарна ангіопластика, ферментативний тромболізис або їх поєднання [3].
На сьогодні основою лікування ГКС з елевацією сегмента ST є найшвидше відновлення кровопостачання міокарда на рівні як епікардіальної артерії, так і мікросудин, що досягається виконанням первинного черезшкірного втручання (ЧШВ) [11, 12]. У разі обмеженої його доступності обґрунтовано використання тромболітичної терапії (ТЛТ), яка покращує прогноз порівняно з лікуванням без реперфузії [4]. ТЛТ може бути використана як етап перед проведенням ЧШВ у складі так званої фармакоінвазивної стратегії [13]. Так, ТЛТ є максимально ефективною в перші 3 год від початку інфаркту, і в цьому випадку її ефективність порівнянна з ефективністю ЧШВ. У більш пізні терміни (3–12 годин від початку симптоматики) результати застосування ЧШВ є значно кращими за результати тромболізису. Разом з тим провідним методом лікування зазначених пацієнтів на сьогодні залишаються ЧШВ, що доведено в численних рандомізованих контрольованих клінічних випробуваннях (DANAMI-2, PRAGUE-2, SIAM-III) [14]. Так, результати довгострокового спостереження свідчать, що кількість смертей при застосуванні тромболітичної терапії та первинного ЧШВ становить відповідно 12,8 і 9,65 %, кількість інфарктів — 10,0 і 4,8 %, комбінована кінцева точка (загальна кількість смертей, повторних інфарктів) — 19 і 12 %.
Необхідно зазначити, що рекомендаціями Європейського товариства кардіологів запропонована схема лікування пацієнтів з гострим інфарктом міокарда з елевацією сегмента ST в перші 12 годин від початку симптоматики. У разі, якщо діагноз встановлено в зазначений проміжок часу і є можливість доставити хворого в центр, де проводяться ургентні ЧШВ, пацієнту показано виконання первинного ЧШВ без будь-якої іншої попередньої репер–фузійної терапії. Якщо діагноз встановлено протягом перших 3 год і немає можливості протягом найближчих 12 год виконати ургентне ЧШВ, необхідно негайно провести ТЛТ. Якщо тромболітична терапія в цьому випадку виявилася безуспішною, потрібно проводити ЧШВ як рятівний захід. Після успішної ТЛТ ЧШВ слід здійснювати лише в тих випадках, коли є можливість провести дану процедуру в перші 24 години від початку симптоматики. Отже, згідно з рекомендаціями Європейського товариства кардіологів, ТЛТ як самостійний вид відновлення перфузії допускається лише в тому випадку, якщо тромболізис проведено успішно, при цьому не було можливості виконати ЧШВ після тромболізису в перші 24 год від початку симптоматики й у хворого при виписці зі стаціонару відсутні симптоми стенокардії. Таким чином, серед усіх лікувальних тактик, спрямованих на відновлення перфузії міокарда при гострому інфаркті міокарда з елевацією сегмента ST, перевагу необхідно віддавати не системним, а інвазивним методам лікування.
Іншим важливим тестом поряд з ЕКГ для деталізації діагнозу є вимірювання рівня біомаркерів в крові. Так, на сьогодні існують декілька біомаркерів (кардіомаркерів), визначення яких використовується лікарями при підозрі на ГКС. До них відносяться білки, які потрапляють в кровоток у випадку некрозу клітин міокарда: тропоніни (І та Т), міоглобін і креатинкіназа-МВ (СК-МВ).
Найбільш специфічним і чутливим кардіомаркером є тропонін, який продукується клітинами серця, наявність його в крові свідчить про ушкодження міокарда. При цьому тропонін з’являється в крові через 3 години після інфаркту міокарда та визначається в ній упродовж 3–8 діб. Міоглобін не є специфічним лише для міокарда, тому окремо цей біомаркер не визначається, проте перевагою є рання його поява в крові при інфаркті міокарда (перші 1–4 години), що може опосередковано підтвердити діагноз ГКС. Визначення рівня СК-МВ вважалося одним із найкращих методів підтвердження некрозу міокарда, проте на сьогодні відомо, що він виділяється в кровоток через 2–6 годин після інфаркту міокарда і через 72 години знову досягає нормальних цифр. Також СК-МВ не є суто специфічним для гострого інфаркту міокарда, що може призводити до діагностичних помилок. Таким чином, у випадку наявності болю у грудях протягом 6 годин найкращим варіантом визначення біомаркерів є комбінація визначення рівня тропоніну та міоглобіну, що дозволить виявити наявність та ступінь ушкодження, а також визначити прогноз перебігу захворювання [15].
Початкова симптоматична терапія ГКС не має суттєвих відмінностей у випадку лікування пацієнтів зі STEMI та NSTEMI. В обох випадках використовуються такі методи терапії:
- антитромбоцитарна терапія;
- антикоагулянтна терапія;
- антиішемічна терапія.
Таким чином, якщо первинна тактика лікування є однаковою в будь-якому варіанті розвитку ГКС, то в подальшому при STEMI можливим є проведення тромболізису, а у випадку NSTEMI — ЧШВ (стентування або аортокоронарне шунтування).
Антитромботична терапія є необхідним видом лікування, за допомогою якого досягається значне зменшення рівня смертності пацієнтів. До засобів, що використовуються для антитромбоцитарної терапії, відносяться декілька груп препаратів, а також застосовуються тромболізис і первинне ЧШВ. Так, з метою обмеження первинної зони ішемії або некрозу міокарда застосовуються тромболізис та ЧШВ, при цьому вторинна зона некрозу обмежується за допомогою антиагрегантів та антикоагулянтів. Обмеження обох зон пошкодження міокарда дозволяє зменшити дисфункцію лівого шлуночка, що значно покращує перебіг захворювання та зменшує смертність. На особливу увагу заслуговують антиагреганти, класичні представники яких за своїм механізмом дії можуть бути:
- інгібіторами циклооксигенази (ацетилсаліцилова кислота та її комбінації);
- тієнопіридинами (клопідогрель, тиклопідин);
- інгібіторами фосфодіестерази (дипіридамол та його комбінації);
- інгібіторами рецепторів тромбоцитів GP IIb/IIa (ептифібатид) [15].
Висновки
Проведений порівняльний аналіз світових тактик лікування хворих з ГКС, які повністю узгоджуються з вітчизняними підходами до лікування досліджуваної категорії хворих, дозволив виявити низку недоліків, зокрема відсутність єдиної системи надання медичної допомоги хворим з ГКС, також залишається невирішеним питання щодо шляхів фінансування та забезпечення препаратами й видатковими матеріалами всіх етапів надання медичної допомоги при ГКС. Значними проблемами є пізнє звернення за медичною допомогою на догоспітальному етапі, відсутність доступного фібринолітичного препарату, низька частота реперфузійної терапії, низький рівень просвітницької роботи серед пацієнтів.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
Список літератури знаходиться в редакції

/4_m.jpg)