Вступ
За рахунок відкриттів у генетиці, молекулярній біології та імунології, які відбулися протягом останніх десятиріч, значною мірою змінилися погляди на етіологію та патогенез розладів аутистичного спектра (РАС) у дітей. Одним із ключових досягнень у даному напрямку є з’ясування асоціації генетичного дефіциту фолатного циклу (ГДФЦ) із РАС, докази якої ґрунтуються на результатах щонайменше 5 метааналізів рандомізованих контрольованих клінічних досліджень та низки додаткових контрольованих випробувань, дані яких поки що належним чином не узагальнені [14, 21, 27–29]. Установлено, що ГДФЦ призводить до патологічних біохімічних змін в організмі дитини, які зумовлюють розвиток енцефалопатії з клінічною картиною РАС за рахунок прямого (метаболічного) та непрямого (імуноопосередкованого) механізмів, причому імунозалежним шляхам церебрального пошкодження зараз надають провідну роль в патогенезі даного психічного розладу. Серед індукованих ГДФЦ порушень обміну речовин в організмі дитини виділяють гіпергомоцистеїнемію, дефіцит низки вітамінів, ознаки мітохондріальної дисфункції, порушення синтезу нуклеотидів та процесів метилювання ДНК, білків і ліпідів [12, 31, 32]. Дані патологічні біохімічні зміни зумовлюють розвиток персистуючого оксидативного стресу, доказом якого є результати двох систематичних оглядів та метааналізів рандомізованих контрольованих клінічних досліджень із даної проблеми [6, 9]. Результатом таких порушень є феномени нейро- та імунотоксичності, що лежать в основі зазначених вище прямих та непрямих механізмів нейронального пошкодження в дітей із РАС. Якщо говорити про імунотоксичність, то зараз встановлено, що при ГДФЦ відзначається порушений розвиток імунної системи дитини з формуванням імунної дисфункції та дизрегуляції, які, зі свого боку, зумовлюють феномен, що отримав назву порушеного нейроімунного інтерфейсу [19, 25]. Сьогодні відомо щонайменше 3 незалежні імуноопосередковані механізми ураження центральної нервової системи (ЦНС) при ГДФЦ, зумовлені персистуючою імунною дисфункцією, що роблять суттєвий внесок у формування енцефалопатії з клінічною картиною РАС. Йдеться про розвиток нейротропних опортуністичних та умовно-патогенних інфекцій [23], автоімунних реакцій до нейронів та мієліну півкуль великого мозку [5, 10], системного та пов’язаного з цим інтрацеребрального асептичного запалення, зумовленого імунною дизрегуляцією [18, 30]. Пригнічення або усунення імунозалежних механізмів пошкодження ЦНС є перспективною стратегією лікування РАС у дітей із ГДФЦ. Зокрема, вважають, що супресія автоімунітету та нейронів та мієліну може суттєво покращити психічні функції хворих дітей. У даному напрямку вже проведено низку клінічних досліджень. Зокрема, у повідомленнях про клінічні випадки і результатах невеликих випробувань показана користь від застосування глюкокортикостероїдів та деяких інших протизапальних агентів у дітей із РАС, механізм дії яких вбачають саме в реалізації протизапальної дії та пригніченні антимозкового автоімунітету [17]. Проведено щонайменше 10 клінічних досліджень із випробування імуномодулюючого агента в/в нормального імуноглобуліну людини при РАС, що, як вважають, покращує психічні функції пацієнтів завдяки пригніченню інтрацеребрального запалення та автоімунних реакцій проти мозкових автоантигенів [1, 3, 4, 7, 8, 12, 13, 16, 20, 24, 26]. Нещодавно інфліксимаб, препарат моноклональних антитіл проти молекули фактора некрозу пухлини альфа, продемонстрував ефективність щодо пригнічення проявів гіперактивності та гіперзбудливості в дітей із РАС, асоційованими з ГДФЦ, у контрольованому клінічному дослідженні [2].
Перспектива розробки нових, більш ефективних і безпечних методів лікування імуноопосередкованої енцефалопатії в дітей із РАС є важливим завданням сучасної нейроімунології. З урахуванням того, що автоімунні реакції до автоантигенів ЦНС при РАС, як вважають, реалізуються переважно за рахунок автоантитіл, а не клітинної автоімунної реакції, перспективним для застосування в таких дітей вважається препарат моноклональних антитіл до молекули СD20 В-лімфоцитів ритуксимаб, що вже пройшов низку успішних випробувань при автоімунних хворобах з аналогічним механізмом розвитку [22]. Теоретично за рахунок індукції В-клітинної деплеції ритуксимаб може суттєво пригнітити або навіть усунути продукцію автоантитіл до мозкових автоантигенів у дітей із РАС, справляючи
нейропротекторний ефект і покращуючи тим самим психічний статус пацієнтів. Необхідне проведення спеціального клінічного дослідження з апробації ритуксимабу в дітей із РАС, асоційованими із ГДФЦ, з ознаками антимозкового гуморального автоімунітету.
Мета дослідження: вивчити ефективність застосування ритуксимабу в дітей із РАС, асоційованими з ГДФЦ, у яких відзначаються серологічні ознаки антинейронального автоімунітету, для розширення сучасного арсеналу нейропротекторної терапії при імуноопосередкованій енцефалопатії в таких випадках.
Матеріали та методи
Проаналізовані медичні дані 138 дітей віком від 3 до 8 років із ГДФЦ, у яких відзначалися клінічні прояви РАС (97 хлопчиків і 41 дівчинка). Усі вони були пацієнтами спеціалізованої нейроімунологічної клініки Vivere (реєстраційне досьє від 22.12.2018 № 10/2212-М). Отримання даних для дослідження та обробка матеріалу проводилися згідно з договором № 150221 від 15.02.2021 р. та висновком комісії біоетичної експертизи (протокол № 140 від 21.12.2020 р. НМУ імені О.О. Богомольця). Діагноз розладів спектра аутизму був установлений дитячими психіатрами за критеріями DSM-IV-TR (Diagnostic and Statistical Manual of mental disorders) та ICD-10 (The International Statistical Classification of Diseases and Related Health Problems). Патогенні поліморфні варіанти генів ензимів фолатного циклу визначали методом полімеразної ланцюгової реакції на підставі виявлення заміни нуклеотидів MTHFR C677T у моноформі (27 пацієнтів), а також у поєднанні з іншими замінами нуклеотидів — MTHFR A1298C, MTRR A66G і/або MTR A2756G (111 осіб).
Оцінювали результати серологічних досліджень сироватки крові на предмет виявлення специфічних антинейрональних автоантитіл, які валідовані як маркери автоімунних лімбічних енцефалітів у дітей і дорослих, а саме автоантитіл до глутамінокислої декарбоксилази (GADA), калієвих каналів нейронів, амфіфізину, NMDA-рецепторів нейронів, GABA, СV2, Yo, Ro, Hu, AMPAR 1 і 2. Позитивні результати таких лабораторних досліджень виявлені у 81 пацієнта.
Дані результати поєднувалися з ознаками гіперінтенсивності МР-сигналу від структур мезолімбічної системи скроневих часток півкуль великого мозку в режимах Т2 і FLAIR при проведенні МР-нейровізуалізації (рис. 1), а також з ЕЕГ-картиною скроневої медіанної епілепсії при здійсненні нейрофункціональних досліджень (рис. 2). Оскільки в даних осіб мали місце ознаки автоімунного лімбічного енцефаліту, з яким можна було пов’язати наявні клінічні нейропсихіатричні розлади, їм було запропоновано лікування ритуксимабом згідно з даними останнього систематичного огляду з проблеми терапії зазначених автоімунних уражень ЦНС [22].
/14.jpg)
Батьки 62 із 81 пацієнта з РАС з ознаками антинейронального автоімунітету погодилися на запропоновану імунотерапію. Їх діти становили досліджувану групу (ДГ). Автоантитіла до GADA мали місце серед пацієнтів ДГ у 30 осіб (48 %), до калієвих каналів нейронів — у 24 осіб (39 % випадків). Також зрідка зустрічалися автоантитіла до амфіфізину (3 особи — 5 %), NMDA-рецепторів нейронів (3 особи — 5 %) та молекули СV2 (2 особи — 3 % випадків) (рис. 3). Родичі інших 19 пацієнтів із подібним розподілом за характером антинейрональних автоантитіл відмовилися від такого лікування (контрольна група, КГ).
Оскільки сироваткові концентрації різних антинейрональних автоантитіл вимірювалися в різних одиницях, для проведення узагальненого аналізу даних використовували спеціальну бальну оцінку. Перевищення сироваткової концентрації певного автоантитіла до 20 % від верхньої межі референтних величин оцінювали як 1 бал, від 21 до 40 % — 2 бали, від 41 до 60 % — 3 бали, від 61 до 80 % — 4 бали, а більше 81 % — 5 балів. Оскільки автоантитіла до GADA і калієвих каналів нейронів зустрічалися в багатьох пацієнтів, провели окремий аналіз даних за даними показниками, що не вдалося здійснити щодо автоантитіл до NMDA-рецепторів ней-ронів, амфіфізину та СV2 через малу кількість випадків їх ідентифікації серед обстежених пацієнтів.
Ритуксимаб, препарат моноклональних антитіл до молекули СD20 В-лімфоцитів, вводили в/в краплинно в дозі 375 мг/м2 поверхні тіла дитини з частотою 1 раз на 1 місяць під контролем результатів визначення сироваткових концентрацій автоантитіл до автоантигенів нейронів мезолімбічної системи головного мозку до моменту зникнення таких автоантитіл із сироватки крові дитини. Усього проводили від 3 до 9 курсів імунотерапії ритуксимабом у дітей ДГ.
Оцінювали динаміку клінічних симптомів РАС згідно зі спеціалізованою шкалою Aberrant Behavior Checklist (АВС) у дітей ДГ і КГ для того, щоб визначити, наскільки зменшення сироваткової концентрації антинейрональних автоантитіл впливає на показники клінічного статусу пацієнтів.
Статистичну обробку матеріалу проводили шляхом порівняльного і структурного аналізів. Для визначення вірогідності відмінностей між досліджуваними показниками в групах спостереження використовували параметричний Т-критерій Стьюдента з показником довірчої ймовірності р та непараметричний критерій — число знаків Z за Ю.В. Урбахом Для дослідження асоціації динаміки сироваткових концентрацій антинейрональних автоантитіл та індикаторів церебрального пошкодження в дітей із РАС проводили розрахунок показника відношення шансів (OR) та 95% довірчого інтервалу (95% СІ).
Для проведення статистичних розрахунків користувалися програмою Microsoft Excel.
Дослідження виконувалося як фрагмент науково-дослідної роботи на замовлення МОЗ України (№ держреєстрації 0121U107940).
Результати та їх обговорення
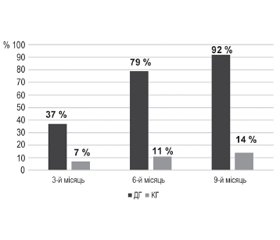
Дані структурного аналізу результатів застосування апробованої імунотерапії серед пацієнтів груп спостереження вказують, що нормалізація раніше підвищеної сироваткової концентрації антинейрональних автоантитіл у дітей ДГ після 3-місячного курсу імунотерапії ритуксимабом відзначалася в 37 % випадків, після 6-місячного — у 79 % випадків, а після 9-місячного — у 92 % випадків, тоді як у КГ аналогічні показники відповідали 7, 11 і 14 % випадків, що становило вірогідну відмінність від ДГ (р < 0,05; Z < Z0,05) (рис. 4). Середній курс імунотерапії ритуксимабом у ДГ становив 4,91 ± 0,65 місяця.
/15.jpg)
Хоча відзначалася невелика питома вага спонтанних нормалізацій сироваткових концентрацій антинейрональних автоантитіл у КГ, імунотерапія ритуксимабом асоціювалася з 5-кратним збільшенням кількості випадків отримання нормального рівня сироваткової концентрації зазначених автоантитіл вже після 3 місяців імунотерапії, 11-кратним — після 6 місяців імунотерапії і більше ніж 14-кратним — після 9 місяців застосування апробованого препарату моноклональних антитіл. Отже, використання ритуксимабу було асоційоване з прогресивним збільшенням випадків негативізації раніше позитивних результатів вимірювання концентрації антинейрональних автоантитіл у сироватці крові дітей ДГ по мірі продовження курсу імунотерапії. Тільки 8 % дітей ДГ виявили стійкість до 9-місячного курсу ритуксимабу. Додатковий аналіз показав, що всі ці діти мали бальну оцінку антинейрональної автоімунної реакції до моменту початку імунотерапії на максимальному рівні (5 балів), що вказувало на велику інтенсивність автоімунної реакції. У всіх даних дітей відмічалось зниження сироваткової концентрації антинейрональних антитіл на 9-му місяці імунотерапії щонайменше на 60 %, що вказувало на парціальну, а не тотальну резистентність до проведених імунотерапевтичних втручань.
Результати дослідження щомісячної динаміки бальної оцінки інтенсивності антинейрональної автоімунної реакції вказують, що протягом всього курсу ритуксимабу відзначалося прогресивне зменшення сироваткової концентрації антинейрональних автоантитіл у дітей ДГ. Так, середній бал оцінки антинейрональної автоімунної реакції в ДГ до моменту початку імунотерапії становив 4,32 ± 0,27 бала, тоді як після 9-місячного курсу терапії — усього 1,31 ± 0,14 бала, що свідчило про зниження інтенсивності сукупної автоімунної реакції майже в 4 рази, хоча в КГ не відзначалося суттєвої динаміки бальної оцінки автоімунітету проти нейронів ЦНС (4,01 ± 0,26 і 4,46 ± 0,47 бала відповідно), що вказувало на вірогідну різницю між результатами груп спостереження (р < 0,05; Z < Z0,05) (рис. 5).
/16.jpg)
Відзначалася затримка в серологічній відповіді на імунотерапію ритуксимабом щонайменше на 2 місяці від початку імунотерапії, що можна пояснити періодом повного розпаду передіснуючих автоантитіл до нейронів, синтезованих В-лімфоцитами до старту імунотерапевтичних втручань, який становить близько 42–46 діб.
Дані на рис. 5 свідчать, що ритуксимаб дійсно впливає на вираженість автоімунної реакції проти нейронів ЦНС у дітей із РАС, асоційованими з ГДФЦ. Причому позитивний ефект імунотерапії розвивається швидко, вже протягом перших 3 місяців імунотерапії, послідовно наростає в міру продовження курсу імунотерапії і призводить до усунення ознак автоімунітету майже у всіх випадках.
Швидкість досягнення кінцевої точки — усунення антинейрональних автоантитіл із сироватки крові пацієнтів — залежить від вихідного рівня їх сироваткової концентрації, оскільки 89 % пацієнтів ДГ, у яких відзначалося зникнення серологічних ознак автоімунітету вже після перших 3 місяців імунотерапії, мали низьку вихідну бальну оцінку автоімунної реакції лише на рівні 1–2 балів, тоді як усі пацієнти з парціальною резистентністю до ритуксимабу, які пройшли всі 9 місяців апробованих імунотерапевтичних втручань без повного усунення антинейрональних автоантитіл із сироватки крові, мали високу вихідну бальну оцінку на рівні 5 балів (р < 0,05; Z < Z0,05).
Додатково було проведено порівняльний аналіз ефективності застосування ритуксимабу при антинейрональному автоімунітеті, зумовленому автоантитілами до калієвих каналів нейронів та GADA, оскільки це дозволяла зробити значна кількість подібних випадків у ДГ (рис. 6). Сепаратний аналіз динаміки сироваткових концентрацій інших автоантитіл до нейронів ЦНС, що відзначалися в дітей ДГ, був унеможливлений малою кількістю відповідних спостережень.
Як показують результати рис. 6, ритуксимаб був ефективніший серед пацієнтів з автоантитілами до калієвих каналів нейронів, ніж при продукції автоантитіл до GADA, хоча загалом ефективність імунотерапії була достатньо високою в обох випадках. Дані результати узгоджуються з усталеними уявленнями, що ритуксимаб ефективніший при антинейрональному автоімунітеті, зумовленому автоантитілами до поверхневих автоантигенів, ніж автоантитілами до внутрішньоклітинних автоантигенів нейронів, оскільки в останньому випадку більшу питому вагу в патогенезі хвороби мають клітинні механізми автоімунітету, на які не діє застосовуваний препарат моноклональних антитіл.
Отже, при ідентифікації серологічних ознак антинейронального автоімунітету до GADA у дітей із РАС, асоційованими з ГДФЦ, слід очікувати тривалішого курсу імунотерапії ритуксимабом, ніж при виявленні автоантитіл до калієвих каналів нейронів. Можливо, для вирівнювання очікуваних термінів імунотерапії в обох зазначених випадках слід стартово застосовувати вищі дози ритуксимабу або поєднувати стандартну імунотерапію з глюкокортикостероїдами саме в пацієнтів з автоантитілами до GADA у сироватці крові.
/16_2.jpg)
Принциповим є питання, чи пов’язаний досягнутий феномен ритуксимабіндукованого усунення сироваткових антинейрональних автоантитіл з ефектом нейропротекції. Для цього вивчили асоціацію негативізації результатів серологічних тестів із нормалізацією раніше підвищених сироваткових концентрацій біомаркерів церебрального пошкодження нейронспецифічної енолази (NSE) і білка S-100 (табл. 1), релевантність яких раніше продемонстрована в спеціально спланованих контрольованих клінічних дослідженнях у дітей із РАС [15, 33].
Як видно з результатів табл. 1, зникнення сироваткових автоантитіл як до GADA, так і до калієвих каналів нейронів було асоційоване з нормалізацією раніше підвищених концентрацій обох досліджуваних лабораторних біомаркерів церебрального пошкодження, що дозволяє говорити про нейропротекторний ефект імунотерапії ритуксимабом у дітей ДГ. У підгрупі пацієнтів з автоантитілами до калієвих каналів нейронів відзначалася вираженіша асоціація динаміки серологічного показника і церебрального біомаркера порівняно з підгрупою осіб з автоантитілами до GADA, що узгоджується з результатами аналізу динаміки сироваткових концентрацій обох видів антинейрональних автоантитіл протягом курсу імунотерапії ритуксимабом у ДГ. При цьому мала місце тісніша асоціація з NSE порівняно з білком S-100, що можна пояснити тропністю виявлених антицеребральних автоантитіл у дітей ДГ. Оскільки відзначалися саме антинейрональні автоантитіла, які уражають насамперед сіру речовину головного мозку, більш інформативною виявилася саме NSE, яка характеризує пошкодження нейронів, а не білок S-100, сироваткова концентрація якого підвищується при пошкодженні білої речовини півкуль великого мозку.
Важливим було також дослідити клінічну значимість феномену ритуксимабіндукованого зникнення автоантитіл до нейронів ЦНС у дітей ДГ, оскільки досі ведуться дискусії щодо ролі антинейронального автоімунітету в патогенезі РАС у дітей. Дані динаміки бальної оцінки психічного стану дітей за шкалою АВС вказують на суттєве покращення з боку усіх досліджуваних показників у дітей, які отримували імунотерапію ритуксимабом, порівняно з пацієнтами КГ. Спостерігалися зниження вираженості клінічних проявів гіперактивності та гіперзбудливості, поліпшення зорового контакту і поведінки, зростання загальної бальної оцінки психічного розвитку дитини. Дані клінічні ефекти розвивалися і поглиблювалися протягом курсу імунотерапії в міру зниження сироваткових концентрацій автоантитіл до нейронів ЦНС (табл. 2).
/17.jpg)
Дані з табл. 2 вказують, що автоімунітет до нейронів ЦНС є важливим компонентом патогенезу РАС у дітей із ГДФЦ, а усунення серологічних проявів антинейронального автоімунітету за допомогою ритуксимабу асоційоване з вірогідним покращенням із боку психічного стану дітей. Отже, імунотерапія ритуксимабом модифікує психічний стан дітей із РАС, асоційованими з генетичним дефіцитом фолатного циклу, рівномірно впливаючи на всі основні клінічні ознаки психічної хвороби.
Висновки
Лікування ритуксимабом призводить до прогресивного зниження сироваткової концентрації антинейрональних автоантитіл у пацієнтів із РАС, асоційованими з ГДФЦ, із вираженішим ефектом у разі продукції автоантитіл до калієвих каналів нейронів порівняно з автоантитілами до GADA, з повним усуненням всіх видів автоантитіл із сироватки крові пацієнтів після 9-місячного курсу імунотерапії щонайменше в 92 % випадків. Феномен ритуксимабіндукованого усунення сироваткових антинейрональних автоантитіл асоційований з ефектом нейропротекції, що підтверджується нормалізацією раніше підвищених концентрацій лабораторних біомаркерів церебрального пошкодження NSE і білка S-100 в сироватці крові. Найімовірніше, саме досягнутий нейропротекторний ефект зумовлює прогресивне покращення з боку основних клінічних проявів РАС у дітей із ГДФЦ протягом всього курсу імунотерапії. Отримані дані підтверджують клінічну значущість сироваткових антинейрональних автоантитіл у дітей із РАС, асоційованими з ГДФЦ, і свідчать про ефективність застосування ритуксимабу з метою нейропротекції шляхом пригнічення антимозкового автоімунітету і досягнення пов’язаного з цим покращення психічного статусу дитини в таких випадках.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 26.05.2021
Рецензовано/Revised 08.06.2021
Прийнято до друку/Accepted 14.06.2021
Список литературы
1. Мальцев Д.В., Евтушенко С.К. Эффективность высокодозовй в/в иммуноглобулинотерапии у детей с расстройствами спектра аутизма, ассоциированными с генетическим дефицитом фолатного цикла. Международный неврологический журнал. 2016. № 2(80). С. 131-144.
2. Мальцев Д.В., Натрус Л.В. Эффективность инфликсимаба при расстройствах спектра аутизма, ассоциированных с генетическим дефицитом фолатного цикла. Психиатрия, психотерапия и клиническая психология. 2020. Т. 11. № 3. С. 583-594.
3. Boris M., Goldblatt A., Edelson S.M., Edelson P.A.-C. Improvement in children with autism treated with intravenous gamma globulin. J. Nutr. Environ. Medicine. 2006. Vol. 15(4). P. 1-8.
4. Bradstreet J., Singh V.K., El-Dahr J. High dose intravenous immunoglobulin improves symptoms in children with autism. The international symposium on autism. 28 Dec 1999. Atnhem, Netherlands.
5. Cabanlit M., Wills S., Goines P. et al. Brain-specific autoantibodies in the plasma of subjects with autistic spectrum disorder. Ann. N. Y. Acad. Sci. 2007. Vol. 107. P. 92-103.
6. Chen L., Shi X.J., Liu H. et al. Oxidative stress marker aberrations in children with autism spectrum disorder: a systematic review and meta-analysis of 87 studies (N = 9109). Transl. Psychiatry. 2021. Vol. 11(1). P. 15.
7. Connery K., Tippett M., Delhey L.M., Rose S. Intravenous immunoglobulin for the treatment of autoimmune encephalopathy in children with autism. Transl. Psychiatry. 2018. Vol. 8(1). P. 148.
8. DelGiudice-Asch G., Simon L., Schmeidler J. Brief report: a pilot open clinical trial of intravenous immunoglobulin in childhood autism. J. Autism Dev. Disord. 1999. Vol. 29(2). P. 157-160.
9. Frustaci A., Neri M., Cesario A. et al. Oxidative stress-related biomarkers in autism: systematic review and meta-analyses. Free Radic. Biol. Med. 2012. Vol. 52(10). P. 2128-2141.
10. Frye R.E., Sequeira J.M., Quadros E.V. et al. Cerebral folate receptor autoantibodies in autism spectrum disorder. Mol. Psychiatry. 2013. Vol. 18(3). P. 369-381.
11. Guo B.Q., Li H.B., Ding S.B. et al. Blood homocysteine levels in children with autism spectrum disorder: An updated systematic review and meta-analysis. Psychiatry Res. 2020. Vol. 291. P. 113283.
12. Gupta S. Treatment of children with autism with intravenous immunoglobulin. J. Child Neurol. 1999. Vol. 14(3). P. 203-205.
13. Gupta S., Samra D., Agrawal S. Adaptive and Innate Immune Responses in Autism: Rationale for Therapeutic Use of Intravenous Immunoglobulin. J. Clin. Immunol. 2010. Vol. 30(1). Р. 90-96.
14. Li Y., Qiu S., Shi J. et al. Association between MTHFR C677T/A1298C and susceptibility to autism spectrum disorders: a meta-analysis. BMC Pediatr. 2020. Vol. 20(1). P. 449.
15. Lv M.N., Zhang H., Shu Y. et al. The neonatal levels of TSB, NSE and CK-BB in autism spectrum disorder from Southern China. Transl. Neurosci. 2016. Vol. 7(1). P. 6-11.
16. Maltsev D.V. Efficiency of a high dose of intravenous immunoglobulin in children with autistic spectrum disorders associated with genetic deficiency of folate cycle enzymes. Journal of global pharma technology. 2019. Vol. 11(05). P. 597-609.
17. Marchezan J., Geyer E., Winkler A. et al. Immunological Dysfunction in Autism Spectrum Disorder: A Potential Target for Therapy. Neuroimmunomodulation. 2018. Vol. 25(5–6). P. 300-319.
18. Masi A., Quintana D.S., Glozier N. et al. Cytokine aberrations in autism spectrum disorder: a systematic review and meta-analysis. Mol. Psychiatry. 2015. Vol. 20(4). P. 440-446.
19. Mead J., Ashwood P. Evidence supporting an altered immune response in ASD. Immunol. Lett. 2015. Vol. 163(1). P. 49-55.
20. Melamed I.R., Heffron M., Testori A., Lipe K. A pilot study of high-dose intravenous immunoglobulin 5% for autism: Impact on autism spectrum and markers of neuroinflammation. Autism Res. 2018. Vol. 11(3). P. 421-433.
21. Mohammad N.S., Shruti P.S., Bharathi V. et al. Clinical utility of folate pathway genetic polymorphisms in the diagnosis of autism spectrum disorders. Psychiatr. Genet. 2016. Vol. 26(6). P. 281-286.
22. Nepal G., Shing K.Y., Yadav J.K. et al. Efficacy and safety of rituximab in autoimmune encephalitis: A meta-analysis. Acta Neurol. Scand. 2020. Vol. 142(5). P. 449-459.
23. Nicolson G.L., Gan R., Nicolson N.L., Haier J. Evidence for Mycoplasma ssp., Chlamydia pneunomiae, and human herpes virus-6 coinfections in the blood of patients with autistic spectrum disorders. J. Neurosci Res. 2007. Vol. 85(5). P. 1143-1148.
24. Niederhofer H., Staffen W., Mair A. Immunoglobulins as an alternative strategy of psychopharmacological treatment of children with autistic disorder. Neuropsychopharmacology. 2003. Vol. 28(5). P. 1014-1015.
25. Noriega D.B., Savelkoul H.F. Immune dysregulation in autism spectrum disorder. Eur. J. Pediatr. 2014. Vol. 173(1). P. 33-43.
26. Plioplys A.V. Intravenous immunoglobulin treatment of children with autism. J. Child Neurol. 1998. Vol. 13(2). P. 79-82.
27. Pu D., Shen Y., Wu J. Association between MTHFR gene polymorphisms and the risk of autism spectrum disorders: a meta-analysis. Autism Res. 2013. Vol. 6(5). P. 384-392.
28. Rai V. Association of methylenetetrahydrofolate reductase (MTHFR) gene C677T polymorphism with autism: evidence of genetic susceptibility. Metab. Brain Dis. 2016. Vol. 31(4). P. 727-735.
29. Sadeghiyeh T., Dastgheib S.A., Mirzaee-Khoramabadi K. et al. Association of MTHFR 677C > T and 1298A > C polymorphisms with susceptibility to autism: A systematic review and meta-analysis. Asian J. Psychiatr. 2019. Vol. 46. P. 54-61.
30. Saghazadeh A., Ataeinia B., Keynejad K. et al. A meta-ana-lysis of pro-inflammatory cytokines in autism spectrum disorders: Effects of age, gender, and latitude. J. Psychiatr. Res. 2019. Vol. 115. P. 90-102.
31. Wang Z., Ding R., Wang J. et al. The Association between Vitamin D Status and Autism Spectrum Disorder (ASD): A Systematic Review and Meta-Analysis. Nutrients. 2020. Vol. 13(1). E86.
32. Yektaş Ç., Alpay M., Tufan A.E. et al. Comparison of serum B12, folate and homocysteine concentrations in children with autism spectrum disorder or attention deficit hyperactivity disorder and healthy controls. Neuropsychiatr. Dis. Treat. 2019. Vol. 15. P. 2213-2219.
33. Zheng Z., Zheng P., Zou X. et al. Peripheral Blood S100B Levels in Autism Spectrum Disorder: A Systematic Review and Meta-Analysis. J. Autism. Dev. Disord. 2020. Online ahead of print.
/15.jpg)

/14.jpg)
/16.jpg)
/16_2.jpg)
/17.jpg)