Вступ
Цереброваскулярні захворювання (ЦВЗ) залишаються значущою медико-соціальною проблемою в сучасному світі. На сьогодні ЦВЗ займають одну із лідируючих позицій із поширеності, частоти смертності та інвалідизації населення земної кулі [1, 2]. Тільки в Україні, за даними офіційної статистики МОЗ, зареєстровано більше ніж 2,5 млн людей з ЦВЗ [1, 3]. У структурі поширеності ЦВЗ майже 90 % становлять хронічні порушення мозкового кровообігу, які позначаються терміном «дисциркуляторна енцефалопатія» (ДЕ) [3, 4].
ДЕ являє собою повільно прогресуюче багатовогнищеве або дифузне ураження головного мозку судинної етіології, що розвивається в умовах повторних гострих порушень мозкового кровообігу та/або хронічної недостатності кровопостачання головного мозку [4–6]. Основними факторами ризику ДЕ вважають церебральний атеросклероз, артеріальну гіпертензію, наявність метаболічного синдрому, і зокрема цукрового діабету, артеріальну гіпотензію, гіперхолестеринемію, ішемічну хворобу серця, фібриляцію передсердь, ниркову недостатність. Суттєву роль відіграють і такі фактори, як похилий вік, стать, спадкова схильність, шкідливі звички, що пов’язані із хронічною інтоксикацією, гіподинамія, психоемоційне перевантаження та інші [4, 7–12].
В основі патогенезу ДЕ лежать прояви атеросклерозу та/або гіпертонічної хвороби на рівні церебральної гемодинаміки: стенозуюче ураження магістральних артерій голови, дифузне ураження пенетруючих артерій і артеріол, порушення реологічних властивостей крові, ендотеліальна дисфункція, що викликають розлади механізмів авторегуляції мозкового кровообігу і порушення цілісності гематоенцефалічного бар’єра. Підвищення проникності гематоенцефалічного бар’єра супроводжується екстравазацією компонентів плазми в прилеглі ділянки мозку з розвитком периваскулярного набряку та процесів асептичного запалення [1, 13–16]. Унаслідок хронічної церебральної ішемії більшою мірою страждає біла речовина головного мозку з формуванням феномена лейкоареозу, морфологічною основою якого є демієлінізація, гліоз і розширення периваскулярних просторів. Найчастіше судинний лейкоареоз розташовується перивентрикулярно, досягаючи максимальної вираженості в ділянці передніх рогів бічних шлуночків. Пошкодження провідних шляхів у білій речовині мозку призводить до роз’єднання кіркових (перш за все лобових) і підкіркових церебральних структур, що обумовлює характерну клініку ДЕ з наявністю когнітивних, емоційно-афективних і неврологічних порушень [1, 4, 5, 17–21].
Клінічна картина ДЕ характеризується прогресуючим розвитком, стадійністю та синдромністю. На початкових стадіях спостерігається переважно астеноневротична симптоматика з подальшим наростанням неврологічного дефіциту, вираженості вогнищевої симптоматики, формуванням складного синдромокомплексу з домінуванням рухових і когнітивних розладів на більш пізніх стадіях захворювання [4–6, 16, 22]. Підходи до лікування ДЕ мають бути, за можливості, етіотропними і патогенетично обґрунтованими і включати виявлення та корекцію факторів ризику у кожного хворого, поліпшення церебральної гемодинаміки і метаболізму мозку, корекцію когнітивних розладів, лікування неврологічних симптомів і синдромів, а також запобігання розвитку транзиторних ішемічних атак та інсультів [22–26].
Протягом десятиліть у неврологічних клініках України для лікування багатьох неврологічних захворювань, у тому числі ДЕ, з успіхом застосовують препарат вінпоцетин. Це один із небагатьох препаратів, що пройшли всебічні клінічні випробування, у яких була визначена їх висока ефективність і добра переносимість [27, 28]. Широкий спектр терапевтичних ефектів вінпоцетину дозволяє віднести його до препаратів з полімодальною нейропротекторною, вазоактивною, антиагрегантною, антиоксидантною та нейрометаболічною дією [29, 30]. Біохімічний механізм дії вінпоцетину проявляється у вигляді блокади фосфодіестерази-1 циклічного гуанозинмонофосфату (цГМФ) з подальшим його збільшенням у судинному ендотелії, що сприяє вазодилатації, запобіганню подальшому розвитку процесів ремоделювання, зниженню виділення запальних цитокінів і хемокінів із ендотеліальних клітин, макрофагів і мікроглії шляхом пригнічення сигнального шляху ядерного фактора NF-kB. Підвищення рівня цГМФ сприяє регулюванню іонних каналів, зміні активності протеїнкіназ, що обумовлює зниження судинного тонусу, ослаблення агрегації тромбоцитів, активацію NMDA-рецепторів, підвищення рівня CREB та підсилення транскрипції генів нейротрофінів BDNF, NGF, які регулюють процеси нейропластичності [28–31].
Терапевтичні ефекти вінпоцетину, що реалізуються через індукцію нейропластичності за допомогою інгібування ГАМК-рецепторів і впливу на експресію ней-ротрофінів, підтверджені в клінічних дослідженнях у пацієнтів з ДЕ. Під впливом вінпоцетину в умовах хронічного порушення мозкового кровообігу відзначалося посилення процесів формування шипів дендритів, вивільнення дофаміну з нервових закінчень, відновлення рівня дофаміну і ослаблення проявів дегенерації нейронів в чорній субстанції, що сприяло ослабленню екстрапірамідних порушень [32]. У хворих з психоемоційними порушеннями на тлі хронічної ішемії мозку вінпоцетин підвищував регіонарний кровотік і нейрометаболізм у лімбічних структурах, переважно в гіпокампі та префронтальній корі [33]. Дослідження впливу вінпоцетину на стан статодинамічної функції у пацієнтів з ДЕ продемонструвало позитивний результат у відновленні процесу підтримки рівноваги, що проявлялося зменшенням вираженості запаморочення і постуральної нестійкості, при цьому отримані значимі кореляції даних шкали DHI зі збільшенням експресії BDNF у плазмі крові протягом усього спостереження [34]. Низка авторів відзначають у хворих з ДЕ покращення когнітивних функцій, зменшення симптомів астенії, підвищення якості життя під впливом вінпоцетину [35–37].
Незважаючи на досягнуті результати, проблема ней-рореабілітації пацієнтів з хронічною ішемією мозку залишається вкрай актуальною. У цьому напрямку досить перспективним є використання в складі комплексної терапії препаратів, які активують синтез нейротрофічних факторів. Фармацевтична компанія Silvestrini пропонує препарат Цеброфіт на основі екстракту Hericium erinaceus, що підсилює синтез фактора росту нейронів NGF і надає нейротрофічний і нейропротекторний ефекти. Hericium erinaceus (герицій гребінчастий) — це ксилотрофний гриб, із його міцеліального екстракту був виділений дитерпеноїд ериноцин, що здатний проникати крізь гематоенцефалічний бар’єр та стимулювати синтез білка NGF [38–40]. У мозку найбільший уміст NGF виявлено в базальних ядрах, гіпокампі, нюховій цибулині і неокортексі [41]. NGF біологічно активний локально в місці вивільнення, його активність проявляється індукцією арборизації дендритів та спраутингу аксонів у напрямку клітин-мішеней, що сприяє утворенню нових полісинаптичних зв’язків та зменшує прояви апоптозу [42, 43].
В експериментальних дослідженнях було з високою вірогідністю доведено, що біологічні ефекти Hericium erinaceus аналогічні дії білка NGF. Показано, як під впливом Hericium erinaceus підвищувався рівень катехоламінів [38, 39], знижувалась бета-амілоїдіндукована нейротоксичність, пригнічувалась активність ацетилхолінестерази, підвищувався спраутинг аксонів [40, 44, 45], зменшувались прояви оксидативного стресу та мітохондріальної дисфункції [47], послаблювалась експресія прозапальних цитокінів, знижувались прояви апоптозу, відновлювалось нервово-м’язове з’єднання [47, 48], підвищувалась експресія мРНК NGF у гіпокампі [49].
Клінічні випробування Hericium erinaceus показали його ефективність щодо збільшення когнітивної продуктивності у пацієнтів з цереброваскулярними та нейродегенеративними захворюваннями, доведено підвищення активності та повсякденної незалежності пацієнтів, покращення якості їх життя [42, 43, 50]. У пацієнтів з метаболічними порушеннями та тривожно-депресивною симптоматикою на тлі прийому Hericium erinaceus підвищувався рівень BDNF, що сприяло стабілізації емоційного стану, покращенню якості нічного сну та зменшенню денної сонливості [51, 52].
У 2020 році вчені з Тайваня опублікували дані подвійного сліпого плацебо-контрольованого дослідження ефективності використання Hericium erinaceus у лікуванні пацієнтів з ранніми формами хвороби Альцгеймера. Отримані результати з високою вірогідністю показали, що на відміну від групи плацебо у пацієнтів, які приймали протягом 49 тижнів Hericium erinaceus, при нейровізуалізаційному обстеженні даних щодо прогресування нейродегенеративних змін у речовині головного мозку не виявлено. Протягом усього періоду лікування Hericium erinaceus не відзначалися випадки зниження таких біомаркерів, як гемоглобін, альбумін, аполіпопротеїн E4, нейротрофічний фактор головного мозку, а також підвищення показників альфа-1-антихімотрипсину й бета-амілоїду пептиду 1-40. Після закінчення 49 тижнів лікування Hericium erinaceus показано статистично значуще поліпшення психоемоційного стану, когнітивних процесів і якості повсякденного функціонування пацієнтів [53].
Визначена здатність вінпоцетину та Hericium erinaceus (Цеброфіт) позитивно впливати на різні ланки патогенезу ДЕ дозволила нам провести дослідження, метою якого стала оцінка клінічної ефективності Hericium erinaceus (Цеброфіт) у комбінації з вінпоцетином порівняно з монотерапією вінпоцетином у пацієнтів з ДЕ.
Для досягнення поставленої мети вирішувались наступні завдання:
1. Визначити динаміку основних клініко-неврологічних симптомів ДЕ в умовах застосування Hericium erinaceus (Цеброфіт) у комбінації з вінпоцетином.
2. Дослідити вплив Hericium erinaceus (Цеброфіт) у комбінації з вінпоцетином на динаміку астенічної симптоматики та емоційного стану пацієнтів з ДЕ.
3. Оцінити вплив Hericium erinaceus (Цеброфіт) у комбінації з вінпоцетином на динаміку когнітивних процесів у пацієнтів з ДЕ.
4. Порівняти ефективність застосування Hericium erinaceus (Цеброфіт) у комбінації з вінпоцетином та монотерапії вінпоцетином у лікуванні пацієнтів з хронічною ішемією мозку.
Матеріали та методи
Дослідження проведено на великій вибірці із 160 пацієнтів віком від 30 до 80 років із ДЕ I та II ст. гіпертонічного і/або атеросклеротичного генезу, підтвердженою за допомогою комп’ютерної рентгенівської або магнітно-резонансної томографії головного мозку та ультразвукової допплерографії. Обстежені були розділені на 2 групи — основну та контрольну, по 80 пацієнтів у кожній. Усім обстеженим проводилась базова терапія, на тлі якої протягом 3 місяців пацієнти основної групи приймали препарат Цеброфіт по 1 капсулі 150 мг двічі на добу і вінпоцетин (Віцеброл) по 1 таблетці 5 мг тричі на добу, а пацієнти контрольної групи застосовували тільки вінпоцетин за описаною вище схемою.
До основної групи увійшли 42 пацієнти з ДЕ I ст., з них 24 жінки і 18 чоловіків, середній вік — 53,83 ± 1,98 року, і 38 пацієнтів з ДЕ II ст., із них 19 жінок і 19 чоловіків, середній вік — 62,63 ± 1,67 року. До контрольної групи увійшли 44 пацієнти з ДЕ I ст., із них 27 жінок і 17 чоловіків, середній вік — 53,07 ± 2,19 року, і 36 пацієнтів з ДЕ II ст., із них 20 жінок і 16 чоловіків, середній вік — 60,94 ± 1,97 року.
Ми провели аналіз тривалості захворювання на ДЕ в обстежених пацієнтів. В обох групах порівняння у пацієнтів з ДЕ II ст. тривалість захворювання була більшою, ніж при ДЕ I ст., статистично значущих міжгрупових відмінностей не визначено. Дані щодо розподілу пацієнтів за тривалістю захворювання наведені в табл. 1.
Дослідження тривало 3 місяці і включало 4 візити пацієнтів упродовж періоду прийому препаратів: у 1-й день, на 7, 28 і 84-й день (заключний візит).
/60.jpg)
У дослідженні застосовувались клініко-неврологічні методи з оцінкою суб’єктивних та об’єктивних симптомів у пацієнтів з ДЕ. Суб’єктивна оцінка загального самопочуття (проводилась пацієнтом) та об’єктивна оцінка вираженості клініко-неврологічної симптоматики (проводилась лікарем) здійснювались за допомогою 10-бальної рейтингової шкали від 1 до 10, де 1 — відсутність, а 10 — максимальна вираженість симптому. Проводилось психодіагностичне обстеження пацієнтів з ДЕ. Психоемоційний стан оцінювався за допомогою госпітальної шкали тривоги і депресії HADS, вираженість астенічної симптоматики визначали за допомогою шкали оцінки астенії MFI-20. Стан когнітивних функцій досліджували із застосуванням Монреальської шкали MoCA. Статистичний аналіз отриманих даних проводили за допомогою пакетів Exсel, SPSS, вірогідність міжгрупових відмінностей оцінювали з використанням непараметричного критерію Манна — Уїтні.
Результати та обговорення
За даними клініко-неврологічного дослідження, що проводилось до початку прийому препаратів, були визначені основні скарги та суб’єктивна оцінка загального самопочуття пацієнтів з ДЕ I та II ст. за 10-бальною рейтинговою шкалою, що наведено в табл. 2.
Перед початком прийому препаратів у пацієнтів в основній та в контрольній групах суб’єктивна оцінка самопочуття не мала значущих відмінностей. Визначено, що у всіх обстежених пацієнтів з ДЕ II ст. загальна кількість скарг та ступінь їх вираженості перевищували (р ≤ 0,001) аналогічні показники пацієнтів з ДЕ I ст. як в основній, так і в контрольній групах.
На підставі даних клініко-анамнестичного обстеження та даних оцінки неврологічного статусу були визначені неврологічні синдроми та об’єктивна оцінка вираженості неврологічної симптоматики за 10-бальною рейтинговою шкалою у пацієнтів з ДЕ I та II ст. в основній та контрольній групах, що наведено в табл. 3.
Як видно із табл. 3, у пацієнтів з ДЕ II ст. як в основній, так і в контрольній групі клінічна картина мала більш складну структуру, а ступінь вираженості неврологічної симптоматики статистично значимо (р ≤ 0,001) перевищував аналогічні показники пацієнтів з ДЕ I ст.
На етапі скринінгу ми провели дослідження стану когнітивних функцій, вираженості астенічних проявів, а також наявності та вираженості тривожної і депресивної симптоматики у пацієнтів з ДЕ I та II ст. в основній та контрольній групах (табл. 4).
Було доведено, що до початку прийому препаратів у всіх обстежених пацієнтів як основної, так і контрольної групи за шкалами тривоги і депресії HADS було діагностовано клінічно виражену тривогу з превалюванням симптоматики (р ≤ 0,001) у пацієнтів з ДЕ I ст. Щодо наявності депресії у всіх обстежених нами пацієнтів було визначено субклінічний рівень депресивної симптоматики, який більшою мірою (р ≤ 0,001) спостерігався у пацієнтів з ДЕ II ст.
За суб’єктивною шкалою астенії MFI-20 у всіх обстежених пацієнтів визначені підвищені показники загальної астенії, зниженої активності та фізичної астенії. Значущих відмінностей за показниками астенії між пацієнтами з ДЕ I та II ст. на етапі скринінгу ми не отримали.
Для оцінки стану когнітивних функцій ми використовували шкалу MoCA, що має високу чутливість до виявлення додементних дизрегуляторних порушень без розподілу на легкі, помірні та тяжкі когнітивні розлади [54]. Ця шкала дозволяє визначити передусім достатній рівень когнітивної продуктивності, що відповідає оцінці 26–30 балів. У нашому дослідженні на етапі скринінгу у більшості пацієнтів з ДЕ, з перевагою у пацієнтів з ДЕ II ст., загальний показник за шкалою MoCA не досягав 26 балів (табл. 4).
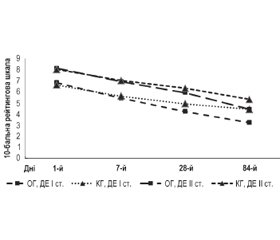
Упродовж всього періоду, коли пацієнти основної та контрольної груп приймали препарати, проводився постійний моніторинг загального стану, неврологічної симптоматики, проявів астенії, показників психоемоційної та когнітивної функцій. Визначено, що у пацієнтів основної групи на тлі прийому Цеброфіту у комбінації з вінпоцетином регресування клініко-неврологічної симптоматики відбувалося швидше, ніж у групі контролю (рис. 1).
/63.jpg)
Проведення порівняльного аналізу показників суб’єктивної оцінки самопочуття визначило, що у пацієнтів з ДЕ I ст. основної групи вже через 28 днів прийому Цеброфіту у комбінації з вінпоцетином загальний стан вірогідно покращився (4,2 ± 0,2 бала — основна група та 4,9 ± 0,2 бала — контрольна група (р ≤ 0,05)), а через 84 дні лікування ця оцінка досягла рівня більш високої вірогідності (3,2 ± 0,2 бала — основна група та 4,4 ± 0,2 бала — контрольна група (р ≤ 0,001)). Позитивна динаміка відмічена і серед пацієнтів з ДЕ II ст., у яких прийом Цеброфіту у комбінації з вінпоцетином сприяв зменшенню кількості скарг та їх вираженості. Найбільш чутливими до дії препаратів були ступінь вираженості головного болю, шуму у вухах, запаморочення, загальної слабкості, вегетативних, когнітивних та емоційних розладів, а також порушень нічного сну. У групі пацієнтів з ДЕ II ст. на 84-й день прийому Цеброфіту у комбінації з вінпоцетином порівняно з контрольною групою, у якій проводилася монотерапія вінпоцетином, вірогідно покращилась суб’єктивна оцінка самопочуття (4,4 ± 0,2 бала — основна група та 5,3 ± 0,2 бала — контрольна група (р ≤ 0,001)).
Аналіз динаміки об’єктивної неврологічної симптоматики визначив у пацієнтів основної групи на тлі прийому Цеброфіту у комбінації з вінпоцетином більш виражене регресування неврологічних порушень (рис. 2).
Під впливом прийому Цеброфіту у комбінації з вінпоцетином ми спостерігали більше регресування ступеня вираженості проявів цефалгічного, лікворно-гіпертензійного, вестибулоатактичного та астенічного синдромів. У пацієнтів з ДЕ I ст. основної групи порівняно з контролем через 28 днів лікування вираженість неврологічної симптоматики вірогідно знизилась (3,6 ± 0,2 бала — основна група та 4,4 ± 0,2 бала — контрольна група (р ≤ 0,05)), а через 84 дні лікування ця оцінка покращилась до 2,8 ± 0,2 бала в основній групі та 4,2 ± 0,2 бала — у контрольній (р ≤ 0,001). У групі пацієнтів з ДЕ II ст. позитивні зміни були більш повільними, значущі відмінності між групами спостереження були відмічені через 84 дні прийому Цеброфіту у комбінації з вінпоцетином (4,3 ± 0,2 бала — основна група та 5,4 ± 0,2 бала — контрольна група (р ≤ 0,001)).
У нашому дослідженні більшу увагу ми приділили визначенню динаміки проявів астенічного синдрому, який спостерігався більше ніж у 90 % обстежених нами пацієнтів з ДЕ. Астенічний синдром має поліморфну структуру та включає такі симптоми, як підвищена фізична стомлюваність, пов’язана з м’язовою слабкістю, зниженою витривалістю; когнітивні розлади, переважно пов’язані з енергетичним забезпеченням діяльності, а саме зниження пам’яті, уваги, здатності до концентрації; вегетативні збої, що проявляються тахікардією та гіпергідрозом; больові порушення, частіше у вигляді кардіалгії та дорсалгії; емоційні розлади, що характеризуються тривожністю, лабільністю або нестійкістю настрою; а також порушення нічного сну [55]. За шкалою оцінки астенії MFI-20 у пацієнтів з ДЕ ми простежили динаміку окремих показників в обох групах упродовж курсу прийому препаратів, дані стосовно пацієнтів з ДЕ I ст. наведені в табл. 5.
Як видно із табл. 5, у пацієнтів з ДЕ I ст. основної групи під впливом прийому Цеброфіту у комбінації з вінпоцетином значно активніше відбувалось регресування астенічної симптоматики, ніж у пацієнтів з ДЕ I ст. групи контролю. Значущі позитивні зміни простежувались вже через тиждень лікування, про що свідчать статистично вірогідні зміни показників загальної астенії та фізичної астенії (р ≤ 0,05). Через 28–84 дні у пацієнтів з ДЕ I ст. визначені вірогідно менші показники загальної астенії (р ≤ 0,001), зниженої активності (р ≤ 0,001), фізичної астенії (р ≤ 0,001) та психічної астенії (р ≤ 0,05) порівняно з аналогічними показниками групи контролю. За тією ж схемою були проаналізовані дані шкали MFI-20 у пацієнтів з ДЕ II ст. основної та контрольної груп (табл. 6).
/64.jpg)
За даними порівняльного аналізу показників шкали астенії MFI-20, у пацієнтів з ДЕ II ст. основної та контрольної груп було відмічено значущі позитивні зміни через 28 днів прийому препаратів. У цей період у пацієнтів з ДЕ II ст. під впливом прийому Цеброфіту у комбінації з вінпоцетином відмічені вірогідно менші показники загальної астенії (р ≤ 0,05) та фізичної астенії (р ≤ 0,05) порівняно з контролем. На 84-й день лікування у пацієнтів з ДЕ II ст., які приймали Цеброфіт у комбінації з вінпоцетином, вірогідно зменшувались показники загальної астенії (р ≤ 0,001), зниження активності (р ≤ 0,001) та фізичної астенії (р ≤ 0,001) порівняно з контролем.
Моніторинг динаміки психоемоційного стану пацієнтів з ДЕ за допомогою шкал тривоги та депресії HADS показав, що позитивні зміни відбувались активніше під впливом Цеброфіту у комбінації з вінпоцетином з перевагою у пацієнтів з ДЕ I ст. У табл. 7 наведені дані щодо динаміки показників за шкалами тривоги та депресії HADS у пацієнтів з ДЕ I ст. в основній та контрольній групах.
У пацієнтів з ДЕ I ст. порівняно з контрольною групою під впливом прийому Цеброфіту у комбінації з вінпоцетином на 28-й день лікування відмічались більш низькі показники тривоги та депресії (р ≤ 0,05) із збереженням даної позитивної динаміки до кінця терміну лікування (р ≤ 0,001). У табл. 8 наведені дані динаміки показників за шкалами тривоги та депресії HADS у пацієнтів з ДЕ II ст. в основній та контрольній групах упродовж лікування.
У пацієнтів з ДЕ II ст. процеси відновлення психо-емоційного стану проходили більш повільно, ніж у пацієнтів з ДЕ I ст. Але при порівнянні динаміки показників за шкалою тривоги та депресії HADS у пацієнтів з ДЕ II ст. в основній та контрольній групах визначено, що прийом Цеброфіту у комбінації з вінпоцетином має більшу терапевтичну ефективність порівняно з монотерапією вінпоцетином. У пацієнтів основної групи з ДЕ II ст. показники за шкалами тривоги та депресії HADS на 84-й день лікування були нижчі, ніж у групі порівняння, з високою статистичною вірогідністю (р ≤ 0,001).
Порівняльний аналіз динаміки показників когнітивного функціонування проводився для пацієнтів з ДЕ I та II ст. обох груп спостереження за шкалою MoCA. В табл. 9 наведені показники загальної суми балів за шкалою MoCA у пацієнтів з ДЕ основної та контрольної груп у динаміці лікування.
/65.jpg)
Під впливом Цеброфіту у комбінації із вінпоцетином порівняно з контролем у пацієнтів з ДЕ I ст. простежувалась більш виражена позитивна динаміка когнітивної продуктивності, що проявлялась поліпшенням зорово-конструктивних функцій, пам’яті, мовлення, виконавчих функцій, абстрактного мислення та орієнтування. У пацієнтів з ДЕ I ст. основної групи відмічені вірогідно (р ≤ 0,05) більш високі показники за шкалою MoCA вже через 7 днів з початку лікування із збереженням даної динаміки до закінчення курсу терапії, коли міжгрупові відмінності мали високий рівень вірогідності (р ≤ 0,001). У пацієнтів з ДЕ II ст. основної групи порівняно з групою контролю на тлі прийому Цеброфіту у комбінації із вінпоцетином також спостерігалась більш виражена позитивна динаміка, яка проявлялась покращенням концентрації уваги, підвищенням працездатності та зменшенням стомлюваності під час розумової діяльності, покращенням функцій пам’яті (більшою мірою короткочасної), мовлення та виконавчих функцій, також слід зазначити і збільшення комунікативної активності. Міжгрупові відмінності у пацієнтів з ДЕ II ст. основної та контрольної груп досягли рівня вірогідності (р ≤ 0,001) за показниками шкали MoCA на 84-й день –терапії.
Підбиваючи підсумки, слід відзначити, що проведене дослідження дозволило встановити у пацієнтів з ДЕ більш виражений клінічний ефект при застосуванні Цеброфіту у комбінації з вінпоцетином порівняно з монотерапією вінпоцетином. Під впливом Цеброфіту у комбінації з вінпоцетином були відмічені вірогідно значущі позитивні зміни в динаміці загального самопочуття пацієнтів, зменшенні вираженості неврологічної симптоматики, стабілізації психоемоційного стану, поліпшенні процесів когнітивного функціонування з переважанням у пацієнтів з ДЕ I ст. У пацієнтів з ДЕ II ст. процеси відновлення клініко-неврологічної симптоматики, зменшення астеноневротичних та когнітивних розладів мали більш повільну динаміку з отриманням вірогідно значущих позитивних змін на тлі прийому Цеброфіту у комбінації з вінпоцетином через 84 дні лікування. Під час усього періоду прийому препаратів Цеброфіт і вінпоцетин в обстежених нами пацієнтів з ДЕ побічні реакції, що потребували відміни препаратів, не були зафіксовані.
Висновки
1. На підставі комплексного дослідження встановлено, що застосування Цеброфіту у комбінації з вінпоцетином порівняно з монотерапією вінпоцетином призводить до прискорення регресування суб’єктивних та об’єктивних проявів ДЕ з перевагою у пацієнтів з ДЕ I ст.
2. Застосування Цеброфіту у комбінації з вінпоцетином при ДЕ I ст. справляє виражений нейропротекторний ефект, що проявляється у вірогідному покращенні загального стану пацієнтів, зниженні вираженості неврологічної симптоматики, зменшенні проявів астенії та тривоги через 28 днів терапії і вірогідному підвищенні когнітивної продуктивності вже через 7 днів терапії із збереженням даної позитивної тенденції до кінця курсу лікування.
3. Під впливом Цеброфіту у комбінації з вінпоцетином у пацієнтів з ДЕ II ст. процеси нейропротекції мають більш повільну позитивну динаміку з досягненням вірогідного результату через 84 дні лікування, що проявлявся зменшенням вираженості клініко-неврологічної симптоматики, показників астенії, тривоги та депресії, а також покращенням когнітивних функцій.
Конфлікт інтересів. Не заявлений.
Отримано/Received 03.08.2021
Рецензовано/Revised 17.08.2021
Прийнято до друку/Accepted 21.08.2021
Список литературы
1. Міщенко Т.С., Міщенко В.М. Неврология в вопросах и ответах. К.: Библиотека «Здоровье Украины», 2018. 340 с.
2. Ahad M.A., Kumaran K.R., Ning T., Mansor N.I., Insights into the neuropathology of cerebral ischemia and its mechanisms. ReV. Neurosci. 2020. 31(5). 521-538 . https://doi.org/10.1515/revneuro-2019-0099.
3. Мищенко Т.С. Эпидемиология цереброваскулярных заболеваний и организация помощи больным с мозговым инсультом в Украине. Український вісник психоневрології. 2017. Т. 25. Вип. 1(90). С. 22-24. URL: http://nbuv.gov.ua/UJRN/ Uvp_2017_25_1_5.
4. Мищенко Т.С. Дисциркуляторная энцефалопатия: устаревший термин или клиническая реальность. Международный неврологический журнал. 2013. № 2(56). С. 134-138.
5. Гусев Е.И., Чуканова А.С. Современные патогенетические аспекты формирования хронической ишемии мозга. Журнал неврологии и психиатрии им. С.С. Корсакова. 2015. № 115(3). С. 4-8.
6. Есин Р.Г., Есин О.Р., Хайруллин И.Х. Дисциркуляторная энцефалопатия и болезнь мелких сосудов. Журнал неврологии и психиатрии им. С.С. Корсакова. 2016. № 116(8). С. 109-15.
7. Міщенко Т.С., Міщенко В.М., Здесенко І.В., Харіна К.В. Фактори ризику розвитку цереброваскулярних порушень у хворих після кардіохірургічних втручань. Український вісник психоневрології. 2020. Т. 28. № 3(104). С. 16-20. https://doi.org/10.36927/2079-0325-V28-is3-2020.
8. Hughes T.M., Wagenknecht L.E., Craft S., Mintz A., Heiss G., Palta P., Wong D., Zhou Y., Knopman D., Mosley T.H., Gottesman R.F. Arterial stiffness and dementia pathology Atherosclerosis Risk in Communities (ARIC)-PET Study. Neurology. 2018. 90(14). 1-9. https://doi.org/10.1212/WNL.0000000000005259
9. Neves M.F., Cunha A.R., Cunha M.R., Gismondi R.A., Oigma W. The Role of Renin-Angiotensin-Aldosterone System and Its New Components in Arterial Stiffness and Vascular Aging. High Blood. Press Cardiovasc PreV. 2018. 25(2). 37-145. https://doi.org/10.1007/s40292-018-0252-5.
10. Ciacciarelli A., Sette G., Giubilei F., Orzi F. Chronical cerebral hypoperfusion: an underfined, relevant entity. Journal of Clinical Neuroscience: Official Journal of the Neurosurgical Society of Australasia. 14 Jan 2020. 73. 8-12. DOI: 10.1016/j.jocn.2020.01.026. PMID: 31948882.
11. Qureshi A.I., Caplan L.R. Intracranial atherosclerosis. Lancet. 2014. 383. 984-998. https://doi.org/10.1016/S0140-6736(13)61088-0.
12. Iadecola C. The Neurovascular Unit Coming of Age: A Journey through Neurovascular Coupling in Health and Disease. Neuron. 2017. 96(1). 17-42. https://doi.org/10.1016/j.neuron.2017.07.030.
13 Ahad M.A., Kumaran K.R., Ning T., Mansor N.I. Insights into the neuropathology of cerebral ischemia and its mechanisms. ReV. Neurosci. 2020. 31(5). 21-538. https://doi.org/10.1515/revneuro-2019-0099.
14. Bridges L.R., Andoh J., Lawrence A.J., Khoong C.H., Poon W.W., Esiri M.M., Markus H.S., Hainsworth A.H. Blood-brain barrier dysfunction and cerebral small vessel disease (arteriolosclerosis) in brains of older people. J. Neuropathol. Exp. Neurol. 2014. 73. 1026-1033. https://doi.org/10.1097/NEN.0000000000000124.
15. Toth P., Tarantini S., Csiszar A., Ungvari Z. Functional vascular contributions to cognitive impairment and dementia: mechanisms and consequences of cerebral autoregulatory dysfunction, endothelial impairment, and neurovascular uncoupling in aging. Am. J. Physiol. Heart Circ. Physiol. 2017. 312. 1-20. https://doi.org/10.1152/ajpheart.00581.2016.
16. Левин О.С., Чимагомедова А.Ш., Полякова Т.А., Араблинский А.В. 60 лет концепции дисциркуляторной энцефалопатии — можно ли в старые мехи налить молодое вино? Журнал неврологии и психиатрии им. С.С. Корсакова. 2018. № 118. (6-2). С. 13-26. doi: 10.17116/jnevro201811806213.
17. Moon S.Y., Barreto P., Rolland Y., Chupin M., Bouyahia A., Fillon L., Mangin J.F., Andrieu S., Cesari M., Vellas B.; For the MAPT/DSA Study Group. Prospective associations between white matter hyperintensities and lower extremity function. Neurology. 2018. 0. 1-7. https://doi.org/10.1212/WNL.0000000000005289.
18. Rosenberg G.A., Wallin A., Wardlaw J.M., Markus H.S., Montaner J., Wolfson L., et al. Consensus statement for diagnosis of subcortical small vessel disease. J. Cereb. Blood Flow Metab. 2016. 36. 6-25. https://doi.org/10.1038/jcbfm.2015.172.
19. Hughes T.M., Wagenknecht L.E., Craft S., Mintz A., Heiss G., Palta P., Wong D., Zhou Y., Knopman D., Mosley T.H., Gottesman R.F. Arterial stiffness and dementia pathology Atherosclerosis Risk in Communities (ARIC)-PET Study. Neurology. 2018. 90(14). 1-9. https://doi.org/10.1212/WNL.0000000000005259.
20. Rosenberg G.A. Extracellular matrix inflammation in vascular cognitive impairment and dementia. Clinical Science. 2017. 131. 425-437. https://doi.org/10.1042/CS20160604.
21. Skrobot O.A., Attems J., Esiri M., Hortob´agyi T., Ironside J.W., Kalaria R.N., King A., Lammie G.A., Mann D., Neal J., Ben-Shlomo Y., Kehoe P.G., Love S. Vascular Cognitive Impairment Neuropathology Guidelines (VCING): The contribution of cerebrovascular pathology to cognitive impairment. Brain. 2016. 139. 2957-2969. https://doi.org/10.1093/brain/aww214.
22 Пизова Н.В. Мультимодальный подход в лечении хронической ишемии головного мозга: что должен знать врач? Медицинский совет. 2020. (4). 66-73. doi: 10.21518/2079-701X-2020-4-66-73.
23. Мищенко Т.С. Когнитивные нарушения в практике семейного врача (актуальность проблемы, факторы риска, патогенез, возможности лечения и профилактики). Cімейна медицина. 2017. № 1(69). URL: http://nbuv.gov.ua/UJRN/simmed_2017_1_6.
24. Мищенко Т.С., Мищенко В.Н., Забродина Л.П. Элфунат в лечении пациентов с дисциркуляторной энцефалопатией. Международный научно-практический журнал «Неврология и нейрохирургия». 2018. № 3(7). С. 507-521.
25. Мищенко В.Н., Забродина Л.П., Мищенко Т.С. Нарушения сна и его коррекция у больных с дисциркуляторной энцефалопатией. Психіатрія, неврологія та медична психологія. 2019. № 11. С. 38-50. DOI: 10.26565/2312-5675-2019-12-05.
26. Міщенко Т.С., Міщенко В.М., Здесенко І.В. Лікування хворих з дисциркуляторною енцефалопатією на фоні метаболічного синдрому. Український вісник психоневрології. 2019. Т. 27. Вип. 1(98). С. 14-19.
27. Лобзин В.Ю., Емелин А.Ю., Воробьeв С.В., Лупанов И.А. Современные подходы к диагностике, профилактике и терапии когнитивных нарушений при дисциркуляторной энцефалопатии. Неврология, нейропсихиатрия, психосоматика. 2014. № 2. С. 51-56. DOI: http://dx.doi.org/10.14412/2074-2711-2014-2-51-56.
28. Кузнецова С.М., Козловский В.И. Механизм действия и клиническая эффективность кавинтона. Журнал неврології ім. Б.М. Маньковського. 2019. № 7(2). С. 15-23.
29. Patyar S., Prakash A., Modi M., Medhi B. Role of vinpocetine in cerebrovascular diseases. Pharmacol. Rep. 2011. 63(3). 618-628. DOI: 10.1016/s1734-1140(11)70574-6.
30. Cai Y., Knight W.E., Guo S. Vinpocetine suppresses pathological vascular remodeling by inhibiting vascular smooth muscle cell proliferation and migration. J. Pharmacol. Exp. 2012. 343(2). 479-488.
31. Sharma S., Kumar K. Phosphodiesterases: regulators of cyclic nucleotide signals and novel molecular target for movement disorders. Eur. J. Pharmacol. 2013. 714(1-3). 486-497.
32. Etgen T., Sander D., Huntgeburth U., Poppert H., Forstl H., Bickel H. Physical activity and incident cognitive impairment in elderly persons the INVADE study. Arch. Intern. Med. 2010. 170. 186-93.
33. Яхно Н.Н., Левин О.С., Дамулин И.В. Сопоставление клинических и МРТ-данных при дисциркуляторной энцефалопатии. Сообщение 1. Двигательные нарушения. Неврол. журн. 2001. № 6(2). С. 10-16.
34. Самарцев И.Н., Живолупов С.А., Бутакова Ю.С. Эффективность длительного приема винпоцетина при лечении головокружения и ассоциированных статодинамических нарушений у пациентов с хронической недостаточностью мозгового крово-обращения (исследование ЭДЕЛЬВЕЙС). Неврология, нейропсихиатрия, психосоматика. 2019. № 11(1). С. 36-47.
35. Вахнина Н.В., Милованова О.В. Неврологические расстройства у пациентов с артериальной гипертензией и их коррекция. Неврология, нейропсихиатрия, психосоматика. 2016. № 8(4). С. 32-37. doi: 10.14412/2074-2711-2016-4-32-37.
36. Табеева Г.Р., Калимеева Е.Ю., Коберская Н.Н., Гере-ева С.И. Возможности терапии ранних проявлений хронической ишемии головного мозга: результаты программы «ПРОФИЛЬ». Неврология, нейропсихиатрия, психосоматика. 2017. № 9(3). С. 36-41. doi: 10.14412/2074-2711-2017-3-36.
37. Шавловская О.А., Локшина А.Б., Гришина Д.А. Кавинтон комфорте в коррекции когнитивных нарушений при хронической ишемии головного мозга. Журнал неврологии и психиатрии им. С.С. Корсакова. 2018. № 118(8). С. 61-65.
38. Shimbo M., Kawagishi H., Yokogoshi H. Erinacine A increases catecholamine and nerve growth factor content in the central nervous system of rats. Nutrition Research. 2005. 25(6). 617-623.
39. Ma B.-J., Shen J.-W., Yu H.-Y., Ruan Y., Wu T.-T., Zhao X. Hericenones and erinacines: stimulators of nerve growth factor (NGF) biosynthesis in Hericium erinaceus. Mycology. 2010. 1–2. 92-98.
40. Phan C.W., David P., Naidu M., Wong K.H., Sabaratnam V. Therapeutic potential of culinary-medicinal mushrooms for the management of neurodegenerative diseases: diversity, metabolite, and mechanism. Crit. ReV. Biotechnol. 2015. 35(3). 355-368.
41. Korsching S., Auburger G., Heumann R., Scott J., Thoenen H. Levels of nerve growth factor and its mRNA in the central nervous system of the rat or relate with cholinergic innervation. EMBO J. 1985. 4. 1389-1393.
42. Мищенко В.Н., Забродина Л.П. Нейропластичность и постинсультные когнитивные нарушения (терапевтические возможности). Международный неврологический журнал. 2020. № 16(1). С. 65-72. DOI: 10.2241/2224-0713. 16.1.2020.197330.
43. Копчак О.О. Нейропротекторный потенциал эринацина в экстракте гриба Hericium erinaceus и механизмы его воздействия на головной мозг при цереброваскулярных заболеваниях. НейроNEWS: психоневрологія та нейропсихіатрія. 2020. № 5 (116). С. 62-66.
44. Khan M.A., Tania M., Liu R., Rahman M.M. Hericium erinaceus: an edible mushroom with medicinal values. J. Complement Integr. Med. 2013. https://www.ncbi.nlm.nih.gov/pubmed/23735479
45. Li C., Lee L.-Y., Chen C.-C. Neurohealth Properties of Hericium erinaceus Mycelia Enriched with Erinacines. Behav. neurol. 2018. https://doi.org/10.1155/2018/5802634.
46. Wang D., Zhang Y., Yang S., Zhao D., Wang M. A polysaccharide from cultured mycelium of Hericium erinaceus relieves ulcerative colitis by counteracting oxidative stress and improving mitochondrial function. International Journal of Biological Macromolecules. 2019. 125. 572-579.
47. Lee K.F., Chen J.H., Teng C.C. Protective effects of Hericium erinaceus mycelium and its isolated erinacine A against ischemia-injury-induced neuronal cell death via the inhibition of inOS/p38 MAPK and nitrotyrosine. International Journal of Molecular Sciences. 2014. 15(9). 15073-15089.
48. Kuo H.C., Lu C.C., Shen C.H., Tung S.Y., Hsieh M.C., Lee K.C., Lee L.Y., Chen C.C., Teng C.C., Huang W.S. Hericium erinaceus mycelium and its isolated erinacine A protection from MPTP-induced neurotoxicity through the ER stress, triggering an apoptosis cascade. J. Transl. Med. 2016. 14. 78. https://doi.org/10.1186/s12967-016-0831-y.
49. Tsai Yu-C., Lin Yu-C., Huang C.-C., Villaflores O.B., Wu T.-Y., Huang S.-M., Chin T.-Yu. Hericium erinaceus Mycelium and Its Isolated Compound, Erinacine A, Ameliorate High-Fat High-Sucrose Diet-Induced Metabolic Dysfunction and Spatial Lear-ning Deficits in Aging Mice. Journal of Medicinal Food. 2019. 22(5). https://doi.org/10.1089/jmf.2018.4288.
50. Kawagishi H. Chapter 11 — Biologically Functional Compounds From Mushroom-Forming Fungi. Natural Products and Drug Discovery. 2018. 309-326. https://doi.org/10.1016/B978-0-08-102081-4.00011-3.
51. Vigna L., Morelli F., Agnelli G.M., Napolitano F., Ratto D., Occhinegro A., Di Iorio C., Savino E., Girometta C., Branda-lise F., Rossi P. Hericium erinaceus Improves Mood and Sleep Disorders in Patients Affected by Overweight or Obesity: Could Circulating Pro-BDNF and BDNF Be Potential Biomarkers? Evid Based Complement Alternat. Med. 2019 Apr 18. 2019. 7861297. doi: 10.1155/2019/7861297.
52. Limanaqi F., Biagioni F., Busceti C.L., Polzella M., Fabrizi C., Fornai F. Potential Antidepressant Effects of Scutellaria baicalensis, Hericium erinaceus and Rhodiola rosea. Antioxidants. 2020. 9(3). 234-246: doi:10.3390/antiox9030234.
53. Li I.-C., Chang H.-H., Lin C.-H., Chen W.-P., Lu T.-H., Lee L.-Y., Chen Y.-W., Chen Y.-P., Chen C.-C., Lin D.P.-C. Prevention of Early Alzheimer’s Disease by Erinacine A-Enriched Hericium erinaceus Mycelia Pilot Double-Blind Placebo-Controlled Study. Front. Aging Neurosci. 2020. 12. 155. doi: 10.3389/fnagi.2020.00155.
54. Carson N., Leach L., Murphy K.J. A re-examination of Montreal Cognitive Assessment (MoCA) cutoff scores. Int. J. Geriatr. Psychiatry. 2018. 33(2). 379-388. https://doi.org/10.1002/gps.4756.
55. Юдельсон Я.Б., Макарова М.А., Кугелева А.О. Лечение функциональной астении. Вестник Смоленской медицинской академии. 2003. № 4. С. 65-67.

/60.jpg)
/61.jpg)
/62.jpg)
/63.jpg)
/64.jpg)
/65.jpg)